Арилгалогенид - Aryl halide
В органическая химия, арилгалогенид (также известен как галоарен или галогеноарен) представляет собой ароматическое соединение, в котором один или несколько атомов водорода, непосредственно связанных с ароматный кольцо заменяется на галогенид. Галоарен отличается от галогеналканы потому что они имеют много различий в способах приготовления и свойствах. Наиболее важными членами являются арилхлориды, но класс соединений настолько широк, что многие производные находят применение в нише.
Подготовка
Двумя основными способами получения арилгалогенидов являются прямое галогенирование и через соли диазония.[1]
Прямое галогенирование
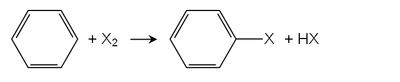
в Галогенирование Friedel-Crafts, Кислоты Льюиса служат катализаторами. Используются многие хлориды металлов, примеры включают хлорид железа (III) или хлорид алюминия. Самый важный арилгалогенид, хлорбензол производится по этому маршруту. Монохлорирование бензола всегда сопровождается образованием производных дихлорбензола.[2]
Арены с электронодонорными группами реагируют с галогенами даже в отсутствие кислот Льюиса. Например, фенолы и анилины быстро реагируют с хлором и бромной водой с образованием нескольких галогенированных продуктов.[3] Обесцвечивание бромной воды аренами, богатыми электронами, используется в бромный тест.
Прямое галогенирование аренов возможно в присутствии света или при высокой температуре. Для производных алкилбензола алкильные положения обычно сначала галогенируются при свободнорадикальном галогенировании. Для галогенирования кольца требуются кислоты Льюиса, и следует исключить свет, чтобы избежать конкурирующей реакции.[1]
Реакции Зандмейера, Бальца-Шимана и Гаттермана
Второй основной маршрут - это Реакция Сандмейера. Анилины (ариламины) превращаются в свои соли диазония с помощью азотистая кислота. Например, хлорид меди (I) превращает соли диазония в арилхлорид. Уходящей группой является газообразный азот, что делает эту реакцию очень благоприятной. Подобный Реакция Шимана использует тетрафторборат анион в качестве донора фторида. Реакцию Гаттермана также можно использовать для превращения соли диазония в хлорбензол или бромбензол с использованием медного порошка вместо хлорида меди или бромида меди. Но это нужно делать в присутствии HCl и HBr соответственно.
Галогенирование в природе
Арилгалогениды широко распространены в природе, чаще всего производятся морскими организмами, которые используют хлорид и бромид в океанских водах. Хлорированные и бромированные ароматические соединения также многочисленны, например производные тирозина, триптофана и различные производные пиррола. Некоторые из этих встречающихся в природе арилгалогенидов обладают полезными лечебными свойствами.[4][5]


Структурные тенденции
Расстояния C-X для арилгалогенидов следуют ожидаемой тенденции. Эти расстояния для фторбензола, хлорбензола, бромбензола и метил-4-иодбензоата составляют 135,6 (4), 173,90 (23), 189,8 (1) и 209,9. вечера соответственно.[6]
Реакции
Замена
В отличие от типичных алкилгалогенидов, арилгалогениды не участвуют в обычных SN2 реакции, поскольку обратная атака требуется для SN2 реакция невозможна из-за планарного строения арильной группы. SN1 реакции теоретически возможны, но обычно не наблюдаются, поскольку образование арильного катиона энергетически невыгодно.
Однако арилгалогениды с электроноакцепторными группами в орто и параграф позиции, могут пройти SNAr реакции. Например, 2,4-динитрохлорбензол может реагировать с водой в щелочном растворе с образованием фенола:

В отличие от большинства других реакций замещения, фторид является лучшей уходящей группой, а йодид - худшей из-за высокой электроотрицательности фторида, позволяющей лучше стабилизировать определяющее скорость переходное состояние, которое приводит к отрицательно заряженному промежуточному продукту Мейзенгеймера. Работа в 2016 году предложила механизм согласованного перемещения (аналогичный передней SN2) возможен в случае фторидного замещения уходящей группы активированного кислорода. В этом механизме «промежуточное звено» Мейзенгеймера фактически является только переходным состоянием, а не истинным промежуточным звеном.[7] В документе 2018 года указывается, что эта ситуация может быть довольно распространенной и происходить в системах, которые ранее предполагались для работы через SNМеханизмы Ar.[8]
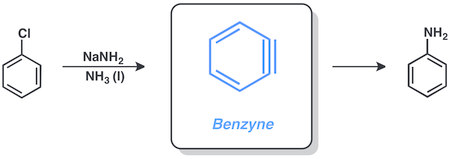
Бензин
Арилгалогениды способны вступать в реакции через бензин механизм, включающий амид натрия в жидкости аммиак. Например, хлорбензол можно превратить в анилин в этих условиях.
Образование металлоорганического реагента
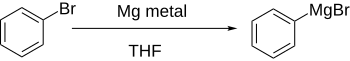
Арилгалогениды реагируют с металлами, обычно литий или магний, чтобы получить более реакционноспособные производные, которые ведут себя как источники ариланионов.
Прямое формирование Реактивы Гриньяра при добавлении магния к арилгалогениду в эфирном растворе хорошо работает, если ароматическое кольцо существенно не дезактивируется электроноакцепторными группами.
Такие соединения, как пара-бромнитробензол, не могут напрямую образовывать стабильные соединения Гриньяра, поскольку их ароматические кольца слишком дезактивированы. Если такой Гриньяр необходим, его обычно получают путем обмена магния и галогена с использованием изопропилмагния хлорида при -78 ° C. Эта реакция происходит потому, что pKа Количество ароматических протонов намного ниже - обычно около 45, в то время как у алифатического алкана больше 50. Гриньяр, приготовленный с использованием этой процедуры, обычно используется немедленно, чтобы избежать разложения.
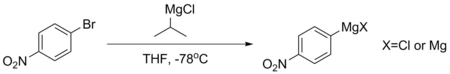
Другие реакции
Галогениды могут быть замещены сильными нуклеофилами посредством реакций с участием анион-радикалов. В качестве альтернативы арилгалогениды, особенно бромиды и йодиды, подвергаются окислительная добавка, и поэтому подлежат Аминирование Бухвальда – Хартвига реакции типа.
Хлорбензол когда-то был предшественником фенол, который теперь производится окислением кумол. При высоких температурах арильные группы реагируют с аммиаком с образованием анилинов.[2]
Биоразложение
Родококк феноликус представляет собой вид бактерий, способных разлагать дихлорбензол как единственный источник углерода.[9]
Приложения
Арилгалогениды, производимые в самых крупных масштабах, представляют собой хлорбензол и изомеры дихлорбензола. Одним из основных, но прекращенных применений было использование хлорбензола в качестве растворителя для диспергирования гербицида Лассо. В целом производство арилхлоридов (также нафтильных производных) снижается с 1980-х годов, отчасти из-за экологических проблем.[2] Трифенилфосфин производится из хлорбензола:
- 3 С6ЧАС5Cl + PCl3 + 6 Na → P (C6ЧАС5)3 + 6 NaCl
Арилбромиды широко используются в качестве антипиренов. Самый выдающийся член тетрабромбисфенол-А, который получают прямым бромированием дифенола.[10]
использованная литература
- ^ а б Бойд, Роберт В .; Моррисон, Роберт (1992). Органическая химия. Энглвуд Клиффс, Нью-Джерси: Prentice Hall. п. 947. ISBN 978-0-13-643669-0.
- ^ а б c Beck, U .; Лезер, Э. (2011). «Хлорированные бензолы и другие ядерно-хлорированные ароматические углеводороды». Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.o06_o03. ISBN 978-3527306732.
- ^ Иллюстративная процедура хлорирования ароматического соединения:Эдвард Р. Аткинсон; Дональд М. Мерфи; Джеймс Э. Луфкин (1951). «dl-4,4 ', 6,6'-Тетрахлордифеновая кислота». Органический синтез.; Коллективный объем, 4, п. 872
- ^ Фухимори, Даника Галонич; Уолш, Кристофер Т. (2007). «Что нового в ферментативном галогенировании». Современное мнение в области химической биологии. 11 (5): 553–60. Дои:10.1016 / j.cbpa.2007.08.002. ЧВК 2151916. PMID 17881282.
- ^ Гриббл, Гордон В. (2004). «Природные органогалогены: новый рубеж для лекарственных средств?». Журнал химического образования. 81 (10): 1441. Bibcode:2004JChEd..81.1441G. Дои:10.1021 / ed081p1441.
- ^ Оберхаммер, Хайнц (2009). «Структурная химия углерод-галогеновых связей». Химия функциональных групп PATai. Дои:10.1002 / 9780470682531.pat0002. ISBN 978-0-470-68253-1.
- ^ Риттер, Тобиас; Хукер, Джейкоб М .; Нойман, Констанце Н. (июнь 2016 г.). «Согласованное нуклеофильное ароматическое замещение 19F− и 18F−». Природа. 534 (7607): 369–373. Bibcode:2016Натура.534..369Н. Дои:10.1038 / природа17667. ISSN 1476-4687. ЧВК 4911285. PMID 27281221.
- ^ Якобсен, Эрик Н .; Харрисон А. Бессер; Цзэн, Ювэнь; Кван, Юджин Э. (сентябрь 2018 г.). «Согласованные нуклеофильные ароматические замены». Химия природы. 10 (9): 917–923. Дои:10.1038 / s41557-018-0079-7. ISSN 1755-4349. ЧВК 6105541. PMID 30013193.
- ^ Rehfuss, Марк; Урбан, Джеймс (2005). "Родококк феноликус sp. nov., новый биопроцессор выделил актиномицет со способностью разлагать хлорбензол, дихлорбензол и фенол как единственные источники углерода ". Систематическая и прикладная микробиология. 28 (8): 695–701. Дои:10.1016 / j.syapm.2005.05.011. PMID 16261859.
- ^ Иоффе, Д .; Кампф, А. (2002). «Бром, органические соединения». Энциклопедия химической технологии Кирка-Отмера. Дои:10.1002 / 0471238961.0218151325150606.a01. ISBN 978-0471238966.
