Chalcone - Chalcone
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Chalcone[2] | |
| Систематическое название ИЮПАК (2E) -1,3-дифенилпроп-2-ен-1-он | |
| Другие имена Chalkone Бензилиденацетофенон Фенилстирилкетон | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.002.119 |
PubChem CID | |
| |
| |
| Характеристики | |
| C15ЧАС12О | |
| Молярная масса | 208.260 г · моль−1 |
| Плотность | 1,071 г / см3 |
| Температура плавления | От 55 до 57 ° C (от 131 до 135 ° F; от 328 до 330 K) |
| Точка кипения | От 345 до 348 ° C (от 653 до 658 ° F, от 618 до 621 K) |
| -125.7·10−6 см3/ моль | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Chalcone является ароматный кетон и Enone который образует центральное ядро для множества важных биологических соединений, которые вместе известны как халконы или халконоиды. Альтернативные названия халкона включают бензилиденацетофенон, фенилстирилкетон, бензалацетофенон, β-фенилакрилофенон, γ-oxo-α,γ-дифенил-α-пропилен и α-фенил-β-бензоилэтилен.
Химические свойства
Халконы имеют два максимума поглощения при 280 нм и 340 нм.[3]
Химические реакции
Синтез
Халконы могут быть приготовлены альдольная конденсация между бензальдегид и ацетофенон в присутствии едкий натр как катализатор.[4][5]
Эта реакция может быть проведена без растворителя в качестве твердое состояние реакция.[6] Реакция между замещенными бензальдегидами и ацетофенонами может быть использована в качестве примера зеленая химия в бакалавриате.[7] В исследовании по изучению зеленого синтеза халконы были синтезированы из тех же исходных материалов в высокотемпературной воде (от 200 до 350 ° C).[8]
Замещенные халконы также синтезировали опосредованной пиперидином конденсации, чтобы избежать побочных реакций, таких как множественная конденсация, полимеризация и перегруппировка.[9]
Другие реакции
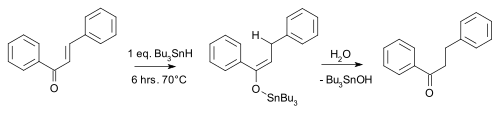
Примером может служить сопряженная редукция из enone гидрид трибутилолова:[10]
3,5-дизамещенный 1ЧАС-пиразолы могут быть получены из замещенного подходящим образом халкона реакцией с гидразингидрат в присутствии элементалей сера[11] или же персульфат натрия,[12] или используя гидразон в этом случае азин производится как побочный продукт. Частный случай образования 3,5-дифенил-1ЧАС-пиразол из самого халкона может быть представлен как:[13]
Возможная фармакология
Халконы и их производные демонстрируют широкий спектр биологической активности, включая противовоспалительную.[14] Некоторые 2'-аминохалконы были изучены как потенциальные противоопухолевые средства.[15][16]Терапевтическое (противораковое, антибактериальное, противогрибковое, противовирусное, противоамеобное, противомалярийное, противотуберкулезное, нематицидное, антиоксидантное, ингибиторы против различных терапевтических целей и т. Д.), Каталитическое, химиочувствительное , и фотосенсибилизирующие потенциалы различных комплексов металл (железо, рутений, платина, медь, цинк, кобальт, марганец, никель, осмий, хром, теллур, бор, вольфрам и кремний) -халкон. [17]
Перспективы ингибирования биологической мишени
Некоторые природные и (полусинтетические) халконы проявили противораковую активность из-за их ингибирующего потенциала против различных мишеней, а именно, члена 2 суперсемейства АТФ-связывающих кассет G (ABCG2), P-гликопротеина (P-gp), белка устойчивости к раку груди (BCRP), 5α-редуктаза, ароматаза, 17-β-гидроксистероиддегидрогеназа, гистондеацетилаза (HDAC) / сиртуин-1, протеасома, фактор роста эндотелия сосудов (VEGF), киназа рецептора фактора роста эндотелия сосудов-2 (VEGFR-2) , матриксные металлопротеиназы (ММП) -2/9, киназы Януса (JAK) / сигнальный преобразователь и активатор сигнальных путей транскрипционных белков (STAT), цикл деления клеток-25 (CDC25B), тубулин, катепсин-K, топоизомераза-II, Wingless сайт интеграции (Wnt), ядерный фактор, каппа-легкая цепь-энхансер активированных В-клеток (NF-κβ), гомолог B1 вирусного онкогена саркомы мыши v-raf (B-Raf), мишень рапамицина у млекопитающих (mTOR), и Т. Д. [18]Молекулы халкона заслуживают похвалы за то, что они являются потенциальными кандидатами для лечения диабета, которые действуют путем модуляции терапевтических мишеней гамма-рецептора, активируемого пролифератором пероксисом (PPAR-Γ), дипептидилпептидазы-4 (DPP-4), α-глюкозидазы, протеин-тирозинфосфатазы 1B (PTP1B), альдозоредуктаза и чувствительность тканей. [19]Халконы были идентифицированы как потенциальные противоинфекционные кандидаты, которые ингибируют различные паразитарные, малярийные, бактериальные, вирусные и грибковые мишени, такие как крузаин-1/2, трипанопаин-Tb, транс-сиалидаза, глицеральдегид-3-фосфатдегидрогеназа (GAPDH), фумаратредуктаза, фальципаин-1/2, β-гематин, топоизомераза-II, плазмепсин-II, лактатдегидрогеназа, протеинкиназы (Pfmrk и PfPK5), сорбитол-индуцированный гемолиз, рекомбинантный вирус денге 1 типа (DEN-1 NS3), грипп Вирус (H1N1), вирус иммунодефицита человека (ВИЧ-интеграза / протеаза), протеинтирозинфосфатаза A / B (Ptp-A / B), нитевидный термочувствительный мутант Z (FtsZ), синтез жирных кислот (FAS-II), лактат / изоцитратдегидрогеназа, откачивающий насос NorA, гираза дезоксирибонуклеиновой кислоты (ДНК), синтаза жирных кислот, хитинсинтаза, β- (1,3) -глюкансинтаза и т. д. [20]Халконы являются многообещающими кандидатами для ингибирования различных сердечно-сосудистых, гематологических и противодействующих ожирению мишеней, таких как ангиотензин-превращающий фермент (ACE), белок-переносчик сложного эфира холестерина (CETP), диацилглицерин-ацилтрансфераза (DGAT), ацил-коэнзим A: холестерин-ацилтрансфераза (ACE) панкреатическая липаза (PL), липопротеинлипаза (LPL), кальциевый (Ca2 +) / калиевый (K +) канал, тромбоксан (TXA2 и TXB2) и т. д. [21]Производные халкона продемонстрировали замечательную противовоспалительную активность благодаря их ингибирующему потенциалу против различных терапевтических мишеней, таких как циклооксигеназа (COX), липооксигеназа (LOX), интерлейкины (IL), простагландины (PGs), синтаза оксида азота (NOS), лейкотриен D4 (LTD4) ), ядерный фактор-κB (NFκB), молекула внутриклеточной клеточной адгезии-1 (ICAM-1), молекула адгезии сосудистых клеток-1 (VCAM-1), хемоаттрактантный белок моноцитов-1 (MCP-1), TLR4 / MD-2 , так далее. [22]
Смотрите также
Рекомендации
- ^ Индекс Merck, 11-е издание, 2028
- ^ «Переднее дело». Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 722. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Песня, Донг-ми; Юнг, Кён-Хун; Мун, Джи Хе; Шин, Дон-Мён (2003). «Фотохимия халкона и применение производных халкона в фото-выравнивающем слое жидкокристаллического дисплея». Оптические материалы. 21 (1–3): 667–71. Bibcode:2003ОптМа..21..667С. Дои:10.1016 / S0925-3467 (02) 00220-3.
- ^ Думитру, Сырбу; Ион, Марин (2011). «СИНТЕЗ И ИК, ЯМР-КАРАКТЕРИЗАЦИЯ НОВЫХ P- (N, N-ДИФЕНИЛАМИНО) ХАЛКОНОВ». Цитировать журнал требует
| журнал =(помощь) - ^ Гомес-Ривера, Авраам; Агилар-Марискаль, Хидеми; Ромеро-Серонио, Нэнси; Роа-де-ла-Фуэнте, Луис Ф .; Лобато-Гарсия, Карлос Э. (2013-10-15). «Синтез и противовоспалительная активность трех нитрохалконов». Письма по биоорганической и медицинской химии. 23 (20): 5519–5522. Дои:10.1016 / j.bmcl.2013.08.061. ISSN 0960-894X.
- ^ Тода, Фумио; Танака, Коичи; Хамай, Коки (1990). «Конденсации альдолов в отсутствие растворителя: ускорение реакции и усиление стереоселективности». Журнал химического общества, Perkin Transactions 1 (11): 3207–9. Дои:10.1039 / P19900003207.
- ^ Паллерос, Даниэль Р. (2004). «Синтез халконов без растворителей». Журнал химического образования. 81 (9): 1345. Bibcode:2004JChEd..81.1345P. Дои:10.1021 / ed081p1345.
- ^ Комисар, Крейг М; Сэвидж, Филипп Э (2004). «Кинетика скрещенных альдольных конденсаций в высокотемпературной воде». Зеленая химия. 6 (4): 227–31. Дои:10.1039 / b314622g.
- ^ Venkatesan, P; Сумати, S (2009). «Пиперидин-опосредованный синтез н-гетероциклических халконов и их антибактериальная активность». Журнал гетероциклической химии. 47 (1): 81–84. Дои:10.1002 / jhet.268.
- ^ Leusink, A.J; Нольтес, Дж. Г. (1966). «Реакция оловоорганических гидридов с α, β-ненасыщенными кетонами». Буквы Тетраэдра. 7 (20): 2221–5. Дои:10.1016 / S0040-4039 (00) 72405-1. HDL:1874/17014.
- ^ Утирит, Моха; Лебрини, Муним; Лагрене, Мишель; Бентисс, Фуад (2008). «Новый одностадийный синтез 3,5-дизамещенных пиразолов при микроволновом облучении и классическом нагревании». Журнал гетероциклической химии. 45 (2): 503–5. Дои:10.1002 / jhet.5570450231.
- ^ Чжан, Цзэ; Тан, Я-Джун; Ван, Чунь-Шань; У, Хао-Хао (2014). «Синтез в одном резервуаре 3,5-дифенил-1H-пиразолов из халконов и гидразина при механохимической шаровой мельнице». Гетероциклы. 89: 103–12. Дои:10.3987 / COM-13-12867.
- ^ Ласри, Джамал; Исмаил, Али И. (2018). «Без металлов и FeCl3-каталитический синтез азинов и 3,5-дифенил-1ЧАС-пиразол из гидразонов и / или кетонов под контролем ESI высокого разрешения+-РС". Индийский химический журнал, раздел B. 57B (3): 362–373.
- ^ Махапатра, Дебарши Кар; Бхарти, Санджай Кумар; Асати, Вивек (2017). «Производные халкона: противовоспалительный потенциал и перспективы молекулярных мишеней». Актуальные темы медицинской химии. 17 (28): 3146–3169. Дои:10.2174/1568026617666170914160446. PMID 28914193.
- ^ Ся, Йи; Ян, Чжэн-Ю; Ся, Пэн; Bastow, Kenneth F .; Наканиши, Юка; Ли, Куо-Сюн (2000). «Противоопухолевые средства. Часть 202: Новые 2'-амино халконы: дизайн, синтез и биологическая оценка». Письма по биоорганической и медицинской химии. 10 (8): 699–701. Дои:10.1016 / S0960-894X (00) 00072-X. ISSN 0960-894X. PMID 10782667.
- ^ Сантос, Мариана Б .; Pinhanelli, Vitor C .; Garcia, Mayara A.R .; Сильва, Габриэль; Baek, Seung J .; França, Suzelei C .; Fachin, Ana L .; Маринс, Моцарт; Регасини, Луис О. (2017). «Антипролиферативная и проапоптотическая активность 2'- и 4'-аминохалконов против опухолевых клеток собак» (PDF). Европейский журнал медицинской химии. 138: 884–889. Дои:10.1016 / j.ejmech.2017.06.049. HDL:11449/174929. ISSN 0223-5234.
- ^ Махапатра, Д. К., Бхарти, С. К., Асати, В., и Синг, С. К. (2017). Перспективы предпочтительных в медицине координационных соединений металлов на основе халконов для биомедицинских приложений. Европейский журнал медицинской химии, 174, 142-158. DOI: https://doi.org/10.1016/j.ejmech.2019.04.032
- ^ Махапатра, Д. К., Бхарти, С. К., и Асати, В. (2015). Противораковые халконы: структурные и молекулярные перспективы. Европейский журнал медицинской химии, 98, 69-114. DOI: https://doi.org/10.1016/j.ejmech.2015.05.004
- ^ Махапатра, Д. К., Асати, В., и Бхарти, С. К. (2015). Халконы и их терапевтические мишени для лечения диабета: структурные и фармакологические перспективы. Европейский журнал медицинской химии, 92, 839-865. DOI: https://doi.org/10.1016/j.ejmech.2015.01.051
- ^ Махапатра, Д. К., Бхарти, С. К., и Асати, В. (2015). Халконовые скаффолды как противоинфекционные средства: структурные и молекулярные перспективы. Европейский журнал медицинской химии, 101, 496-524. DOI: https://doi.org/10.1016/j.ejmech.2015.06.052
- ^ Махапатра, Д. К., и Бхарти, С. К. (2016). Лечебный потенциал халконов как сердечно-сосудистых агентов. Науки о жизни, 148, 154-172. DOI: https://doi.org/10.1016/j.lfs.2016.02.048
- ^ Махапатра, Д. К., Бхарти, С. К., и Асати, В. (2017). Производные халкона: противовоспалительный потенциал и перспективы молекулярных мишеней. Актуальные темы медицинской химии, 17 (28), 3146-3169. DOI: https://doi.org/10.2174/1568026617666170914160446