Редукция Кори – Ицуно - Corey–Itsuno reduction
Эта статья может требовать уборка встретиться с Википедией стандарты качества. (Январь 2011 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
| Редукция Кори – Ицуно | |
|---|---|
| Названный в честь | Элиас Джеймс Кори Шиничи Ицуно |
| Тип реакции | Органическая окислительно-восстановительная реакция |
| Идентификаторы | |
| Портал органической химии | Кори-бакши-шибата-сокращение |
В Редукция Кори – Ицуно, также известный как Сокращение Кори – Бакши – Шибата (КОС), представляет собой химическую реакцию, в которой ахиральный кетон энантиоселективно восстанавливается с образованием соответствующего хиральный, нерацемический спирт. Реагент оксазаборолидин, который опосредует энантиоселективное восстановление кетонов был ранее разработан лабораторией Ицуно, и, таким образом, это преобразование может более правильно называться восстановлением оксазаборолидина Ицуно-Кори.[1]

В 1981 году Ицуно и его коллеги впервые сообщили об использовании хиральных комплексов алкокси-амин-боран для восстановления ахиральных кетонов до хиральных спиртов энантиоселективно и с высоким выходом.[1] Несколько лет спустя, в 1987 г., Э. Дж. Кори с коллегами разработали реакцию между хиральными аминоспиртами и бораном (BH3), порождая оксазаборолидин продукты, которые, как было показано, быстро катализируют энантиоселективное восстановление ахиральных кетонов в присутствии BH3• THF.[2][3]
С тех пор восстановление CBS использовалось химиками-органиками как надежный метод асимметричного восстановления ахиральных кетонов. Примечательно, что он нашел широкое применение не только в синтезе ряда натуральных продуктов, но и в больших масштабах в промышленности (см. Объем Ниже). Опубликовано несколько обзоров.[4][5][6]
Механизм
Кори и соавторы первоначально предложили следующий механизм реакции, чтобы объяснить селективность, полученную при каталитическом восстановлении.[2][3]
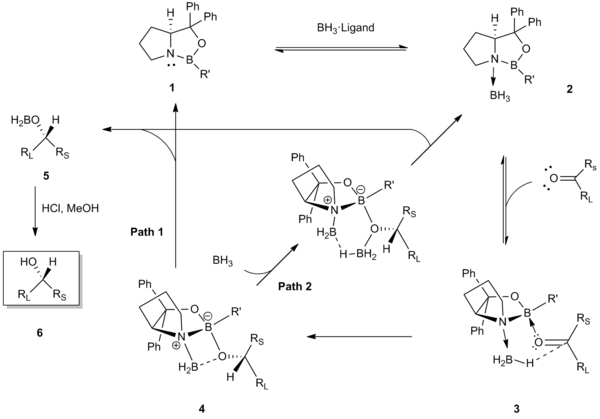
Первый шаг механизма предполагает согласование BH3 к атому азота оксазаборолидинового катализатора CBS 1. Эта координация служит для активации ЧД.3 в качестве донора гидрида и для повышения льюисовской кислотности эндоциклического бора катализатора.[5] Рентгеновские кристаллические структуры и 11Спектроскопический анализ ЯМР В координированного комплекса катализатор-боран 2 оказали поддержку на этом начальном этапе.[5][7] Впоследствии эндоциклический бор катализатора координируется с кетоном в стерически более доступной неподеленной паре электронов (то есть неподеленной паре ближе к меньшему заместителю, Rs). Эта преференциальная привязка в 3 действует, чтобы минимизировать стерические взаимодействия между кетоном (большой RL заместитель направлен в сторону) и группу R ’катализатора, и выравнивает карбонил и скоординированный боран для благоприятного лицевого селективного переноса гидрида через шестичленное переходное состояние 4.[8][9] Перенос гидрида дает хиральный алкоксиборан 5, который после кислотной обработки дает хиральный спирт 6. Последний этап регенерации катализатора может происходить двумя разными путями (Путь 1 или же 2).[10][11][12]
Преобладающей движущей силой этого избирательного по отношению к граням внутримолекулярного переноса гидрида является одновременная активация боранового реагента за счет координации с основным азотом Льюиса и повышения кислотности Льюиса эндоциклического атома бора для координации с кетоном.[5]
Объем и ограничения
Стерео и хемоселективность
Снижение количества CBS оказалось эффективным и действенным методом снижения широкого спектра различных типов кетонов как в стереоселективный и хемоселективный манера. Субстраты включают большое количество арилалифатических, диалифатических, диарильных, α, β ненасыщенных Enone и нет системы, а также кетоны, содержащие гетероатомы.[5][13] Для оптимизации энантиоселективности использовали комбинации различных производных катализатора CBS и борановых восстанавливающих агентов.

В этом выборе субстратов стоит отметить несколько интересных случаев. Во-первых, в случае дневной системы 9, относительно высокая стереоселективность достигается, несмотря на изостерическую природу кетоновых заместителей, предполагая, что электроника в дополнение к стерическим может играть роль в стереоселективности восстановления CBS.[5] Различия в замещении алкиновых фрагментов в инонах 11 и 12 приводит к изменению селективности функционирования алкина в качестве более стерически объемного заместителя, а не меньшего. Для α, β ненасыщенных систем 10-12, эффективное восстановление кетона происходит, несмотря на возможную побочную реакцию гидроборирования ненасыщенной связи C-C. Также было показано, что восстановление CBS допускает присутствие гетероатомов, как в кетоне. 13, который способен координироваться с бораном.
Экспериментальные соображения и ограничения
Было показано, что присутствие воды в реакционной смеси оказывает значительное влияние на энантиомерные избытки, и, таким образом, восстановление CBS необходимо проводить в безводных условиях.[14] Температура также играет решающую роль в наблюдаемой стереоселективности. Как правило, при более низких температурах получают энантиомерные избытки (ее). Однако при повышении температуры значения ee достигают максимального значения, которое зависит от структуры катализатора и используемого боранового восстановителя.[15] Использование боранового реагента катехолборана, который, как было показано, участвует в восстановлении CBS, проводимом при температурах до -126 ° C с заметной энантиоселективностью, предлагает потенциальное решение для улучшения уменьшенных значений ee, полученных при более низких температурах.[16][17]
Проблемы энантиоселективности, связанные с использованием BH3 в качестве восстановителя для снижения CBS. Коммерчески доступные решения BH3• THF оценивается крапивой и другие. было показано, что они содержат следовые количества боргидридных разновидностей, которые участвуют в неселективном восстановлении, что привело к снижению энантиоселективности.[18] Хотя путь восстановления, катализируемый борогидридом, намного медленнее, чем восстановление, катализируемое CBS, побочная реакция по-прежнему представляет потенциальную проблему для оптимизации стереоселективности.
В 2012 году Махале и другие. разработали безопасную и недорогую процедуру асимметричного восстановления кетонов с использованием на месте готовый N,N-диэтиланилин -боран и оксазаборолидиновый катализатор из боргидрида натрия, N,N-диэтиланилина гидрохлорид и (S) -α, α-дифенилпролинол [19]
Вариации
Хотя катализатор CBS 1 Разработанный Кори стал широко использоваться в реакции восстановления CBS, другие производные катализатора были разработаны и успешно используются. Группа R ’катализатора CBS играет важную роль в энантиоселективности восстановления, и, как показано выше в разделе« Объем », для оптимизации селективности использовались несколько вариаций группы R’ CBS.[5][13]
Приложения
За последние пару десятилетий сокращение CBS получило значительную синтетическую пользу в синтезе значительного числа натуральных продуктов, включая лактоны, терпеноиды, алкалоиды, стероиды и биотины.[5][6][20] Энантионелективное восстановление также широко применялось в промышленности. Джонс и другие. использовали снижение CBS в общем синтезе MK-0417, водорастворимого ингибитора карбоангидразы, который применялся терапевтически для снижения внутриглазного давления.[14] Асимметричное восстановление ключевого промежуточного бициклического сульфона было достигнуто с использованием оксазаборолидинового катализатора CBS, содержащего Me в качестве группы R ’.

Асимметричное восстановление 1,1,1-трихлор-2-кето соединения является первой стадией Реакция Кори – Линка для синтеза аминокислот и родственных структур с выбором естественной или неприродной стереохимии и различных боковых цепей.
Асимметричное восстановление 7- (Бензилокси) гепт-1-ен-3-она приводит к (S) -7- (Бензилокси) гепт-1-ен-3-олу, хиральному спирту, который непосредственно приводит к синтезу канамиенамиды, которые в настоящее время исследуются как энамид, содержащий простые эфиры енола, которые демонстрируют сильное ингибирование раковых клеток. Селективное образование хирального продукта достигается с помощью (R) -CBS катализатора с выходом 89% и с 91% энантиомерным избытком.[21]
Смотрите также
Рекомендации
- ^ а б Hirao, A .; Itsuno, S .; Nakahama, S .; Ямазаки, Н. (1981), "Асимметричное восстановление ароматических кетонов с помощью хиральных алкокси-аминоборановых комплексов", Журнал химического общества, химические коммуникации, 7 (7): 315, Дои:10.1039 / C39810000315
- ^ а б Кори, Э. Дж .; Бакши, Р. К .; Шибата, С. (1987), "Высокоэнантиоселективное борановое восстановление кетонов, катализируемое хиральными оксазаборолидинами. Механизм и синтетические последствия", Журнал Американского химического общества, 109 (18): 5551–5553, Дои:10.1021 / ja00252a056
- ^ а б Кори, Э. Дж .; Бакши, Р. К .; Shibata, S .; Chen, C.P .; Сингх В. К. (1987), "Стабильный и легко приготовленный катализатор для энантиоселективного восстановления кетонов. Применения для многостадийных синтезов", Журнал Американского химического общества, 109 (25): 7925–7926, Дои:10.1021 / ja00259a075
- ^ Deloux, L .; Сребник, М. (1993), "Асимметричные реакции, катализируемые бором", Химические обзоры, 93 (2): 763–784, Дои:10.1021 / cr00018a007
- ^ а б c d е ж грамм час Кори, Э. Дж .; Хелал, К. Дж. (1998), "Восстановление карбонильных соединений с помощью хиральных оксазаборолидиновых катализаторов: новая парадигма энантиоселективного катализа и новый мощный метод синтеза", Angewandte Chemie International Edition, 37 (15): 1986–2012, Дои:10.1002 / (sici) 1521-3773 (19980817) 37:15 <1986 :: aid-anie1986> 3.0.co; 2-z, PMID 29711061
- ^ а б Чо, Б. Т. (2006), «Последние достижения в синтетических применениях асимметричного восстановления, опосредованного оксазаборолидином», Тетраэдр, 62 (33): 7621–7643, Дои:10.1016 / j.tet.2006.05.036
- ^ Кори, Э. Дж .; Azimioara, M .; Саршар, С. (1992), "Рентгеновская кристаллическая структура хирального оксазаборолидинового катализатора для энантиоселективного восстановления карбонила", Буквы Тетраэдра, 33 (24): 3429–3430, Дои:10.1016 / s0040-4039 (00) 92654-6
- ^ Эванс, Д. (1988), "Стереоселективные органические реакции: катализаторы процессов присоединения карбонила", Наука, 240 (4851): 420–6, Bibcode:1988Научный ... 240..420E, Дои:10.1126 / science.3358127, PMID 3358127
- ^ Джонс, Д. К .; Liotta, D.C .; Shinkai, I .; Матре, Д. Дж. (1993), "Истоки энантиоселективности, наблюдаемые при катализируемом оксазаборолидином восстановлении кетонов", Журнал органической химии, 58 (4): 799–801, Дои:10.1021 / jo00056a001
- ^ Кори, Э. Дж. (1990), "Новые энантиоселективные пути получения биологически интересных соединений", Журнал Американского химического общества, 62 (7): 1209–1216, Дои:10.1351 / pac199062071209, S2CID 97731491
- ^ Невалайнен В. (1994), "Квантово-химическое моделирование хирального катализа. Часть 15. О роли гидридно-мостиковых комплексов боран-алкоксиборан в каталитическом энантиоселективном восстановлении кетонов под действием хиральных оксазаборолидинов", Тетраэдр: асимметрия, 5 (2): 289–296, Дои:10.1016 / s0957-4166 (00) 86186-8
- ^ Quallich, G.J .; Blake, J. F .; Woodall, T. M. (1994), "Комбинированное синтетическое и неэмпирическое исследование структуры хиральных оксазаборолидинов и взаимосвязей энантиоселективности", Журнал Американского химического общества, 116 (19): 8516–8525, Дои:10.1021 / ja00098a012
- ^ а б Quallich, G.J .; Woodall, T. M. (1993), "Энантиоселективное оксазаборолидиновое восстановление кетонов, содержащих гетероатомы", Буквы Тетраэдра, 34 (5): 785–788, Дои:10.1016 / 0040-4039 (93) 89012-ф
- ^ а б Jones, T. K .; Mohan, J. J .; Xavier, L.C .; Blacklock, T. J .; Mathre, D. J .; Sohar, P .; Jones, E. T. T .; Reamer, R.A .; Робертс, Ф. Э .; Грабовски, Э. Дж. Дж. (1991), "Асимметричный синтез МК-0417. Наблюдения за восстановлением, катализируемым оксазаборолидином", Журнал органической химии, 56 (2): 763–769, Дои:10.1021 / jo00002a050
- ^ Буллиард, Майкл (1999). «Глава 11.1: Асимметричное восстановление прохиральных кетонов, катализируемое оксазаборолидинами». В Агере, Дэвид (ред.). Справочник хиральных химикатов. Марсель Деккер. стр.211 –225. ISBN 0824710584.
- ^ Кори, Э. Дж .; Линк, Дж. О. (1989), «Новый хиральный катализатор для энантиоселективного синтеза вторичных спиртов и дейтерированных первичных спиртов путем восстановления карбонила», Буквы Тетраэдра, 30 (46): 6275–6278, Дои:10.1016 / s0040-4039 (01) 93871-7
- ^ Кори, Э. Дж .; Бакши, Р. К. (1990), "Новая система каталитического энантиоселективного восстановления ахиральных кетонов до хиральных спиртов. Синтез хиральных α-гидроксикислот", Буквы Тетраэдра, 31 (5): 611–614, Дои:10.1016 / s0040-4039 (00) 94581-7
- ^ Nettles, S.M .; Matos, K .; Burkhardt, E. R .; Rouda, D. R .; Корелла, Дж. А. (2002), "Роль стабилизатора NaBH 4 в катализируемом оксазаборолидином асимметричном восстановлении кетонов с помощью BH 3 - THF", Журнал органической химии, 67 (9): 2970–2976, Дои:10.1021 / jo016257c, PMID 11975554
- ^ Mahale, Rajendra D .; Chaskar, Sudhir P .; Патил, Киран Э .; Майкап, Голак Ц .; Гурджар, Мукунд К. (2012). «Восстановление кетонов Кори-Ицуно: разработка безопасного и недорогого процесса синтеза некоторых промежуточных продуктов API». Исследования и разработки в области органических процессов. 16 (4): 710–713. Дои:10.1021 / op300034u.
- ^ Стеммлер, Р. Т. (2007), "Оксазаборолидины CBS - универсальные катализаторы для асимметричного синтеза", Synlett, 2007 (6): 0997–0998, Дои:10.1055 / с-2007-973876
- ^ Prabhakar Reddy, D .; Чжан, Нин; Ю, Чжимэй; Ван, Чжэнь; Он, Юн (2017-10-02). «Полный синтез канамиенамида». Журнал органической химии. 82 (20): 11262–11268. Дои:10.1021 / acs.joc.7b01984. ISSN 0022-3263. PMID 28944669.
