Дэвид М. Лемаль - David M. Lemal - Wikipedia
Дэвид М. Лемаль (1934 г.р.) - почетный профессор химии имени Альберта В. Смита и профессор-исследователь химии в Дартмутский колледж.[1][2][3] Он получил A.B. степень (сумма) от Амхерст Колледж в 1955 г. и докторскую степень. по химии из Гарвардский университет в 1959 году. В Гарварде он работал с Р. Б. Вудворд на дезоксисахарах и синтез алкалоида йохимбина.[4]
Исследования и обучение
Лемаль начал свою независимую академическую карьеру в Университет Висконсина в Мэдисоне сначала инструктором (1958–60), а затем доцентом (1960–65). В 1965 году поступил на химический факультет Дартмутский колледж и стал профессором в 1969 году. Он возглавлял кафедру с 1976 по 1979 год. В 1981 году он был назначен профессором химии имени Альберта В. Смита. В Висконсине Лемал на протяжении всей карьеры проявлял интерес к сильно напряженным молекулам, короткоживущим видам и согласованным реакциям. В конце 1960-х он увлекся химией фторорганических соединений, которая остается основным направлением его исследований. Лемаль был активным участником Гордонские исследовательские конференции. В 1970 году он председательствовал на конференции GRC по химии углеводородов, в 1971 году - на конференции GRC по гетероциклическим соединениям; он был членом Попечительского совета (1973–79; председатель, 1977–78). Он был сопредседателем международных зимних конференций по фтору в 1987 и 1989 годах, затем в 1990 году возглавил фторное отделение Американского химического общества. С 1996 по 2004 год он работал в Комитете Общества по науке. В 2005 году Лемаль ушел с преподавания и стал профессором-исследователем химии, продолжая работать в области синтеза фторорганических соединений до 2016 года. За свою карьеру Лемал руководил исследованиями более ста студентов, аспирантов и докторантов, а также преподавал курсы химии для 50 лет.[1]
Почести и награды
Лемал был удостоен награды стипендиата Национального научного фонда (1955–58) и научного сотрудника Фонда Альфреда П. Слоана (1968–70). В 1987 году он получил награду Ассоциации производителей химической продукции Catalyst Award. В 1989 году Совет по развитию и поддержке образования назвал его профессором года Нью-Гэмпшира. Он был награжден премией президента Дартмута за выдающиеся лидерские качества и достижения (1991) и премией имени Роберта А. Фиша за выдающийся вклад в обучение студентов (1996). В 2002 году он выиграл премию Американского химического общества за творческую работу в области химии фтора. В 2011 году Лемаль стал членом Американского химического общества.[1]
Избранные исследования
Некоторые контрасты углеводород-фторуглерод[5]
Синтезировав и изучив гексаметилпризман в 1966 г.,[6] Группу Лемаля интересовало, каким образом призман, замещенный акцепторными электронами вместо донорных групп, будет отличаться по природе и реакционной способности. Это привело к парофазному фотолизу перфторгексаметилбензола (1), что дало не только присману (2), а бензол Дьюара (3) и бензвален (4) также.[7] Группа англичан независимо сделала то же открытие.[8] Эти напряженные молекулы были удивительно прочными и термически стабильными по сравнению с их довольно хрупкими углеводородными аналогами, и этот интригующий контраст привел к дальнейшим исследованиям химии фторуглеродов.
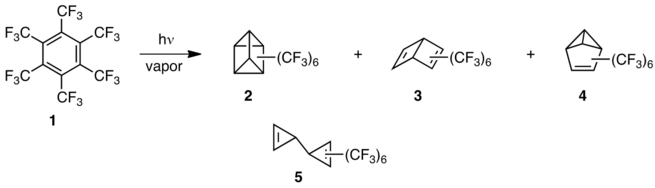
Позже они синтезировали перфторгексаметилбициклопропенил (5), чтобы конкретизировать первый полный набор изомеров валентности бензола.[9] Это соединение термически перестраивается в 1 с периодом полураспада ≥ 2 ч при 360 ° C по сравнению с исходным углеводородом, который полимеризуется при -10 ° C.[10] Лемал придумал термин «перфторалкильный эффект» для обозначения смеси стабилизирующих влияний, термодинамических и кинетических, которые перфторалкильные группы оказывают на сильно напряженные углеродные каркасы.[11] Эффект оказался общим, но если фтор вместо перфторалкильных групп украшает углеродный скелет, поведение может быть совсем другим, как показывает следующий пример.
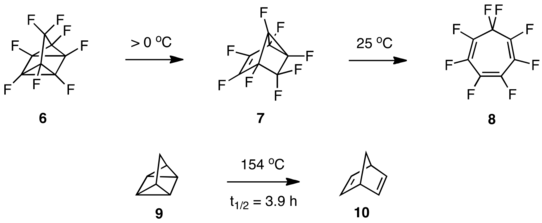
Другой случай противоречивой химии возник, когда группа Лемала приготовила перфторквадрициклан (6) путем фотореакции при -30 ° C и позволили ему нагреться выше 0 ° C.[12] Перегруппировка в трициклический изомер 7 произошел, и дальнейшее нагревание до комнатной температуры давало перфтортропилиден (8). Родительский квадрициклан (9) вместо этого перестраивается на норборнадиен (10) в гораздо более жестких условиях.[13]
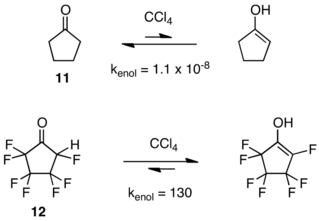
На кето-енольное равновесие сильно влияет замещение фтора. В отличие от кетонов, производных от углеводородов, енольные таутомеры которых обычно присутствуют только в следовых количествах при равновесии, фторированные кетоны иногда гораздо менее стабильны, чем их енолы.[14][15][16][17] Кето-енольные равновесия для циклопентанона (11) и гептафторциклопентанон (12) являются показательными.[16]
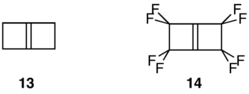
Сильно напряженные и высокореакционные алкены бицикло [2.2.0] гекс-1 (4) -ен (13) и его перфторированный аналог 14 обеспечивают еще один замечательный контраст в стабильности. В то время как 13 димеризуется и полимеризуется при температуре ниже 0 ° C,[18] 14 выдерживает нагревание до 140 ° C и не образует димеры ни при каких условиях.[19]
Циклические согласованные преобразования
В 1966 году Лемаль и его коллеги изучили класс реакций, которые впоследствии стали называть хелетропными, циклическими согласованными процессами, в которых две связи образуются или разрываются в одном и том же атоме. Обнаружив, что они происходят стереоспецифично, результаты основывались на идеях Вудворда и Хоффмана о независимой разработке теории этого класса преобразований, объясняющей экспериментальные результаты группы, показанные здесь:[20][21]
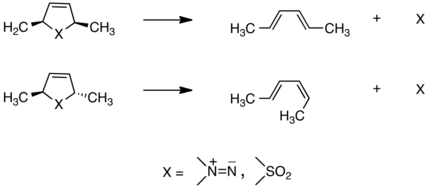
Десять лет спустя, когда было общепризнано, что все циклические согласованные процессы (названные перициклическими) подчиняются правилам орбитальной симметрии Вудворда-Хоффмана (из которых правила для хелетропных реакций являются подмножеством), Лемаль и его сотрудники обнаружили чрезвычайно легкую вырожденную перегруппировку. это заставило их бросить вызов этому убеждению.[22] Группа S = O в молекуле ниже ступенчато движется вокруг 4-членной с экстраполированной константой скорости 70 миллионов с.−1 при 25 ° C![23]

Учитывая молекулярную геометрию, исследователи предположили, что это может произойти только в том случае, если неподеленная пара серы образует новую связь S-C, поскольку электронная пара разрывающейся связи S-C становится новой неподеленной парой. Позже было показано, что это неверно,[24][25] эта идея, тем не менее, привела к ключевому открытию. Лемаль и его коллеги признали, что существует множество циклических согласованных процессов, в которых несвязывающие и связывающие электроны могут меняться ролями, процессы, которые не подчиняются правилам орбитальной симметрии. Это привело к сроку псевдоперициклический.[22] Идея хорошо иллюстрируется пиролизом сложного эфира, который, как было показано, протекает через плоское переходное состояние:

У карбонильного кислорода неподеленная пара образует связь с водородом, а пи-связь становится новой неподеленной парой. Поскольку эти орбитали лежат в перпендикулярных плоскостях и, таким образом, ортогональны, в циклической орбитальной решетке фактически существует «разъединение», которое освобождает реакцию от ограничений орбитальной симметрии.
Вера в правила была такова, что идея псевдоперициклических реакций игнорировалась почти 20 лет, но затем Дэвид Бирни Техасского технологического института взялись за дело.[25] В ходе длительного и непрерывного исследования, в котором эксперимент и вычисления были объединены с большим эффектом, его группа, а затем и другие, установили, что есть псевдоперициклические примеры, которые можно найти во всех классах циклических согласованных процессов.
«Равновесие Ванзлика»
В 1960 году Ванзлик сообщил, что тетрааминоэтилен 1 легко диссоциирует на половинки диаминокарбена,[26] и последовала длинная серия статей его группы, описывающих интересные реакции 1 интерпретируется как происходящее из карбена. На основе перекрестного эксперимента Лемаль и его коллеги показали в 1964 году, что 1 не диссоциирует даже в самых сильных условиях, которые использовал Ванзлик.[27] Химия реакции была объяснена с точки зрения электрофильной атаки на тетрааминоэтилен с последующим разрывом центральной связи.
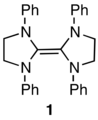
Много лет спустя, в 1991 году, Ардуенго сделал поразительное открытие, что диаминокарбены со структурой 2 стабильны и не димеризуются.[28] Это побудило Денка в 1999 году повторить эксперимент Лемаля с кроссовером, найти кроссовер и, таким образом, сделать вывод, что Ванзлик был прав в отношении диссоциации.[29] Группа Лемала отреагировала тем, что повторила работу самостоятельно, и показала, что устранение электрофильного катализа предотвратило возникновение кроссовера, таким образом подтвердив результат, полученный Лемалом 36 лет назад.[30]

Выбрав диаминокарбеновую структуру, промежуточную по характеру между карбенами Ванзлика и Ардуенго, группа Лемаля нашла и изучила пару карбен-димер, которая действительно существует в равновесии.[31] Здесь димер (3) лежит примерно на 5 ккал / моль ниже своих «половинок» (4) в свободной энергии при 25 ° C.

Другие соединения из лаборатории Lemal
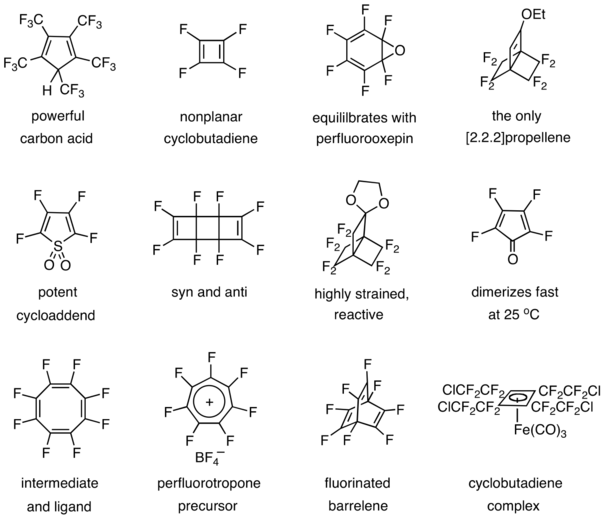
Другие вклады включают подготовку и исследования мощной угольной кислоты,[32] тетрафторциклобутадиен,[33][34] оксид гексафторбензола,[35][36] [2.2.2] пропеллен,[37] диоксид тетрафтортиофена,[38] октафтортрициклооктадиен,[39] высокореактивное топливо,[40] тетрафторциклопентадиенон,[41] октафторциклооктатетраен,[42] соль гептафтортропилия, октафторбаррелен,[43] и циклобутадиеновый комплекс.[44]
Рекомендации
- ^ а б c "Дэвид М. Лемаль". Dartmouth.edu. Получено 17 декабря, 2016.
- ^ "Лемаль, Дэвид М." WorldCat.org. Получено 17 декабря, 2016.
- ^ "Дэвид Лемаль". Dartmouth.edu. Получено 17 декабря, 2016.
- ^ Химия фтора на пороге тысячелетия: увлеченные фтором. Глава 20: Порка фторуглеродов. Эльзевир. 2000 г.
- ^ Лемаль, Дэвид М. (2004-01-01). «Перспективы химии фторуглеродов». Журнал органической химии. 69 (1): 1–11. Дои:10.1021 / jo0302556. ISSN 0022-3263. PMID 14703372.
- ^ Lemal, Дэвид М .; Локенсгард, Джерролд П. (1966-12-01). «Гексаметилпризман». Журнал Американского химического общества. 88 (24): 5934–5935. Дои:10.1021 / ja00976a046. ISSN 0002-7863.
- ^ Lemal, Дэвид М .; Старос, Джеймс V .; Остель, Фольхард (1969-06-01). «Валентные изомеры (CCF3) 6 [гексакис (трифторметил) бензола]». Журнал Американского химического общества. 91 (12): 3373–3374. Дои:10.1021 / ja01040a047. ISSN 0002-7863.
- ^ Barlow, M. G .; Haszeldine, R.N .; Хаббард, Р. (1969-01-01). «Изомеры с валентной связью гексакис (трифторметил) - и гексакис (пентафторэтил) бензолов». Журнал химического общества D: Химические коммуникации. 0 (5): 202–203. Дои:10.1039 / C29690000202. ISSN 0577-6171.
- ^ Grayston, Майкл У .; Лемаль, Дэвид М. (1976-03-01). «Перфторгексаметилбициклопропенил». Журнал Американского химического общества. 98 (5): 1278–1280. Дои:10.1021 / ja00421a048. ISSN 0002-7863.
- ^ Billups, W. E .; М. Хейли, Майкл; Бозе, Роланд; Блейзер, Дитер (1 января 1994). «Синтез бициклопропенилов». Тетраэдр. Международный журнал быстрой публикации Critical. 50 (36): 10693–10700. Дои:10.1016 / S0040-4020 (01) 89261-9.
- ^ Lemal, D. M .; Данлэп, Л. Х. (1972-09-01). «Кинетика и термодинамика превращений валентных изомеров (CCF3) 6». Журнал Американского химического общества. 94 (18): 6562–6564. Дои:10.1021 / ja00773a061. ISSN 0002-7863.
- ^ Дейли, Уильям П .; Лемаль, Дэвид М. (1984-02-01). «Перфтортропилиденовые валентные изомеры и перфтортропилиевый ион». Журнал Американского химического общества. 106 (4): 1169–1170. Дои:10.1021 / ja00316a087. ISSN 0002-7863.
- ^ Dauben, William G .; Каргилл, Роберт Л. (1961-01-01). «Фотохимические превращения - VIII». Тетраэдр. 15 (1): 197–201. Дои:10.1016/0040-4020(61)80026-4.
- ^ Correa, Ricardo A .; Линднер, Патрик Э .; Лемаль, Дэвид М. (1994-11-01). «Новые кето-енольные системы». Журнал Американского химического общества. 116 (23): 10795–10796. Дои:10.1021 / ja00102a059. ISSN 0002-7863.
- ^ Линднер, Патрик Э .; Correa, Ricardo A .; Джино, Джеймс; Лемаль, Дэвид М. (1996-01-01). "Новые кето-енольные системы: производные циклобутана". Журнал Американского химического общества. 118 (11): 2556–2563. Дои:10.1021 / ja952998h. ISSN 0002-7863.
- ^ а б Линднер, Патрик Э .; Лемаль, Дэвид М. (1996-01-01). «Сильно фторированные циклопентаноны и их енолы». Журнал органической химии. 61 (15): 5109–5115. Дои:10.1021 / jo9602940. ISSN 0022-3263.
- ^ Линднер, Патрик Э .; Лемаль, Дэвид М. (1997-04-01). «Перфторированные циклические и ациклические кето-енольные системы: замечательный контраст». Журнал Американского химического общества. 119 (14): 3259–3266. Дои:10.1021 / ja963788n. ISSN 0002-7863.
- ^ Wiberg, Kenneth B .; Маттурро, Майкл Дж .; Окарма, Пол Дж .; Джейсон, Марк Э .; Дейли, Уильям П .; Burgmaier, Джордж Дж .; Бейли, Уильям Ф .; Уорнер, Филип (1986-01-01). «Бицикло [2.2.0] гекс-1 (4) -ен». Тетраэдр. 42 (6): 1895–1902. Дои:10.1016 / S0040-4020 (01) 87609-2.
- ^ Джанк, Кристофер П .; Он, Иган; Чжан, Инь; Smith, Joshua R .; Глейтер, Рольф; Касс, Стивен Р .; Jasinski, Jerry P .; Лемаль, Дэвид М. (06.02.2015). «Синтез и свойства деформированного алкенового перфторбицикло [2.2.0] гекс-1 (4) -ена». Журнал органической химии. 80 (3): 1523–1532. Дои:10.1021 / jo502456h. ISSN 0022-3263. PMID 25574561.
- ^ Lemal, Дэвид М .; МакГрегор, Стэнли Д. (1966-03-01). «Диены из 3-пирролинов. Стереоспецифическое дезаминирование». Журнал Американского химического общества. 88 (6): 1335–1336. Дои:10.1021 / ja00958a056. ISSN 0002-7863.
- ^ МакГрегор, Стэнли Д .; Лемаль, Дэвид М. (1966-06-01). «Фрагментации. Термическое 5 → 4 + 1 Реакция1». Журнал Американского химического общества. 88 (12): 2858–2859. Дои:10.1021 / ja00964a048. ISSN 0002-7863.
- ^ а б Росс, Джеймс А .; Seiders, Reginald P .; Лемаль, Дэвид М. (1976-07-01). «Чрезвычайно легкая автомеризация сульфоксида». Журнал Американского химического общества. 98 (14): 4325–4327. Дои:10.1021 / ja00430a060. ISSN 0002-7863.
- ^ Бушвеллер, К. Хакетт; Росс, Джеймс А .; Лемаль, Дэвид М. (1977-01-01). «Автомеризация тиофена Дьюара и его экзо-S-оксида. Драматический контраст». Журнал Американского химического общества. 99 (2): 629–631. Дои:10.1021 / ja00444a063. ISSN 0002-7863.
- ^ Снайдер, Джеймс П .; Халгрен, Томас А. (1980-04-01). «Сероорганические механизмы. 11. [1,3] -Сигматропные сдвиги для 5-X-бицикло [2.1.0] пент-2-енов. Оценка псевдоперициклической модели». Журнал Американского химического общества. 102 (8): 2861–2863. Дои:10.1021 / ja00528a069. ISSN 0002-7863.
- ^ а б Бирни, Дэвид М .; Вагенселлер, П. Юджин (1994-07-01). "Изучение реакционной способности формилкетена ab Initio. Возвращение к псевдоперициклическим реакциям". Журнал Американского химического общества. 116 (14): 6262–6270. Дои:10.1021 / ja00093a028. ISSN 0002-7863.
- ^ Wanzlick, H.-W .; Шикора, Э. (1960-07-21). "Ein neuer Zugang zur Carben-Chemie". Angewandte Chemie. 72 (14): 494. Дои:10.1002 / ange.19600721409. ISSN 1521-3757.
- ^ Lemal, Дэвид М .; Ловальд, Роджер А .; Кавано, Кеннет И. (1964-06-01). «Тетрааминоэтилены. Вопрос о диссоциации». Журнал Американского химического общества. 86 (12): 2518–2519. Дои:10.1021 / ja01066a044. ISSN 0002-7863.
- ^ Ардуенго, Энтони Дж .; Харлоу, Ричард Л .; Клайн, Майкл (1991-01-01). «Стабильный кристаллический карбен». Журнал Американского химического общества. 113 (1): 361–363. Дои:10.1021 / ja00001a054. ISSN 0002-7863.
- ^ Денк, Майкл К .; Хатано, Кен; Ма, Мартин (1999-03-12). «Нуклеофильные карбены и равновесие Ванзлика: повторное исследование». Буквы Тетраэдра. 40 (11): 2057–2060. Дои:10.1016 / S0040-4039 (99) 00164-1.
- ^ Лю, Юфа; Лемаль, Дэвид М (2000-01-29). "Относительно равновесия Ванзлика'". Буквы Тетраэдра. 41 (5): 599–602. Дои:10.1016 / S0040-4039 (99) 02161-9.
- ^ Лю, Юфа; Линднер, Патрик Э .; Лемаль, Дэвид М. (1999-11-01). «Термодинамика равновесия диаминокарбен-тетрааминоэтилен». Журнал Американского химического общества. 121 (45): 10626–10627. Дои:10.1021 / ja9922678. ISSN 0002-7863.
- ^ Лаганис, Эван Д .; Лемаль, Дэвид М. (1980-10-08). «Стереоспецифическое 1,3-диполярное циклоэлиминирование в напряженных пиразолинах». Журнал Американского химического общества. 102 (21): 6634–6636. Дои:10.1021 / ja00541a076. ISSN 0002-7863.
- ^ Петерссон, Э. Джеймс; Fanuele, Jason C .; Nimlos, Mark R .; Lemal, Дэвид М .; Эллисон, Дж. Барни; Радзишевский, Дж. Джордж (1997-11-01). «Непланарность тетрафторциклобутадиена». Журнал Американского химического общества. 119 (45): 11122–11123. Дои:10.1021 / ja971930u. ISSN 0002-7863.
- ^ Gerace, M. J .; Lemal, D. M .; Эртл, Х. (1975-09-01). «Тетрафторциклобутадиен». Журнал Американского химического общества. 97 (19): 5584–5586. Дои:10.1021 / ja00852a046. ISSN 0002-7863.
- ^ Такенака, Натали Э .; Хэмлин, Роберт; Лемаль, Дэвид М. (1990-08-01). «Гексафторбензол оксид и гексафтороксепин». Журнал Американского химического общества. 112 (18): 6715–6716. Дои:10.1021 / ja00174a043. ISSN 0002-7863.
- ^ Химия синтетического фтора. Вайли. 1992-08-11. ISBN 978-0-471-54370-1.
- ^ Джанк, К. П., докторская диссертация, Дартмутский колледж, 2000, стр. 51-54, 94, 95
- ^ Lemal, Дэвид М .; Акаши, Марк; Лу, Ян; Кумар, Вивек (2013-12-20). «Тетрафтортиофен S, S-диоксид: перфторированный строительный блок». Журнал органической химии. 78 (24): 12330–12337. Дои:10.1021 / jo402373x. ISSN 0022-3263. PMID 24313897.
- ^ Barefoot, A. C .; Saunders, W. D .; Бузби, Джон М .; Grayston, M.W .; Лемаль, Д. М. (1980-10-01). «Конфигурации и химия перфтортрицикло [4.2.0.02,5] окта-3,7-диенов». Журнал органической химии. 45 (22): 4292–4295. Дои:10.1021 / jo01310a008. ISSN 0022-3263.
- ^ Он, Иган; Джанк, Кристофер П .; Коули, Джон Дж .; Лемаль, Дэвид М. (01.05.2003). «Замечательный [2.2.2] пропеллан». Журнал Американского химического общества. 125 (19): 5590–5591. Дои:10.1021 / ja030077y. ISSN 0002-7863. PMID 12733871.
- ^ Grayston, M.W .; Saunders, W. D .; Лемаль, Д. М. (1980-01-01). «Перфторциклопентадиенон». Журнал Американского химического общества. 102 (1): 413–414. Дои:10.1021 / ja00521a088. ISSN 0002-7863.
- ^ Lemal, Дэвид М .; Бузби, Джон М .; Barefoot, Aldos C .; Grayston, Майкл У .; Лаганис, Эван Д. (1 июля 1980 г.). «Новый синтез перфторциклооктатетраена». Журнал органической химии. 45 (15): 3118–3120. Дои:10.1021 / jo01303a037. ISSN 0022-3263.
- ^ Ралли, Филипп; Чжан, Инь; Лемаль, Дэвид М. (22 декабря 2008 г.). «Перфторбаррелен». Буквы Тетраэдра. 49 (52): 7349–7351. Дои:10.1016 / j.tetlet.2008.10.017.
- ^ Smith, Joshua R .; Лемаль, Дэвид М. (2000-03-01). «Синтетические подходы к фторированному тетраэдрану». Журнал химии фтора. 102 (1–2): 323–332. Дои:10.1016 / S0022-1139 (99) 00297-3.
