Экзэргоническая реакция - Exergonic reaction
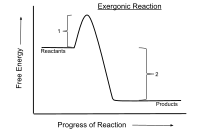
An экзэргоническая реакция это химическая реакция где изменение свободная энергия отрицательный (чистый выброс свободной энергии).[1] Это указывает на спонтанная реакция если система закрыто и начальная и конечная температуры одинаковы. Для процессов, происходящих в замкнутой системе при постоянном давлении и температуре, Свободная энергия Гиббса используется, тогда как Энергия Гельмгольца актуально для процессов, протекающих при постоянном объеме и температуре. Любая реакция, протекающая при постоянной температуре без подвода электрической или фотонной энергии, является экергонической, согласно второй закон термодинамики. Примером является клеточное дыхание.
Символически высвобождение свободной энергии, г, в экзергонической реакции (при постоянных давлении и температуре) обозначается как
Хотя говорят, что происходят экзэргонические реакции спонтанно, это не означает, что реакция будет происходить при наблюдаемой ставка. Например, диспропорционирование перекиси водорода высвобождает свободную энергию, но происходит очень медленно в отсутствие подходящего катализатора. Было высказано предположение, что жаждущий было бы более интуитивным термином в этом контексте.[2]
В более общем плане термины экзергонический и эндергонический относятся к свободная энергия изменение любого процесса, а не только химических реакций. Напротив, условия экзотермический и эндотермический относятся к энтальпия изменение в закрытой системе во время процесса, обычно связанное с обменом высокая температура.
Смотрите также
Рекомендации
- ^ ИЮПАК Золотая книга определение: экзэргоническая реакция (экзоэргическая реакция)
- ^ Хамори, Евгений; Джеймс Э. Малдри (1984). «Использование слова« нетерпеливый »вместо« спонтанного »для описания экзэргонических реакций». Журнал химического образования. 61 (8): 710. Bibcode:1984JChEd..61..710H. Дои:10.1021 / ed061p710.

