Рибозим вируса гепатита дельта - Hepatitis delta virus ribozyme
| Рибозим вируса гепатита дельта | |
|---|---|
 Предсказанный вторичная структура и сохранение последовательности рибозима HDV | |
| Идентификаторы | |
| Символ | HDV_ribozyme |
| Рфам | RF00094 |
| Прочие данные | |
| РНК тип | Ген; рибозим |
| Домен (ы) | Вирусы |
| ТАК | ТАК: 0000374 |
| PDB структуры | PDBe |
В рибозим вируса гепатита дельта (HDV) это некодирующая РНК найдено в вирус гепатита дельта это необходимо для репликации вируса, и это единственный известный человеческий вирус, который использует активность рибозима для заражения своего хозяина.[1] В рибозим действует для обработки транскриптов РНК до единиц длины в реакции саморасщепления во время репликации вируса гепатита дельта, который, как полагают, распространяется по механизму двойного катящегося круга.[2][3] Рибозим активен in vivo в отсутствие каких-либо белковых факторов и была самой быстрой из известных естественных саморасщепляющихся РНК на момент своего открытия.[4]
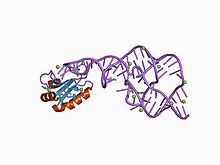
Кристаллическая структура этого рибозима была решена с использованием Рентгеновская кристаллография и показаны пять спиральных сегментов, соединенных двойным псевдоузел.[1]
Помимо смысла (геномная версия), все вирусы HDV также имеют антигеномный версия рибозима HDV.[5] Эта версия не является точной комплементарной последовательностью, но имеет ту же структуру, что и смысловая (геномная) цепь. Единственные «существенные» различия между ними - это небольшая выпуклость на стержне P4 и более короткое соединение J4 / 2. Для репликации необходимы как геномные, так и антигеномные рибозимы.[2]
HDV-подобные рибозимы
Рибозим HDV структурно и биохимически родственен многим другим саморасщепляющимся рибозимам. Эти другие рибозимы часто называют примерами рибозимов HDV из-за их сходства, даже если они не обнаружены в вирусах гепатита дельта. Их также можно назвать «подобными HDV», чтобы указать на этот факт.[6]
HDV-подобные рибозимы включают рибозим CPEB3 млекопитающих, ретротранспозоны члены (например, в R2 элемент РНК у насекомых и в L1Tc и, вероятно, в других ретротранспозонах у трипаносоматид) и в последовательностях бактерий.[7][8][6][9][10] Группировка, вероятно, является результатом конвергентная эволюция: Дельтавирус обнаруженные за пределами человека, также содержат рибозим DV, и горизонтальный перенос генов Предложенные сценарии еще могут это объяснить.[11][12]
Механизм катализа
Рибозим HDV катализирует расщепление фосфодиэфирной связи между нуклеотидом или олигонуклеотидом субстрата и 5'-гидроксилом рибозима. В вирусе гепатита дельта эта нуклеотидная последовательность субстрата начинается с уридина и известна как U (-1), однако идентичность нуклеотида -1 существенно не меняет скорость катализа.[1] Требуется только его химическая природа, поскольку, как показали Перротта и Бин, замещение U (-1) рибозы дезоксирибозой отменяет реакцию, что согласуется с предсказанием, что 2'-гидроксил является нуклеофилом в химическая реакция.[13] Следовательно, в отличие от многих других рибозимов, таких как рибозим «головка молотка», рибозим HDV не имеет дополнительных требований для катализа и для эффективной реакции требуется только один -1 рибонуклеотид в качестве субстрата.[1]
Первоначально считалось, что 75-й нуклеотид в рибозиме, цитозин, известный как C75, способен действовать как общее основание с N3 C75, отщепляющим протон от 2'-гидроксила U (-1) нуклеотида до облегчают нуклеофильную атаку на фосфодиэфирную связь.[1] Однако, хотя точно установлено, что у N3 C75 pKa отклоняется от своего нормального значения 4,45 и ближе к примерно 6,15 или 6,40,[14][15] он недостаточно нейтрален, чтобы действовать как основной катализатор. Вместо этого N3 в C75, как полагают, действует как кислота Льюиса, стабилизируя уходящий 5'-гидроксил рибозима; это подтверждается его близостью к 5'-гидроксилу в кристаллической структуре.[1][16] Замена нуклеотида C75 на любой другой нуклеотид отменяет или существенно снижает активность рибозима, хотя эта активность может быть частично восстановлена имидазолом, что дополнительно влияет на каталитическую активность C75.[17]
C75 в рибозиме HDV был предметом нескольких исследований из-за его специфической pKa. Типичные значения pKa для свободных нуклеозидов составляют от 3,5 до 4,2; эти более низкие значения pKa являются кислыми, и маловероятно, что они станут основными. Однако вполне вероятно, что структурная среда внутри рибозима, которая включает десольватированную щель активного сайта, обеспечивает отрицательный электростатический потенциал, который может возмущать pKa цитозина, достаточный для того, чтобы действовать как кислота Льюиса.[18][19][20][21]

В дополнение к стабилизации кислотой Льюиса уходящей 5'-гидроксильной группы, теперь также принято, что рибозим HDV может использовать ион металла, чтобы способствовать активации 2'-гидроксила для атаки на U (-1) нуклеотид. Ион магния в активном центре рибозима координирован с 2’-гидроксильным нуклеофилом и кислородом ножничного фосфата и может действовать как кислота Льюиса, активируя 2’-гидроксил.[17][16] Кроме того, возможно, что фосфат U23 может действовать как кислота Льюиса, принимая протон от 2'-гидроксила с магнием, выступающим в качестве координирующего иона.[22] Поскольку рибозим HDV не требует активности ионов металлов, он не является облигатным металлоферментом, но присутствие магния в активном центре значительно улучшает реакцию расщепления. Рибозим HDV, по-видимому, имеет неспецифическую потребность в небольших количествах двухвалентных катионов для сворачивания, будучи активным в Mg.2+, Ca2+, Mn2+, а Sr2+.[1] В отсутствие ионов металлов кажется вероятным, что вода может заменить магний в качестве кислоты Льюиса.
Регулирование восходящей РНК
Эта секция отсутствует информация об иллюстрации различных состояний SS (см. PMID 17956974, нужно перерисовать с помощью R2R). (Май 2020 г.) |
Из-за того, что рибозим HDV является быстрым саморасщеплением, предыдущие эксперименты с рибонуклеазой проводились с 3'-продуктом самоотщепления, а не с предшественником.[23] Однако известно, что фланкирующая последовательность участвует в регуляции активности саморасщепления рибозима HDV.[24][25][26] Следовательно, для изучения результирующей активности саморасщепления рибозима HDV была включена предшествующая последовательность 5 'от сайта саморасщепления.[24] Были определены две альтернативные структуры.
Первая ингибирующая структура складывается с помощью расширенного транскрипта (т.е. транскрипта -30/99, координаты указаны относительно сайта саморасщепления), охватывающего от 30 нуклеотидов перед сайтом расщепления до 15 нуклеотидов ниже 3'-конца.[24] Фланкирующая последовательность изолирует рибозим в кинетической ловушке во время транскрипции и приводит к чрезвычайно низкой скорости саморасщепления.[24] Эта предотвращающая саморасщепление структура включает 3 альтернативных стержня: Alt1, Alt2 и Alt3, которые нарушают активную конформацию. Alt1 представляет собой дальнодействующее взаимодействие длиной 10 пар оснований, образованное ингибирующим участком выше по течению (-25 / -15 нуклеотидов) и ниже по течению (76/86 нуклеотидов).[24] Alt1 разрушает стебель P2 в активной конформации, при этом предполагается, что P2 играет активирующую роль как для геномного, так и для антигеномного рибозима.[24][27][28] Alt2 представляет собой взаимодействие между вышестоящей фланкирующей последовательностью и рибозимом, а Alt3 представляет собой неродное взаимодействие рибозим-рибозим.[24]
Вторичная структура этой ингибирующей конформации подтверждается различными экспериментальными подходами.[24] Сначала было выполнено прямое зондирование с помощью рибонуклеаз, а последующее моделирование с помощью mfold 3.0 с использованием ограничений из результатов зондирования согласуется с предлагаемой структурой.[24] Во-вторых, ряд олигомеров ДНК, комплементарных различным областям AS1 / 2, был использован для восстановления активности рибозима; результаты подтверждают ингибирующую роль AS1 / 2.[24] В-третьих, мутационный анализ вводит одиночные / двойные мутации вне рибозима, чтобы гарантировать, что наблюдаемая активность рибозима напрямую связана со стабильностью Alt1.[24] Установлено, что стабильность AS1 обратно пропорциональна активности саморасщепления.[24]
Вторая пермиссивная структура позволяет рибозиму HDV саморасщепляться котранскрипционно, и эта структура дополнительно включает часть -54 / -18 нуклеотидов транскрипта РНК.[24] Находящийся выше ингибирующий участок -24 / -15 от вышеупомянутой ингибирующей конформации теперь изолирован в шпильке P (-1), расположенной выше сайта расщепления.[24][29][30] Мотив P (-1), однако, обнаруживается только в геномной последовательности, что может быть коррелировано с явлением, что геномные копии РНК HDV более многочисленны в инфицированных клетках печени.[24][31] Экспериментальные данные также подтверждают эту альтернативную структуру. Во-первых, структурное картирование с помощью рибонуклеазы используется для зондирования фрагмента -54 / -1 вместо всего транскрипта-предшественника из-за быстро расщепляющейся природы этой структуры, которая согласуется с локальной шпилькой P (-1) (между -54 / -40 и -18 / -30 нт).[24] Во-вторых, эволюционная консервация обнаруживается в P (-1) и связывающей области между P (-1) и P1 среди 21 геномного изолята РНК HDV.[24]
Использование в подготовке транскриптов РНК
Особые свойства реакции расщепления рибозима HDV делают его полезным инструментом для получения транскриптов РНК с гомогенными 3'-концами, альтернативой транскрипции РНК с помощью РНК-полимеразы Т7, которая часто может давать гетерогенные концы или нежелательные присоединения. Вариант кДНК рибозима может быть получен рядом с кДНК последовательности РНК-мишени и РНК, полученной путем транскрипции с помощью РНК-полимеразы Т7. Последовательность рибозима будет эффективно расщепляться без дополнительных требований, поскольку -1 нуклеотид является инвариантным, оставляя 2'-3'-циклический фосфат, который можно легко удалить обработкой фосфатазой или полинуклеотидкиназой Т4.[32] Затем целевую РНК можно очистить с помощью гель-очистки.
Рекомендации
- ^ а б c d е ж грамм час Ферре-Д'Амаре А.Р., Чжоу К., Дудна Д.А. (октябрь 1998 г.). «Кристаллическая структура рибозима вируса гепатита дельта». Природа. 395 (6702): 567–574. Bibcode:1998Натура.395..567F. Дои:10.1038/26912. PMID 9783582.
- ^ а б Modahl LE, Lai MM (июль 1998 г.). «Транскрипция мРНК антигена гепатита дельта продолжается на протяжении всей репликации вируса гепатита дельта (HDV): новая модель транскрипции и репликации РНК HDV». Журнал вирусологии. 72 (7): 5449–5456. ЧВК 110180. PMID 9621000.
- ^ Macnaughton TB, Shi ST, Modahl LE, Lai MM (апрель 2002 г.). «Репликация РНК вируса гепатита дельта по катящемуся кругу осуществляется двумя различными клеточными РНК-полимеразами». Журнал вирусологии. 76 (8): 3920–3927. Дои:10.1128 / JVI.76.8.3920-3927.2002. ЧВК 136092. PMID 11907231.
- ^ Куо М.Ю., Шармин Л., Динтер-Готтлиб Г., Тейлор Дж. (Декабрь 1988 г.). «Характеристика последовательностей саморасщепляющейся РНК на геноме и антигеноме дельта-вируса гепатита человека». Журнал вирусологии. 62 (12): 4439–4444. ЧВК 253552. PMID 3184270.
- ^ Чен П.Дж., Калпана Дж., Голдберг Дж., Мейсон В., Вернер Б., Герин Дж., Тейлор Дж. (Ноябрь 1986 г.). «Структура и репликация генома вируса гепатита дельта». Труды Национальной академии наук Соединенных Штатов Америки. 83 (22): 8774–8778. Дои:10.1073 / пнас.83.22.8774. ЧВК 387014. PMID 2430299.
- ^ а б Уэбб Ч., Луптак А (2011). «HDV-подобные саморасщепляющиеся рибозимы». РНК Биология. 8 (5): 719–727. Дои:10.4161 / rna.8.5.16226. ЧВК 3256349. PMID 21734469.
- ^ Эйкбуш Д.Г., Айкбуш Т.Х. (июль 2010 г.). «Ретротранспозоны R2 кодируют саморасщепляющийся рибозим для процессинга из котранскрипта рРНК». Молекулярная и клеточная биология. 30 (13): 3142–3150. Дои:10.1128 / MCB.00300-10. ЧВК 2897577. PMID 20421411.
- ^ Webb CH, Riccitelli NJ, Ruminski DJ, Lupták A (ноябрь 2009 г.). «Широкое распространение саморасщепляющихся рибозимов». Наука. 326 (5955): 953. Bibcode:2009Sci ... 326..953W. Дои:10.1126 / science.1178084. ЧВК 3159031. PMID 19965505.
- ^ Санчес-Луке Ф. Дж., Лопес М.С., Масиас Ф., Алонсо К., Томас М.К. (октябрь 2011 г.). «Идентификация рибозима, подобного вирусу гепатита дельта, на 5'-конце мРНК ретротранспозона L1Tc из Trypanosoma cruzi». Исследования нуклеиновых кислот. 39 (18): 8065–8077. Дои:10.1093 / nar / gkr478. ЧВК 3185411. PMID 21724615.
- ^ Санчес-Луке Ф., Лопес М.С., Масиас Ф., Алонсо К., Томас М.К. (январь 2012 г.). «Pr77 и L1TcRz: двойная система на 5'-конце ретротранспозона L1Tc, внутренний промотор и HDV-подобный рибозим». Мобильные генетические элементы. 2 (1): 1–7. Дои:10.4161 / mge.19233. ЧВК 3383444. PMID 22754746.
- ^ Hetzel U, Szirovicza L, Smura T, Prähauser B, Vapalahti O, Kipar A, Hepojoki J (апрель 2019 г.). «Выявление нового дельтавируса у удавов». мБио. 10 (2). Дои:10,1128 / мБио,00014-19. ЧВК 6445931. PMID 30940697.
- ^ Чанг В.С., Петтерссон Дж. Х., Ле Лэй С., Ши М., Ло Н, Вилле М., Иден Дж. С., Холмс ЕС (июль 2019 г.). «Новые агенты, подобные гепатиту D, у позвоночных и беспозвоночных». Эволюция вирусов. 5 (2): vez021. Дои:10.1093 / ve / vez021. ЧВК 6628682. PMID 31321078.
- ^ Perrotta, AT; Бин, Мэриленд (14 января 1992 г.). «Расщепление олигорибонуклеотидов рибозимом, полученным из последовательности РНК вируса гепатита дельта». Биохимия. 31 (1): 16–21. Дои:10.1021 / bi00116a004. PMID 1731868.
- ^ Ли Т.С., Радак Б.К., Харрис М.Э., Йорк Д.М. (2016). «Путь конформационного переключения, опосредованного двумя металлами и ионами для активации рибозима HDV». Катализ ACS. 6 (3): 1853–1869. Дои:10.1021 / acscatal.5b02158. ЧВК 5072530. PMID 27774349.
- ^ Гонг Б., Чен Дж. Х., Чейз Е., Чадалавада Д.М., Ядзима Р., Голден Б.Л., Бевилаква П.С., Кэри П.Р. (октябрь 2007 г.). «Прямое измерение pK (a), близкого к нейтральному, для каталитического цитозина в геномном рибозиме HDV с использованием рамановской кристаллографии». Журнал Американского химического общества. 129 (43): 13335–13342. Дои:10.1021 / ja0743893. PMID 17924627.
- ^ а б Чен Дж. Х., Ядзима Р., Чадалавада Д. М., Чейз Е., Бевилаква П.С., Golden BL (август 2010 г.). «Кристаллическая структура 1,9 предварительного расщепления рибозима HDV предполагает, что и кислота Льюиса, и общие кислотные механизмы вносят вклад в расщепление фосфодиэфира». Биохимия. 49 (31): 6508–6518. Дои:10.1021 / bi100670p. PMID 20677830.
- ^ а б Накано С., проктор ди-джей, Bevilacqua PC (октябрь 2001 г.). «Механистическая характеристика геномного рибозима HDV: оценка каталитического и структурного вклада ионов двухвалентных металлов в механизм многоканальной реакции». Биохимия. 40 (40): 12022–12038. Дои:10.1021 / bi011253n. PMID 11580278.
- ^ Раджагопал П., Фейгон Дж. (Июнь 1989 г.). «Образование тройной цепи в гомопурине: гомопиримидиновые ДНК-олигонуклеотиды d (G-A) 4 и d (T-C) 4». Природа. 339 (6226): 637–640. Дои:10.1038 / 339637a0. PMID 2733796.
- ^ Скленар В., Фейгон Дж. (Июнь 1990 г.). «Формирование стабильного триплекса из одиночной нити ДНК». Природа. 345 (6278): 836–838. Bibcode:1990Натура.345..836С. Дои:10.1038 / 345836a0. PMID 2359461.
- ^ Коннелл Г.Дж., Ярус М. (май 1994 г.). «РНК с двойной специфичностью и двойные РНК со сходной специфичностью». Наука. 264 (5162): 1137–1141. Bibcode:1994Научный ... 264.1137C. Дои:10.1126 / science.7513905. PMID 7513905.
- ^ Legault P, Pardi A (сентябрь 1994 г.). «Исследование протонирования аденина в РНК на месте с помощью 13С ЯМР». Журнал Американского химического общества. 116 (18): 8390–8391. Дои:10.1021 / ja00097a066.
- ^ Каспрович А., Кемпиньска А., Смольска Б., Вжесиньски Ю., Цесёлка Ю. (2015). «Применение флуоресцентно меченного транс-действующего антигеномного рибозима HDV для мониторинга взаимодействий антибиотик-РНК». Аналитические методы. 7 (24): 10414–10421. Дои:10.1039 / C5AY02953H.
- ^ Rosenstein SP, Been MD (октябрь 1991 г.). «Доказательства того, что элементы саморасщепляющейся геномной и антигеномной РНК вируса гепатита дельта имеют сходные вторичные структуры». Исследования нуклеиновых кислот. 19 (19): 5409–5416. Дои:10.1093 / nar / 19.19.5409. ЧВК 328906. PMID 1923826.
- ^ а б c d е ж грамм час я j k л м п о п q Чадалавада Д.М., Кнудсен С.М., Накано С., Bevilacqua PC (август 2000 г.). «Роль вышестоящей структуры РНК в облегчении каталитической укладки рибозима геномного дельта-вируса гепатита». Журнал молекулярной биологии. 301 (2): 349–367. Дои:10.1006 / jmbi.2000.3953. PMID 10926514.
- ^ Perrotta AT, Been MD (декабрь 1990 г.). «Саморасщепляющийся домен геномной РНК вируса гепатита дельта: требования к последовательности и эффекты денатурирующего средства». Исследования нуклеиновых кислот. 18 (23): 6821–6827. Дои:10.1093 / nar / 18.23.6821. ЧВК 332737. PMID 2263447.
- ^ Perrotta AT, Been MD (апрель 1991 г.). «Псевдоузелеподобная структура, необходимая для эффективного самоотщепления РНК вируса гепатита дельта». Природа. 350 (6317): 434–436. Bibcode:1991Натура.350..434П. Дои:10.1038 / 350434a0. PMID 2011192.
- ^ Matysiak M, Wrzesinski J, Ciesiołka J (август 1999 г.). «Последовательная укладка геномного рибозима вируса гепатита дельта: структурный анализ промежуточных продуктов транскрипции РНК». Журнал молекулярной биологии. 291 (2): 283–294. Дои:10.1006 / jmbi.1999.2955. PMID 10438621.
- ^ Перротта А.Т., Никифорова О., Бин М.Д. (февраль 1999 г.). «Консервативный выпуклый аденозин в периферическом дуплексе антигеномной саморасщепляющейся РНК HDV снижает кинетический захват неактивных конформаций». Исследования нуклеиновых кислот. 27 (3): 795–802. Дои:10.1093 / nar / 27.3.795. ЧВК 148249. PMID 9889275.
- ^ Мэтьюз Д.Х., Сабина Дж., Цукер М., Тернер Д.Х. (май 1999 г.). «Расширенная зависимость термодинамических параметров от последовательности улучшает предсказание вторичной структуры РНК». Журнал молекулярной биологии. 288 (5): 911–940. Дои:10.1006 / jmbi.1999.2700. PMID 10329189.
- ^ Цукер М., Мэтьюз Д., Тернер Д. (1999). "Алгоритмы и термодинамика для предсказания вторичной структуры РНК". В Кларке JB (ред.). Биохимия и биотехнология РНК. Серия НАТО ASI. Дордрехт, Нидерланды: Kluwer Academic Publishers.
- ^ Чен П.Дж., Калпана Дж., Голдберг Дж., Мейсон В., Вернер Б., Герин Дж., Тейлор Дж. (Ноябрь 1986 г.). «Структура и репликация генома вируса гепатита дельта». Труды Национальной академии наук Соединенных Штатов Америки. 83 (22): 8774–8778. Дои:10.1073 / пнас.83.22.8774. ЧВК 387014. PMID 2430299.
- ^ Wichlacz A, Legiewicz M, Ciesiołka J (февраль 2004 г.). «Создание in vitro транскриптов с гомогенными 3'-концами с использованием транс-действующего антигеномного дельта-рибозима». Исследования нуклеиновых кислот. 32 (3): 39e – 39. Дои:10.1093 / nar / gnh037. ЧВК 373431. PMID 14973333.
