Гомосинаптическая пластичность - Homosynaptic plasticity - Wikipedia
Гомосинаптическая пластичность это один из видов синаптическая пластичность.[1] Гомосинаптическая пластичность зависит от входа, это означает, что изменения в силе синапсов происходят только на постсинаптических мишенях, специфически стимулируемых пресинаптической мишенью.[2] Следовательно, распространение сигнала от пресинаптической клетки локализовано.
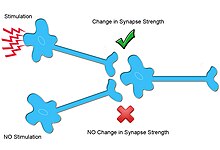
Другой тип синаптической пластичности, гетеросинаптическая пластичность, не является специфическим для входа и отличается от гомосинаптической пластичности во многих механизмах.
Помимо специфичности входа, усиление синапса посредством гомосинаптической пластичности является ассоциативным, потому что оно зависит от срабатывания пресинаптического и постсинаптического нейрона во времени. Эта ассоциативность увеличивает шансы срабатывания постсинаптического нейрона.[3] Теоретически эти механизмы лежат в основе обучения и краткосрочная память.[3]
Обзор
Постулат Хебба
Дональд Хебб предположил, что усиление синаптических связей происходит из-за скоординированной активности между пресинаптическим концом и постсинаптическим дендритом. По словам Хебба, эти две клетки усилены, потому что их передача сигналов происходит вместе в пространстве и / или времени, что также известно как совпадающая активность. Этот постулат часто резюмируется как Ячейки, которые стреляют вместе, соединяются вместе, что означает, что синапсы, у которых есть нейроны с совпадающим возбуждением, усиливаются, в то время как другие синапсы на этих нейронах остаются неизменными.[3] Постулат Хебба предоставил концептуальную основу того, как синаптическая пластичность лежит в основе длительного хранения информации.[1]
Механизмы специфичности ввода
Изменения пластичности часто происходят через внедрение или интернализацию рецепторов AMPA (AMPAR) в постсинаптическую мембрану синапса, претерпевающую изменение соединительной силы.[1] Ca2+ представляет собой один сигнальный ион, который вызывает это изменение плотности рецептора AMPA, вызывая каскад биологических изменений внутри клетки. Побудить долгосрочное потенцирование (LTP), Ca2+ активирует CAMKII и PKC, вызывая фосфорилирование и вставку AMPAR, в то время как длительная депрессия (LTD) происходит от Ca2+ активируя протеинфосфатазы, которые дефосфорилируют и вызывают интернализацию AMPAR.[1]
Чтобы создать специфичные для входа изменения в синаптической силе, Ca2+ сигнал должен быть ограничен определенными дендритными шипами. Дендритное ограничение Ca2+ опосредуется несколькими механизмами. Внеклеточный Ca2+ может проникать в позвоночник через рецепторы NMDA (NMDAR) и потенциал-зависимый Ca2+ каналы (VGCC). И NMDAR, и VGCC концентрируются на дендритных шипах, опосредуя специфический для шипов Ca2+ приток. Внутриклеточные запасы Са2+ в эндоплазматическом ретикулуме и митохондриях могут также вносить вклад в ограниченную передачу сигналов в позвоночнике, хотя некоторые исследования не смогли найти доказательств этого.[4] Очистка Ca2+ контролируется буферными белками, которые связываются с Ca2+ и не дать ему просочиться к другим шипам. Ограниченная диффузия Ca2+ через шейку дендритного отростка также помогает изолировать его от определенных дендритов.[4]
Другой механизм долгосрочной потенциации, зависящей от входов, - временной. NMDAR требуют как деполяризации, чтобы снять блокировку магния, так и активации глутамата, чтобы открыть свои каналы, чтобы позволить Ca2+ приток. Таким образом, LTP локализуется в местах, где каналы NMDA открываются активными синаптическими входами, которые высвобождают глутамат и вызывают деполяризацию постсинаптической клетки и не влияют на близлежащие неактивные синапсы.[1]
Сохранение долгосрочных изменений
Чтобы стабилизировать LTP и продлить его действие, новые белки, поддерживающие это изменение, синтезируются в ответ на стимуляцию в потенцирующем синапсе. Возникающая проблема заключается в том, как доставить специфические, вновь синтезированные белки к нужным входным синапсам, в которых они нуждаются. Два решения этой проблемы включают синаптическая маркировка и локальный синтез белка.
Синаптические теги
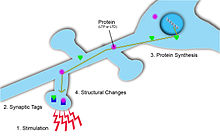
Синаптические теги Отметьте, где произошла синаптическая пластичность, и, таким образом, может предоставить информацию о синаптической прочности и потенциале долгосрочных пластических изменений.[5] Тег является временным и включает большое количество белков, активируемых притоком Ca2+ в постсинаптическую клетку.[5] Кроме того, в зависимости от типа и величины синаптических изменений для маркировки используются разные белки. Например, когда пластические изменения приводят к длительной депрессии, кальциневрин используется. И наоборот, когда пластичность приводит к длительной потенциации, CaMKII используется.[5] Для того, чтобы синаптическая пластичность была специфичной для входа, эти синаптические теги необходимы на постсинаптических мишенях, чтобы гарантировать локализацию синаптической потенциации.[5] Эти метки позже инициируют синтез белка, который, в свою очередь, вызывает изменения синаптической пластичности в этих активированных нейронах.[1]
Местный синтез белка
Синтез белка при дендриты необходим для гомосинаптической пластичности. Деполяризация и связанная с этим активация рецепторов AMPA и NMDA в постсинаптической клетке вызывает эндоцитоз этих рецепторов. Для поддержания количества поверхностных рецепторов в синапсе необходим локальный синтез белка. Эти новые белки помогают стабилизировать структурные изменения, вызванные гомосинаптической пластичностью.[6] Есть свидетельства наличия в дендритах рибосом, которые могут производить эти белки. Кроме того, есть свидетельства наличия гранул РНК в дендритах, что указывает на присутствие вновь образованных белков. LTP может быть индуцирован дендритами, отделенными от сомы постсинаптического нейрона-мишени. Напротив, LTP может быть заблокирован в этих дендритах блокаторами синтеза белка, такими как эндомиацин, что дополнительно указывает на место локального синтеза белка. Эти данные показывают, что для стабилизации и поддержания L-LTP необходим локальный синтез белка.[1]
Рекомендации
- ^ а б c d е ж грамм Первес, Д., Августин, Дж. Дж., Фицпатрик, Д., Холл, У. К., Ламантия, А. С., Уайт, Л. Е. (2012). Синаптическая пластичность. В неврологии (5-е изд.) (Стр. 163-182). Сандерленд, Массачусетс: Sinauer Associates.
- ^ Бирн, Дж. (1997). Синаптическая пластичность. В Neuroscience Online (Раздел 1, Глава 7).
- ^ а б c Бейли, К., Джустетто, М., Хуанг, Ю., Хокинс, Р., Кандел, Э. (октябрь 2000 г.). Обзоры: Важна ли гетеросинаптическая модуляция для стабилизации пластичности и памяти Хебба ?. В журнале Macmillan Magazines Ltd (Том 1). Получено с www.nature.com/reviews/neuroscience.
- ^ а б Хигли, М.Дж., Сабатини, Б.Л. (февраль 2012 г.) Передача сигналов кальция в дендритных шипах. Перспективы Колд-Спринг-Харбор в биологии. Извлекаются из http://cshperspectives.cshlp.org/. DOI: 10.1101 / cshperspect.a005686.
- ^ а б c d Редондо, Роджер Л. и Ричард Г. М. Моррис. (2011) «Сделать воспоминания последними: гипотеза синаптических тегов и захвата». Nature Reviews Neuroscience, 12, 17-30.
- ^ Пфайффер Б. Э., Хубер К. М. (2006). Текущие достижения в области локального синтеза белков и синаптической пластичности. Журнал неврологии, 26 (27), 7147-7150.
