Добавление альдола Мукаяма - Mukaiyama aldol addition
| выводит |
|---|
 альдегид (р1 = Алкил, Арил) или же форматировать (р1 = ИЛИ) |
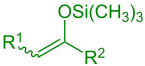 силиловый эфир енола (р1 = Алкил, Арил, Н; р2 = Алкил, Арил, H, OR, SR) |
В Добавление альдола Мукаяма является органическая реакция и тип альдольная реакция между силиловый эфир енола и альдегид или же форматировать.[1] Реакция была обнаружена Теруаки Мукаяма (1927–2018) в 1973 г.[2] Его выбор реагентов допускает перекрестную альдольную реакцию между альдегидом и кетон или другой альдегид без самоконденсации альдегида. По этой причине реакция широко используется в органический синтез.
Общая схема реакции
Добавление альдола Мукаяма представляет собой опосредованное кислотой Льюиса присоединение енолсиланов к карбонильным соединениям. В этой реакции могут использоваться соединения с различными органическими группами (см. Исходные продукты).[3]Базовая версия (р2 = H) без присутствия хиральных катализаторов показано ниже.

Создается рацемическая смесь энантиомеров. Если в этой реакции используются Z- или E-енольные силаны, образуется смесь четырех продуктов с образованием двух рацематов.

Был ли анти-диастереомер или синСтроение -диастереомера во многом зависит от условий реакции, субстратов и кислот Льюиса.
Типичной реакцией является реакция силиленольного эфира циклогексанон с бензальдегид. В комнатная температура это производит диастереомерный смесь трео (63%) и эритро (19%) β-гидроксикетон, а также 6% экзоциклический Enone продукт конденсации. В первоначальном масштабе кислота Льюиса (тетрахлорид титана ) использовался в стехиометрических количествах, но существуют и настоящие каталитические системы. Реакция также оптимизирована для асимметричный синтез.
Механизм
Ниже механизм реакции показан с помощью р2 = H:
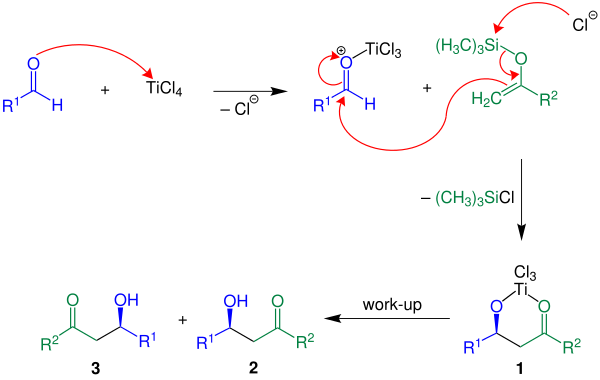
В приведенном примере кислота Льюиса TiCl4 используется. Сначала кислота Льюиса активирует альдегидный компонент с последующим образованием углерод-углеродной связи между енолсиланом и активированным альдегидом. С потерей хлорсилана соединение 1 построено. Желаемый продукт, рацемат 2 и 3, получается водной обработкой.[3]
Объем
Типичная реакция с участием двух кетонов - это реакция между ацетофенон как энол и ацетон:[4]

Кетоновые реакции этого типа требуют более высоких температур реакции. На создание этой работы Мукаяма был вдохновлен более ранней работой, выполненной Георг Виттиг в 1966 г. по скрещенным альдольным реакциям с литиированным имины.[5][6] Конкурирующая работа с альдольными реакциями енолята лития была также опубликована в 1973 году Гербертом О. Хаусом.[7]
Мукайяма использовал в исполнении общий синтез таксола (1999) две добавки альдола,[8][9] один с кетен силилацеталь и избыток бромид магния:

и второй с амином хиральный лиганд и трифлатная соль катализатор:

Использование хиральных комплексов кислот Льюиса и оснований Льюиса в асимметричных каталитических процессах является наиболее быстрорастущей областью использования альдольной реакции Мукаямы.[3]
Рекомендации
- ^ Mukaiyama, T .; Кобаяши, С. (1994). «Олово (II) еноляты в Aldol, Michael и родственных реакциях». Орг. Реагировать. 46: 1. Дои:10.1002 / 0471264180.or046.01. ISBN 0471264180.
- ^ Реакция нового альдольного типа Теруаки Мукаяма, Коичи Нарасака и Кадзуо Банно Письма по химии Том 2 (1973), №9, с. 1011–1014 Дои:10.1246 / cl.1973.1011
- ^ а б c Курти, Ласло; Чако, Барбара (2005). Стратегические применения названных реакций в органическом синтезе: предпосылки и подробные механизмы. Elsevier Academic Press. стр.298 –299. ISBN 978-0-12-429785-2.
- ^ Органический синтез, Сб. Vol. 8, стр. 323 (1993); Vol. 65, стр. 6 (1987). http://www.orgsynth.org/orgsyn/pdfs/CV8P0323.pdf
- ^ Wittig, G .; Сучанек П. (январь 1966 г.). «Über gezielte aldokondensationen - II». Тетраэдр. 22: 347–358. Дои:10.1016 / S0040-4020 (01) 82193-1.
- ^ НАПРАВЛЕННЫЕ АЛДОЛЬНЫЕ КОНДЕНСАЦИИ: β-PHENYLCINNAMALDEHYDE Organic Syntheses, Coll. Vol. 6, p.901 (1988); Vol. 50, стр.66 (1970). Г. Виттиг, А. Гессе, Аллан Ю. Тераниши и Герберт О. Хаус http://www.orgsynth.org/orgsyn/prep.asp?prep=cv6p0901
- ^ House, Herbert O .; Крамрин, Дэвид С .; Тераниши, Аллан Й .; Олмстед, Хью Д. (май 1973 г.). «Химия карбанионов. XXIII. Использование комплексов металлов для контроля альдольной конденсации». Журнал Американского химического общества. 95 (10): 3310–3324. Дои:10.1021 / ja00791a039.
- ^ Мукаяма, Теруаки; Шиина, Исаму; Ивадаре, Хаято; Сайто, Масахиро; Нисимура, Тошихиро; Окава, Наото; Сако, Хироки; Нисимура, Кодзи; Тани, Ю-ичиро; Хасэгава, Масатоши; Ямада, Кодзи; Сайто, Кацуюки (4 января 1999 г.). «Асимметричный тотальный синтез таксола R». Химия - Европейский журнал. 5 (1): 121–161. Дои:10.1002 / (SICI) 1521-3765 (19990104) 5: 1 <121 :: AID-CHEM121> 3.0.CO; 2-O.
- ^ TBS = трет-бутилдиметилсилил, Bn = бензил, PMB = п-метоксибензиловый эфир
