Малая условная РНК - Small conditional RNA
А малая условная РНК (скРНК) - небольшой РНК молекула или комплекс (обычно менее примерно 100 нуклеотидов), сконструированный для взаимодействия и изменения конформации условно в ответ на родственные молекулярные входы, чтобы выполнять преобразование сигнала in vitro, на месте, или in vivo.[1]
В отсутствие родственных входных молекул скРНК созданы для сосуществования метастабильно или стабильно без взаимодействия. Обнаружение родственных входов инициирует последующие конформационные изменения одной или нескольких скРНК, приводящие к генерации желаемого выходного сигнала. Выходной сигнал может быть предназначен для считывания состояния эндогенный биологические схемы (например, отображение экспрессия гена для биологических исследований или медицинской диагностики),[2] или для регулирования состояния эндогенных биологических схем (например, нарушение экспрессии генов для биологических исследований или медицинского лечения).[1] Последовательности скРНК могут быть запрограммированы для распознавания различных входов или активации разных выходов,[1][2][3] достижение даже селективности по однонуклеотидной последовательности.[3] Передача сигнала scRNA использует принципы новых дисциплин, таких как нанотехнология динамической РНК, молекулярное программирование и синтетическая биология.

Примеры передачи сигнала скРНК
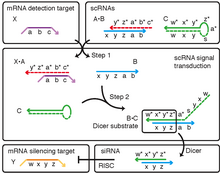
Меченные флуорофором скРНК были сконструированы для преобразования между обнаружением мРНК мишени и генерация ярких флуоресцентных полимеров для амплификации in situ (рис. 1).[2] В этом контексте сигнальная трансдукция скРНК делает возможным мультиплексное картирование экспрессии мРНК в интактных эмбрионах позвоночных (рис. 2).[2]scRNAs были сконструированы для выполнения трансдукции формы и последовательности для условного получения Дайсер субстрат, нацеленный на мРНК Y «мишень для молчания» при обнаружении независимой мРНК X «мишень для обнаружения», с последующим процессингом Dicer, приводящим к небольшой мешающей РНК (миРНК ), направленной на разрушение мРНК Y (рис. 3).[1] В этом контексте передача сигнала скРНК обеспечивает шаг к реализации условного РНК-интерференция (Рисунок 4).


Элементы дизайна
scRNA могут быть созданы для использования различных элементов дизайна:[1]
- Реагенты scRNA могут быть метастабильный или стабильный
- Каскады передачи сигнала скРНК могут быть каталитический или некаталитический
- скРНК могут зародыш друг с другом или с входными или выходными молекулами посредством зародышеобразования зацепа / зацепа, зародышеобразования петли / зацепа или зародышеобразования по шаблону / зацеплению
- scRNA могут диссоциировать друг с другом или с входными или выходными молекулами посредством 3-сторонней миграции ветвей, 4-сторонней миграции ветвей или спонтанной диссоциации
- Реагенты scRNA могут быть мономерами, димерами или другими мультимерами.
использованная литература
- ^ а б c d е ж г Hochrein LM, Schwarzkopf M, Shahgholi M, Yin P, Pierce NA (2013). «Условное образование субстрата дайсера посредством трансдукции формы и последовательности с небольшими условными РНК». Журнал Американского химического общества. 135 (46): 17322–17330. Дои:10.1021 / ja404676x. ЧВК 3842090. PMID 24219616.
- ^ а б c d е ж Чой Х.М., Чанг Дж.Й., Тринь Л.А., Падилья Дж.Э., Фрейзер С.Е., Пирс Н.А. (2010). «Программируемая амплификация in situ для мультиплексной визуализации экспрессии мРНК». Природа Биотехнологии. 28 (11): 1208–1212. Дои:10.1038 / nbt.1692. ЧВК 3058322. PMID 21037591.
- ^ а б Штернберг Дж. Б., Пирс Н. А. (2014). «Превосходная селективность последовательности с небольшими условными РНК». Нано буквы. 14 (8): 4568–4572. Bibcode:2014NanoL..14.4568S. Дои:10.1021 / nl501593r. ЧВК 4134187. PMID 24979041.
