Отжиг прядей в зависимости от синтеза - Synthesis-dependent strand annealing
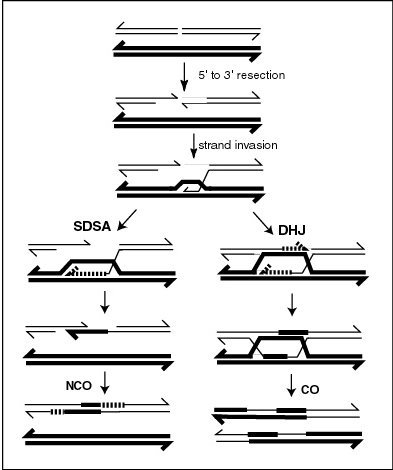
В генетика, начальные процессы, участвующие в ремонте двухниточный разрыв к зависимая от синтеза цепь отжиг (SDSA) идентичны таковым в двойная модель соединения Холлидея, и были наиболее широко изучены у видов дрожжей Saccharomyces cerevisiae. После двухцепочечного разрыва белковый комплекс (MRX) связывается с любым концом разрыва, работая с ДНК нуклеазы выполнять резекция, что приводит к перевариванию на 5'-конце с образованием 3'-выступов одноцепочечной ДНК (см. рисунок). Затем эти выступы обязательно образуют нуклеопротеин филамент, который затем может локализовать последовательности ДНК, подобные одному из 3 'выступов, инициируя вторжение одноцепочечной цепи в дуплекс ДНК, содержащий эти последовательности. Как только произошло вторжение нити, петля смещения, или D-петля, в этот момент либо SDSA, либо двойная Холлидей Джанкшн происходит.[1]
Гомологичная рекомбинация через путь SDSA происходит как в митотических, так и в мейотических клетках как важный механизм не-кроссовер рекомбинации, и впервые была предложена в качестве модели в 1976 г.[2] получил свое нынешнее название в 1994 году.[3] Поскольку модель двойного соединения Холлидея была первой предложенной для объяснения этого явления,[4] позже были предложены различные версии модели SDSA для объяснения гетеродуплекс Конфигурации ДНК, которые не соответствовали предсказаниям модели двойного соединения Холлидея. Исследования в С. cerevisiae обнаружили, что непересекающиеся продукты появляются раньше, чем двойные перекрестные соединения Холлидея или перекрестные продукты, что ставит под сомнение предыдущее представление о том, что как кроссоверные, так и непересекающиеся продукты производятся двойными соединениями Холлидея.[5]
В модели SDSA репарация двухцепочечных разрывов происходит без образования двойного соединения Холлидея, так что два процесса гомологичной рекомбинации идентичны до момента образования D-петли.[6] У дрожжей D-петля образуется путем инвазии цепи с помощью белков. Rad51 и Rad52,[7] а затем действует ДНК геликаза Srs2 для предотвращения образования двойного соединения Холлидея, чтобы возник путь SDSA.[8] Таким образом, вторгающаяся 3'-цепь удлиняется вдоль дуплекса гомологичной ДНК реципиента посредством ДНК-полимераза в направлении 5 'к 3', так что D-петля физически перемещается - процесс, называемый синтезом ДНК с миграцией пузырьков.[9] Образовавшееся одиночное соединение Холлидея затем скользит вниз по дуплексу ДНК в том же направлении в процессе, называемом миграция веток, смещая удлиненную прядь от пряди шаблона. Эта смещенная нить выскакивает, образуя выступ 3 'в исходном двухцепочечном разрывном дуплексе, который затем может отжигаться с противоположным концом исходного разрыва. дополнительная база спаривание. Таким образом, синтез ДНК заполняет пробелы, оставшиеся от отжига, и удлиняет оба конца все еще существующего разрыва одноцепочечной ДНК, перевязка все оставшиеся пробелы для получения рекомбинантной неперекрестной ДНК.[1]
SDSA уникален тем, что транслокация D-петли приводит к консервативному, а не к полуконсервативная репликация, при смещении первой вытянутой нити шаблон прядь, оставляя гомологичный дуплекс нетронутым. Следовательно, хотя SDSA производит продукты без кроссовера, поскольку фланкирующие маркеры гетеродуплексной ДНК не обмениваются, преобразование гена действительно происходит, при этом невзаимный генетический перенос происходит между двумя гомологичными последовательностями.[10]
Ферменты, используемые в SDSA во время мейоза
Сборка нуклеопротеинового филамента, содержащего одноцепочечную ДНК (оцДНК) и RecA гомолог Rad51, это ключевой шаг, необходимый для гомология поиск во время рекомбинация. В зародышевых дрожжах Saccharomyces cerevisiae Транслоказа Srs2 разрушает волокна Rad51 во время мейоз.[11] Непосредственно взаимодействуя с Rad51, Srs2 вытесняет Rad51 из нуклеопротеиновых нитей, тем самым ингибируя Rad51-зависимое образование совместных молекул и D-петля конструкции. Эта деятельность по разборке специфична для Rad51, так как Srs2 не разбирает DMC1 (специфичный для мейоза гомолог Rad51), Rad52 (медиатор Rad 51) или репликационный белок А (RPA, одноцепочечный ДНК-связывающий белок). Srs2 способствует непересекающемуся пути SDSA, по-видимому, регулируя связывание RAD51 во время обмена цепью.[12]
Sgs1 (BLM ) геликаза является ортолог человека Белок синдрома Блума. Похоже, что это центральный регулятор большинства рекомбинация события, которые происходят во время С. cerevisiae мейоз.[13] SGS1 (BLM) можно разобрать D-петля структуры, аналогичные промежуточным продуктам инвазии ранних цепей и, таким образом, способствуют образованию NCO с помощью SDSA.[13] Хеликаза Sgs1 образует консервативный комплекс с топоизомеразой III (Топ-3 )-RMI1 гетеродимер (который катализирует одноцепочечный пассаж ДНК). Этот комплекс, называемый STR (из-за его трех компонентов), способствует раннему образованию рекомбинантов NCO с помощью SDSA во время мейоза.[14]
В обзоре Uringa et al.[15] геликаза RTEL1 необходима для регулирования рекомбинации во время мейоза у червя. Caenorhabditis elegans. RTEL1 - ключевой белок в репарации DSB. Это нарушает D-петли и продвигает результаты НКО через SDSA.
Количество DSB, созданных во время мейоза, может значительно превышать количество финальных событий CO. На заводе Arabidopsis thaliana, только около 4% DSB восстанавливаются за счет рекомбинации CO,[16] это указывает на то, что большинство DSB репарируются за счет рекомбинации NCO. Данные, основанные на тетрадном анализе нескольких видов грибов, показывают, что только меньшая часть (в среднем около 34%) событий рекомбинации во время мейоза являются CO (см. Whitehouse,[17] Таблицы 19 и 38 содержат сводные данные из С. cerevisiae, Podospora anserina, Сордария фимикола и Sordaria brevicollis). В плодовой мушке D. melanogaster во время мейоза у самок соотношение NCO и CO составляет не менее 3: 1.[18] Эти наблюдения показывают, что большинство событий рекомбинации во время мейоза являются NCOs, и предполагают, что SDSA является основным путем рекомбинации во время мейоза. Основная функция SDSA во время мейоза, по-видимому, заключается в восстановлении повреждений ДНК, особенно DSB, в геномах, которые передаются гаметам (см. Генетическая рекомбинация ).[нужна цитата ]
Рекомендации
- ^ а б Хелледей Т., Энгелвард Б.П. (2007). «Ремонт двухцепочечных разрывов ДНК: от понимания механизмов к лечению рака». Ремонт ДНК. 6 (7): 923–935. Дои:10.1016 / днареп.2007.02.006. PMID 17363343.
- ^ Резник MA (1976). «Ремонт двунитевых разрывов в ДНК - модель с рекомбинацией». Журнал теоретической биологии. 59 (1): 97–106. Дои:10.1016 / с0022-5193 (76) 80025-2. PMID 940351.
- ^ Нассиф Н., Пенни, Пал С., Энгельс В. Р., Глор Б. Б. (1994). «Эффективное копирование негомологичных последовательностей из эктопических сайтов посредством репарации разрывов, индуцированной Р-элементом». Молекулярная и клеточная биология. 14 (3): 1613–25. Дои:10.1128 / mcb.14.3.1613. ЧВК 358520. PMID 8114699.
- ^ Холлидей Р. (1964). «Индукция митотической рекомбинации митомицином C в Ustilago и Сахаромицеты". Генетика. 50 (3): 325–35. ЧВК 1210654. PMID 14207702.
- ^ Аллерс Т, Лихтен М (2001). «Дифференциальное время и контроль рекомбинации некроссинговера и кроссовера во время мейоза». Клетка. 106 (1): 47–57. Дои:10.1016 / s0092-8674 (01) 00416-0. PMID 11461701.
- ^ МакМахилл М.С., Шам Ч.В., Епископ Д.К. (2007). «Синтез-зависимый отжиг нитей в мейозе». PLOS Биология. 5 (11): 2589–2601. Дои:10.1371 / journal.pbio.0050299. ЧВК 2062477. PMID 17988174.
- ^ Dupaigne P, Le Breton C, Fabre F, Gangloff S, Le Carn E, Veaute X (2008). «Активность геликазы Srs2 стимулируется филаментами Rad51 на дцДНК: влияние на частоту кроссовера во время митотической рекомбинации». Молекулярная клетка. 29 (2): 243–254. Дои:10.1016 / j.molcel.2007.11.033. PMID 18243118.
- ^ Миура Т., Ямана Ю., Усуи Т., Огава Х.И., Ямамото М.Т., Кусано К. (2012). «Гомологичная рекомбинация посредством зависимого от синтеза отжига цепи в дрожжах требует ДНК-геликаз Irc20 и Srs2». Генетика. 191 (1): 65–78. Дои:10.1534 / генетика.112.139105. ЧВК 3338270. PMID 22367032.
- ^ Формоза Т., Альбертс Б.М. (1986). «Синтез ДНК, зависящий от генетической рекомбинации - характеристика реакции, катализируемой очищенными белками бактериофага-Т4». Клетка. 47 (5): 793–806. Дои:10.1016/0092-8674(86)90522-2. PMID 3022939.
- ^ Махер Р.Л., Бранаган А.М., Morrical SW (2011). «Координация репликации и рекомбинации ДНК в поддержании стабильности генома». Журнал клеточной биохимии. 112 (10): 2672–2682. Дои:10.1002 / jcb.23211. ЧВК 3178728. PMID 21647941.
- ^ Сасанума Х, Фурихата Й, Шинохара М, Шинохара А (2013). «Ремоделирование белка обмена нити ДНК Rad51 с помощью геликазы Srs2». Генетика. 194 (4): 859–72. Дои:10.1534 / genetics.113.150615. ЧВК 3730916. PMID 23770697.
- ^ Ира Г., Малкова А., Либери Г., Фойани М., Хабер Дж. Э. (2003). «Srs2 и Sgs1-Top3 подавляют кроссоверы во время восстановления двухцепочечных разрывов в дрожжах». Клетка. 115 (4): 401–11. Дои:10.1016 / s0092-8674 (03) 00886-9. ЧВК 4493758. PMID 14622595.
- ^ а б Де Майт А., Джессоп Л., Колар Э., Сурираджан А., Чен Дж., Даяни Ю., Лихтен М. (2012). «Ортолог геликазы BLM Sgs1 является центральным регулятором промежуточного метаболизма мейотической рекомбинации». Мол. Клетка. 46 (1): 43–53. Дои:10.1016 / j.molcel.2012.02.020. ЧВК 3328772. PMID 22500736.
- ^ Каур Х., Де Муйт А, Лихтен М (2015). «Одноцепочечная декатеназа ДНК Top3-Rmi1 является неотъемлемой частью образования и разделения промежуточных продуктов мейотической рекомбинации». Мол. Клетка. 57 (4): 583–94. Дои:10.1016 / j.molcel.2015.01.020. ЧВК 4338413. PMID 25699707.
- ^ Уринга EJ, Youds JL, Lisaingo K, Lansdorp PM, Boulton SJ (2011). «RTEL1: важная геликаза для поддержания теломер и регуляции гомологичной рекомбинации». Нуклеиновые кислоты Res. 39 (5): 1647–55. Дои:10.1093 / nar / gkq1045. ЧВК 3061057. PMID 21097466.
- ^ Crismani W, Girard C, Froger N, Pradillo M, Santos JL, Chelysheva L, Copenhaver GP, Horlow C, Mercier R (2012). «FANCM ограничивает мейотические кроссоверы». Наука. 336 (6088): 1588–90. Bibcode:2012Sci ... 336.1588C. Дои:10.1126 / science.1220381. PMID 22723424.
- ^ Белый дом, HLK (1982). Генетическая рекомбинация: понимание механизмов. Вайли. п. 321 и таблица 38. ISBN 978-0471102052.
- ^ Mehrotra S, McKim KS (2006). «Временной анализ образования и репарации двухцепочечных разрывов мейотической ДНК у самок дрозофилы». PLoS Genet. 2 (11): e200. Дои:10.1371 / journal.pgen.0020200. ЧВК 1657055. PMID 17166055.
