Вольфрамат - Tungstate
4)
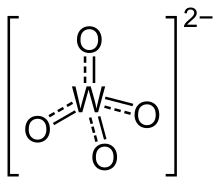
В химии вольфрамат это соединение, которое содержит оксоанион из вольфрам или является смешанный оксид содержащие вольфрам. Самый простой вольфрамат ион является WO2−
4, «ортовольфрамат».[1] Многие другие вольфраматы принадлежат к большой группе многоатомных ионов, которые называются полиоксометаллаты, («ПОМ»), и конкретно называемые изополиоксометаллатами, поскольку они содержат, наряду с кислородом и, возможно, водородом, только один другой элемент. Практически все полезные вольфрамовые руды - вольфраматы.[2]
Структуры
Ортовольфраматы имеют тетраэдрические центры W (VI) с короткими расстояниями W – O 1,79.Å. По структуре они напоминают сульфаты. В полиоксовольфраматах преобладает шестикоординатный октаэдрический вольфрам. В этих соединениях расстояния W – O удлинены.[1]
Некоторые примеры ионов вольфрама:[3]
- HWO−
4 (водовольфрамат)[3] - полимерный W
2О2−
7 ионы различного строения в Na2W2О7, Ли2W2О7 и Ag2W2О7[4] - [W7О24]6− (паравольфрамат А)[3]
- [W10О32]4− (вольфрамат Y)[5]
- [ЧАС2W12О42]10− (паравольфрамат B) [3]
- α- [H2W12О40]6− (метавольфрамат)[5]
- β- [H2W12О40]6− (вольфрамат X)[5]
Увидеть категория вольфраматов для списка вольфраматов.
Вхождение
Вольфраматы встречаются в природе с молибдаты. Шеелит, минерал вольфрамат кальция, часто содержит небольшое количество молибдата. Вольфрамит это вольфрамат марганца и железа, и все это ценные источники вольфрама. Powellite представляет собой минеральную форму молибдата кальция, содержащую небольшое количество вольфрамата.
Реакции
Растворы вольфраматов, таких как молибдаты, дают интенсивно синие растворы сложного вольфрамата (V, VI), аналогичные растворам молибденовый блюз при уменьшении большинством органических материалов.[1]
В отличие от хромат, вольфрамат не хороший окислитель, но, как и хромат, растворы вольфрамата конденсируются с образованием изополивольфраматов при подкислении.
Рекомендации
- ^ а б c Эгон Виберг, Арнольд Фредерик Холлеман (2001). Неорганическая химия. Эльзевир. ISBN 0-12-352651-5.
- ^ Ласснер, Эрик; Шуберт, Вольф-Дитер; Людериц, Эберхард; Вольф, Ханс Уве (2005). «Вольфрам, вольфрамовые сплавы и соединения вольфрама». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a27_229.CS1 maint: лишняя пунктуация (связь)
- ^ а б c d Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- ^ Уэллс А.Ф. (1984) Структурная неорганическая химия 5-е издание Oxford Science Publications ISBN 0-19-855370-6
- ^ а б c Джон А. МакКлеверти, Н. Г. Коннелли, Номенклатура неорганической химии II: рекомендации 2000 г., Комиссия Международного союза теоретической и прикладной химии по номенклатуре неорганической химии, опубликовано Королевским химическим обществом, 2001 г. ISBN 0-85404-487-6
