Винс лактам - Vince lactam - Wikipedia
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК 2-Азабицикло [2.2.1] гепт-5-ен-3-он | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ChemSpider | |||
PubChem CID | |||
| |||
| |||
| Характеристики | |||
| C6ЧАС7NО | |||
| Молярная масса | 109.128 г · моль−1 | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Винс лактам[1] коммерческое название, данное бициклическая молекула γ-лактам 2-азабицикло [2.2.1] гепт-5-ен-3-он. Этот лактам представляет собой универсальное промежуточное химическое соединение, используемое в органической и медицинской химии. Он используется в качестве синтетического прекурсора для трех препаратов (одобренных или находящихся в клинических испытаниях).[2][3] Он назван в честь Роберт Винс кто использовал структурные особенности этой молекулы для получения карбоциклические нуклеозиды.[4] Работа Винса с этим лактамом в конечном итоге привела к его синтезу абакавир.[5][6][7] Перамивир Синтез также зависит от исходного материала лактама Винса.
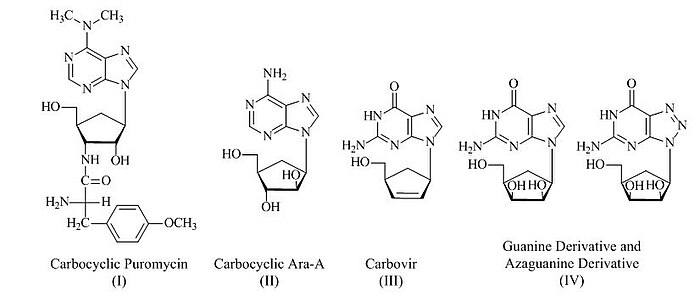
Лактам Винса широко использовался для получения различных карбоциклических нуклеозидов в медицинских целях, включая карбоциклический пуромицин (I),[8] карбоциклический Ara-A (II),[9] карбовир (III)[10] и гуанин, а также карбоциклические производные азагуанина (IV)[11]
Лактам Винса также является промежуточным звеном в синтезе различных аналогов нуклеозидов, таких как производные дифторгуанозина (V),[12][13] карбоциклический оксанозин и родственные производные (VI),[14] и предшественники азидокарбонуклеозидов (VII).[15] Лактам нашел несколько применений в борьбе с множеством различных болезненных состояний, также предоставляя различные ненуклеозидные терапевтические молекулы. Некоторые хорошо известные примеры включают каркасы для приготовления ингибиторов гликозидазы (VIII).[16] и ингибиторы ГАМК-АТ (IX).[17]
Рекомендации
- ^ Singh, R .; Винс, Р. Chem. Ред. 2012, 112 (8), стр. 4642–4686. «2-Азабицикло [2.2.1] гепт-5-ен-3-он: химический профиль универсального синтетического строительного блока и его влияние на развитие терапевтических средств»
- ^ Рухи, А. М. (14 июля 2003 г.). «Упрощение синтезов - всегда ключевая цель». C&EN. 80 (28): 40.
- ^ Холт-Тиффин, К. Э. Чимика Огги 2009, 27, 23-25.
- ^ «Роберт Винс, доктор философии». Центр дизайна лекарств, Университет Миннесоты.
- ^ Daluge, S .; Винс, Р. J. Org. Chem. 1978, 43, 2311-2320.
- ^ Винс, Р .; Хуа, М. «Синтез карбовира и абакавира из карбоциклического предшественника» Текущие протоколы в химии нуклеиновых кислот Под ред. Бокаж, С. Л. 2006, Глава 14 Раздел 14.4. Дои:10.1002 / 0471142700.nc1404s25.
- ^ Винс, Р. «Краткая история развития Ziagen» Chemtracts 2008, 21, 127-134.
- ^ Винс, Р .; Daluge, S .; Браунелл, Дж. J. Med. Chem. 1986, 29, 2400.
- ^ Daluge, S .; Винс, Р. J. Org. Chem., 1978, 43, 2311-2320.
- ^ Винс, Р .; Хуа, М. J. Med. Chem. 1990, 33, 17.
- ^ Peterson, M. L .; Винс, Р. J. Med. Chem. 1990, 33, 1214-1219.
- ^ Toyota, A .; Habutani, C .; Katagiri, N .; Канеко, К. Tetrahedron Lett. 1994, 35, 5665-5668.
- ^ Toyota, A .; Aizawa, M .; Habutani, C .; Katagiri, N .; Канеко, К. Тетраэдр 1995, 36, 8783-8798.
- ^ Saito, Y .; Накамура, М .; Оно, Т .; Chaicharoenpong, C .; Ichikawa, E .; Yamamura, S .; Като, К .; Умедзава, К. J. Антибиотики 2000, 53, 309-313.
- ^ Поцелуй, Л .; Форро, Э .; Sillanpaa, R .; Фулоп, Ф. Синтез 2010, 153-160.
- ^ Rommel, M .; Эрнст, А .; Кёрт, У. Евро. J. Org. Chem. 2007, 4408-4430.
- ^ Минено, Т .; Миллер, М. Дж. J. Org. Chem. 2003, 68, 6591-6596.