Виридин - Viridin
 | |
| Имена | |
|---|---|
| Название ИЮПАК (1S, 2S, 11bR) -1-Гидрокси-2-метокси-11b-метил-1,7,8,11b-тетрагидроциклопента [7,8] фенантро [10,1-bc] фуран-3,6,9 ( 2H) -трион | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.019.989 |
| UNII | |
| |
| |
| Характеристики | |
| C20ЧАС16О6 | |
| Молярная масса | 352,337 г моль−1 |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Виридин противогрибковый метаболит из Gliocladium virens об этом впервые сообщили в 1945 году.[1] Принадлежащий к классу молекул, известных как фураностероиды, он имеет характерное сильно напряженное электрофильное фурановое кольцо, слитое между C-4 и C-6 стероидный препарат рамки. Члены этой семьи, в том числе вортманнин, как известно, являются мощными необратимыми ковалентными ингибиторами фосфоинозитид-3-киназы (PI3Ks).[2]
Биосинтез
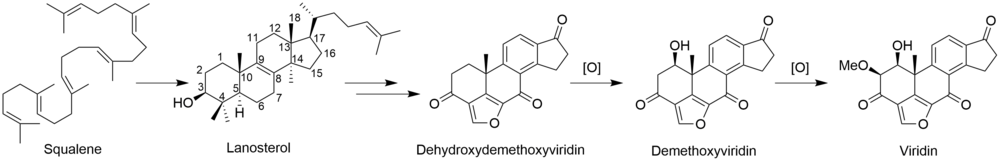
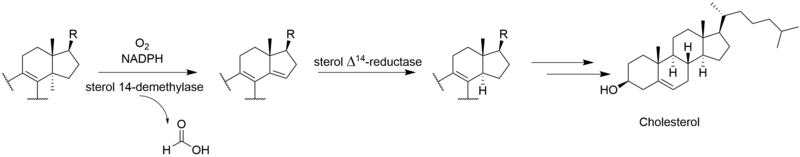
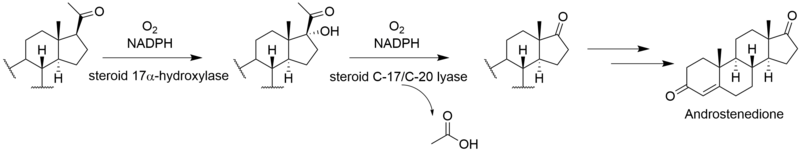
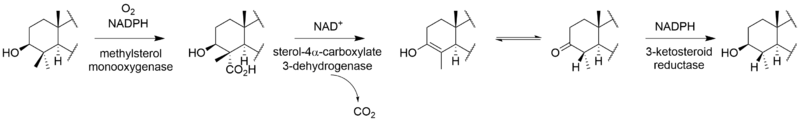
Полный биосинтез виридина не известно. Через [2-14C] исследования мечения мевалоновой кислоты показали, что виридин биосинтезируется из тритерпеноид путь, который начинается с сквален, а не дитерпеноид путь.[3] Включение ланостерин в виридин.[4] Хотя механизмы и порядок оставшихся стадий от ланостерола до виридина не определены, они включают образование фуранового кольца, потерю метильных групп C-13 и C-14, ароматизацию C-кольца, удаление бокового кольца. цепь и окисление A-кольца. Некоторые из этих шагов могут быть аналогичны путям других стероидов. Потеря атома водорода из C-15 во время удаления метильной группы C-14 предполагает путь, аналогичный таковому при биосинтезе других стероидов.[5] Аналогично холестерин В этом пути метильная группа C-14 теряется в виде муравьиной кислоты под действием стерол-14-деметилазы.[6] Хотя метильная группа C-13 не удаляется в пути альдостерон, возможно, что виридин подвергается аналогичному окислению по C-18 с последующей потерей муравьиной кислоты или декарбоксилированием для удаления C-13-метила. Было показано, что удаление боковой цепи происходит по пути у млекопитающих.[7] Вероятно, это следует по пути андростендион и окислительно удаляет боковую цепь в виде уксусной кислоты, в результате чего образуется кетон на D-кольце.[6] «Дополнительный» углерод в фурановом кольце у C-4 происходит из 3’-положения мевалоновой кислоты и представляет собой C-4β-метильную группу ланостерина.[5] Окисление и декарбоксилирование C-4α-метильной группы соответствует нормальному стероидному пути у млекопитающих; однако вместо повторения этих шагов для удаления другой метильной группы вторая окисленная метильная группа, вероятно, перехватывается с образованием фуранового кольца по неизвестному механизму. Исследования показывают, что ароматизация С-кольца протекает без перестройки скелета.[5]
В биосинтезе виридиола Gliocladium Deliquescensсообщалось о восстановленной форме 3β-ОН виридина, о включении сквалена, ланостерина, дегидроксидеметоксивиридина и деметоксивиридина.[8][9] Это говорит о том, что вицинальная оксигенация на C-1 и C-2 является независимой стадией, включающей гидроксилирование.
Рекомендации
- ^ BRIAN, P.W .; МАКГОВАН, Дж. Г. (4 августа 1945 г.). «Виридин: высоко фунгистатическое вещество, продуцируемое Trichoderma viride». Природа. 156 (3953): 144–145. Дои:10.1038 / 156144a0.
- ^ Яно, Н; Наканиши, S; Кимура, К; Hanai, N; Сайто, Y; Фукуи, Y; Нономура, Y; Мацуда, Y (5 декабря 1993 г.). «Ингибирование секреции гистамина с помощью вортманнина посредством блокады фосфатидилинозитол-3-киназы в клетках RBL-2H3». Журнал биологической химии. 268 (34): 25846–56. PMID 7503989.
- ^ Blight, Маргарет М .; Coppen, J. J. W .; Гроув, Джон Фредерик. «Биогенез из мевалоновой кислоты стероидного противогрибкового метаболита виридина». Химические коммуникации (Лондон) (18): 1117. Дои:10.1039 / C19680001117.
- ^ Golder, Walter S .; Уотсон, Томас Р. "Производные ланостерина в качестве предшественников в биосинтезе виридина. Часть 1". Журнал химического общества, Perkin Transactions 1: 422. Дои:10.1039 / P19800000422.
- ^ а б c Хэнсон, Джеймс Р .; О'Лири, Маргарет А .; Уодсворт, Гарри Дж. "Исследования в области биосинтеза терпеноидов. Часть 28. Ацетатные и мевалонатные паттерны мечения стероида, деметоксивиридина". Журнал химического общества, Perkin Transactions 1: 867. Дои:10.1039 / P19830000867.
- ^ а б Дьюик, Пол М. (2009). Лекарственные натуральные продукты: биосинтетический подход (3-е изд.). Чичестер: John Wiley & Sons. ISBN 978-0-470-74167-2.
- ^ Хэнсон, Джеймс Р .; О'Лири, Маргарет А .; Уодсворт, Гарри Дж. "Грибковое расщепление боковой цепи стерола". Журнал химического общества, химические коммуникации (18): 853. Дои:10.1039 / C39800000853.
- ^ Хэнсон, Джеймс Р .; О'лири, Маргарет А .; Wadsworth, Гарри Дж .; благо, ленг йео. «Биосинтез стероида, виридиола, Gliocladium Deliquescens». Фитохимия. 27 (2): 387–389. Дои:10.1016/0031-9422(88)83104-2.
- ^ Джонс, Ричард (1987). «Превращение виридина в виридиол грибами, продуцирующими виридин». Канадский журнал микробиологии. 33 (11): 963–966. Дои:10,1139 / м87-169.
