Катализ окисления воды - Water oxidation catalysis

Катализ окисления воды (WOC) - это ускорение (катализ) превращения воды в кислород и протоны:
- 2 ч2O → 4 H+ + 4 е− + O2
Многие катализаторы эффективны, оба гомогенные катализаторы и гетерогенные катализаторы. В кислород выделяющий комплекс в фотосинтезе - главный пример. Нет никакого интереса в получении кислорода путем окисления воды, поскольку кислород легко получается из воздуха. Напротив, интерес к окислению воды мотивирован его актуальностью для расщепление воды, что обеспечило бы "солнечную водород, "то есть окисление воды приведет к образованию электронов и протонов для производства водорода.[2] Идеальный WOC должен работать быстро при низком перенапряжении, демонстрировать высокую стабильность и иметь низкую стоимость, полученную из нетоксичных компонентов.
Механические и энергетические принципы
Воду окислить сложнее, чем сопряженное с ней основание. гидроксид. Гидроксид стабилизирован координацией с катионами металлов. Некоторые гидроксиды металлов, содержащие окислительно-восстановительные центры металлов, могут быть окислены с образованием оксокомплексы металлов. Атака воды на оксоцентры металлов представляет собой один из путей образования связи O-O, ведущей к дикислоду. Альтернативно, решающая стадия образования связи O-O может возникать путем связывания подходящим образом расположенных пар гидроксоцентров металлов. Молекулярный механизм OEC не выяснен.
Превращение даже гидроксокомплексов металлов в O2 требует очень сильных окислителей. При фотосинтезе такие окислители обеспечиваются электронными дырками на катион-радикалах порфирина. Для применений в устройствах аспирационный окислитель является фотоэлектрический материал. Для проверки WOC, аммиачная селитра церия является типичным акцептором электронов.

Гомогенный катализ
Рутениевые комплексы
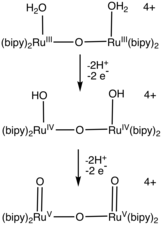
Ряд рутений-аквакомплексы катализируют окисление воды. Особенности большинства катализаторов бипиридин и терпиридин лиганды.[3][4][2] Катализаторы, содержащие пиридин-2-карбоксилат выставочные ставки (300 с−1) сравнимо с фотосистема II.[5][6] Работа в этой области привела к появлению многих новых полипиридильных лигандов.[7][8]
Комплексы кобальта и железа
Ранние образцы WOC на основе кобальта страдали от нестабильности.[9] Однородный WOC [Co (Py5)(ЧАС2O)] (ClO4)2[10] действует посредством переноса электронов, связанных с протонами, с образованием [CoIII--ОЙ]2+ частицы, которые при дальнейшем окислении образуют CoIV промежуточный. Образовавшийся промежуточный продукт реагирует с водой с высвобождением O2. Кобальт-полиоксометаллат комплекс [Co4(ЧАС2O)2(α-PW9О34)2]10− это высокоэффективный WOC.[11]
Некоторые комплексы железа катализируют окисление воды. Водорастворимый комплекс [Fe (OTf)2(Меня2Pytacn)] (Pytacn = пиридин-замещенный триметилтриазациклононан; OTf = трифлат ) - эффективный WOC. Было обнаружено, что концентрация катализатора и окислителя сильно влияет на процесс окисления. Многие родственные комплексы с цис-лабильными центрами являются активными катализаторами. Было обнаружено, что большинство комплексов разлагаются в течение нескольких часов. Более высокая стабильность молекулярного катализатора может быть достигнута с использованием надежных клатрохелатных лигандов, которые стабилизируют высокие степени окисления железа и предотвращают быстрое разложение катализатора.[12] Количество и стереохимия реактивных координационных центров на Fe были оценены, но появилось несколько рекомендаций.[13]
Иридиевые комплексы
Комплексы [Ir (ppy)2(ОЙ2)2]+ (ppy = 2-фенилпиридин) демонстрируют высокие числа оборотов, но низкие каталитические скорости. Замена ppy на Cp * (C5меня5) приводит к увеличению каталитической активности, но снижает число оборотов.[14] Было обнаружено, что нуклеофильная атака воды на частицы Ir = O ответственна за O2 формирование.[15]
Гетерогенный катализ
Оксид иридия представляет собой стабильный объемный катализатор WOC с низким перенапряжением.[16]
Оксидная пленка на основе Ni высвобождает кислород в квазинейтральных условиях при перенапряжении ~ 425 мВ и демонстрирует длительную стабильность.[17] Рентгеновская спектроскопия выявила наличие ди-µ-оксидного мостика между NiIII/ NiIV ионы, но не было обнаружено никаких доказательств образования мостиков моно-μ-оксидов между ионами.[18] Подобные структуры можно найти в пленках Co-WOC и катализаторах Mn-WOC.[19][20]
Оксиды кобальта (Co3О4) были исследованы, чтобы работать по той же схеме, что и другие соли кобальта.[21] Фосфаты кобальта также являются активными WOC при нейтральном pH.[22] Стабильные и высокоактивные WOC могут быть получены путем адсорбции CoII на наночастицах кремнезема.[23]
Дополнительные обзоры
- Мейер Т. Дж. Химические подходы к искусственному фотосинтезу. Счета химических исследований 1989, 22, 163–170.
- Бальзани, В .; Credi, A .; Вентури М. Фотохимическое преобразование солнечной энергии. ChemSusChem 2008, 1, 26–58.
- Сала, X .; Romero, I .; Родригес, М .; Escriche, L .; Льобет А. Молекулярные катализаторы, окисляющие воду до кислорода. Angewandte Chemie International Edition 2009, 48, 2842–2852.
- Гратцель М. Фотоэлектрохимические ячейки. Nature 2001, 414, 338–344.
- Eisenberg, R .; Грей, Х. Б., Предисловие о получении кислорода. Неорганическая химия 2008, 47, 1697–1699.
- Вс, л .; Hammarstrom, L .; Акермарк, Б .; Стайринг, С., На пути к искусственному фотосинтезу: химия рутения-марганца для производства энергии. Обзоры химического общества 2001, 30, 36–49.
- Gust, D .; Мур, Т. А .; Мур, А. Л., Солнечное топливо посредством искусственного фотосинтеза. Счета химических исследований 2009, 42, 1890–1898.
использованная литература
- ^ Умена, Ясуфуми; Каваками, Кейсуке; Шен, Цзянь-Рен; Камия, Нобуо (май 2011 г.). «Кристаллическая структура фотосистемы II с выделением кислорода при разрешении 1,9 Å» (PDF). Природа. 473 (7345): 55–60. Bibcode:2011Натура 473 ... 55U. Дои:10.1038 / природа09913. PMID 21499260.
- ^ а б c Лю, Ф .; Concepcion, J. J .; Jurss, J. W .; Cardolaccia, T .; Templeton, J. L .; Мейер, Т. Дж. (2008). «Механизмы окисления воды от голубого димера до фотосистемы II». Неорганическая химия. 47 (6): 1727–1752. Дои:10.1021 / ic701249s. PMID 18330966.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Wada, T .; Цуге, К .; Танака, К. (2000). «Электрохимическое окисление воды до кислорода, катализируемое окисленной формой бис (рутений-гидроксо) комплекса в H2О ". Angewandte Chemie International Edition. 39 (8): 1479–1482. Дои:10.1002 / (SICI) 1521-3773 (20000417) 39: 8 <1479 :: AID-ANIE1479> 3.0.CO; 2-4.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Sens, C .; Romero, I .; Родригес, М .; Llobet, A .; Parella, T .; Бенет-Бухгольц, Дж. (2004). «Новый комплекс Ru, способный каталитически окислять воду до молекулярного кислорода». Журнал Американского химического общества. 126 (25): 7798–7799. Дои:10.1021 / ja0486824. PMID 15212526.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Duan, L .; Фишер, А .; Xu, Y .; Солнце, Л. (2009). «Изолированный семикоординатный димерный комплекс Ru (IV) с [HOHOH] - мостиковым лигандом в качестве промежуточного продукта для каталитического окисления воды». Журнал Американского химического общества. 131 (30): 10397–10399. Дои:10.1021 / ja9034686. PMID 19601625.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Duan, L .; Бозоглян, Ф .; Mandal, S .; Стюарт, B .; Привалов, Т .; Llobet, A .; Солнце, Л. (2012). «Молекулярный рутениевый катализатор с активностью окисления воды, сравнимой с активностью фотосистемы II». Nat. Chem. 4 (5): 418–423. Bibcode:2012НатЧ ... 4..418Д. Дои:10.1038 / nchem.1301. PMID 22522263.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Zong, R .; Таммел, Р. П. (2005). «Новое семейство комплексов Ru для окисления воды». Журнал Американского химического общества. 127 (37): 12802–12803. Дои:10.1021 / ja054791m. PMID 16159265.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ Zhang, G .; Zong, R .; Tseng, H.-W .; Таммел, Р. П. (2008). «Ru (II) Комплексы тетрадентатных лигандов, связанных с 2,9-ди (пирид-2'-ил) -1,10-фенантролином». Неорганическая химия. 47 (3): 990–998. Дои:10.1021 / ic701798v. PMID 18183971.CS1 maint: несколько имен: список авторов (ссылка на сайт).
- ^ Brunschwig, B.S .; Chou, M. H .; Creutz, C .; Ghosh, P .; Сутин Н. Механизмы окисления воды в кислород: кобальт (IV) как интермедиат в реакции, катализируемой аквокобальтом (II). Журнал Американского химического общества, 1983, 105, 4832-4833.
- ^ Василенко, Д. Дж .; Ganesamoorthy, C .; Borau-Garcia, J .; Berlinguette, C.P., Электрохимические доказательства каталитического окисления воды, опосредованного комплексом высоковалентного кобальта. Химические коммуникации 2011, 47, 4249-4251.
- ^ Инь, Q .; Tan, J.M .; Besson, C .; Гелети, Ю. В .; Мусаев Д.Г .; Кузнецов, А.Е .; Luo, Z .; Hardcastle, K. I .; Хилл, К. Л., Быстрорастворимый безуглеродный молекулярный катализатор окисления воды на основе большого количества металлов. Science 2010, 328, 342-345.
- ^ Фрицкий, Игорь Олегович; Берггрен, Густав; Са, Хасинто; Мамедов, Фикрет; Д’Амарио, Лука; Павлюк, Мария В .; Шилин, Сергей И. (18.02.2019). «Эффективное окисление воды под действием видимого света, катализируемое клатрохелатным комплексом железа (IV)». Химические коммуникации. 55 (23): 3335–3338. Дои:10.1039 / C9CC00229D. ISSN 1364-548X. PMID 30801592.
- ^ Fillol, J. L .; Codolà, Z .; Garcia-Bosch, I .; Gómez, L .; Pla, J. J .; Костас М. Эффективные катализаторы окисления воды на основе легко доступных координационных комплексов железа. Nat Chem 2011, 3, 807-813.
- ^ Hull, J. F .; Balcells, D .; Blakemore, J.D .; Incarvito, C.D .; Эйзенштейн, O .; Brudvig, G.W .; Крэбтри, Р. Х. (2009). «Высокоактивные и надежные комплексы Cp * иридия для каталитического окисления воды». Журнал Американского химического общества. 131 (25): 8730–8731. Дои:10.1021 / ja901270f. ЧВК 2742501. PMID 19496565.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Blakemore, J.D .; Schley, N.D .; Balcells, D .; Hull, J. F .; Olack, G.W .; Incarvito, C.D .; Эйзенштейн, O .; Brudvig, G.W .; Крэбтри, Р. Х. (2010). «Полусэндвич-иридиевые комплексы для гомогенного водно-окислительного катализа». Журнал Американского химического общества. 132 (45): 16017–16029. Дои:10.1021 / ja104775j. PMID 20964386.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Youngblood, W. J .; Ли, С.-Х. А .; Maeda, K .; Маллук, Т. Э. (2009). «Расщепление воды в видимом свете с использованием оксидных полупроводников, чувствительных к красителям». Отчеты о химических исследованиях. 42 (12): 1966–1973. Дои:10.1021 / ar9002398. PMID 19905000.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Dincă, M .; Сурендранатх, Й .; Ночера Д. Г., Катализатор, выделяющий кислород на основе бората никеля, работающий в благоприятных условиях. Слушания Национальной академии наук 2010, 107, 10337-10341.
- ^ Risch, M .; Klingan, K .; Heidkamp, J .; Эренберг, Д .; Чернев, П .; Захариева, И .; Дау Х. Никель-оксидоструктура пленки водоокислительного катализатора. Химические коммуникации 2011, 47, 11912-11914.
- ^ Захариева, И .; Najafpour, M. M .; Wiechen, M .; Haumann, M .; Kurz, P .; Дау, Х., Синтетические оксиды марганца и кальция имитируют водоокислительный комплекс фотосинтеза функционально и структурно. Энергетика и экология 2011, 4, 2400-2408.
- ^ Kanan, M. W .; Яно, Дж .; Сурендранатх, Й .; Dincă, M .; Ячандра, В. К .; Ночера, Д. Г., Структура и валентность кобальто-фосфатного катализатора окисления воды, определенная с помощью рентгеновской спектроскопии in situ. Журнал Американского химического общества 2010, 132, 13692-13701.
- ^ Harriman, A .; Пикеринг, И. Дж .; Thomas, J.M .; Кристенсен П. А., Оксиды металлов как гетерогенные катализаторы выделения кислорода в фотохимических условиях. Журнал химического общества, Труды Фарадея 1: Физическая химия в конденсированных фазах 1988, 84, 2795-2806.
- ^ Мэтью В. Канан, Йогеш Сурендранатха, Дэниел Г. Ночера (2009). «Кобальт-фосфатное соединение, выделяющее кислород». Chem. Soc. Rev. 38 (1): 109–114. Дои:10.1039 / B802885K. PMID 19088970.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Зидки, Т .; Zhang, L .; Шафирович, В .; Лымарь, С. В. (2012). «Окисление воды, катализируемое кобальтом (II), адсорбированным на наночастицах кремнезема». Журнал Американского химического общества. 134 (35): 14275–14278. Дои:10.1021 / ja304030y. PMID 22913479.CS1 maint: использует параметр авторов (ссылка на сайт)
