Кислотная соль - Acid salt
Кислотные соли являются классом соли которые производят кислый раствор после растворения в растворитель. Его образование как вещество имеет большую электрическую проводимость, чем у чистого растворителя.[1] Кислый раствор, образованный кислотной солью, образуется во время частичного нейтрализация из дипротический или же полипротонные кислоты. А полунейтрализация происходит за счет остатков сменных водород атомы от частичной диссоциации слабых кислот, не вступивших в реакцию с гидроксид-ионы (ОЙ−) для создания молекул воды. Кислая соль - это ионное соединение состояла из аниона, внесенного из слабая исходная кислота, и катион, внесенный из сильная родительская база.
Кислый раствор и примеры кислотных солей
Кислотно-основной Свойство полученного раствора в результате реакции нейтрализации зависит от оставшихся солевых продуктов. Соль, содержащая реактивные катионы, претерпевает гидролиз посредством которых они реагируют с молекулами воды, вызывая депротонирование конъюгированных кислот.
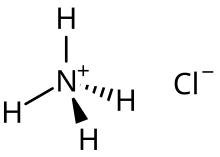
Например, кислотная соль хлорид аммония является основным видом, образовавшимся на половинная нейтрализация аммиака в растворе соляной кислоты:[2]
| Личность: | Бисульфат натрия | Мононатрий фосфат | Динатрий фосфат |
|---|---|---|---|
| Структурная формула |  |  | |
| Химическая формула | NaHSO 4 | Неа 2PO 4 | Na 2HPO 4 |
| Название ИЮПАК | Гидросульфат натрия | Дигидрофосфат натрия | Гидрофосфат натрия |
| Другое имя |
|
|
|
| Молекулярный вес | 120,054 г / моль | 119,976 г / моль | 141,957 г / моль |
| Формальное обвинение | нуль | Нуль | Нуль |
| Запах | Без запаха | Без запаха | Без запаха[3] |
| Внешность | Белые кристаллы или гранулы | Белый кристаллический порошок[4] | Белый гигроскопичный порошок[5] |
| Структура |
| Моноклинные кристаллы[6] | Моноклинные кристаллы (безводные)[7] |
| Растворимость |
|
|
|
| Плотность |
| 0,5-1,2 г / см3 | 1,7 г / см3 |
| Разложение (через нагрев) | Образует карбонат натрия, воду и диоксид углерода. | Выбрасывает токсичные пары фосфоксидов и оксида натрия.[8] | Выбрасывает токсичные пары оксидов фосфора и натрия.[8] |
| Использует |
|
|
|
Использование в еде
Кислотные соли часто используются в пищевых продуктах как часть разрыхлителей. В этом контексте кислые соли называются «заквасочными кислотами».[9] Общие заквасочные кислоты включают: винный камень и монокальций фосфат.
Кислотную соль можно смешать с солью щелочного металла (такой как бикарбонат натрия или пищевая сода) для создания разрыхлителей, которые выделяют углекислый газ.[10] Разрыхлители могут быть медленно действующими (например, фосфат натрия-алюминия ), которые реагируют при нагревании, или быстродействующие (например, зубной камень), которые немедленно реагируют при низких температурах. Разрыхлители двойного действия содержат разрыхлители как медленного, так и быстродействующего действия и реагируют при низких и высоких температурах, обеспечивая повышение разрыхленности в процессе выпечки.[11]
Динатрий фосфат, Na2HPO4, используется в пищевых продуктах и фосфате натрия, NaH2PO4, используется в кормах для животных, зубной пасте и сгущенном молоке.
Интенсивность кислоты
Кислота с высшим Kа значение преобладает в химической реакции. Он служит лучшим помощником протоны (ЧАС+). Сравнение между Kа и Kб указывает на кислотно-основные свойства полученного раствора, благодаря которым:
- Раствор кислый, если Kа > Kб. Он содержит большую концентрацию H+ ионов, чем концентрация OH− ионы из-за более обширного гидролиза катионов по сравнению с гидролизом анионов.
- Раствор щелочной, если Kа < Kб. Анионы гидролизуют больше, чем катионы, в результате чего концентрация OH− ионы.
- Ожидается, что решение будет нейтральным, только если Kа и Kб идентичны.[12]
Другие возможные факторы, которые могут отличаться уровень pH решения являются актуальными константы равновесия и дополнительные количества любого основания или кислоты.
- Например, в хлорид аммония раствор, NH4+ - основное влияние на кислый раствор. У него больше Kа ценность по сравнению с молекулами воды; Kа NH4+ составляет 5,6 х 10−10 и Kш из H2O составляет 1,0 x 10−14. Это обеспечивает его депротонирование при реакции с водой и отвечает за pH ниже 7 при комнатной температуре. Cl− не будет близость для ч+ ни склонности к гидролизу, так как его Kб значение очень низкое (Kб Cl− 7,7 х 10−21).[13]
- Гидролиз аммония при комнатной температуре дает:
- = 5,6 х 10−10
Смотрите также
- Щелочная соль
- Соль (химия)
- Оксокислота
- Бикарбонат натрия
- Бисульфат натрия
- Динатрий фосфат
- Мононатрий фосфат
Рекомендации
- ^ Cady, H.P .; Эльси, Х. М. (1928). «Общее определение кислот, оснований и солей». Журнал химического образования. 5 (11): 1425. Bibcode:1928JChEd ... 5.1425C. Дои:10.1021 / ed005p1425.
- ^ Декок, Роджер Л .; Грей, Гарри Б. (1989). Химическая связь и структура (Второе изд.). Саусалито, Калифорния: Университетская научная книга. С. 97–98. ISBN 978-0-935702-61-3. Получено 8 февраля 2018.
- ^ Береговая охрана США, Министерство транспорта. CHRIS - Данные об опасных химических веществах. Том II. Вашингтон, округ Колумбия: Типография правительства США, 1984-5.
- ^ Льюис, Р.Дж. Sr .; Сжатый химический словарь Хоули, 15-е издание. John Wiley & Sons, Inc. Нью-Йорк, Нью-Йорк, 2007 г., стр. 1153
- ^ Лиде, Д. CRC Справочник по химии и физике 88-е издание 2007-2008 гг. CRC Press, Тейлор и Фрэнсис, Бока-Ратон, Флорида, 2007 г., стр. 4-90
- ^ Хейнс, У. (ред.). CRC Справочник по химии и физике. 95-е издание. CRC Press LLC, Бока-Ратон: Флорида, 2014-2015, стр. 4-89
- ^ Сомов, Н.В .; Чаусов, Ф.Ф .; Русс, Дж. (2017). «Высокосимметричный полиморф безводного гидрофосфата динатрия». Российский журнал неорганической химии. 62 (2): 172–174. Дои:10.1134 / S0036023617020176.
- ^ а б Уайли, Джон; Хобокен, штат Нью-Джерси (2004). Опасные свойства промышленных материалов Sax (11-е издание под ред. Ричарда Дж. Льюиса). Wiley-Interscience. п. 3274. Дои:10.1021 / ja041002c. ISBN 978-0-471-47662-7.
- ^ Уоллес, Дэвид. «Закваски | Компоненты для выпечки». БЕЙКЕРпедия. Получено 17 октября 2019.
- ^ "Многоразовое использование винного камня". Управление науки и общества. Получено 17 октября 2019.
- ^ Габриала, Поп (2007). «ИССЛЕДОВАНИЯ РОЛИ ХИМИЧЕСКИХ ОТХОДОВ В КАЧЕСТВЕ ХЛЕБОПРОДУКТОВ». Журнал агрохимических процессов и технологий. XIII, № 1: 105–112. S2CID 54052197.
- ^ Раймонд, Чанг (2010). Химия (десятое изд.). Америка, Нью-Йорк: Макгроу-Хилл. стр.725 –727. ISBN 978-0077274313. Получено 9 февраля 2018.
- ^ Нижний, С.К., (1999). Введение в кислотно-щелочную химию. Chem1 Общая химия Текст. Извлекаются из http://www.chem1.com/acad/pdf/c1xacid1.pdf



![{ displaystyle K _ { mathrm {a}} = { frac { mathrm {[NH_ {3}] [H_ {3} O ^ {+}]}} { mathrm {[NH_ {4} ^ {+ }]}}} = { frac {K _ { mathrm {w}}} {K _ { mathrm {b}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5eac34ff25fa376268b6f116d33bf3d00ca7dfab)
![{ displaystyle K _ { mathrm {a}} = { frac {[ mathrm {1.0x10 ^ {- 14}}]} { mathrm {[1.8x10 ^ {- 5}]}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/43d24dff3502894f6db53fd1cab6c23105952ce0)