Дитионат - Dithionate
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Дитионат | |||
| Систематическое название ИЮПАК Бис (триоксидосульфат) (S—S)(2−)[1] | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
PubChem CID | |||
| |||
| |||
| Характеристики | |||
| S 2О2− 6 | |||
| Молярная масса | 160,126 г моль−1 | ||
| Конъюгированная кислота | Дитионовая кислота | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
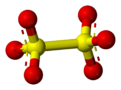
В дитионат (или метабисульфат) анион, S
2О2−
6, это сера оксоанион [2] полученный из дитионовая кислота, H2S2О6. это химическая формула иногда записывается в полуструктурном формате, как [O3SSO3]2−.
Атомы серы дитионат-иона находятся в +5 степень окисления из-за наличия связи S – S. Обычно дитионаты образуют стабильные соединения, которые нелегко окисляются или восстанавливаются. Сильные окислители окисляют их до сульфаты и сильные восстановители снижают их до сульфиты и дитиониты.[3] Водные растворы дитионатов достаточно стабильны и их можно кипятить без разложения.[4]
В γ-облучение кристаллических дитионатов производит ТАК•−
3 радикальный ионы.[5] Непарный электрон в ТАК•−
3 радикал может быть обнаружен с помощью электронный парамагнитный резонанс и дитионат бария был предложен в качестве основы для радиационной дозиметр.[6]
Дитионат-ион может действовать как бидентатный лиганд.[7]
Структура дитионат-иона в твердом состоянии имеет вид потрясенный в Na2S2О6· 2H2O, тогда как в безводной калиевой соли он почти затмил.[3]
Соединения
Соединения, содержащие дитионат-ион, включают:
- дитионат натрия, Na2S2О6
- дитионат калия, К2S2О6
- дитионат бария, BaS2О6
использованная литература
- ^ «Дитионат (2-) (CHEBI: 29209)». Химические объекты, представляющие биологический интерес (ChEBI). Великобритания: Европейский институт биоинформатики.
- ^ Международный союз теоретической и прикладной химии (2005). Номенклатура неорганической химии (Рекомендации ИЮПАК 2005 г.). Кембридж (Великобритания): RSC –ИЮПАК. ISBN 0-85404-438-8. п. 130. Электронная версия.
- ^ а б Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- ^ Коттон, Ф. Альберт; Уилкинсон, Джеффри; Мурильо, Карлос А .; Бохманн, Манфред (1999), Продвинутая неорганическая химия (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 0-471-19957-5
- ^ Радиационная химия дитионатов Г.С. Мурти, Р.Л. Игер и К.Дж. Маккаллум. J. Chem. 49 (22), (1971), 3733
- ^ Дитионат бария как дозиметр ЭПР Баран М.П., Бугай О.А., Колесник С.П., Максименко В.М., Тесленко В.В., Петренко Т.Л., Десрозье М.Ф. Дозиметрия радиационной защиты 2006 120, 202; Дои:10.1093 / rpd / nci531
- ^ Структуры некоторых комплексов меди (II), содержащих S
2О2−
6 Ион Исии М. Вестник Университета Ямагата 5, 1,(2001), 7
внешняя ссылка
![]() СМИ, связанные с Дитионат-ион в Wikimedia Commons
СМИ, связанные с Дитионат-ион в Wikimedia Commons