Радикал (химия) - Radical (chemistry)

В химия, а радикальный является атом, молекула, или же ион который имеет неспаренный валентный электрон.[1][2]За некоторыми исключениями, эти неспаренные электроны делают радикалы очень сильными. химически реактивный. Многие радикалы спонтанно димеризовать. Большинство органических радикалов имеют короткое время жизни.
Ярким примером радикала является гидроксильный радикал (HO •), молекула, имеющая один неспаренный электрон на атоме кислорода. Два других примера: триплетный кислород и триплетный карбен (:CH
2) с двумя неспаренными электронами.
Радикалы могут быть получены разными способами, но типичные методы включают: окислительно-восстановительные реакции. Ионизирующего излучения, тепло, электрические разряды и электролиз как известно, производят радикалы. Радикалы являются промежуточными звеньями во многих химических реакциях, в большей степени, чем это видно из сбалансированных уравнений.
Радикалы важны в горение, химия атмосферы, полимеризация, плазма химия, биохимия, и многие другие химические процессы. Большинство натуральных продуктов производится ферментами, генерирующими радикалы. В живых организмах радикалы супероксид и оксид азота и продукты их реакции регулируют многие процессы, такие как контроль сосудистого тонуса и, следовательно, артериального давления. Они также играют ключевую роль в промежуточном метаболизме различных биологических соединений. Такие радикалы могут даже быть посланниками в процессе, получившем название редокс-сигнализация. Радикал может оказаться в ловушке клетка для растворителя или быть связанным иным образом.
Стабильность и формирование
Устойчивость органических радикалов

Хотя органические радикалы обычно временны, некоторые из них довольно долгоживущие. Обычно органические радикалы стабилизируются одним или всеми из этих факторов: присутствием электронодонорных групп, делокализацией и стерической защитой.[3] Состав 2,2,6,6-тетраметилпиперидинилоксил иллюстрирует сочетание всех трех факторов. Это коммерчески доступное твердое вещество, которое, помимо того, что является магнитным, ведет себя как обычное органическое соединение.
Легкие доноры H-атома
Стабильность многих (или большинства) органических радикалов не определяется их изолированностью, но проявляется в их способности действовать как доноры H.. Это свойство отражает ослабленную связь с водородом, обычно O-H, но иногда N-H или C-H. Такое поведение важно, потому что эти H. доноры служат антиоксидантами в биологии и торговле. Иллюстративным является α-токоферол (витамин Е ). Сам токоферольный радикал недостаточно стабилен для выделения, но исходная молекула является высокоэффективным донором атома водорода. Связь C-H ослаблена в трифенилметил (тритил) производных.

Устойчивость неорганических радикалов
Неорганическое соединение оксид азота (NO) - стабильный радикал. Соль фреми (Нитрозодисульфонат калия, (KSO3)2НЕТ) является связанным примером. Также есть сотни примеров тиазил радикалы, несмотря на ограниченную степень π резонансная стабилизация.[4][5]
Радикалы образуются разрыв ковалентных связей к гомолиз. Гомолитический энергии диссоциации связи, обычно сокращенно "ΔЧАС ° "являются мерой прочности сцепления. Расщепление H2 в 2H •, например, требуется ΔЧАС ° из +435 КJ·моль-1, при расщеплении Cl2 на два Cl • требует ΔЧАС ° +243 кДж·моль-1. Для слабых связей гомолиз можно вызвать термически. Сильные связи требуют фотонов высокой энергии или даже пламени, чтобы вызвать гомолиз.
Бирадикалы
Бирадикалы представляют собой молекулы, содержащие два радикальных центра. Диоксид (O2) является главным примером стабильного бирадикала. Синглетный кислород, нерадикальное состояние дикислорода с наименьшей энергией, менее стабильно, чем бирадикал из-за Правило максимальной множественности Хунда. Относительная стабильность кислородного бирадикала в первую очередь связана с запрещено вращать природа триплет-синглетного перехода, необходимого для захвата электронов, т. е. "окислить ». Бирадикальное состояние кислорода также приводит к его парамагнитному характеру, что демонстрируется его притяжением к внешнему магниту.[6] Бирадикалы также могут встречаться в металлооксокомплексы, занимаясь изучением спин запрещенные реакции в переходный металл химия.[7] Карбены в их триплетном состоянии могут рассматриваться как бирадикалы с центром на одном атоме, хотя обычно они обладают высокой реакционной способностью. стойкие карбены известны, причем наиболее распространенным примером являются N-гетероциклические карбены.
Триплет карбены и нитрены бирадикалы. Их химические свойства отличаются от свойств синглетных аналогов.
Появление радикалов
Горение
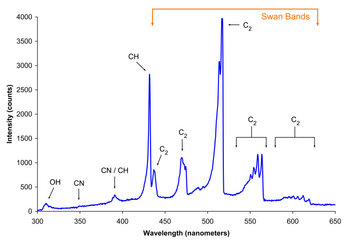
Знакомая радикальная реакция горение. В кислород молекула стабильная бирадикал, лучше всего представлен · O-O ·. Потому что спины электронов параллельны, эта молекула устойчива. В то время основное состояние кислорода - это нереактивный спин-неспаренный (триплет ) бирадикал, чрезвычайно реактивный спин-парный (синглет ) состояние доступно. Чтобы произошло горение, необходимо энергетический барьер между ними необходимо преодолеть. Этот барьер можно преодолеть с помощью тепла, требующего высоких температур. Триплет-синглетный переход также "запрещенный ". Это создает дополнительный барьер для реакции. Это также означает, что молекулярный кислород относительно инертен при комнатной температуре, за исключением присутствия каталитического тяжелого атома, такого как железо или медь.
Горение состоит из различных цепных радикальных реакций, которые может инициировать синглетный радикал. В воспламеняемость данного материала сильно зависит от концентрации радикалов, которые должны быть получены до того, как реакции инициирования и распространения преобладают, приводя к горение материала. После того, как горючий материал израсходован, снова преобладают реакции обрыва, и пламя гаснет. Как указано, стимулирование реакций распространения или прекращения приводит к изменению воспламеняемости. Например, потому что сам свинец дезактивирует радикалы в бензиновоздушной смеси, тетраэтилсвинец когда-то обычно добавлялся в бензин. Это предотвращает начало горения неконтролируемым образом или в несгоревших остатках (стук двигателя ) или преждевременное зажигание (предварительное зажигание ).
При сжигании углеводорода задействовано большое количество различных кислородных радикалов. Первоначально, гидропероксильный радикал (HOO ·) сформированы. Затем они реагируют дальше, чтобы дать органические гидропероксиды которые распадаются на гидроксильные радикалы (НО ·).
Полимеризация
Много полимеризация реакции инициируются радикалами. Полимеризация включает добавление начального радикала к нерадикальному (обычно алкену) с образованием новых радикалов. Этот процесс лежит в основе радикальная цепная реакция. Искусство полимеризации влечет за собой метод введения инициирующего радикала. Например, метилметакрилат (ММА) можно полимеризовать для получения Полиметилметакрилат) (ПММА - оргстекло или плексиглас) с помощью повторяющейся серии радикальное добавление шаги:
 Радикальные промежуточные продукты в образовании полиметакрилата (оргстекло или плексиглас).
Радикальные промежуточные продукты в образовании полиметакрилата (оргстекло или плексиглас).
Новые методы радикальной полимеризации известны как живая радикальная полимеризация. Варианты включают обратимый перенос цепи присоединения-фрагментации (РАФТ ) и радикальной полимеризации с переносом атома (ATRP ).
Будучи распространенным радикалом, O2 реагирует со многими органическими соединениями с образованием радикалов вместе с гидропероксид радикальный. Олифы и алкидные краски затвердевают из-за радикального сшивания, инициированного кислородом из атмосферы.
Атмосферные радикалы
Самый распространенный радикал в нижних слоях атмосферы - это молекулярный кислород. Фотодиссоциация исходных молекул производит другие радикалы. В нижних слоях атмосферы важные радикалы образуются в результате фотодиссоциации диоксид азота к атому кислорода и оксид азота (увидеть экв. 1. 1 ниже), который играет ключевую роль в смог образование - и фотодиссоциация озона с образованием возбужденного атома кислорода O (1D) (см. экв. 1. 2 ниже). Также показаны чистая и обратная реакции (экв. 1. 3 и экв. 1. 4, соответственно).
(экв. 1. 1)
(экв. 1. 2)
(экв. 1. 3)
(экв. 1. 4)
В верхних слоях атмосферы фотодиссоциация обычно нереактивных хлорфторуглероды (ХФУ) солнечной ультрафиолетовая радиация является важным источником радикалов (см. уравнение 1 ниже). Эти реакции дают хлор радикал Cl •, катализирующий превращение озон тоже2, тем самым облегчая истощение озонового слоя (экв. 2. 2–экв. 2. 4 ниже).
(экв. 2. 1)
(экв. 2. 2)
(экв. 2. 3)
(экв. 2. 4)
(экв. 2. 5)
Такие реакции вызывают истощение озоновый слой особенно потому, что радикал хлора может свободно участвовать в другой цепочке реакций; следовательно, использование хлорфторуглеродов в качестве хладагенты был ограничен.
В биологии


Радикалы играют важную роль в биологии. Многие из них необходимы для жизни, например, внутриклеточное уничтожение бактерий фагоцитарными клетками, такими как гранулоциты и макрофаги. Радикалы участвуют в клеточная сигнализация процессы,[9] известный как редокс-сигнализация. Например, радикальная атака линолевой кислоты вызывает ряд 13-гидроксиоктадекадиеновые кислоты и 9-гидроксиоктадекадиеновые кислоты, которые могут регулировать локализованные воспалительные и / или заживляющие реакции в тканях, восприятие боли и разрастание злокачественных клеток. Радикальные атаки на арахидоновую кислоту и докозагексаеновую кислоту производят аналогичный, но более широкий набор сигнальных продуктов.[10]
Радикалы также могут быть вовлечены в болезнь Паркинсона, старческий и лекарственный глухота, шизофрения, и Болезнь Альцгеймера.[11] Классический свободнорадикальный синдром, болезнь накопления железа. гемохроматоз, обычно ассоциируется с целым рядом симптомов, связанных со свободными радикалами, включая двигательное расстройство, психоз, пигментацию кожи. меланин аномалии, глухота, артрит и сахарный диабет. В свободнорадикальная теория старения предполагает, что радикалы лежат в основе процесс старения сам. Точно так же и процесс митогормезис предполагает, что повторное воздействие радикалов может продлить жизнь.
Поскольку радикалы необходимы для жизни, в организме есть ряд механизмов для минимизации повреждений, вызванных радикалами, и восстановления возникающих повреждений, таких как ферменты супероксиддисмутаза, каталаза, глутатионпероксидаза и глутатионредуктаза. К тому же, антиоксиданты играют ключевую роль в этих защитных механизмах. Часто это три витамина, витамин А, Витамин С и витамин Е и полифенольные антиоксиданты. Кроме того, есть убедительные доказательства того, что билирубин и мочевая кислота могут действовать как антиоксиданты, помогая нейтрализовать определенные радикалы. Билирубин возникает из-за распада красные кровяные тельца 'содержимого, в то время как мочевая кислота является продуктом распада пурины. Однако слишком много билирубина может привести к желтуха, что в конечном итоге может повредить центральную нервную систему, а слишком большое количество мочевой кислоты вызывает подагра.[12]
Активные формы кислорода
Активные формы кислорода или ROS представляют собой такие виды, как супероксид, пероксид водорода, и гидроксильный радикал, обычно связанный с повреждением клеток. Форма ROS как естественный побочный продукт нормального метаболизма кислород и играют важную роль в передаче сигналов в клетке. Два важных кислородно-центрированных радикала: супероксид и гидроксильный радикал. Они образуются из молекулярного кислорода в восстановительных условиях. Однако из-за своей реакционной способности эти же радикалы могут участвовать в нежелательных побочных реакциях, приводящих к повреждению клеток. Чрезмерное количество этих радикалов может привести к повреждению клеток и смерть, которые могут способствовать развитию многих заболеваний, таких как рак, Инсульт, инфаркт миокарда, сахарный диабет и серьезные расстройства.[13] Многие формы рак считаются результатом реакции между радикалами и ДНК, что может привести к мутации что может отрицательно повлиять на клеточный цикл и потенциально могут привести к злокачественному образованию.[14] Некоторые симптомы старение Такие как атеросклероз также связаны с радикальным окислением холестерина до 7-кетохолестерина.[15] Кроме того, радикалы способствуют алкоголь -индуцированный печень ущерб, возможно, больше, чем сам алкоголь. Радикалы, произведенные сигарета курить вовлечены в инактивацию альфа-1-антитрипсин в легкое. Этот процесс способствует развитию эмфизема.
Оксибензон Было обнаружено, что в солнечном свете они образуют радикалы и, следовательно, также могут быть связаны с повреждением клеток. Это происходило только в сочетании с другими ингредиентами, обычно присутствующими в солнцезащитных кремах, такими как оксид титана и октилметоксициннамат.[16]
ROS атакуют полиненасыщенная жирная кислота, линолевая кислота, чтобы сформировать серию 13-гидроксиоктадекадиеновая кислота и 9-гидроксиоктадекадиеновая кислота продукты, которые служат сигнальными молекулами, которые могут запускать реакции, противодействующие повреждению тканей, вызвавшему их образование. АФК атакует другие полиненасыщенные жирные кислоты, например арахидоновая кислота и докозагексаеновая кислота, чтобы произвести аналогичную серию сигнальных продуктов.[17]
История и номенклатура

Вплоть до конца 20 века слово «радикал» использовалось в химии для обозначения любой связанной группы атомов, такой как метильная группа или карбоксил, будь то часть более крупной молекулы или молекула сама по себе. Квалификатор «свободный» был необходим для указания несвязанного случая. После недавних изменений номенклатуры часть более крупной молекулы теперь называется функциональная группа или заместитель, а «радикальный» теперь означает «свободный». Однако старая номенклатура все еще может появляться в некоторых книгах.
Термин радикальный уже использовался, когда ныне устаревшее радикальная теория был развит. Луи-Бернар Гайтон де Морво ввел фразу «радикальный» в 1785 году, и эта фраза была использована Антуан Лавуазье в 1789 г. в его Traité Élémentaire de Chimie. Затем радикал был идентифицирован как корневая основа некоторых кислот (латинское слово «radix» означает «корень»). Исторически термин радикальный в радикальная теория также использовался для связанных частей молекулы, особенно когда они остаются неизменными в реакциях. Теперь они называются функциональные группы. Например, метиловый спирт был описан как состоящий из метильного «радикала» и гидроксильного «радикала». Не являются и радикалы в современном химическом смысле, поскольку они постоянно связаны друг с другом и не имеют неспаренных реактивных электронов; однако они могут наблюдаться как радикалы в масс-спектрометрии при разрушении путем облучения энергичными электронами.
В современном контексте первая органический (углеродсодержащий) радикал идентифицирован трифенилметильный радикал, (C6ЧАС5)3C •. Этот вид был открыт Моисей Гомберг в 1900 г. В 1933 г. Моррис С. Хараш и Фрэнк Мэйо предположил, что свободные радикалы несут ответственность за антимарковниковское дополнение из бромистый водород к аллилбромид.[18][19]
В большинстве областей химии историческое определение радикалов утверждает, что молекулы имеют ненулевой электронный спин. Однако в таких областях, как спектроскопия, химическая реакция, и астрохимия, определение немного другое. Герхард Херцберг, получивший Нобелевскую премию за исследования электронной структуры и геометрии радикалов, предложил более свободное определение свободных радикалов: «любые временные (химически нестабильные) частицы (атом, молекула или ион)».[20] Суть его предположения состоит в том, что существует много химически нестабильных молекул с нулевым спином, например C2, С3, CH2 и так далее. Это определение более удобно для обсуждения переходных химических процессов и астрохимии; поэтому исследователи в этих областях предпочитают использовать это расплывчатое определение.[21]
Диагностика
Радикалы обычно проявляют парамагнетизм. Электронный спиновой резонанс - это окончательный и широко используемый метод характеристики радикалов. Природу атома, несущего неспаренный электрон, и соседних с ним атомов часто можно определить по спектру ЭПР.[22]
Присутствие радикалов также можно обнаружить или сделать вывод с помощью химические реагенты, улавливающие (т.е. соединить с) радикалами. Часто эти ловушки сами по себе являются радикалами, например ТЕМП.
Изображение в химических реакциях
В химических уравнениях радикалы часто обозначаются точкой, помещенной непосредственно справа от символа атома или молекулярной формулы, как показано ниже:
Радикальный механизмы реакции используйте односторонние стрелки, чтобы изобразить движение отдельных электронов:

В гомолитический разрыв разрывающейся связи изображен стрелкой «рыболовный крючок», чтобы отличить от обычного движения двух электронов, изображенного стандартной фигурной стрелкой. Второй электрон разрывающейся связи также движется, чтобы спариться с атакующим радикальным электроном; в данном случае это не указывается явно.
Радикалы также принимают участие в радикальное добавление и радикальное замещение так как реактивные промежуточные продукты. Цепные реакции с участием радикалов обычно можно разделить на три различных процесса. Эти инициация, распространение, и прекращение.
- Инициация реакции - это те, которые приводят к чистому увеличению количества радикалов. Они могут включать образование радикалов из стабильных частиц, как в реакции 1 выше, или могут включать реакции радикалов со стабильными частицами с образованием большего количества радикалов.
- Распространение реакции - это реакции с участием радикалов, в которых общее количество радикалов остается неизменным.
- Прекращение реакции - это те реакции, которые приводят к чистому уменьшению количества радикалов. Обычно два радикала объединяются, образуя более стабильные частицы, например: 2Cl·→ Cl2
Смотрите также
- Электронная пара
- Согласованная на глобальном уровне система классификации и маркировки химических веществ
- Реакция Гофмана – Лёффлера
- Исследования свободных радикалов
Рекомендации
- ^ Золотая книга ИЮПАК радикал (свободный радикал) PDF
- ^ Хайян, М .; Hashim, M.A .; АльНашеф, И.М. (2016). «Ион супероксида: образование и химические последствия». Chem. Rev. 116 (5): 3029–85. Дои:10.1021 / acs.chemrev.5b00407. PMID 26875845.
- ^ Гриллер, Дэвид; Ингольд, Кейт У. (1976). «Стойкие углеродные радикалы». Отчеты о химических исследованиях. 9: 13–19. Дои:10.1021 / ar50097a003.
- ^ Окли, Ричард Т. (1988). «Циклические и гетероциклические тиазены» (PDF). Прогресс в неорганической химии. Циклические и гетероциклические тиазены (раздел). Прогресс неорганической химии. 36. С. 299–391. Дои:10.1002 / 9780470166376.ch4. ISBN 978-0-470-16637-6.
- ^ Роусон, Дж; Банистер, А; Лаванда, я (1995). Достижения в химии гетероциклов. Химия дитиадиазолилиевого и дитиадиазолильного колец (раздел) =. Успехи химии гетероциклов. 62. С. 137–247. Дои:10.1016 / S0065-2725 (08) 60422-5. ISBN 978-0-12-020762-6.
- ^ Однако, парамагнетизм не обязательно подразумевает радикальный характер.
- ^ Linde, C .; Åkermark, B .; Norrby, P.-O .; Свенссон, М. (1999). «Время имеет решающее значение: влияние спиновых изменений на диастереоселективность в Mn (Сален) -катализированном эпоксидировании». Журнал Американского химического общества. 121 (21): 5083–84. Дои:10.1021 / ja9809915.
- ^ Broderick, J.B .; Duffus, B.R .; Duschene, K.S .; Шепард, Э.М. (2014). «Радикальные ферменты S-аденозилметионина». Химические обзоры. 114 (8): 4229–317. Дои:10.1021 / cr4004709. ЧВК 4002137. PMID 24476342.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ Pacher P, Beckman JS, Liaudet L (2007). «Оксид азота и пероксинитрит в здоровье и болезни». Physiol. Rev. 87 (1): 315–424. Дои:10.1152 / Physrev.00029.2006. ЧВК 2248324. PMID 17237348.
- ^ Нджие-Мбай, Я Фату; Кулкарни-Читнис, Мадхура; Опере, Екатерина А .; Барретт, Аарон; Охия, Санни Э. (2013). «Перекисное окисление липидов: патофизиологические и фармакологические последствия для глаза». Границы физиологии. 4: 366. Дои:10.3389 / fphys.2013.00366. ЧВК 3863722. PMID 24379787.
- ^ Флойд, Р.А. (1999). «Нейровоспалительные процессы важны при нейродегенеративных заболеваниях: гипотеза, объясняющая повышенное образование активных форм кислорода и азота как основных факторов, участвующих в развитии нейродегенеративных заболеваний». Свободная радикальная биология и медицина. 26 (9–10): 1346–55. Дои:10.1016 / s0891-5849 (98) 00293-7.
- ^ Обзор роли радикалов в биологии и использования электронного спинового резонанса в их обнаружении можно найти в Родс С.Дж. (2000). Токсикология окружающей человека среды - решающая роль свободных радикалов. Лондон: Тейлор и Фрэнсис. ISBN 978-0-7484-0916-7.
- ^ Раджамани Картикеян; Manivasagam T; Anantharaman P; Баласубраманский T; Сомасундарам СТ (2011). «Химиопрофилактический эффект экстрактов Padina boergesenii на индуцированное нитрилотриацетатом железа (Fe-NTA) окислительное повреждение у крыс Wistar». J. Appl. Phycol. 23 (2): 257–63. Дои:10.1007 / s10811-010-9564-0.
- ^ Мукерджи, П.К .; Marcheselli, V.L .; Serhan, C.N .; Базан, Н. (2004). «Нейропротецин D1: докозатриен, полученный из докозагексановой кислоты, защищает клетки пигментного эпителия сетчатки человека от окислительного стресса». Труды Национальной академии наук США. 101 (22): 8491–96. Bibcode:2004ПНАС..101.8491М. Дои:10.1073 / pnas.0402531101. ЧВК 420421. PMID 15152078.
- ^ Лион, Массачусетс; Браун, AJ (1999). «7-Кетохолестерин». Int. J. Biochem. Cell Biol. 31 (3–4): 369–75. Дои:10.1016 / с 1357-2725 (98) 00123-х. PMID 10224662.
- ^ Серпоне, N; Салинаро, А; Эмелин, А.В.; Хорикоши, S; Hidaka, H; Чжао, JC (2002). «Систематическое спектроскопическое исследование in vitro фотостабильности случайного набора коммерческих солнцезащитных лосьонов и их химических активных агентов UVB / UVA». Фотохимические и фотобиологические науки. 1 (12): 970–81. Дои:10.1039 / b206338g. PMID 12661594.
- ^ Нджие-Мбай, Я Фату; Кулкарни-Читнис, Мадхура; Опере, Екатерина А .; Барретт, Аарон; Охия, Санни Э. (2013). «Перекисное окисление липидов: патофизиологические и фармакологические последствия для глаза». Границы физиологии. 4. Дои:10.3389 / fphys.2013.00366. ЧВК 3863722. PMID 24379787.
- ^ Хараш, М. С. (1933). «Эффект перекиси при добавлении реагентов к ненасыщенным соединениям. I. Добавление бромоводорода к аллилбромиду». Журнал Американского химического общества. 55: 2468–2496. Дои:10.1021 / ja01333a041.
- ^ Ян, М; Lo, JC; Эдвардс, JT; Баран П.С. (2016). «Радикалы: реактивные промежуточные соединения с трансляционным потенциалом». J Am Chem Soc. 138: 12692–12714. Дои:10.1021 / jacs.6b08856. ЧВК 5054485. PMID 27631602.
- ^ Г. Герцберг (1971), «Спектры и структуры простых свободных радикалов», ISBN 0-486-65821-X.
- ^ 28-й Международный симпозиум по свободным радикалам В архиве 2007-07-16 на Wayback Machine.
- ^ Чечик Виктор; Картер, Эмма; Мерфи, Дэмиен (2016). Электронный парамагнитный резонанс. Издательство Оксфордского университета. ISBN 978-0-19-872760-6.


![{displaystyle {ce {NO2 -> [h u] NO + O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5da627b27ee3e5b4dc45b156c54a91e1d79ffbd1)

![{displaystyle {ce {NO2 + O2 -> [h u] NO + O3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eae7fc4c91c01822b8db1423a88911a1eb56a171)

![{displaystyle {ce {CFCS -> [h u] Cl.}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bcc02008a4a0f755ebbd69f8cfaf0ddfcfb751ac)

![{displaystyle {ce {O3 -> [h u] O + O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3acd85b4a5f671e0a421576bf91c3352bec070c1)

![{displaystyle {ce {2O3 -> [h u] 3O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/afc621f0abb1c9cfc08b3cf82f43d9fc60a29c40)
