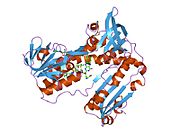
Глутатионредуктаза - Glutathione reductase
Глутатионредуктаза (GR) также известный как глутатион-дисульфидредуктаза (GSR) является фермент что у человека кодируется GSR ген. Глутатионредуктаза (EC 1.8.1.7) катализирует восстановление дисульфида глутатиона (GSSG ) в сульфгидрильную форму глутатион (GSH ), которая является важной молекулой в сопротивлении окислительный стресс и поддержание восстанавливающей среды клетки.[5][6][7] Глутатионредуктаза действует как димерная дисульфид оксидоредуктаза и использует FAD протезная группа и НАДФН для уменьшения одного молярного эквивалента GSSG до двух молярных эквивалентов GSH:

Глутатионредуктаза сохраняется между всеми королевства. В бактерии, дрожжи, и животные обнаружен один ген глутатионредуктазы; однако в растение геномов кодируются два гена GR. Дрозофила и трипаносомы вообще не имеют GR.[8] У этих организмов восстановление глутатиона осуществляется либо тиоредоксин или трипанотион система соответственно.[8][9]
Функция
| глутатион-дисульфидредуктаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
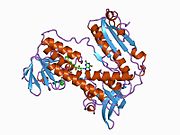
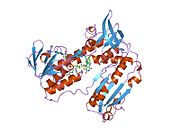
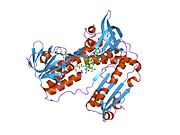
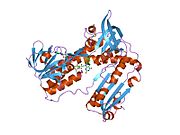
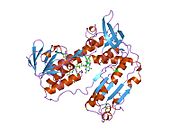
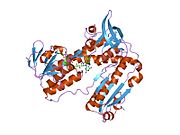
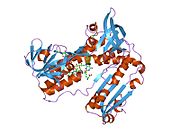
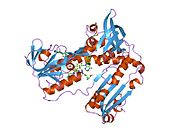
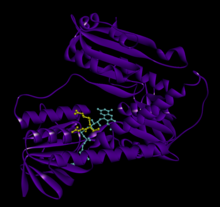 GSR человека со связанным глутатионом и FADH | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 1.8.1.7 | ||||||||
| Количество CAS | 9001-48-3 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Глутатион играет ключевую роль в поддержании надлежащего функционирования и предотвращении окислительный стресс в клетках человека. Он может действовать как мусорщик для гидроксильные радикалы, синглетный кислород, и различные электрофилы. Восстановленный глутатион восстанавливает окисленную форму фермента глутатионпероксидаза, что, в свою очередь, уменьшает пероксид водорода (H2O2), опасно реактивный вид внутри клетки. Кроме того, он играет ключевую роль в метаболизме и удалении ксенобиотики, действует как кофактор некоторых детоксифицирующих ферментов, участвует в транспорте и восстанавливает антиоксиданты, такие как витамины E и C, до их реактивных форм. Соотношение GSSG / GSH, присутствующих в клетке, является ключевым фактором в правильном поддержании окислительного баланса клетки, то есть критически важно, чтобы клетка поддерживала высокий уровень восстановленного глутатиона и низкий уровень окисленного дисульфида глутатиона. Этот узкий баланс поддерживается глутатионредуктазой, которая катализирует восстановление GSSG до GSH.[5]

Структура
Глутатионредуктаза из эритроцитов человека - это гомодимер состоящий из мономеров 52Kd, каждый из которых содержит 3 домена. GR имеет однослойную, двухслойную топологию, где антипараллельный бета-лист в значительной степени подвергается воздействию растворителя с одной стороны, а с другой стороны покрывается случайными витками.[10] Это включает и НАДФН -binding Domain, FAD -связывающий домен (ы) и домен димеризации. Каждый мономер содержит 478 остатков и одну молекулу FAD. GR - это термостабильный белок, сохраняющий функцию до 65 ° C.[11][12]
Механизм реакции
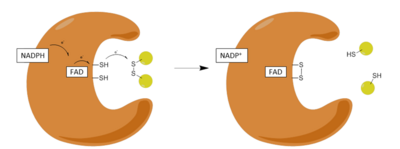

Шаги:
| 1 | Связывание НАДФН с окисленным ферментом |
| 2 | Снижение FAD до FADH− анион НАДФН |
| 3 | Сниженный FADH− анион коллапсирует в комплекс реле заряда и восстанавливает Cys58-Cys63 дисульфид |
| 4 | Окисленный дисульфид глутатиона связывается с восстановленным ферментом и образует смешанный дисульфид с Cys58 и высвобождает один восстановленный глутатион |
| 5 | Cys63 атакует смешанный дисульфид на Cys58 для высвобождения восстановленного глутатиона и преобразования окислительно-восстановительного активного дисульфида |
Восстановительная половина
Действие GR протекает через две отдельные половинные реакции: восстановительный полумеханизм, за которым следует окислительная половина. В первой половине NADPH снижает FAD, присутствующий в GSR, с образованием переходного FADH.− анион. Затем этот анион быстро разрывает дисульфидную связь Cys.58 - Cys63, образуя короткоживущую ковалентную связь, стабильный комплекс с переносом заряда между флавином и Cys63. Окисленный теперь НАДФ + высвобождается и впоследствии заменяется новой молекулой НАДФН. Это конец так называемой редуктивной половины механизма.
Окислительная половина
В окислительной половине механизма Cys63 нуклеофильно атакует ближайшую сульфидную единицу в молекуле GSSG (продвигаемой His467), которая создает смешанную дисульфидную связь (GS-Cys58) и GS− анион. Его467 GSR затем протонирует GS-анион с высвобождением первой молекулы GSH. Далее, Cys63 нуклеофильно атакует сульфид Cys58, выпуская GS− анион, который, в свою очередь, улавливает растворитель протон и высвобождается из фермента, тем самым создавая второй GSH. Таким образом, для каждого GSSG и NADPH, два уменьшенных GSH молекулы , которые снова могут действовать как антиоксиданты, убирающие активные формы кислорода в клетка.[13]
Торможение
In vitro глутатионредуктаза ингибируется низкими концентрациями арсенит натрия и метилированные метаболиты арсената, но in vivo значительное ингибирование глутатионредуктазы за счет арсенат натрия только 10 мг / кг / день.[14] Глутатионредуктаза также подавляется некоторыми флаваноиды, класс пигментов, производимых растениями.[15]
Клиническое значение
GSH является ключевым клеточным антиоксидантом и играет важную роль во второй фазе метаболического клиренса электрофильных ксенобиотиков. Важность пути GSH и ферментов, влияющих на этот тонкий баланс, в последние годы привлекает повышенное внимание. Хотя глутатионредуктаза является привлекательной мишенью для многих фармацевтических препаратов, до настоящего времени не было создано эффективных терапевтических соединений, связанных с глутатионредуктазой. В частности, глутатионредуктаза, по-видимому, является хорошей мишенью для противомалярийных препаратов, поскольку глутатионредуктаза малярийного паразита Плазмодий falciparum существенно отличается белковая складка чем у глутатионредуктазы млекопитающих.[16] Создавая препараты, специфичные для п. Falciparum можно избирательно вызвать окислительный стресс у паразита, не затрагивая при этом хозяина.
Существует два основных класса соединений, нацеленных на GR:[17][18][19][20]
- Ингибиторы связывания или димеризации GSSG: реактивные электрофилы такие как соединения золота и фторнафтохиноны.
- Лекарства, которые используют глутатионредуктазу для регенерации, например, окислительно-восстановительные циклы. Два примера этих типов соединений: Метиленовый синий и Нафтохинон.
Клинические испытания, проведенные в Буркина-Фасо показали смешанные результаты при лечении малярии с помощью Нафтохиноны
В клетках, подверженных высоким уровням окислительный стресс, подобно красные кровяные тельца, до 10% от глюкоза потребление может быть направлено на пентозофосфатный путь (PPP) для производства НАДФН, необходимого для этой реакции. В случае эритроцитов, если PPP нефункционален, окислительный стресс в клетке приведет к лизис и анемия.[21]
Волчанка это аутоиммунное заболевание, при котором у пациентов вырабатывается повышенное количество антител, которые атакуют ДНК и другие компоненты клетки. В недавнем исследовании было обнаружено, что однонуклеотидный полиморфизм (SNP) в гене глутатионредуктазы тесно связан с волчанка у афроамериканцев в исследовании.[22] Афроамериканцы с волчанка также было показано, что они выражают менее сокращенный глутатион в их Т-клетках.[23] Авторы исследования считают, что сниженная активность глутатионредуктазы может способствовать увеличению производства реактивного кислорода у афроамериканцев с волчанка.[22]
У мышей глутатионредуктаза участвует в окислительном всплеске, компоненте иммунного ответа.[24] Окислительный взрыв - это защитный механизм, при котором нейтрофилы производят и высвобождают реактивные окислительные формы в непосредственной близости от бактерий или грибов, чтобы разрушить чужеродные клетки. Было показано, что нейтрофилы с дефицитом глутатионредуктазы вызывают более кратковременный окислительный всплеск в ответ на действие бактерий, чем нейтрофилы, которые экспрессируют GR на обычных уровнях.[24] Механизм действия глутатионредуктазы в поддержании окислительного всплеска до сих пор неизвестен.[24]
Дефицит
Дефицит глутатионредуктазы - редкое заболевание, при котором активность глутатионредуктазы отсутствует. эритроциты, лейкоциты или оба. В одном исследовании это нарушение наблюдалось только в двух случаях из 15 000 тестов на дефицит глутатионредуктазы, проведенных в течение 30 лет.[25] В том же исследовании дефицит глутатионредуктазы был связан с катарактой и фавизм у одного пациента и его семьи, а также с тяжелыми неконъюгированными гипербилирубинемия у другого пациента.[25] Было высказано предположение, что редокс-система глутатиона (частью которой является глутатионредуктаза) почти полностью отвечает за защиту клеток хрусталика глаза от пероксид водорода потому что эти клетки испытывают дефицит каталаза, фермент, который катализирует распад пероксид водорода и высокий уровень заболеваемости катарактой у лиц с дефицитом глутатионредуктазы.[26]
У некоторых пациентов наблюдается недостаточный уровень активности глутатиона из-за недостаточного потребления. рибофлавин в их рационе. Рибофлавин является предшественником FAD, восстановленная форма которого отдает два электрона дисульфидной связи, которая присутствует в окисленной форме глутатионредуктазы, чтобы начать каталитический цикл фермента. В 1999 году исследование показало, что 17,8% мужчин и 22,4% женщин, обследованных в Саудовская Аравия страдали от низкой активности глутатионредуктазы из-за дефицита рибофлавина.[27]
Связь с фавизмом
В фавизм, пациентам не хватает глюкозо-6-фосфатдегидрогеназа, фермент пентозофосфатного пути, который снижает НАДФ+ в НАДФН, катализируя превращение глюкозо-6-фосфат к 6-фосфоглюконо-δ-лактон. Люди с дефицитом глюкозо-6-фосфатдегидрогеназы имеют меньше НАДФН, доступного для восстановления окисленных глутатион через глутатионредуктазу. Таким образом, их базальное отношение окисленных к восстановленным глутатион значительно выше, чем у пациентов, которые обычно экспрессируют глюкозо-6-фосфатдегидрогеназу, что делает их неспособными эффективно реагировать на высокие уровни активных форм кислорода, которые вызывают лизис клеток.[28]
Мониторинг активности глутатионредуктазы
Активность глутатионредуктазы используется в качестве индикатора для окислительный стресс. Активность можно отслеживать с помощью НАДФН потребления, с поглощением при 340 нм, или образованный GSH можно визуализировать с помощью Реагент Эллмана.[29] В качестве альтернативы активность можно измерить с помощью roGFP (редокс-чувствительный зеленый флуоресцентный белок).[30]
В растениях
Как и в клетках человека, глутатионредуктаза помогает защитить клетки растений от активных форм кислорода. У растений восстановленный глутатион участвует в глутатион-аскорбатный цикл в котором восстановленный глутатион снижает дегидроаскорбат, реактивный побочный продукт восстановления пероксида водорода. В частности, глутатионредуктаза способствует реакции растений на абиотический стресс.[31] Было показано, что активность фермента модулируется в ответ на металлы, металлоиды, засоление, засуху, УФ-излучение и стресс, вызванный нагревом.[31]
История
Глутатионредуктаза была впервые очищена в 1955 г. Йельский университет Э. Ракера.[32] Ракер также идентифицировал НАДФН в качестве первичного донора электронов для фермента. Более поздние группы подтвердили присутствие FAD и тиоловой группы, и первоначальный механизм был предложен в 1965 году.[33][34] Первоначальная структура (низкого разрешения) глутатионредуктазы была решена в 1977 году. За ней вскоре последовала структура 3Å Shulze et al. в 1978 г.[35] Глутатионредуктаза была исчерпывающе изучена с момента этих ранних экспериментов, и впоследствии она является одним из наиболее хорошо изученных ферментов на сегодняшний день.
Интерактивная карта проезда
Интерактивный путь можно найти здесь:карта пути
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000104687 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000031584 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б Депонте М (май 2013 г.). «Глутатионный катализ и механизмы реакции глутатион-зависимых ферментов». Биохим. Биофиз. Acta. 1830 (5): 3217–66. Дои:10.1016 / j.bbagen.2012.09.018. PMID 23036594.
- ^ Мейстер А. (ноябрь 1988 г.). «Метаболизм глутатиона и его селективная модификация». J. Biol. Chem. 263 (33): 17205–8. PMID 3053703.
- ^ Маннервик Б (август 1987 г.). «Ферменты метаболизма глутатиона: обзор». Biochem. Soc. Транс. 15 (4): 717–8. Дои:10.1042 / bst0150717. PMID 3315772.
- ^ а б Канзок С.М., Фехнер А., Бауэр Х., Ульшмид Дж. К., Мюллер Х. М., Ботелла-Муньос Дж., Шнейвли С., Ширмер Р., Беккер К. (2001). «Замена тиоредоксиновой системы на глутатионредуктазу в Drosophila melanogaster». Наука. 291 (5504): 643–6. Bibcode:2001Научный ... 291..643K. Дои:10.1126 / science.291.5504.643. PMID 11158675.
- ^ Краут-Сигель Р.Л., Комини М.А. (2008). «Редокс-контроль в трипаносоматидах, паразитарных простейших с метаболизмом тиолов на основе трипанотиона». Biochim Biophys Acta. 1780 (11): 1236–48. Дои:10.1016 / j.bbagen.2008.03.006. PMID 18395526.
- ^ Гришем, Реджинальд Х. Гаррет, ... Чарльз М. (2005). Биохимия (3-е изд.). Бельмонт, Калифорния: Томсон Брукс / Коул. ISBN 0534490336.
- ^ Маселла Р., Ди Бенедетто Р., Вари Р., Филси К., Джованнини С. (октябрь 2005 г.). «Новые механизмы природных антиоксидантных соединений в биологических системах: участие глутатиона и связанных с глутатионом ферментов». J. Nutr. Биохим. 16 (10): 577–86. Дои:10.1016 / j.jnutbio.2005.05.013. PMID 16111877.
- ^ Дим О., Айзенберг Д. (сентябрь 2001 г.). «Анализ структуры последовательностей FAD-содержащих белков». Белковая наука. 10 (9): 1712–28. Дои:10.1110 / пс. 12801. ЧВК 2253189. PMID 11514662.
- ^ Беркхольц Д.С., Фабер Х.Р., Саввидес С.Н., Карплюс ПА (октябрь 2008 г.). «Каталитический цикл человеческой глутатионредуктазы с разрешением около 1 А». J. Mol. Биол. 382 (2): 371–84. Дои:10.1016 / j.jmb.2008.06.083. ЧВК 2593804. PMID 18638483.
- ^ Родригес В.М., Дель Разо Л.М., Лимон-Пачеко Дж. Х., Джордано М., Санчес-Пенья Л.С., Урибе-Кероль Е., Гутьеррес-Оспина Г., Гонсебатт М.Э. (март 2005 г.). «Ингибирование глутатионредуктазы и распределение метилированного мышьяка в мозге и печени мышей Cd1». Toxicol. Наука. 84 (1): 157–66. Дои:10.1093 / toxsci / kfi057. PMID 15601678.
- ^ Эллиотт AJ, Scheiber SA, Thomas C, Pardini RS (октябрь 1992 г.). «Ингибирование глутатионредуктазы флавоноидами. Исследование структуры-активности». Biochem. Pharmacol. 44 (8): 1603–8. Дои:10.1016/0006-2952(92)90478-2. PMID 1329770.
- ^ Сарма Г. Н., Саввидес С. Н., Беккер К., Ширмер М., Ширмер Р. Х., Карплюс П. А. (май 2003 г.). «Глутатионредуктаза малярийного паразита Plasmodium falciparum: кристаллическая структура и развитие ингибитора». J. Mol. Биол. 328 (4): 893–907. Дои:10.1016 / с0022-2836 (03) 00347-4. PMID 12729762.
- ^ Buchholz K, Schirmer RH, Eubel JK, Akoachere MB, Dandekar T., Becker K, Gromer S (январь 2008 г.). «Взаимодействие метиленового синего с дисульфидредуктазами человека и их ортологами из Plasmodium falciparum». Антимикробный. Агенты Chemother. 52 (1): 183–91. Дои:10.1128 / AAC.00773-07. ЧВК 2223905. PMID 17967916.
- ^ Мюллер Т., Иоганн Л., Яннак Б., Брюкнер М., Ланфранчи Д.А., Бауэр Х., Санчес С., Ярдли В., Дереньокур С., Шревель Дж., Ланцер М., Ширмер Р. Х., Давиуд-Шарве Е. (август 2011 г.). «Катализируемый глутатионредуктазой каскад окислительно-восстановительных реакций для биоактивации мощных противомалярийных 1,4-нафтохинонов - новая стратегия борьбы с малярийными паразитами». Варенье. Chem. Soc. 133 (30): 11557–71. Дои:10.1021 / ja201729z. PMID 21682307.
- ^ Депонте М., Уриг С., Арскотт Л.Д., Фриц-Вольф К., Реау Р., Херольд-Менде С., Конкаревич С., Мейер М., Давиуд-Шарве Е., Баллоу Д.П., Уильямс СН, Беккер К. (май 2005 г.). «Механистические исследования нового высокоэффективного золото-фосфол-ингибитора глутатионредуктазы человека». J. Biol. Chem. 280 (21): 20628–37. Дои:10.1074 / jbc.M412519200. PMID 15792952.
- ^ Депонте М (май 2013 г.). «Глутатионный катализ и механизмы реакции глутатион-зависимых ферментов». Биохим. Биофиз. Acta. 1830 (5): 3217–66. Дои:10.1016 / j.bbagen.2012.09.018. PMID 23036594.
- ^ Champe PC, Харви Р.А., Феррье Д.Р. (2008). Биохимия (четвертое изд.). Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-6960-0.
- ^ а б Рамос П.С., Оутс Дж.С., Камен Д.Л., Уильямс А.Х., Гаффни П.М., Келли Дж.А., Кауфман К.М., Кимберли Р.П., Ниволд ТБ, Джейкоб КО, Цао Б.П., Аларкон Г.С., Браун Э.Е., Эдберг Дж.К., Петри М.А., Рэмси-Голдман Р., Ревейлл Дж. Д., Вила Л. М., Джеймс Дж. А., Гатридж Дж. М., Меррилл Дж. Т., Бокл С. А., Фридман Б. И., Скофилд Р. Х., Стивенс А. М., Вайс Т. Дж., Крисвелл Л. А., Мозер К. Л., Аларкон-Рикельме М.Э., Лангефельд К.Д., Харли Дж. Б., Гилкесон Г.С. ( Июнь 2013). «Вариабельная ассоциация реактивных промежуточных генов с системной красной волчанкой в популяциях с различным африканским происхождением». J. Rheumatol. 40 (6): 842–9. Дои:10.3899 / jrheum.120989. ЧВК 3735344. PMID 23637325.
- ^ Гергей П., Гроссман С., Ниланд Б., Пушкаш Ф., Неупане Х., Аллам Ф., Банки К., Филлипс П.Е., Perl A (январь 2002 г.). «Гиперполяризация митохондрий и истощение АТФ у пациентов с системной красной волчанкой». Ревматоидный артрит. 46 (1): 175–90. Дои:10.1002 / 1529-0131 (200201) 46: 1 <175 :: AID-ART10015> 3.0.CO; 2-H. ЧВК 4020417. PMID 11817589.
- ^ а б c Ян Дж., Мэн Х, Ванкет Л.М., Линтнер К., Нелин Л.Д., Чен Б., Фрэнсис К.П., Смит CV, Роджерс Л.К., Лю Ю. (март 2012 г.). «Глутатионредуктаза способствует защите хозяина, поддерживая фагоцитарный окислительный взрыв и способствуя развитию внеклеточных ловушек нейтрофилов». J. Immunol. 188 (5): 2316–27. Дои:10.4049 / jimmunol.1102683. ЧВК 3480216. PMID 22279102.
- ^ а б Камербик Н.М., Цвитен Р., Бур М., Моррен Г., Вуил Х, Баннинк Н., Линке С., Долман К. М., Беккер К., Ширмер Р. Х., Громер С., Роос Д. (2007). «Молекулярные основы дефицита глутатионредуктазы в клетках крови человека». Кровь. 109 (8): 3560–3566. Дои:10.1182 / кровь-2006-08-042531. PMID 17185460.
- ^ Roos D, Weening RS, Voetman AA, van Schaik ML, Bot AA, Meerhof LJ, Loos JA (май 1979). «Защита фагоцитарных лейкоцитов эндогенным глутатионом: исследования в семье с дефицитом глутатионредуктазы». Кровь. 53 (5): 851–66. Дои:10.1182 / кровь.V53.5.851.851. PMID 435643.
- ^ Варси А.С., Эль-Хазми Массачусетс (ноябрь 1999 г.). «Дефицит глутатионредуктазы в Саудовской Аравии». Восток. Mediterr. Здоровье J. 5 (6): 1208–12. PMID 11924113.
- ^ Cappellini MD, Fiorelli G (январь 2008 г.). «Дефицит глюкозо-6-фосфатдегидрогеназы». Ланцет. 371 (9606): 64–74. Дои:10.1016 / S0140-6736 (08) 60073-2. PMID 18177777. S2CID 29165746.
- ^ Смит И.К., Фиреллер Т.Л., Торн Калифорния (1988). «Анализ глутатионредуктазы в сырых гомогенатах тканей с использованием 5,5'-дитиобис (2-нитробензойной кислоты)». Анальный биохим. 175 (2): 408–13. Дои:10.1016/0003-2697(88)90564-7. PMID 3239770.
- ^ Марти Л., Сиала В., Шварцлендер М., Фрикер М. Д., Вирц М., Sweetlove LJ, Мейер Ю., Мейер А. Дж., Райхельд Дж. П., Ад R (2009). «НАДФН-зависимая тиоредоксиновая система представляет собой функциональную резервную копию цитозольной глутатионредуктазы у Arabidopsis». Proc Natl Acad Sci U S A. 106 (22): 9109–14. Bibcode:2009ПНАС..106.9109М. Дои:10.1073 / pnas.0900206106. ЧВК 2690020. PMID 19451637.
- ^ а б Гилл С.С., Анджум Н.А., Хасануззаман М., Гилл Р., Триведи Д.К., Ахмад И., Перейра Е., Тутеха Н. (сентябрь 2013 г.). «Глутатион и глутатионредуктаза: замаскированное благо для защиты растений от абиотического стресса». Plant Physiol. Биохим. 70: 204–12. Дои:10.1016 / j.plaphy.2013.05.032. PMID 23792825.
- ^ Рэкер Э. (декабрь 1955 г.). «Глутатионредуктаза из пекарских дрожжей и говяжьей печени». J. Biol. Chem. 217 (2): 855–65. PMID 13271446.
- ^ Massey V, Williams CH (ноябрь 1965 г.). «О механизме реакции дрожжевой глутатионредуктазы». J. Biol. Chem. 240 (11): 4470–80. PMID 4378936.
- ^ Мапсон Л. В., Ишервуд Ф. А. (январь 1963 г.). «Глутатионредуктаза проросшего гороха». Biochem. J. 86: 173–91. Дои:10.1042 / bj0860173. ЧВК 1201730. PMID 13932735.
- ^ Schulz GE, Schirmer RH, Sachsenheimer W, Pai EF (май 1978 г.). «Структура флавоэнзима глутатионредуктазы». Природа. 273 (5658): 120–4. Bibcode:1978Натура.273..120С. Дои:10.1038 / 273120a0. PMID 25387. S2CID 4153363.
дальнейшее чтение
- Синет П.М., Брессон Дж. Л., Кутюрье Дж., Лоран С., Приер М., Реторе М. О., Тайллемит Дж. Л., Тудик Д., Жером Х., Лежен Дж. (1977). «[Возможная локализация глутатионредуктазы (EC 1.6.4.2) на полосе 8p21]». Анна. Genet. (На французском). 20 (1): 13–7. PMID 302667.
- Krohne-Ehrich G, Schirmer RH, Untucht-Grau R (1978). «Глутатионредуктаза из эритроцитов человека. Выделение фермента и анализ последовательности окислительно-восстановительного пептида». Евро. J. Biochem. 80 (1): 65–71. Дои:10.1111 / j.1432-1033.1977.tb11856.x. PMID 923580.
- Loos H, Roos D, Weening R, Houwerzijl J (1976). «Семейный дефицит глутатионредуктазы в клетках крови человека». Кровь. 48 (1): 53–62. Дои:10.1182 / кровь.V48.1.53.53. PMID 947404.
- Tutic M, Lu XA, Schirmer RH, Werner D (1990). «Клонирование и секвенирование кДНК глутатионредуктазы млекопитающих». Евро. J. Biochem. 188 (3): 523–8. Дои:10.1111 / j.1432-1033.1990.tb15431.x. PMID 2185014.
- Палмер EJ, MacManus JP, Mutus B (1990). «Ингибирование глутатионредуктазы онкомодулином». Arch. Biochem. Биофизы. 277 (1): 149–54. Дои:10.1016 / 0003-9861 (90) 90563-Е. PMID 2306116.
- Арнольд HH, Хайнце H (1990). «Обработка периферических лимфоцитов человека конканавалином А активирует экспрессию глутатионредуктазы». FEBS Lett. 267 (2): 189–92. Дои:10.1016/0014-5793(90)80922-6. PMID 2379581. S2CID 40084640.
- Karplus PA, Schulz GE (1987). «Уточненная структура глутатионредуктазы при разрешении 1,54 А». J. Mol. Биол. 195 (3): 701–29. Дои:10.1016/0022-2836(87)90191-4. PMID 3656429.
- Пай Э. Ф., Шульц Г. Е. (1983). «Каталитический механизм глутатионредуктазы, полученный из анализа дифракции рентгеновских лучей промежуточных продуктов реакции». J. Biol. Chem. 258 (3): 1752–7. PMID 6822532.
- Krauth-Siegel RL, Blatterspiel R, Saleh M, Schiltz E, Schirmer RH, Untucht-Grau R (1982). «Глутатионредуктаза из эритроцитов человека. Последовательности домена НАДФН и интерфейсного домена». Евро. J. Biochem. 121 (2): 259–67. Дои:10.1111 / j.1432-1033.1982.tb05780.x. PMID 7060551.
- Тиме Р., Пай Э. Ф., Ширмер Р. Х., Шульц Г. Е. (1982). «Трехмерная структура глутатионредуктазы при разрешении 2 А». J. Mol. Биол. 152 (4): 763–82. Дои:10.1016/0022-2836(81)90126-1. PMID 7334521.
- Хуанг Дж, Филберт МА (1995). «Распределение глутатиона и связанных с глутатионом ферментных систем в митохондриях и цитозоле культивируемых астроцитов мозжечка и гранулярных клеток». Мозг Res. 680 (1–2): 16–22. Дои:10.1016/0006-8993(95)00209-9. PMID 7663973. S2CID 39710661.
- Саввидес С.Н., Карплюс П.А. (1996). «Кинетика и кристаллографический анализ глутатионредуктазы человека в комплексе с ингибитором ксантена». J. Biol. Chem. 271 (14): 8101–7. Дои:10.1074 / jbc.271.14.8101. PMID 8626496.
- Nordhoff A, Tziatzios C, van den Broek JA, Schott MK, Kalbitzer HR, Becker K, Schubert D, Schirmer RH (1997). «Денатурация и реактивация димерной глутатионредуктазы человека - анализ ингибиторов сворачивания». Евро. J. Biochem. 245 (2): 273–82. Дои:10.1111 / j.1432-1033.1997.00273.x. PMID 9151953.
- Столл В.С., Симпсон С.Дж., Краут-Сигель Р.Л., Уолш К.Т., Пай Э. (1997). «Глутатионредуктаза превратилась в трипанотионредуктазу: структурный анализ инженерного изменения специфичности субстрата». Биохимия. 36 (21): 6437–47. Дои:10.1021 / bi963074p. PMID 9174360.
- Беккер К., Саввидес С.Н., Киз М., Ширмер Р.Х., Karplus PA (1998). «Инактивация ферментов через окисление сульфгидрила физиологическими NO-носителями». Nat. Struct. Биол. 5 (4): 267–71. Дои:10.1038 / nsb0498-267. PMID 9546215. S2CID 20607289.
- Кельнер MJ, Монтойя MA (2000). «Структурная организация гена глутатионредуктазы человека: определение правильной последовательности кДНК и идентификация лидерной последовательности митохондрий». Biochem. Биофиз. Res. Сообщество. 269 (2): 366–8. Дои:10.1006 / bbrc.2000.2267. PMID 10708558.
- Канунго С., Мукерджа М. (2001). «Онтогенный профиль некоторых антиоксидантов и перекисное окисление липидов в тканях плаценты и плода человека». Мол. Клетка. Биохим. 215 (1–2): 11–9. Дои:10.1023 / А: 1026511420505. PMID 11204445. S2CID 22048227.
- Берри Y, Truscott RJ (2001). «Наличие человеческого УФ-фильтра в линзе представляет собой окислительный стресс». Exp. Глаз Res. 72 (4): 411–21. Дои:10.1006 / exer.2000.0970. PMID 11273669.
- Ри Джи, Шин М.Х., Со Дж.Й., Чой В.В., Чо К.Х., Ким К.Х., Пак К.С., Ын Х.С., Чанг Дж.Х. (2001). «Старение и фотостарение зависимых изменений ферментных и неферментативных антиоксидантов в эпидермисе и дерме кожи человека in vivo». J. Invest. Дерматол. 117 (5): 1212–7. Дои:10.1046 / j.0022-202x.2001.01469.x. PMID 11710935.
- Zatorska A, Józwiak Z (2003). «Вовлечение глутатиона и связанных с глутатионом ферментов в защиту нормальных и трисомных человеческих фибробластов от даунорубицина». Cell Biol. Int. 26 (5): 383–91. Дои:10.1006 / cbir.2002.0861. PMID 12095224. S2CID 31321422.