Тиоредоксин - Thioredoxin
Тиоредоксин это класс малых редокс белки известно, что присутствует во всех организмы. Он играет роль во многих важных биологические процессы, включая редокс-сигнализацию. У человека тиоредоксины кодируются TXN и TXN2 гены.[5][6] Мутация потери функции любого из двух генов тиоредоксина человека является летальным на четырехклеточной стадии развития эмбрион. Хотя это не совсем понятно, тиоредоксин играет центральную роль в организме человека и все чаще связывается с медициной благодаря их реакции на активные формы кислорода (ROS). В растения, тиоредоксины регулируют спектр важнейших функций, от фотосинтеза до роста, цветения, развития и прорастания семян. Также недавно было обнаружено, что они играют роль в связь между ячейками.[7]
Функция
Тиоредоксины являются белки которые действуют как антиоксиданты, способствуя снижение других белков цистеин тиол-дисульфидный обмен. Тиоредоксины содержатся почти во всех известных организмах и необходимы для жизни в млекопитающие.[8][9]
Тиоредоксин представляет собой фермент оксидоредуктазы массой 12 кДа, содержащий активный центр дитиолдисульфида. Он встречается повсеместно и встречается во многих организмах, от растений и бактерий до млекопитающих. Было идентифицировано множество субстратов для тиоредоксина in vitro, в том числе рибонуклеаза, хориогонадотропины, факторы свертывания крови, рецепторы глюкокортикоидов и инсулин. Снижение инсулина классически используется как тест активности.[10]
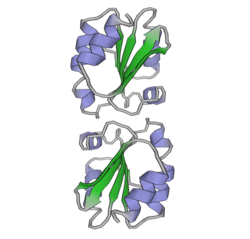
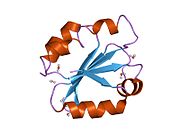
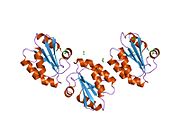
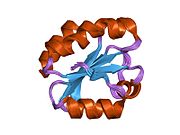
Тиоредоксины охарактеризованы на уровне их аминокислота последовательность по наличию двух вицинальный цистеины в CXXC мотив. Эти два цистеина являются ключом к способности тиоредоксина восстанавливать другие белки. Белки тиоредоксина также обладают характерным третичная структура назвал тиоредоксиновый фолд.
Тиоредоксины сохраняются в восстановленном состоянии за счет флавоэнзим тиоредоксинредуктаза, в НАДФН-зависимой реакции.[11] Тиоредоксины действуют как доноры электронов для пероксидазы и рибонуклеотидредуктаза.[12] Связанные глутаредоксины разделяют многие функции тиоредоксинов, но уменьшаются за счет глутатион а не конкретная редуктаза.
Польза тиоредоксинов для уменьшения окислительный стресс показано трансгенный мыши со сверхэкспрессией тиоредоксина, более устойчивы к воспалениям и живут на 35% дольше[13] - поддержка свободнорадикальная теория старения. Однако средства контроля в этом исследовании были недолговечными, что, возможно, способствовало очевидному увеличению продолжительности жизни.[14]. Trx1 может регулировать не-окислительно-восстановительные посттрансляционные модификации.[15]. У мышей со специфической для сердца сверхэкспрессией Trx1 протеомное исследование показало, что SET и MYND-домен-содержащий белок 1 (SMYD1), лизинметилтрансфераза, высоко экспрессируемая в сердечной и других мышечных тканях, также активируется. Это указывает на то, что Trx1 может также играть роль в метилировании белков посредством регуляции экспрессии SMYD1, которая не зависит от его оксидоредуктазной активности.[16]
Растения имеют необычно сложное дополнение Trxs, состоящее из шести четко определенных типов (Trxs f, m, x, y, h и o), которые находятся в разных клеточные отсеки и функционируют в массиве процессов. В 2010 году было впервые обнаружено, что белки тиоредоксина способны перемещаться из ячейка в ячейку, представляющий новую форму клеточной коммуникации у растений.[7]
Механизм действия
Основная функция тиоредоксина (Trx) - восстановление окисленных остатков цистеина и разрыв дисульфидных связей.[17] Для Trx1 этот процесс начинается с атаки Cys32, одного из остатков, консервативных в мотиве тиоредоксина CXXC, на окисленную группу субстрата.[18] Почти сразу после этого события Cys35, другой консервативный остаток Cys в Trx1, образует дисульфидную связь с Cys32, тем самым передавая 2 электрона субстрату, который теперь находится в восстановленной форме. Окисленный Trx1 затем восстанавливается тиоредоксинредуктазой, которая, в свою очередь, восстанавливается за счет НАДФН как описано выше.[18]

Взаимодействия
Было показано, что тиоредоксин взаимодействовать с:
- ASK1,[19][20][21]
- Коллаген, тип I, альфа 1,[22]
- Рецептор глюкокортикоидов,[23]
- SENP1,[24]
- TXNIP.[25]
- NF-κB - уменьшая дисульфидную связь в NF-κB, Trx1 способствует связыванию этого фактор транскрипции к ДНК.[26]
- AP1 через Ref1 - Trx1 косвенно увеличивает ДНК-связывающую активность белка-активатора 1 (AP1) за счет уменьшения Ремонт ДНК фермент окислительно-восстановительный фактор 1 (Ref-1), который, в свою очередь, снижает AP1 в примере каскада окислительно-восстановительной регуляции.[27]
- АМПК - Функция AMPK в кардиомиоциты сохраняется во время окислительного стресса за счет взаимодействия между AMPK и Trx1. Образуя дисульфидный мостик между двумя белками, Trx1 предотвращает образование и агрегацию окисленной AMPK, тем самым позволяя AMPK нормально функционировать и участвовать в сигнальные каскады.[28]
Влияние на гипертрофию сердца
Было показано, что Trx1 подавляет сердечная гипертрофия утолщение стенок нижних камер сердца за счет взаимодействия с несколькими различными мишенями. Trx1 активирует транскрипционную активность ядерных респираторных факторов 1 и 2 (NRF1 и NRF2 ) и стимулирует проявление пероксисома коактиватор рецептора γ, активированного пролифератором 1-α (PGC-1α ).[29][30] Кроме того, Trx1 снижает два остатка цистеина в гистондеацетилазе 4 (HDAC4 ), что позволяет импортировать HDAC4 из цитозоль, где находится окисленная форма,[31] в ядро.[32] Попадая в ядро, восстановленный HDAC4 подавляет активность факторов транскрипции, таких как NFAT, которые опосредуют гипертрофию сердца.[18] Trx 1 также управляет микроРНК уровни в сердце, и было обнаружено, что он подавляет гипертрофию сердца за счет активации miR-98 /let-7.[33] Trx1 может регулировать уровень экспрессии SMYD1, таким образом, может косвенно модулировать метилирование белка с целью защиты сердца.[34]
Тиоредоксин в уходе за кожей
Тиоредоксин используется в продуктах по уходу за кожей в качестве антиоксиданта в сочетании с глутаредоксином и глутатионом.[нужна цитата ]
Смотрите также
- RuBisCO - активность ферментов регулируется тиоредоксином
- Пероксиредоксин - активность ферментов регулируется тиоредоксином
- Тиоредоксиновый фолд
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000136810 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000028367 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Wollman EE, d'Auriol L, Rimsky L, Shaw A, Jacquot JP, Wingfield P, Graber P, Dessarps F, Robin P, Galibert F (октябрь 1988 г.). «Клонирование и экспрессия кДНК тиоредоксина человека». Журнал биологической химии. 263 (30): 15506–12. PMID 3170595.
- ^ "Entrez Gene: TXN2 тиоредоксин 2".
- ^ а б Менг Л., Вонг Дж. Х., Фельдман Л. Дж., Лемо П. Г., Бьюкенен Б. Б. (февраль 2010 г.). «Связанный с мембраной тиоредоксин, необходимый для роста растений, перемещается от клетки к клетке, что свидетельствует о его роли в межклеточной коммуникации». Труды Национальной академии наук Соединенных Штатов Америки. 107 (8): 3900–5. Дои:10.1073 / pnas.0913759107. ЧВК 2840455. PMID 20133584.
- ^ Холмгрен А. (август 1989 г.). «Тиоредоксиновая и глутаредоксиновая системы» (PDF). Журнал биологической химии. 264 (24): 13963–6. PMID 2668278.
- ^ Нордберг Дж., Арнер Э.С. (декабрь 2001 г.). «Активные формы кислорода, антиоксиданты и тиоредоксиновая система млекопитающих». Свободная радикальная биология и медицина. 31 (11): 1287–312. Дои:10.1016 / S0891-5849 (01) 00724-9. PMID 11728801.
- ^ «Энтрез Джин: тиоредоксин TXN».
- ^ Mustacich D, Powis G (февраль 2000 г.). «Тиоредоксинредуктаза». Биохимический журнал. 346 (1): 1–8. Дои:10.1042/0264-6021:3460001. ЧВК 1220815. PMID 10657232.
- ^ Арнер Э.С., Хольмгрен А. (октябрь 2000 г.). «Физиологические функции тиоредоксина и тиоредоксинредуктазы». Европейский журнал биохимии. 267 (20): 6102–9. Дои:10.1046 / j.1432-1327.2000.01701.x. PMID 11012661.
- ^ Йошида Т., Накамура Х, Масутани Х, Йодой Дж (декабрь 2005 г.). «Участие тиоредоксина и тиоредоксин-связывающего белка-2 в клеточной пролиферации и процессе старения». Летопись Нью-Йоркской академии наук. 1055: 1–12. Дои:10.1196 / Анналы.1323.002. PMID 16387713. S2CID 37043674.
- ^ Muller FL, Lustgarten MS, Jang Y, Richardson A, Van Remmen H (август 2007 г.). «Тенденции в теориях окислительного старения». Свободная радикальная биология и медицина. 43 (4): 477–503. Дои:10.1016 / j.freeradbiomed.2007.03.034. PMID 17640558.
- ^ Лю Т., Ву К., Джайн М.Р., Нагараджан Н., Ян Л., Дай Х, Цуй К., Байкал А., Пан С., Аго Т., Садошима Дж., Ли Х. (декабрь 2015 г.). «Главный редокс-регулятор Trx1 активирует SMYD1 и модулирует метилирование лизина». Biochimica et Biophysica Acta (BBA) - Белки и протеомика. 1854 (12): 1816–1822. Дои:10.1016 / j.bbapap.2015.09.006. ЧВК 4721509. PMID 26410624.
- ^ Лю Т., Ву С., Джайн М.Р., Нагараджан Н., Ян Л., Дай Х, Цуй С., Байкал А., Пан С., Аго Т., Садошима Дж., Ли Х. (декабрь 2015 г.). «Главный редокс-регулятор Trx1 активирует SMYD1 и модулирует метилирование лизина». Biochimica et Biophysica Acta (BBA) - Белки и протеомика. 1854 (12): 1816–1822. Дои:10.1016 / j.bbapap.2015.09.006. ЧВК 4721509. PMID 26410624.
- ^ Накамура Х., Накамура К., Йодой Дж. (1 января 1997 г.). «Редокс-регуляция клеточной активации». Ежегодный обзор иммунологии. 15 (1): 351–69. Дои:10.1146 / annurev.immunol.15.1.351. PMID 9143692.
- ^ а б c Нагараджан Н., Ока С., Садошима Дж. (Декабрь 2016 г.). «Модуляция сигнальных механизмов в сердце тиоредоксином 1». Свободная радикальная биология и медицина. 109: 125–131. Дои:10.1016 / j.freeradbiomed.2016.12.020. ЧВК 5462876. PMID 27993729.
- ^ Лю И, Мин В. (июнь 2002 г.). «Тиоредоксин способствует убиквитинированию и деградации ASK1, подавляя апоптоз, опосредованный ASK1, независимо от окислительно-восстановительной активности». Циркуляционные исследования. 90 (12): 1259–66. Дои:10.1161 / 01.res.0000022160.64355.62. PMID 12089063.
- ^ Морита К., Сайто М., Тобиуме К., Мацуура Х., Эномото С., Нишито Х., Итиджо Х. (ноябрь 2001 г.). «Регулирование отрицательной обратной связи ASK1 протеинфосфатазой 5 (PP5) в ответ на окислительный стресс». Журнал EMBO. 20 (21): 6028–36. Дои:10.1093 / emboj / 20.21.6028. ЧВК 125685. PMID 11689443.
- ^ Сайто М., Нишито Х., Фуджи М., Такеда К., Тобиуме К., Савада Й., Кавабата М., Миядзоно К., Итиджо Х. (май 1998 г.). «Тиоредоксин млекопитающих является прямым ингибитором киназы, регулирующей сигнал апоптоза (ASK) 1». Журнал EMBO. 17 (9): 2596–606. Дои:10.1093 / emboj / 17.9.2596. ЧВК 1170601. PMID 9564042.
- ^ Мацумото К., Масутани Х., Нишияма А., Хашимото С., Гон Й, Хори Т, Йодой Дж. (Июль 2002 г.). «С-пропептидная область человеческого коллагена про альфа 1 типа 1 взаимодействует с тиоредоксином». Сообщения о биохимических и биофизических исследованиях. 295 (3): 663–7. Дои:10.1016 / s0006-291x (02) 00727-1. PMID 12099690.
- ^ Макино Ю., Йошикава Н., Окамото К., Хирота К., Йодой Дж., Макино И., Танака Х. (январь 1999 г.). «Прямая связь с тиоредоксином позволяет регулировать окислительно-восстановительную функцию рецепторов глюкокортикоидов». Журнал биологической химии. 274 (5): 3182–8. Дои:10.1074 / jbc.274.5.3182. PMID 9915858.
- ^ Ли Икс, Ло И, Ю Л, Лин И, Ло Д, Чжан Х, Хе И, Ким Йо, Ким И, Тан С., Мин В. (апрель 2008 г.). «SENP1 опосредует TNF-индуцированное десумоилирование и цитоплазматическую транслокацию HIPK1 для усиления ASK1-зависимого апоптоза». Гибель клеток и дифференциация. 15 (4): 739–50. Дои:10.1038 / sj.cdd.4402303. PMID 18219322.
- ^ Нишияма А., Мацуи М., Ивата С., Хирота К., Масутани Х., Накамура Х., Такаги Й., Соно Х., Гон Й, Йодой Дж. (Июль 1999 г.). «Идентификация тиоредоксин-связывающего белка-2 / витамина D (3), активирующего белок 1, как отрицательного регулятора функции и экспрессии тиоредоксина». Журнал биологической химии. 274 (31): 21645–50. Дои:10.1074 / jbc.274.31.21645. PMID 10419473.
- ^ Мэтьюз JR, Wakasugi N, Virelizier JL, Yodoi J, Hay RT (август 1992 г.). «Тиоредоксин регулирует ДНК-связывающую активность NF-каппа B путем восстановления дисульфидной связи с участием цистеина 62». Исследования нуклеиновых кислот. 20 (15): 3821–30. Дои:10.1093 / nar / 20.15.3821. ЧВК 334054. PMID 1508666.
- ^ Хирота К., Мацуи М., Ивата С., Нишияма А., Мори К., Йодой Дж. (Апрель 1997 г.). «Транскрипционная активность AP-1 регулируется прямой связью между тиоредоксином и Ref-1». Труды Национальной академии наук Соединенных Штатов Америки. 94 (8): 3633–8. Дои:10.1073 / пнас.94.8.3633. ЧВК 20492. PMID 9108029.
- ^ Шао Д., Ока С., Лю Т., Чжай П., Аго Т., Скиарретта С., Ли Х., Садошима Дж. (Февраль 2014 г.). «Редокс-зависимый механизм регуляции активации AMPK тиоредоксином1 во время энергетического голодания». Клеточный метаболизм. 19 (2): 232–45. Дои:10.1016 / j.cmet.2013.12.013. ЧВК 3937768. PMID 24506865.
- ^ Ago T, Yeh I, Yamamoto M, Schinke-Braun M, Brown JA, Tian B, Sadoshima J (2006). «Тиоредоксин1 активирует митохондриальные белки, связанные с окислительным фосфорилированием и циклом TCA в сердце». Антиоксиданты и редокс-сигналы. 8 (9–10): 1635–50. Дои:10.1089 / ars.2006.8.1635. PMID 16987018.
- ^ Ямамото М., Ян Дж., Хонг К., Лю Дж., Холле Э, Ю Икс, Вагнер Т., Ватнер С.Ф., Садошима Дж. (Ноябрь 2003 г.). «Подавление эндогенного тиоредоксина в сердце увеличивает окислительный стресс и гипертрофию сердца». Журнал клинических исследований. 112 (9): 1395–406. Дои:10.1172 / JCI17700. ЧВК 228400. PMID 14597765.
- ^ Мацусима С., Курода Дж., Аго Т., Чжай П., Пак Дж. Й., Се Л. Х., Тиан Б., Садосима Дж. (Февраль 2013 г.). «Повышенный окислительный стресс в ядре, вызванный Nox4, опосредует окисление HDAC4 и гипертрофию сердца». Циркуляционные исследования. 112 (4): 651–63. Дои:10.1161 / CIRCRESAHA.112.279760. ЧВК 3574183. PMID 23271793.
- ^ Аго Т., Лю Т., Чжай П., Чен В., Ли Х., Молькентин Д.Д., Ватнер С.Ф., Садошима Дж. (Июнь 2008 г.). «Редокс-зависимый путь регуляции HDAC класса II и гипертрофии сердца». Клетка. 133 (6): 978–93. Дои:10.1016 / j.cell.2008.04.041. PMID 18555775. S2CID 2678474.
- ^ Ян Й, Аго Т., Чжай П., Абделлатиф М., Садошима Дж. (Февраль 2011 г.). «Тиоредоксин 1 негативно регулирует гипертрофию сердца, индуцированную ангиотензином II, за счет активации miR-98 / let-7». Циркуляционные исследования. 108 (3): 305–13. Дои:10.1161 / CIRCRESAHA.110.228437. ЧВК 3249645. PMID 21183740.
- ^ Лю Т., Ву К., Джайн М.Р., Нагараджан Н., Ян Л., Дай Х, Цуй К., Байкал А., Пан С., Аго Т., Садошима Дж., Ли Х. (декабрь 2015 г.). «Главный редокс-регулятор Trx1 активирует SMYD1 и модулирует метилирование лизина». Biochimica et Biophysica Acta (BBA) - Белки и протеомика. 1854 (12): 1816–1822. Дои:10.1016 / j.bbapap.2015.09.006. ЧВК 4721509. PMID 26410624.
дальнейшее чтение
- Арнер Э.С., Хольмгрен А. (октябрь 2000 г.). «Физиологические функции тиоредоксина и тиоредоксинредуктазы». Европейский журнал биохимии. 267 (20): 6102–9. Дои:10.1046 / j.1432-1327.2000.01701.x. PMID 11012661.
- Нисинака Й, Масутани Х, Накамура Х, Йодой Дж (2002). «Регуляторные роли тиоредоксина в клеточных ответах, вызванных окислительным стрессом». Редокс-отчет. 6 (5): 289–95. Дои:10.1179/135100001101536427. PMID 11778846. S2CID 34079507.
- Аго Т., Садошима Дж. (Ноябрь 2006 г.). «Тиоредоксин и ремоделирование желудочков». Журнал молекулярной и клеточной кардиологии. 41 (5): 762–73. Дои:10.1016 / j.yjmcc.2006.08.006. ЧВК 1852508. PMID 17007870.
- Тониссен К.Ф., Уэллс-младший (июнь 1991 г.). «Выделение и характеристика генов, кодирующих тиоредоксин человека». Ген. 102 (2): 221–8. Дои:10.1016 / 0378-1119 (91) 90081-Л. PMID 1874447.
- Мартин Х., Дин М. (февраль 1991 г.). «Идентификация тиоредоксин-родственного белка, связанного с плазматическими мембранами». Сообщения о биохимических и биофизических исследованиях. 175 (1): 123–8. Дои:10.1016 / S0006-291X (05) 81209-4. PMID 1998498.
- Forman-Kay JD, Clore GM, Wingfield PT, Gronenborn AM (март 1991 г.). «Трехмерная структура с высоким разрешением восстановленного рекомбинантного тиоредоксина человека в растворе». Биохимия. 30 (10): 2685–98. Дои:10.1021 / bi00224a017. PMID 2001356.
- Жако Дж. П., де Ламотт Ф., Фонтекаве М., Шюрманн П., Декоттиньи П., Мигиниак-Маслоу М., Вольман Е. (декабрь 1990 г.). «Взаимосвязь структуры и функции тиоредоксина человека». Сообщения о биохимических и биофизических исследованиях. 173 (3): 1375–81. Дои:10.1016 / S0006-291X (05) 80940-4. PMID 2176490.
- Forman-Kay JD, Clore GM, Driscoll PC, Wingfield P, Richards FM, Gronenborn AM (август 1989 г.). «Назначение протонного ядерного магнитного резонанса и определение вторичной структуры рекомбинантного тиоредоксина человека». Биохимия. 28 (17): 7088–97. Дои:10.1021 / bi00443a045. PMID 2684271.
- Тагая Й., Маэда Й., Мицуи А., Кондо Н., Мацуи Х., Хамуро Дж., Браун Н., Араи К., Йокота Т., Вакасуги Х. (март 1989 г.). «Фактор, производный от ATL (ADF), рецептор IL-2 / индуктор Tac, гомологичный тиоредоксину; возможное участие дитиол-восстановления в индукции рецептора IL-2». Журнал EMBO. 8 (3): 757–64. Дои:10.1002 / j.1460-2075.1989.tb03436.x. ЧВК 400872. PMID 2785919.
- Wollman EE, d'Auriol L, Rimsky L, Shaw A, Jacquot JP, Wingfield P, Graber P, Dessarps F, Robin P, Galibert F (октябрь 1988 г.). «Клонирование и экспрессия кДНК тиоредоксина человека». Журнал биологической химии. 263 (30): 15506–12. PMID 3170595.
- Хеппелл-Партон А, Кан А, Бенч А, Лоу Н., Лехрах Х, Зехетнер Г, Кролик П. (март 1995 г.). «Тиоредоксин, медиатор ингибирования роста, соответствует 9q31». Геномика. 26 (2): 379–81. Дои:10.1016/0888-7543(95)80223-9. PMID 7601465.
- Цинь Дж., Хлор Дж. М., Кеннеди В. М., Хут Дж. Р., Гроненборн А. М. (март 1995 г.). «Структура раствора тиоредоксина человека в смешанном промежуточном дисульфидном комплексе с его целевым пептидом из фактора транскрипции NF каппа B». Структура. 3 (3): 289–97. Дои:10.1016 / S0969-2126 (01) 00159-9. PMID 7788295.
- Като С., Секин С., О С.В., Ким Н.С., Умедзава И., Абэ Н., Ёкояма-Кобаяси М., Аоки Т. (декабрь 1994 г.). «Строительство банка полноразмерных кДНК человека». Ген. 150 (2): 243–50. Дои:10.1016/0378-1119(94)90433-2. PMID 7821789.
- Цинь Дж., Хлор Г. М., Гроненборн А. М. (июнь 1994 г.). «Трехмерные структуры растворов с высоким разрешением окисленного и восстановленного состояний тиоредоксина человека». Структура. 2 (6): 503–22. Дои:10.1016 / S0969-2126 (00) 00051-4. PMID 7922028.
- Гасдаска П.Ю., Продолговатый Дж. Э., Котгрив И. А., Повис Г. (август 1994 г.). «Предсказанная аминокислотная последовательность тиоредоксина человека идентична аминокислотной последовательности аутокринного фактора роста человеческого фактора, полученного из Т-клеток взрослого человека (ADF): мРНК тиоредоксина повышена в некоторых опухолях человека». Biochimica et Biophysica Acta (BBA) - Структура и экспрессия гена. 1218 (3): 292–6. Дои:10.1016/0167-4781(94)90180-5. PMID 8049254.
- Цинь Дж., Хлор Г. М., Кеннеди В. П., Кушевски Дж., Гроненборн А. М. (май 1996 г.). «Структура раствора тиоредоксина человека в комплексе с его мишенью из Ref-1 показывает обращение пептидной цепи». Структура. 4 (5): 613–20. Дои:10.1016 / S0969-2126 (96) 00065-2. PMID 8736558.
- Вайксель А., Гасдаска Дж. Р., Повис Дж., Монфор В. Р. (июнь 1996 г.). «Кристаллические структуры восстановленных, окисленных и мутировавших тиоредоксинов человека: доказательства регуляторного гомодимера». Структура. 4 (6): 735–51. Дои:10.1016 / S0969-2126 (96) 00079-2. PMID 8805557.
- Андерсен Дж. Ф., Сандерс Д. А., Гасдаска Дж. Р., Вайксель А., Повис Дж., Монфор В. Р. (ноябрь 1997 г.). «Гомодимеры тиоредоксина человека: регуляция pH, роль аспартата 60 и кристаллическая структура аспартата 60 -> мутант аспарагина». Биохимия. 36 (46): 13979–88. Дои:10.1021 / bi971004s. PMID 9369469.
- Маруяма Т., Китаока Ю., Сачи Ю., Наканоин К., Хирота К., Сиодзава Т., Йошимура И., Фуджи С., Йодой Дж. (Ноябрь 1997 г.). «Экспрессия тиоредоксина в эндометрии человека во время менструального цикла». Молекулярная репродукция человека. 3 (11): 989–93. Дои:10.1093 / моль / ч / 3.11.989. PMID 9433926.
- Сахлин Л., Стьернхольм И., Холмгрен А., Экман Г., Эрикссон Х. (декабрь 1997 г.). «Экспрессия мРНК тиоредоксина повышена в шейке матки человека во время беременности». Молекулярная репродукция человека. 3 (12): 1113–7. Дои:10.1093 / моль · ч / 3.12.1113. PMID 9464857.
- Маэда К., Хэгглунд П., Финни С., Свенссон Б., Хенриксен А. (ноябрь 2006 г.). «Структурная основа распознавания целевого белка тиоредоксином протеин-дисульфидредуктазы». Структура. 14 (11): 1701–10. Дои:10.1016 / j.str.2006.09.012. PMID 17098195.
внешняя ссылка
- Тиоредоксин в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Обзор всей структурной информации, доступной в PDB за UniProt: P10599 (Тиоредоксин) в PDBe-KB.