Ядро клетки - Cell nucleus - Wikipedia

| Клеточная биология | |
|---|---|
| В животная клетка | |
 Компоненты типичной животной клетки:
|
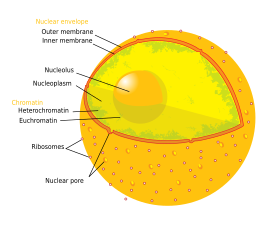
В клеточная биология, то ядро (пл. ядра; из латинский ядро или же nuculeus, смысл ядро или же семя) это мембраносвязанный органелла нашел в эукариотический клетки. Эукариоты обычно имеют одно ядро, но несколько типов клеток, например, у млекопитающих. красные кровяные тельца, имеют нет ядер и некоторые другие, включая остеокласты имеют много. Основными структурами, составляющими ядро, являются ядерная оболочка, двойная мембрана, которая охватывает всю органеллу и изолирует ее содержимое от клеточного цитоплазма; и ядерная матрица (который включает ядерная пластинка ), сеть внутри ядра, которая добавляет механическую поддержку, во многом как цитоскелет поддерживает клетку в целом.
Ядро клетки содержит все клеточные геном, за исключением небольшого количества митохондриальная ДНК, организованных как несколько длинных линейных молекул ДНК в сложный с большим разнообразием белки, Такие как гистоны, чтобы сформировать хромосомы. В гены в этих хромосомах структурированный таким образом, чтобы способствовать функции клеток. Ядро поддерживает целостность генов и контролирует деятельность клетки, регулируя экспрессия гена - поэтому ядро является центром управления клеткой.
Поскольку ядерная оболочка непроницаема для больших молекул, ядерные поры требуются для регулирования ядерный транспорт молекул через оболочку. Поры пересекают обе ядерные мембраны, обеспечивая канал через которые более крупные молекулы должны активно транспортироваться белками-носителями, позволяя при этом свободное движение малых молекул и ионы. Движение больших молекул, таких как белки и РНК через поры требуется как для экспрессии генов, так и для поддержания хромосом.
Хотя внутренняя часть ядра не содержит каких-либо мембраносвязанных субкомпартментов, его содержимое неоднородно, и ряд ядерные тела существуют, состоящие из уникальных белков, молекул РНК и определенных частей хромосом. Самым известным из них является ядрышко, который в основном участвует в сборке рибосомы. После образования в ядрышке рибосомы экспортируются в цитоплазму, где они переводят информационная РНК.
Структуры
Ядро содержит почти всю ДНК клетки, окруженную сетью волокнистых промежуточные нити и окутанный двойной мембраной, называемой "ядерная оболочка ". Ядерная оболочка разделяет жидкость внутри ядра, называемую нуклеоплазма, от остальной части ячейки. Размер ядра зависит от размера клетки, в которой оно содержится, при этом ядро обычно занимает около 8% от общего объема клетки.[1] Ядро самое большое органелла в клетках животных.[2]:12 В млекопитающее клеток, средний диаметр ядра примерно 6 микрометры (мкм).[3]
Ядерная оболочка и поры

В ядерная оболочка состоит из двух клеточные мембраны, называемые внутренней и внешней ядерными мембранами.[4]:649 Вместе эти мембраны служат для отделения генетического материала клеток от остального содержимого клетки и позволяют ядру поддерживать среду, отличную от остальной части клетки. Несмотря на их близкое расположение вокруг большей части ядра, две мембраны существенно различаются по форме и содержанию. Внутренняя мембрана окружает ядерное содержимое, обеспечивая его определяющий край.[2]:14 Встроенные во внутреннюю мембрану различные белки связывают промежуточные волокна, которые придают ядру его структуру.[4]:649 Наружная мембрана как охватывает внутреннюю мембрану, так и является продолжением прилегающей эндоплазматический ретикулум мембрана.[4]:649 Как часть мембраны эндоплазматического ретикулума, внешняя ядерная мембрана усеяна рибосомы которые активно транслируют белки через мембрану.[4]:649 Пространство между двумя мембранами, называемое «перинуклеарное пространство», непрерывно с эндоплазматическим ретикулумом. просвет.[4]:649
Ядерные поры, которые обеспечивают водные каналы через оболочку, состоят из нескольких белков, вместе называемых нуклеопорины. Поры около 60–80 млн. дальтон в молекулярный вес и состоят из около 50 (в дрожжи ) до нескольких сотен белков (в позвоночные ).[2]:622–4 Общий диаметр пор составляет 100 нм; однако щель, через которую молекулы свободно диффундируют, имеет ширину всего около 9 нм из-за присутствия регуляторных систем в центре поры. Этот размер избирательно позволяет прохождение небольших водорастворимых молекул, предотвращая при этом более крупные молекулы, такие как нуклеиновые кислоты и более крупные белки из-за неправильного входа или выхода из ядра. Вместо этого эти большие молекулы должны активно транспортироваться в ядро. Ядро типичной клетки млекопитающего будет иметь от 3000 до 4000 пор по всей своей оболочке.[5] каждый из которых содержит восьмисимметричную кольцевую структуру в месте слияния внутренней и внешней мембран.[6] К кольцу прикреплена структура, называемая ядерная корзина который простирается в нуклеоплазму, и серию нитевидных расширений, доходящих до цитоплазмы. Обе структуры служат для связывания с ядерными транспортными белками.[7]:509–10
Большинство белков, рибосомных субъединиц и некоторые ДНК транспортируются через поровые комплексы в процессе, опосредованном семейством транспортных факторов, известных как кариоферины. Те кариоферины, которые опосредуют движение в ядро, также называются импортинами, тогда как те, которые опосредуют движение из ядра, называются экспортинами. Большинство кариоферинов напрямую взаимодействуют со своим грузом, хотя некоторые используют адаптерные белки.[8] Стероидные гормоны Такие как кортизол и альдостерон, а также другие небольшие жирорастворимые молекулы, участвующие в межклеточном сигнализация, могут диффундировать через клеточную мембрану в цитоплазму, где они связываются ядерный рецептор белки, которые попадают в ядро. Там они служат факторы транскрипции когда привязан к их лиганд; в отсутствие лиганда многие такие рецепторы функционируют как гистоновые деацетилазы которые подавляют экспрессию генов.[7]:488
Ядерная пластинка
В клетках животных две сети промежуточные нити обеспечить ядро механической опорой: ядерная пластинка образует организованную сетку на внутренней стороне оболочки, в то время как менее организованная поддержка обеспечивается на цитозольной стороне оболочки. Обе системы обеспечивают структурную поддержку ядерной оболочки и якорных участков для хромосом и ядерных пор.[9]
Ядерная пластинка состоит в основном из ламинат белки. Как и все белки, ламины синтезируются в цитоплазме, а затем транспортируются во внутреннюю часть ядра, где они собираются перед включением в существующую сеть ядерной пластинки.[10][11] Ламины, обнаруженные на цитозольной поверхности мембраны, такие как Emerin и несприн, связываются с цитоскелетом для обеспечения структурной поддержки. Ламины также находятся внутри нуклеоплазмы, где они образуют другую регулярную структуру, известную как нуклеоплазматическая вуаль,[12][13] что видно с помощью флуоресцентная микроскопия. Фактическая функция вуали не ясна, хотя она исключена из ядрышка и присутствует во время межфазный.[14] Ламинированные структуры, из которых состоит вуаль, такие как LEM3, связывают хроматин и нарушение их структуры подавляет транскрипцию генов, кодирующих белок.[15]
Как и компоненты других промежуточные нити, ламинат мономер содержит альфа-спиральный домен, используемый двумя мономерами для наматывания друг на друга, образуя димер структура называется спиральная катушка. Две из этих димерных структур затем соединяются бок о бок в антипараллельный расположение, чтобы сформировать тетрамер называется протофиламент. Восемь из этих протофиламентов образуют боковое расположение, которое скручивается, образуя веревочную веревку. нить. Эти нити можно собирать или разбирать динамически, а это означает, что изменения длины нити зависят от конкурирующих скоростей добавления и удаления нити.[9]
Мутации в генах ламина, ведущие к дефектам сборки филаментов, вызывают группу редких генетических нарушений, известных как ламинопатии. Самая известная ламинопатия - это семейство болезней, известных как прогерия, что вызывает появление преждевременных старение у больных. Точный механизм, с помощью которого связанный биохимический изменения рождают пожилых фенотип не совсем понятно.[16]
Хромосомы

Ядро клетки содержит большую часть генетического материала клетки в виде множества линейных молекул ДНК, организованных в структуры, называемые хромосомы. Каждая клетка человека содержит примерно два метра ДНК.[7]:405 В течение большей части клеточный цикл они организованы в комплекс ДНК-белок, известный как хроматин, и во время деления клетки можно увидеть, что хроматин формирует четко определенные хромосомы, знакомые по кариотип. Вместо этого небольшая часть генов клетки находится в митохондрии.[7]:438
Есть два типа хроматина. Эухроматин является менее компактной формой ДНК и содержит гены, которые часто выразил по ячейке.[17] Другой тип, гетерохроматин, является более компактной формой и содержит редко транскрибируемую ДНК. Эта структура далее подразделяется на факультативный гетерохроматин, состоящий из генов, которые организованы как гетерохроматин только в определенных типах клеток или на определенных стадиях развития, и учредительный гетерохроматин который состоит из структурных компонентов хромосомы, таких как теломеры и центромеры.[18] Во время интерфазы хроматин организуется в отдельные отдельные участки,[19] называется хромосомные территории.[20] Активные гены, которые обычно находятся в эухроматической области хромосомы, имеют тенденцию располагаться ближе к границе территории хромосомы.[21]
Антитела к определенным типам организации хроматина, в частности, нуклеосомы, были связаны с рядом аутоиммунные заболевания, Такие как системная красная волчанка.[22] Они известны как антиядерные антитела (ANA), а также наблюдались совместно с рассеянный склероз как часть общей дисфункции иммунной системы.[23]
Ядрышко

В ядрышко это самая большая из дискретных плотно окрашенных безмембранных структур, известных как ядерные тела найдено в ядре. Он формируется вокруг тандем повторяет из рДНК, ДНК, кодирующая рибосомная РНК (рРНК). Эти регионы называются области ядрышкового организатора (НИ). Основные функции ядрышка - синтез рРНК и собрать рибосомы. Структурная когезия ядрышка зависит от его активности, поскольку сборка рибосом в ядрышке приводит к временной ассоциации ядрышковых компонентов, облегчая дальнейшую сборку рибосом и, следовательно, дальнейшую ассоциацию. Эта модель подтверждается наблюдениями, что инактивация рДНК приводит к перемешиванию ядрышковых структур.[24]
На первом этапе сборки рибосомы белок, называемый РНК-полимераза I транскрибирует рДНК, которая образует большой предшественник пре-рРНК. Это расщеплено на субъединицы 5,8S, 18S, и 28S рРНК.[25] Транскрипция, посттранскрипционный процессинг и сборка рРНК происходит в ядрышке при помощи малая ядрышковая РНК (snoRNA) молекулы, некоторые из которых происходят из сплайсированных интроны из информационные РНК кодирующие гены, связанные с функцией рибосом. Собранные субъединицы рибосом - самые большие структуры, прошедшие через ядерные поры.[7]:526
При наблюдении под электронный микроскоп видно, что ядрышко состоит из трех различимых областей: самого внутреннего фибриллярные центры (FCs) в окружении плотный фибриллярный компонент (DFC) (содержащий фибрилларин и нуклеолин ), который, в свою очередь, ограничен гранулированный компонент (GC) (который содержит белок нуклеофозмин ). Транскрипция рДНК происходит либо в FC, либо на границе FC-DFC, и, следовательно, когда транскрипция рДНК в клетке увеличивается, обнаруживается больше FC. Большая часть расщепления и модификации рРНК происходит в DFC, тогда как последние стадии, включающие сборку белка на рибосомные субъединицы, происходят в GC.[25]
Другие ядерные тела
| Название структуры | Диаметр конструкции | Ref. |
|---|---|---|
| Тела Кахала | 0,2–2,0 мкм | [26] |
| Кластосомы | 0,2-0,5 мкм | [27] |
| ПИКА | 5 мкм | [28] |
| Тела PML | 0,2–1,0 мкм | [29] |
| Параспеклы | 0,5–1,0 мкм | [30] |
| Пятнышки | 20–25 нм | [28] |
Помимо ядрышка, ядро содержит ряд других ядерных тел. К ним относятся Тела Кахала, близнецы тельцов Кахаля, полиморфная интерфазная кариосомная ассоциация (PIKA), тельца промиелоцитарного лейкоза (PML), параспек, и спеклы сращивания. Хотя о ряде этих доменов известно немного, они важны тем, что показывают, что нуклеоплазма не является однородной смесью, а скорее содержит организованные функциональные субдомены.[29]
Другие субядерные структуры появляются как часть патологических процессов болезни. Например, в некоторых случаях сообщалось о наличии небольших внутриядерных стержней. немалиновая миопатия. Это состояние обычно возникает в результате мутаций в актин, а сами палочки состоят из мутантного актина, а также других белков цитоскелета.[31]
Тела Кахала и драгоценные камни
Ядро обычно содержит от одной до десяти компактных структур, называемых тельцами Кахаля или спиралевидными телами (CB), диаметр которых составляет от 0,2 до 2,0 мкм в зависимости от типа и вида клеток.[26] Под электронным микроскопом они напоминают клубки запутанной нити.[28] и являются плотными очагами распределения белка катушка.[32] CB участвуют в ряде различных ролей, связанных с процессингом РНК, в частности малая ядрышковая РНК (мяРНК) и малая ядерная РНК созревание (мяРНК) и модификация мРНК гистонов.[26]
Подобно телам Кахала, тела Близнецов Кахала или драгоценные камни, название которых происходит от Созвездие Близнецов в отношении их близких "близнецов" отношений с CB. Драгоценные камни похожи по размеру и форме на CB, и фактически их практически невозможно различить под микроскопом.[32] В отличие от CB, драгоценные камни не содержат малые ядерные рибонуклеопротеины (мяРНП), но содержат белок, называемый выживаемость двигательного нейрона (SMN), функция которого связана с биогенезом snRNP. Считается, что драгоценные камни помогают CBs в биогенезе snRNP,[33] хотя на основании данных микроскопии также было высказано предположение, что CB и драгоценные камни являются разными проявлениями одной и той же структуры.[32] Более поздние ультраструктурные исследования показали, что драгоценные камни являются двойниками тел Кахала с разницей в компоненте койлин; Тела Кахаля имеют положительный SMN и положительный полюс, а драгоценные камни - положительный SMN и отрицательный полюс.[34]
Домены PIKA и PTF
Домены PIKA, или полиморфные интерфазные кариосомные ассоциации, были впервые описаны в микроскопических исследованиях в 1991 году. Их функция остается неясной, хотя не считалось, что они связаны с активной репликацией ДНК, транскрипцией или процессингом РНК.[35] Было обнаружено, что они часто ассоциируются с дискретными доменами, определяемыми плотной локализацией фактора транскрипции PTF, который способствует транскрипции малая ядерная РНК (мяРНК).[36]
Тела PML
Тельца промиелоцитарного лейкоза (Тельца PML) представляют собой сферические тела размером около 0,1–1,0 мкм, разбросанные по всей нуклеоплазме. Они известны под рядом других названий, включая ядерный домен 10 (ND10), тельца Кремера и онкогенные домены PML.[37] Тельца ПМЛ названы в честь одного из их основных компонентов - белка промиелоцитарного лейкоза (ПМЛ). Они часто встречаются в ядре вместе с тельцами Кахаля и тельцами расщепления.[29] Мыши Pml - / -, которые не могут создавать тельца PML, развиваются нормально без очевидных побочных эффектов, что показывает, что тельца PML не требуются для большинства важных биологических процессов.[38]
Спеклы сращивания
Спеклы - это субядерные структуры, которые обогащены факторами сплайсинга пре-мессенджерской РНК и расположены в межхроматиновых областях нуклеоплазмы клеток млекопитающих. На уровне флуоресцентного микроскопа они выглядят как неправильные точечные структуры, которые различаются по размеру и форме, а при исследовании с помощью электронной микроскопии они видны как скопления гранулы интерхроматина. Спеклы - это динамические структуры, и их белковые и РНК-белковые компоненты могут непрерывно перемещаться между спеклами и другими ядерными участками, включая активные сайты транскрипции. Исследования состава, структуры и поведения спеклов предоставили модель для понимания функциональной компартментализации ядра и организации механизма экспрессии генов.[39] сращивание snRNPs[40][41] и другие белки сплайсинга, необходимые для процессинга пре-мРНК.[39] Из-за меняющихся требований клетки состав и расположение этих тел изменяются в соответствии с транскрипцией и регуляцией мРНК через фосфорилирование специфических белков.[42] Спеклы сплайсинга также известны как ядерные спеклы (ядерные пятнышки), компартменты факторов сплайсинга (компартменты SF), кластеры межхроматиновых гранул (IGC) и B snurposomes.[43]В-снурпосомы обнаружены в ядрах ооцитов амфибий и в Drosophila melanogaster эмбрионы. На электронных микрофотографиях ядер амфибий B-снарпосомы появляются по отдельности или прикреплены к тельцам Кахаля.[44] IGC функционируют как места хранения факторов сращивания.[45]
Параспеклы
Обнаружено Fox et al. в 2002 г. параспеклы представляют собой компартменты неправильной формы в межхроматиновом пространстве ядра.[46] Впервые зарегистрировано в клетках HeLa, где обычно имеется 10–30 на ядро,[47] В настоящее время известно, что параспеклы также присутствуют во всех первичных клетках человека, трансформированных клеточных линиях и срезах тканей.[48] Их название происходит от их распределения в ядре; «пара» - это сокращение от «параллель», а «спеклы» относятся к спеклам сращивания, к которым они всегда находятся в непосредственной близости.[47]
Параспеклы изолируют ядерные белки и РНК и, таким образом, действуют как молекулярная губка.[49] который участвует в регуляции экспрессии генов.[50] Кроме того, парашюты - это динамические структуры, которые изменяются в ответ на изменения клеточной метаболической активности. Они зависят от транскрипции[46] и в отсутствие транскрипции РНК Pol II параспек исчезает, и все связанные с ним белковые компоненты (PSP1, p54nrb, PSP2, CFI (m) 68 и PSF) образуют перинуклеолярный колпачок серповидной формы в ядрышке. Это явление демонстрируется во время клеточного цикла. в клеточный цикл, во время межфазный и в течение всего митоз кроме телофаза. Во время телофазы, когда образуются два дочерних ядра, нет РНК Pol II транскрипция поэтому белковые компоненты вместо этого образуют перинуклеолярный колпачок.[48]
Фибриллы перихроматина
Фибриллы перихроматина видны только под электронным микроскопом. Они расположены рядом с транскрипционно активным хроматином и предположительно являются сайтами активных пре-мРНК обработка.[45]
Кластосомы
Кластосомы представляют собой небольшие ядерные тельца (0,2–0,5 мкм), имеющие форму толстого кольца из-за периферической капсулы вокруг этих тел.[27] Это название происходит от греческого кластос, сломанный и сома, тело.[27] Кластосомы обычно не присутствуют в нормальных клетках, что затрудняет их обнаружение. Они образуются под высокими протеолитический условия в ядре и деградируют, когда наблюдается снижение активности или если клетки обрабатываются ингибиторы протеасом.[27][51] Недостаток кластосом в клетках указывает на то, что они не требуются для протеасома функция.[52] Осмотический стресс также было показано, что вызывает образование кластосом.[53] Эти ядерные тельца содержат каталитические и регуляторные субъединицы протеасомы и ее субстратов, что указывает на то, что кластосомы являются сайтами деградации белков.[52]
Функция
Ядро обеспечивает сайт генетической транскрипции, который отделен от местоположения перевод в цитоплазме, позволяя уровни генная регуляция которые недоступны для прокариоты. Основная функция ядра клетки - контролировать экспрессию генов и опосредовать репликацию ДНК во время клеточного цикла.[7]:171
Ядро - это органелла, обнаруженная в эукариотических клетках. Внутри полностью закрытого ядерного мембрана, он содержит большую часть генетического материала клетки. Этот материал организован как ДНК молекулы, наряду с множеством белки, чтобы сформировать хромосомы.[7]:405
Компартментализация клеток
Ядерная оболочка позволяет ядру контролировать свое содержимое и при необходимости отделять его от остальной цитоплазмы. Это важно для управления процессами по обе стороны ядерной мембраны. В большинстве случаев, когда необходимо ограничить цитоплазматический процесс, ключевой участник удаляется в ядро, где он взаимодействует с факторами транскрипции, подавляя выработку определенных ферментов в этом пути. Этот регуляторный механизм возникает в случае гликолиз, клеточный путь разрушения глюкоза производить энергию. Гексокиназа это фермент, ответственный за первую стадию гликолиза, образуя глюкозо-6-фосфат из глюкозы. При высоких концентрациях фруктозо-6-фосфат, молекула, образованная позже из глюкозо-6-фосфата, белок-регулятор удаляет гексокиназу в ядро,[54] где он образует комплекс репрессора транскрипции с ядерными белками, чтобы снизить экспрессию генов, участвующих в гликолизе.[55]
Чтобы контролировать, какие гены транскрибируются, клетка отделяет некоторые белки факторов транскрипции, ответственные за регулирование экспрессии генов, от физического доступа к ДНК до тех пор, пока они не будут активированы другими сигнальными путями. Это предотвращает даже низкие уровни несоответствующей экспрессии генов. Например, в случае NF-κB -контролируемые гены, которые участвуют в большинстве воспалительный ответов, транскрипция индуцируется в ответ на сигнальный путь например, инициированный сигнальной молекулой TNF-α, связывается с рецептором клеточной мембраны, что приводит к привлечению сигнальных белков и, в конечном итоге, к активации фактора транскрипции NF-κB. А сигнал ядерной локализации на белке NF-κB позволяет ему транспортироваться через ядерную пору в ядро, где он стимулирует транскрипцию генов-мишеней.[9]
Компартментализация позволяет клетке предотвращать трансляцию несплайсированной мРНК.[56] Эукариотическая мРНК содержит интроны, которые необходимо удалить перед трансляцией для производства функциональных белков. Сплайсинг выполняется внутри ядра до того, как рибосомы смогут получить доступ к мРНК для трансляции. Без ядра рибосомы транслируют вновь транскрибируемую (необработанную) мРНК, что приводит к появлению уродливых и нефункциональных белков.[7]:108–15
Репликация
Основная функция ядра клетки - контролировать экспрессию генов и опосредовать репликацию ДНК во время клеточного цикла.[7]:171 Было обнаружено, что репликация происходит локализованным образом в ядре клетки. В S фазе интерфазы клеточного цикла; репликация имеет место. В отличие от традиционного взгляда на перемещение репликационных вилок по застойной ДНК, концепция фабрики репликации возникла, что означает, что вилки репликации сконцентрированы в некоторых иммобилизованных «фабричных» областях, через которые нити матричной ДНК проходят как конвейерные ленты.[57]
Экспрессия гена

Экспрессия генов сначала включает транскрипцию, при которой ДНК используется в качестве матрицы для производства РНК. В случае генов, кодирующих белки, эта РНК, полученная в результате этого процесса, представляет собой информационную РНК (мРНК), которая затем должна транслироваться рибосомами для образования белка. Поскольку рибосомы расположены вне ядра, продуцируемая мРНК должна экспортироваться.[58]
Поскольку ядро является местом транскрипции, оно также содержит множество белков, которые либо непосредственно опосредуют транскрипцию, либо участвуют в регуляции этого процесса. Эти белки включают геликасы, которые раскручивают двухцепочечную молекулу ДНК для облегчения доступа к ней, РНК-полимеразы, которые связываются с промотором ДНК для синтеза растущей молекулы РНК, топоизомеразы, которые изменяют количество суперспирализация в ДНК, помогая ей раскручиваться и раскручиваться, а также большое количество факторов транскрипции, регулирующих экспрессию.[59]
Обработка пре-мРНК
Недавно синтезированные молекулы мРНК известны как первичные стенограммы или пре-мРНК. Они должны пройти посттранскрипционная модификация в ядре перед экспортом в цитоплазму; мРНК, которая появляется в цитоплазме без этих модификаций, разрушается, а не используется для трансляции белка. Три основных модификации: 5 'крышка, 3' полиаденилирование, и Сплайсинг РНК. Находясь в ядре, пре-мРНК связана с множеством белков в комплексах, известных как гетерогенные рибонуклеопротеиновые частицы (hnRNPs). Добавление 5'-кэпа происходит котранскрипционно и является первым шагом посттранскрипционной модификации. 3 'поли-аденин хвост добавляется только после завершения транскрипции.[7]:509–18
Сплайсинг РНК, осуществляемый комплексом, называемым сплайсосома, это процесс, с помощью которого интроны или области ДНК, которые не кодируют белок, удаляются из пре-мРНК, а оставшиеся экзоны соединены, чтобы переформировать единую непрерывную молекулу. Этот процесс обычно происходит после 5'-кэппинга и 3'-полиаденилирования, но может начаться до завершения синтеза в транскриптах с большим количеством экзонов.[7]:494 Многие пре-мРНК могут быть сплайсированы разными способами для получения различных зрелых мРНК, которые кодируют разные белковые последовательности. Этот процесс известен как альтернативное сращивание, и позволяет производить большое количество белков из ограниченного количества ДНК.[60]
Динамика и регулирование
Ядерный транспорт

Вход и выход больших молекул из ядра строго контролируются комплексами ядерных пор. Хотя небольшие молекулы могут проникать в ядро без регуляции,[61] макромолекулы, такие как РНК и белки, требуют ассоциации кариоферинов, называемых importins войти в ядро и Exportins выходить. «Грузовые» белки, которые должны быть перемещены из цитоплазмы в ядро, содержат короткие аминокислотные последовательности, известные как сигналы ядерной локализации, которые связываются импортинами, а те, которые транспортируются из ядра в цитоплазму, несут сигналы ядерного экспорта связаны экспортными продуктами. Возможность импортеров и экспортеров транспортировать свои грузы регулируется GTPases, ферменты, которые гидролизовать молекула гуанозинтрифосфата (ГТФ) высвобождает энергию. Ключевой GTPase в ядерном транспорте является Ран, который связан либо с GTP, либо с GDP (гуанозиндифосфат), в зависимости от того, находится ли он в ядре или цитоплазме. В то время как importins зависят от RanGTP, чтобы отделиться от своего груза, exportin требует RanGTP для привязки к своему грузу.[8]
Ядерный импорт зависит от импорта, связывающего свой груз в цитоплазме и переносящего его через ядерную пору в ядро. Внутри ядра RanGTP отделяет груз от импортина, позволяя импортину выйти из ядра и повторно использоваться. Ядерный экспорт аналогичен, поскольку экспортин связывает груз внутри ядра в процессе, которому способствует RanGTP, выходит через ядерную пору и отделяется от своего груза в цитоплазме.[62]
Существуют специализированные экспортные белки для транслокации зрелой мРНК и тРНК в цитоплазму после завершения посттранскрипционной модификации. Этот механизм контроля качества важен из-за центральной роли этих молекул в трансляции белков. Неправильная экспрессия белка из-за неполного удаления экзонов или неправильного включения аминокислот может иметь негативные последствия для клетки; таким образом, не полностью модифицированная РНК, которая достигает цитоплазмы, скорее разрушается, чем используется для трансляции.[7]
Сборка и разборка

В течение своей жизни ядро может быть разрушено или разрушено, либо в процессе деление клеток или как следствие апоптоз (процесс запрограммированная гибель клеток ). Во время этих событий структурные компоненты ядра - оболочка и пластинка - могут систематически разрушаться. В большинстве клеток разборка ядерной оболочки отмечает конец профаза митоза. Однако такая разборка ядра не является универсальным признаком митоза и встречается не во всех клетках. Некоторые одноклеточные эукариоты (например, дрожжи) подвергаются так называемому закрытый митоз, в котором ядерная оболочка остается неповрежденной. При закрытом митозе дочерние хромосомы мигрируют к противоположным полюсам ядра, которое затем делится на две части. Однако клетки высших эукариот обычно подвергаются открытый митоз, который характеризуется разрушением ядерной оболочки. Затем дочерние хромосомы мигрируют к противоположным полюсам митотического веретена, и новые ядра снова собираются вокруг них.[7]:854
В определенный момент клеточного цикла в открытом митозе клетка делится, образуя две клетки. Для того чтобы этот процесс был возможен, каждая из новых дочерних клеток должна иметь полный набор генов, процесс, требующий репликации хромосом, а также сегрегации отдельных наборов. Это происходит за счет реплицированных хромосом, сестринские хроматиды, прикрепляя к микротрубочки, которые, в свою очередь, прикреплены к разным центросомы. Затем сестринские хроматиды могут быть перемещены в разные места в клетке. Во многих клетках центросома расположена в цитоплазме, вне ядра; микротрубочки не смогли бы прикрепиться к хроматидам в присутствии ядерной оболочки.[63] Следовательно, на ранних стадиях клеточного цикла, начиная с профазы и до прометафаза, ядерная мембрана демонтирована.[12] Аналогичным образом, в тот же период ядерная пластинка также разбирается, и этот процесс регулируется фосфорилированием ламинов протеинкиназами, такими как CDC2 протеинкиназа.[64] Ближе к концу клеточного цикла происходит реформирование ядерной мембраны, и примерно в то же время происходит повторная сборка ядерной пластинки путем дефосфорилирования ламинов.[64]
Однако в динофлагелляты ядерная оболочка остается неповрежденной, центросомы располагаются в цитоплазме, а микротрубочки контактируют с хромосомами, центромерные области которых включены в ядерную оболочку (так называемый закрытый митоз с внеядерным веретеном). У многих других протистов (например, инфузории, спорозоиды ) и грибов центросомы являются внутриядерными, и их ядерная оболочка также не разбирается при делении клеток.[65]
Апоптоз - это контролируемый процесс, при котором структурные компоненты клетки разрушаются, что приводит к гибели клетки. Изменения, связанные с апоптозом, напрямую влияют на ядро и его содержимое, например, на конденсацию хроматина и распад ядерной оболочки и пластинки. Разрушение ламинатных сетей контролируется специализированными апоптотическими протеазы называется каспасы, которые расщепляют белки ламина и, таким образом, нарушают структурную целостность ядра. Расщепление ламина иногда используется как лабораторный индикатор активности каспаз в анализы для ранней апоптотической активности.[12] Клетки, которые экспрессируют мутантные каспазо-устойчивые ламины, испытывают дефицит ядерных изменений, связанных с апоптозом, что позволяет предположить, что ламины играют роль в инициации событий, которые приводят к апоптотической деградации ядра.[12] Само по себе ингибирование сборки ламина является индуктором апоптоза.[66]
Ядерная оболочка действует как барьер, предотвращающий проникновение в ядро как ДНК, так и РНК вирусов. Некоторым вирусам требуется доступ к белкам внутри ядра для репликации и / или сборки. ДНК-вирусы, такие как герпесвирус реплицируются и собираются в ядре клетки и выходят почкованием через внутреннюю ядерную мембрану. Этот процесс сопровождается разборкой пластинки на ядерной стороне внутренней мембраны.[12]
Первоначально предполагалось, что иммуноглобулины в целом и аутоантитела в частности, не попадают в ядро. Теперь есть ряд доказательств того, что при патологических состояниях (например, Красная волчанка ) IgG может попасть в ядро.[67]
Ядер на клетку
Наиболее эукариотический типы клеток обычно имеют одно ядро, но у некоторых нет ядер, а у других их несколько. Это может быть результатом нормального развития, например, при созревании млекопитающих. красные кровяные тельца, или из-за неправильного деления клеток.[68]
Безъядерные клетки

Безъядерная клетка не содержит ядра и, следовательно, неспособна делиться с образованием дочерних клеток. Самая известная безъядерная клетка - это эритроцит млекопитающих, или эритроцит, в котором также отсутствуют другие органеллы, такие как митохондрии, и который служит в основном транспортным судном для переправы кислород от легкие к тканям организма. Эритроциты созревают через эритропоэз в Костный мозг, где они теряют свои ядра, органеллы и рибосомы. Ядро удаляется в процессе дифференциации от эритробласт к ретикулоцит, который является непосредственным предшественником зрелого эритроцита.[69] Наличие мутагены может вызвать выброс некоторых незрелых «микроядерных» эритроцитов в кровоток.[70][71] Безъядерные клетки также могут возникать в результате неправильного деления клеток, когда у одной дочери отсутствует ядро, а у другой - два ядра.
В цветущие растения, это условие возникает в элементы ситовой трубки.[72]
Многоядерные клетки
Многоядерный клетки содержат несколько ядер. Наиболее акантарей виды простейшие[73] и немного грибы в микориза[74] имеют естественно многоядерные клетки. Другие примеры включают кишечные паразиты в роду Лямблии, которые имеют два ядра на клетку.[75] Инфузории имеют два вида ядер в одной клетке, соматические макронуклеус и зародышевой линии микронуклеус.[76] В людях, скелетные мышцы клетки, называемые миоциты и синцитий, в процессе развития становятся многоядерными; в результате расположение ядер вблизи периферии клеток обеспечивает максимальное внутриклеточное пространство для миофибриллы.[7] Другие многоядерные клетки человека: остеокласты тип костная клетка. Многоядерные и двухъядерные клетки также может быть ненормальным у людей; например, клетки, возникающие в результате слияния моноциты и макрофаги, известный как гигантские многоядерные клетки, иногда сопровождают воспаление[77] и также участвуют в образовании опухолей.[78]
Номер динофлагелляты как известно, имеют два ядра. В отличие от других многоядерных клеток эти ядра содержат две различные линии ДНК: одну от динофлагеллат, а другую от симбиотической диатомовые водоросли.[79]
Эволюция
Как основная определяющая характеристика эукариотической клетки, ядро эволюционный происхождение было предметом многих предположений. Для объяснения существования ядра были предложены четыре основные гипотезы, хотя ни одна из них еще не получила широкой поддержки.[80][81][82]
Первая модель, известная как «синтрофическая модель», предполагает, что симбиотический отношения между археи и бактерии создал содержащую ядро эукариотическую клетку. (У организмов домена архей и бактерий нет клеточного ядра.[83]) Предполагается, что симбиоз зародился, когда древние археи, похожие на современные метаногенный архей, вторглись и жили внутри бактерий, подобных современным миксобактерии, в конечном итоге формируя раннее ядро. Эта теория аналогична принятой теории происхождения митохондрий эукариот и хлоропласты, которые, как полагают, возникли из сходных эндосимбиотических отношений между протоэукариотами и аэробными бактериями.[84] Архейное происхождение ядра подтверждается наблюдениями, что археи и эукарии имеют схожие гены определенных белков, в том числе гистоны. Наблюдения за тем, что миксобактерии подвижны, могут образовывать многоклеточные комплексы и обладают киназы и G белки подобно эукариотам, подтверждают бактериальное происхождение эукариотической клетки.[85]
Вторая модель предполагает, что протоэукариотические клетки произошли от бактерий без эндосимбиотической стадии. Эта модель основана на существовании современных планктомицеты бактерии, обладающие ядерной структурой с примитивными порами и другими секционированными мембранными структурами.[86] В аналогичном предложении говорится, что клетка, подобная эукариотам, хроноцит, возникла первая и фагоцитированный архей и бактерий для образования ядра и эукариотической клетки.[87]
Самая противоречивая модель, известная как вирусный эукариогенез, утверждает, что связанное с мембраной ядро, наряду с другими эукариотическими особенностями, возникло в результате заражения прокариота вирусом. Это предположение основано на сходстве между эукариотами и вирусами, таких как линейные цепи ДНК, кэппирование мРНК и прочное связывание с белками (аналогия гистонов с вирусные конверты ). Одна из версий предложения предполагает, что ядро эволюционировало вместе с фагоцитоз сформировать ранний клеточный "хищник ".[88] Другой вариант предполагает, что эукариоты произошли от ранних архей, инфицированных поксвирусы, на основании наблюдаемого сходства между ДНК-полимеразы у современных поксвирусов и эукариот.[89][90] Было высказано предположение, что нерешенный вопрос эволюция пола может быть связано с гипотезой вирусного эукариогенеза.[91]
Более недавнее предложение, экзомембранная гипотеза, предполагает, что ядро вместо этого произошло от единственной предковой клетки, которая развила вторую внешнюю клеточную мембрану; внутренняя мембрана, окружающая исходную клетку, затем стала ядерной мембраной и развила все более сложные пористые структуры для прохождения внутренне синтезированных клеточных компонентов, таких как субъединицы рибосом.[92]
История


Ядро было первой обнаруженной органеллой. Наиболее вероятно, что самый старый из сохранившихся рисунков датируется ранним микроскопистом Антони ван Левенгук (1632–1723). Он наблюдал «просвет», ядро, в красных кровяных тельцах лосось.[93] В отличие от эритроцитов млекопитающих, у других позвоночных все еще есть ядра.[94]
Ядро было также описано Франц Бауэр в 1804 г.[95] и более подробно в 1831 году шотландским ботаник Роберт Браун в разговоре на Линнеевское общество Лондона. Браун учился орхидеи под микроскопом, когда он наблюдал непрозрачную область, которую он назвал «ареолой» или «ядром», в клетках внешнего слоя цветка.[96] Он не предлагал потенциальную функцию.
В 1838 г. Маттиас Шлейден предположил, что ядро играет роль в создании клеток, поэтому он ввел название "цитобласт«(« строитель клеток »). Он полагал, что наблюдал, как новые клетки собираются вокруг« цитобластов ». Франц Мейен был ярым противником этой точки зрения, уже описав клетки, размножающиеся путем деления, и полагая, что многие клетки не будут иметь ядер. Идея о том, что клетки могут генерироваться de novo «цитобластом» или иным образом, противоречит работе Роберт Ремак (1852) и Рудольф Вирхов (1855), который решительно пропагандировал новую парадигму, согласно которой клетки создаются исключительно клетками ("Omnis Cellula e Cellula"). Функция ядра осталась неясной.[97]
Между 1877 и 1878 годами Оскар Хертвиг опубликовал несколько исследований по оплодотворение из морской еж яйца, показывая, что ядро сперма входит в ооцит и сливается со своим ядром. Это был первый случай, когда было высказано предположение, что человек развивается из (единственной) ядерной клетки. Это противоречило Эрнст Геккель теория, что полный филогения вида будет повторяться во время эмбрионального развития, включая образование первой ядерной клетки из «монерулы», бесструктурной массы первичной протоплазмы («Уршлейм Поэтому вопрос о необходимости ядра сперматозоида для оплодотворения обсуждался довольно долго. Однако Хертвиг подтвердил свои наблюдения на других группах животных, в том числе амфибии и моллюски. Эдуард Страсбургер дал те же результаты для растений в 1884 году. Это открыло путь к тому, чтобы отвести ядру важную роль в наследственности. В 1873 г. Август Вейсманн постулировал эквивалентность материнского и отцовского зародыша клетки по наследственности. Функция ядра как носителя генетической информации прояснилась лишь позже, после открытия митоза и Менделирующие правила были заново открыты в начале 20 века; то хромосомная теория наследственности поэтому был разработан.[97]
Смотрите также
Рекомендации
- ^ Кантвелл Х., медсестра П. (2019). «Уничтожение контроля над размером ядер». Текущая генетика. Springer. 65 (6): 1282. Дои:10.1007 / s00294-019-00999-3. ЧВК 6820586. PMID 31147736.
- ^ а б c Lodish HF, Berk A, Kaiser C, Krieger M, Bretscher A, Ploegh H и др. (2016). Молекулярная клеточная биология (Восьмое изд.). Нью-Йорк: W.H. Фримен. ISBN 978-1-4641-8339-3.
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). Молекулярная биология клетки (4-е изд.). Нью-Йорк: Наука о гирляндах. п. 197. ISBN 978-0-8153-4072-0.
- ^ а б c d е Альбертс Б., Джонсон А., Льюис Дж, Морган Д., Рафф М., Робертс К., Уолтер П. (2015). Молекулярная биология клетки (6 изд.). Нью-Йорк: Наука о гирляндах.
- ^ Rhoades R, Pflanzer R, ред. (1996). «Ч3». Физиология человека (3-е изд.). Издательство Saunders College Publishing.
- ^ Шульга Н., Мосаммапараст Н., Возняк Р., Гольдфарб Д.С. (май 2000 г.). «Нуклеопорины дрожжей, участвующие в пассивной проницаемости ядерной оболочки». Начальный. Журнал клеточной биологии. 149 (5): 1027–38. Дои:10.1083 / jcb.149.5.1027. ЧВК 2174828. PMID 10831607.
- ^ а б c d е ж грамм час я j k л м п Лодиш Х., Берк А., Мацудаира П., Кайзер Калифорния, Кригер М., Скотт М.П., Зипурски С.Л., Дарнелл Дж. (2004). Молекулярная клеточная биология (5-е изд.). Нью-Йорк: WH Freeman. ISBN 978-0-7167-2672-2.
- ^ а б Пембертон Л.Ф., Паскаль Б.М. (март 2005 г.). «Механизмы рецепторно-опосредованного ядерного импорта и ядерного экспорта». Рассмотрение. Трафик. 6 (3): 187–98. Дои:10.1111 / j.1600-0854.2005.00270.x. PMID 15702987. S2CID 172279.
- ^ а б c Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П., ред. (2002). «Глава 4: ДНК и хромосомы». Молекулярная биология клетки (4-е изд.). Нью-Йорк: Наука о гирляндах. С. 191–234. ISBN 978-0-8153-4072-0.
- ^ Стурман Н., Хайнс С., Эби Ю. (1998). «Ядерные ламины: их структура, сборка и взаимодействие». Рассмотрение. Журнал структурной биологии. 122 (1–2): 42–66. Дои:10.1006 / jsbi.1998.3987. PMID 9724605.
- ^ Голдман А.Е., Мойр Р.Д., Монтэг-Лоуи М., Стюарт М., Голдман Р.Д. (ноябрь 1992 г.). «Путь внедрения микроинъектированного ламина А в ядерную оболочку». Начальный. Журнал клеточной биологии. 119 (4): 725–35. Дои:10.1083 / jcb.119.4.725. ЧВК 2289687. PMID 1429833.
- ^ а б c d е Goldman RD, Gruenbaum Y, Moir RD, Shumaker DK, Spann TP (март 2002 г.). «Ядерные ламины: строительные блоки ядерной архитектуры». Рассмотрение. Гены и развитие. 16 (5): 533–47. Дои:10.1101 / gad.960502. PMID 11877373.
- ^ Броерс Дж. Л., Рамаекерс ФК (2004). «Динамика сборки и разборки ядерных пластин». Рассмотрение. Симпозиумы Общества экспериментальной биологии (56): 177–92. ISBN 9781134279838. PMID 15565881.
- ^ Мойр Р.Д., Юн М., Кхуон С., Голдман Р.Д. (декабрь 2000 г.). «Ядерные ламины A и B1: различные пути сборки во время формирования ядерной оболочки в живых клетках». Начальный. Журнал клеточной биологии. 151 (6): 1155–68. Дои:10.1083 / jcb.151.6.1155. ЧВК 2190592. PMID 11121432.
- ^ Spann TP, Goldman AE, Wang C, Huang S, Goldman RD (февраль 2002 г.). «Изменение организации ядерного ламина ингибирует зависимую от РНК-полимеразы II транскрипцию». Начальный. Журнал клеточной биологии. 156 (4): 603–8. Дои:10.1083 / jcb.200112047. ЧВК 2174089. PMID 11854306.
- ^ Маункес Л.К., Стюарт К.Л. (июнь 2004 г.). «Старение и ядерная организация: ламины и прогерия». Рассмотрение. Текущее мнение в области клеточной биологии. 16 (3): 322–7. Дои:10.1016 / j.ceb.2004.03.009. PMID 15145358.
- ^ Эренхофер-Мюррей AE (июнь 2004 г.). «Динамика хроматина при репликации, транскрипции и репарации ДНК». Рассмотрение. Европейский журнал биохимии. 271 (12): 2335–49. Дои:10.1111 / j.1432-1033.2004.04162.x. PMID 15182349.
- ^ Григорьев С.А., Булынко Ю.А., Попова Е.Ю. (2006). «Конец регулирует средства: ремоделирование гетерохроматина во время дифференцировки терминальных клеток». Рассмотрение. Хромосомные исследования. 14 (1): 53–69. Дои:10.1007 / s10577-005-1021-6. PMID 16506096. S2CID 6040822.
- ^ Шардин М., Кремер Т., Хагер HD, Ланг М. (декабрь 1985 г.). «Специфическое окрашивание хромосом человека в гибридных клеточных линиях китайского хомяка и человека демонстрирует интерфазные хромосомные территории» (PDF). Начальный. Генетика человека. 71 (4): 281–7. Дои:10.1007 / BF00388452. PMID 2416668. S2CID 9261461.
- ^ Ламонд А.И., Эрншоу WC (апрель 1998 г.). «Структура и функции в ядре» (PDF). Рассмотрение. Наука. 280 (5363): 547–53. CiteSeerX 10.1.1.323.5543. Дои:10.1126 / science.280.5363.547. PMID 9554838.
- ^ Курц А., Лэмпел С., Николенко Дж. Э., Брэдл Дж., Беннер А., Зирбель Р. М. и др. (Декабрь 1996 г.). «Активные и неактивные гены локализуются преимущественно на периферии хромосомных территорий». Начальный. Журнал клеточной биологии. 135 (5): 1195–205. Дои:10.1083 / jcb.135.5.1195. ЧВК 2121085. PMID 8947544. Архивировано из оригинал 29 сентября 2007 г.
- ^ Ротфилд Н.Ф., Столлар Б.Д. (ноябрь 1967 г.). «Отношение класса иммуноглобулинов, структуры антиядерных антител и комплемент-связывающих антител к ДНК в сыворотке крови пациентов с системной красной волчанкой». Начальный. Журнал клинических исследований. 46 (11): 1785–94. Дои:10.1172 / JCI105669. ЧВК 292929. PMID 4168731.
- ^ Барнед С., Гудман А.Д., Мэтсон Д.Х. (февраль 1995 г.). «Частота появления антиядерных антител при рассеянном склерозе». Начальный. Неврология. 45 (2): 384–5. Дои:10.1212 / WNL.45.2.384. PMID 7854544. S2CID 30482028.
- ^ Эрнандес-Верден Д. (январь 2006 г.). «Ядрышко: от структуры к динамике». Рассмотрение. Гистохимия и клеточная биология. 125 (1–2): 127–37. Дои:10.1007 / s00418-005-0046-4. PMID 16328431. S2CID 20769260.
- ^ а б Ламонд А.И., Слиман Дж. Э. (октябрь 2003 г.). «Ядерная субструктура и динамика». Рассмотрение. Текущая биология. 13 (21): R825-8. Дои:10.1016 / j.cub.2003.10.012. PMID 14588256. S2CID 16865665.
- ^ а б c Чиоче М., Ламонд А.И. (2005). «Тела Кахала: долгая история открытий». Рассмотрение. Ежегодный обзор клеточной биологии и биологии развития. 21: 105–31. Дои:10.1146 / annurev.cellbio.20.010403.103738. PMID 16212489. S2CID 8807316.
- ^ а б c d Лафарга М., Берчано М.Т., Пена Э., Майо И., Кастаньо Дж. Г., Боманн Д. и др. (Август 2002 г.). «Кластосома: подтип ядерного тела, обогащенный протеасомами 19S и 20S, убиквитином и белковыми субстратами протеасомы». Начальный. Молекулярная биология клетки. 13 (8): 2771–82. CiteSeerX 10.1.1.321.6138. Дои:10.1091 / mbc.e02-03-0122. ЧВК 117941. PMID 12181345.
- ^ а б c Поллард Т.Д., Эрншоу В.К. (2004). Клеточная биология. Филадельфия: Сондерс. ISBN 978-0-7216-3360-2.
- ^ а б c Дундр М., Мистели Т. (июнь 2001 г.). «Функциональная архитектура в ядре клетки». Рассмотрение. Биохимический журнал. 356 (Pt 2): 297–310. Дои:10.1042/0264-6021:3560297. ЧВК 1221839. PMID 11368755.
- ^ Bond CS, Fox AH (сентябрь 2009 г.). «Параспеклы: ядерные тела, построенные на длинной некодирующей РНК». Рассмотрение. Журнал клеточной биологии. 186 (5): 637–44. Дои:10.1083 / jcb.200906113. ЧВК 2742191. PMID 19720872.
- ^ Goebel HH, Warlo I (январь 1997 г.). «Немалиновая миопатия с внутриядерными стержнями - миопатия внутриядерных стержней». Рассмотрение. Нервно-мышечные расстройства. 7 (1): 13–9. Дои:10.1016 / S0960-8966 (96) 00404-X. PMID 9132135. S2CID 29584217.
- ^ а б c Матера А.Г., Фрей М.Р. (август 1998 г.). "Скрученные тела и драгоценные камни: Янус или близнецы?". Рассмотрение. Американский журнал генетики человека. 63 (2): 317–21. Дои:10.1086/301992. ЧВК 1377332. PMID 9683623.
- ^ Matera AG (август 1998 г.). «Из свернутых кольцами тел, драгоценных камней и лосося». Рассмотрение. Журнал клеточной биохимии. 70 (2): 181–92. Дои:10.1002 / (sici) 1097-4644 (19980801) 70: 2 <181 :: aid-jcb4> 3.0.co; 2-k. PMID 9671224.
- ^ Saunders WS, Cooke CA, Earnshaw WC (ноябрь 1991 г.). «Компартментализация внутри ядра: открытие нового субядерного региона». Начальный. Журнал клеточной биологии. 115 (4): 919–31. Дои:10.1083 / jcb.115.4.919. ЧВК 2289954. PMID 1955462.
- ^ Помбо А., Куэлло П., Шул В., Юн Дж. Б., Рёдер Р. Г., Кук PR, Мерфи С. (март 1998 г.). «Региональная и временная специализация в ядре: транскрипционно-активный ядерный домен, богатый антигенами PTF, Oct1 и PIKA, связывается со специфическими хромосомами в начале клеточного цикла». Начальный. Журнал EMBO. 17 (6): 1768–78. Дои:10.1093 / emboj / 17.6.1768. ЧВК 1170524. PMID 9501098.
- ^ Зимбер А., Нгуен К. Д., Геспах С. (октябрь 2004 г.). «Ядерные тела и компартменты: функциональные роли и клеточная передача сигналов в здоровье и болезни». Рассмотрение. Сотовая связь. 16 (10): 1085–104. Дои:10.1016 / j.cellsig.2004.03.020. PMID 15240004.
- ^ Lallemand-Breitenbach V, de Thé H (май 2010 г.). «Ядерные тела ПМЛ». Рассмотрение. Перспективы Колд-Спринг-Харбор в биологии. 2 (5): a000661. Дои:10.1101 / cshperspect.a000661. ЧВК 2857171. PMID 20452955.
- ^ а б Ламонд А.И., Спектор Д.Л. (август 2003 г.). «Ядерные спеклы: модель ядерных органелл». Рассмотрение. Обзоры природы. Молекулярная клеточная биология. 4 (8): 605–12. Дои:10.1038 / nrm1172. PMID 12923522. S2CID 6439413.
- ^ Трипати К., Парнаик В.К. (сентябрь 2008 г.). «Дифференциальная динамика фактора сплайсинга SC35 во время клеточного цикла» (PDF). Начальный. Журнал биологических наук. 33 (3): 345–54. Дои:10.1007 / s12038-008-0054-3. PMID 19005234. S2CID 6332495. В архиве (PDF) из оригинала 15 ноября 2011 г.
- ^ Трипати К., Парнаик В.К. (сентябрь 2008 г.). «Дифференциальная динамика фактора сплайсинга SC35 во время клеточного цикла». Начальный. Журнал биологических наук. 33 (3): 345–54. Дои:10.1007 / s12038-008-0054-3. PMID 19005234. S2CID 6332495.
- ^ Хандвергер К.Э., Галл Дж. Г. (январь 2006 г.). «Субъядерные органеллы: новое понимание формы и функции». Рассмотрение. Тенденции в клеточной биологии. 16 (1): 19–26. Дои:10.1016 / j.tcb.2005.11.005. PMID 16325406.
- ^ «Клеточный компонент Ядро спекл». UniProt: UniProtKB. Получено 30 августа 2013.
- ^ Галл Дж. Г., Беллини М., Ву З., Мерфи С. (декабрь 1999 г.). «Сборка оборудования для ядерной транскрипции и обработки: тельца Кахаля (спиральные тела) и транскриптосомы». Начальный. Молекулярная биология клетки. 10 (12): 4385–402. Дои:10.1091 / mbc.10.12.4385. ЧВК 25765. PMID 10588665.
- ^ а б Матера А.Г., Тернс Р.М., Тернс МП (март 2007 г.). «Некодирующие РНК: уроки малых ядерных и малых ядрышковых РНК». Рассмотрение. Обзоры природы. Молекулярная клеточная биология. 8 (3): 209–20. Дои:10.1038 / nrm2124. PMID 17318225. S2CID 30268055.
- ^ а б Фокс А. Х., Ламонд А. И. (июль 2010 г.). "Параспеклы". Рассмотрение. Перспективы Колд-Спринг-Харбор в биологии. 2 (7): a000687. Дои:10.1101 / cshperspect.a000687. ЧВК 2890200. PMID 20573717.
- ^ а б Фокс А., Бикмор В. (2004). «Ядерные отсеки: Парашюты». База данных ядерных белков. Архивировано из оригинал 10 сентября 2008 г.. Получено 6 марта 2007.
- ^ а б Фокс А.Х., Бонд С.С., Ламонд А.И. (ноябрь 2005 г.). «P54nrb образует гетеродимер с PSP1, который локализуется в параспеклах РНК-зависимым образом». Начальный. Молекулярная биология клетки. 16 (11): 5304–15. Дои:10.1091 / mbc.E05-06-0587. ЧВК 1266428. PMID 16148043.
- ^ Накагава С., Ямадзаки Т., Хиросе Т. (октябрь 2018 г.). «Молекулярное вскрытие ядерных парашютов: к пониманию развивающегося мира среды RNP». Рассмотрение. Открытая биология. 8 (10): 180150. Дои:10.1098 / рсоб.180150. ЧВК 6223218. PMID 30355755.
- ^ Пизани Г., барон Б. (декабрь 2019 г.). «Ядерные парашюты играют роль посредника в регуляции генов и в путях апоптоза». Рассмотрение. Исследование некодирующей РНК. 4 (4): 128–134. Дои:10.1016 / j.ncrna.2019.11.002. ЧВК 7012776. PMID 32072080.
- ^ Kong XN, Yan HX, Chen L, Dong LW, Yang W, Liu Q и др. (Октябрь 2007 г.). «LPS-индуцированное подавление сигнального регуляторного белка {альфа} способствует активации врожденного иммунитета в макрофагах». Начальный. Журнал экспериментальной медицины. 204 (11): 2719–31. Дои:10.1084 / jem.20062611. ЧВК 2118489. PMID 17954568.
- ^ а б Кармо-Фонсека М, Берчиано МТ, Лафарга М (сентябрь 2010 г.). «Орфанные ядерные тела». Рассмотрение. Перспективы Колд-Спринг-Харбор в биологии. 2 (9): a000703. Дои:10.1101 / cshperspect.a000703. ЧВК 2926751. PMID 20610547.
- ^ Сампуда К.М., Райли М., Бойд Л. (апрель 2017 г.). «Вызванные стрессом ядерные гранулы образуются в ответ на накопление неправильно свернутых белков у Caenorhabditis elegans». Начальный. BMC Cell Biology. 18 (1): 18. Дои:10.1186 / с12860-017-0136-х. ЧВК 5395811. PMID 28424053.
- ^ Ленингер А.Л., Нельсон Д.Л., Кокс М.М. (2000). Принципы биохимии Ленингера (3-е изд.). Нью-Йорк: Worth Publishers. ISBN 978-1-57259-931-4.
- ^ Морено Ф., Ауаци Д., Риера А., Паломино, Калифорния, Эрреро П. (февраль 2005 г.). «Чувствительность к глюкозе через Hxk2-зависимый сигнальный путь». Начальный. Сделки Биохимического Общества. 33 (Пт 1): 265–8. Дои:10.1042 / BST0330265. PMID 15667322. S2CID 20647022.
- ^ Герлих Д., Кутай Ю. (1999). «Транспорт между ядром клетки и цитоплазмой». Рассмотрение. Ежегодный обзор клеточной биологии и биологии развития. 15 (1): 607–60. Дои:10.1146 / annurev.cellbio.15.1.607. PMID 10611974.
- ^ Хозак П., Cook PR (февраль 1994 г.). «Фабрики репликации». Рассмотрение. Тенденции в клеточной биологии. 4 (2): 48–52. Дои:10.1016/0962-8924(94)90009-4. PMID 14731866.
- ^ Нирхаус К. Х., Уилсон Д. Н. (2004). Синтез белков и структура рибосом: трансляция генома. Wiley-VCH. ISBN 978-3-527-30638-1.
- ^ Николини CA (1997). Структура и функции генома: от характеристики хромосом до генной технологии. Springer. ISBN 978-0-7923-4565-7.
- ^ Черный DL (2003). «Механизмы альтернативного сплайсинга пре-мессенджерных РНК» (PDF). Рассмотрение. Ежегодный обзор биохимии. 72 (1): 291–336. Дои:10.1146 / annurev.biochem.72.121801.161720. PMID 12626338.
- ^ Уотсон Дж. Д., Бейкер Т. А., Белл С. П., Ганн А., Левин М., Лосик Р. (2004). «Ч9–10». Молекулярная биология гена (5-е изд.). Писон Бенджамин Каммингс; CSHL Press. ISBN 978-0-8053-9603-4.
- ^ Cavazza T, Vernos I (2015). «Путь RanGTP: от ядерно-цитоплазматического транспорта к сборке веретена и не только». Рассмотрение. Границы клеточной биологии и биологии развития. 3: 82. Дои:10.3389 / fcell.2015.00082. ЧВК 4707252. PMID 26793706.
- ^ Lippincott-Schwartz J (март 2002 г.). «Клеточная биология: разрыв ядерной оболочки». Комментарий. Природа. 416 (6876): 31–2. Bibcode:2002Натура 416 ... 31л. Дои:10.1038 / 416031a. PMID 11882878. S2CID 4431000.
- ^ а б Буликас Т (1995). «Фосфорилирование факторов транскрипции и контроль клеточного цикла». Рассмотрение. Критические обзоры экспрессии эукариотических генов. 5 (1): 1–77. PMID 7549180.
- ^ Бетчер Б., Баррал И. (2013). «Клеточная биология открытого и закрытого митоза». Рассмотрение. Ядро. Остин, Техас. 4 (3): 160–5. Дои:10.4161 / nucl.24676. ЧВК 3720745. PMID 23644379.
- ^ Стин Р.Л., Коллас П. (апрель 2001 г.). «Неверное нацеливание ламинов B-типа в конце митоза: последствия для выживания клеток и регуляции экспрессии ламинов A / C». Начальный. Журнал клеточной биологии. 153 (3): 621–6. Дои:10.1083 / jcb.153.3.621. ЧВК 2190567. PMID 11331311.
- ^ Бём I (ноябрь 2007 г.). «Отложения IgG могут быть обнаружены в ядрах клеток пациентов с красной волчанкой и злокачественными новообразованиями». Начальный. Клиническая ревматология. 26 (11): 1877–82. Дои:10.1007 / s10067-007-0597-у. PMID 17364135. S2CID 44879431.
- ^ Рессель Л. (2017). «Ядерная морфология». Нормальная морфология клеток в цитологии собак и кошек: руководство по идентификации. Хобокен, Нью-Джерси: Джон Уайли и сыновья. п. 6. ISBN 978-1-119-27891-7.
- ^ Скутельский Э., Данон Д. (июнь 1970 г.). «Сравнительное исследование ядерного изгнания из позднего эритробласта и цитокинеза». Начальный. Экспериментальные исследования клеток. 60 (3): 427–36. Дои:10.1016/0014-4827(70)90536-7. PMID 5422968.
- ^ Тороус Д.К., Дертингер С.Д., Холл Н.Е., Томецко С.Р. (февраль 2000 г.). «Подсчет микроядерных ретикулоцитов в периферической крови крыс: исследование проточной цитометрии». Начальный. Мутационные исследования. 465 (1–2): 91–9. Дои:10.1016 / S1383-5718 (99) 00216-8. PMID 10708974.
- ^ Hutter KJ, Stöhr M (1982). «Быстрое обнаружение мутаген-индуцированных микроядерных эритроцитов с помощью проточной цитометрии». Начальный. Гистохимия. 75 (3): 353–62. Дои:10.1007 / bf00496738. PMID 7141888. S2CID 28973947.
- ^ Хэм Б.К., Лукас В.Дж. (апрель 2014 г.). «Решетчатая система флоэмы покрытосеменных растений: роль в передаче признаков, важных для современного сельского хозяйства». Журнал экспериментальной ботаники. 65 (7): 1799–816. Дои:10.1093 / jxb / ert417. PMID 24368503.
- ^ Зеттлер Л.А., Согин М.Л., Карон Д.А. (октябрь 1997 г.). «Филогенетические отношения между Acantharea и Polycystinea: молекулярная перспектива радиолярии Геккеля». Начальный. Труды Национальной академии наук Соединенных Штатов Америки. 94 (21): 11411–6. Bibcode:1997PNAS ... 9411411A. Дои:10.1073 / пнас.94.21.11411. ЧВК 23483. PMID 9326623.
- ^ Хортон TR (2006). «Число ядер в базидиоспорах 63 видов эктомикоризных Homobasidiomycetes». Начальный. Микология. 98 (2): 233–8. Дои:10.3852 / mycologia.98.2.233. PMID 16894968.
- ^ Адам Р.Д. (декабрь 1991 г.). «Биология Giardia spp». Рассмотрение. Микробиологические обзоры. 55 (4): 706–32. Дои:10.1128 / MMBR.55.4.706-732.1991. ЧВК 372844. PMID 1779932.
- ^ Фогт А., Гольдман А.Д., Мочизуки К., Ландвебер Л.Ф. (1 августа 2013 г.). «Одомашнивание транспозона против мутуализма в перестройке генома ресничек». PLOS Genetics. 9 (8): e1003659. Дои:10.1371 / journal.pgen.1003659. ЧВК 3731211. PMID 23935529.
- ^ Макиннес А., Ренник Д.М. (февраль 1988 г.). «Интерлейкин 4 побуждает культивируемые моноциты / макрофаги образовывать гигантские многоядерные клетки». Начальный. Журнал экспериментальной медицины. 167 (2): 598–611. Дои:10.1084 / jem.167.2.598. ЧВК 2188835. PMID 3258008.
- ^ Goldring SR, Roelke MS, Petrison KK, Bhan AK (февраль 1987 г.). «Человеческие гигантоклеточные опухоли кости, идентификация и характеристика типов клеток». Начальный. Журнал клинических исследований. 79 (2): 483–91. Дои:10.1172 / JCI112838. ЧВК 424109. PMID 3027126.
- ^ Иманян Б., Помберт Дж. Ф., Доррелл Р. Г., Бурки Ф., Килинг П. Дж. (2012). «Третичный эндосимбиоз у двух динотомов вызвал незначительные изменения в митохондриальных геномах их динофлагеллят-хозяев и эндосимбионтов диатомовых водорослей». Начальный. PLOS ONE. 7 (8): e43763. Bibcode:2012PLoSO ... 743763I. Дои:10.1371 / journal.pone.0043763. ЧВК 3423374. PMID 22916303.
- ^ Pennisi E (август 2004 г.). «Эволюционная биология. Рождение ядра». Новости. Наука. 305 (5685): 766–8. Дои:10.1126 / science.305.5685.766. PMID 15297641. S2CID 83769250.
- ^ Девос Д.П., Грэф Р., Полевой МС (июнь 2014 г.). «Эволюция ядра». Рассмотрение. Текущее мнение в области клеточной биологии. 28: 8–15. Дои:10.1016 / j.ceb.2014.01.004. ЧВК 4071446. PMID 24508984.
- ^ Лопес-Гарсия П., Морейра Д. (ноябрь 2015 г.). «Открытые вопросы о происхождении эукариот». Рассмотрение. Тенденции в экологии и эволюции. 30 (11): 697–708. Дои:10.1016 / j.tree.2015.09.005. ЧВК 4640172. PMID 26455774.
- ^ Хоган CM (2010). «Архея». В Monosson E, Cleveland C (ред.). Энциклопедия Земли. Вашингтон, округ Колумбия: Национальный совет по науке и окружающей среде. Архивировано из оригинал 11 мая 2011 г.
- ^ Маргулис Л (1981). Симбиоз в эволюции клетки. Сан-Франциско: У. Х. Фриман и компания. стр.206–227. ISBN 978-0-7167-1256-5.
- ^ Лопес-Гарсия П., Морейра Д. (май 2006 г.). «Селективные силы для происхождения эукариотического ядра». Рассмотрение. BioEssays. 28 (5): 525–33. Дои:10.1002 / bies.20413. PMID 16615090.
- ^ Фуэрст Дж. А. (2005). «Внутриклеточная компартментация у планктомицетов». Рассмотрение. Ежегодный обзор микробиологии. 59: 299–328. Дои:10.1146 / annurev.micro.59.030804.121258. PMID 15910279.
- ^ Хартман Х., Федоров А (февраль 2002 г.). «Происхождение эукариотической клетки: геномное исследование». Начальный. Труды Национальной академии наук Соединенных Штатов Америки. 99 (3): 1420–5. Bibcode:2002PNAS ... 99.1420H. Дои:10.1073 / pnas.032658599. ЧВК 122206. PMID 11805300.
- ^ Белл PJ (сентябрь 2001 г.). «Вирусный эукариогенез: был ли предком ядра сложный ДНК-вирус?». Комментарий. Журнал молекулярной эволюции. 53 (3): 251–6. Bibcode:2001JMolE..53..251L. Дои:10.1007 / s002390010215. PMID 11523012. S2CID 20542871.
- ^ Такемура М (май 2001 г.). «Поксвирусы и происхождение ядра эукариот». Начальный. Журнал молекулярной эволюции. 52 (5): 419–25. Bibcode:2001JMolE..52..419T. Дои:10.1007 / s002390010171. PMID 11443345. S2CID 21200827.
- ^ Вильярреал LP, DeFilippis VR (август 2000 г.). «Гипотеза ДНК-вирусов как источника белков репликации эукариот». Начальный. Журнал вирусологии. 74 (15): 7079–84. Дои:10.1128 / JVI.74.15.7079-7084.2000. ЧВК 112226. PMID 10888648.
- ^ Белл П.Дж. (ноябрь 2006 г.). «Пол и эукариотический клеточный цикл соответствуют вирусному происхождению эукариотического ядра». Начальный. Журнал теоретической биологии. 243 (1): 54–63. Дои:10.1016 / j.jtbi.2006.05.015. PMID 16846615.
- ^ де Роос А.Д. (2006). «Происхождение эукариотической клетки на основе сохранения существующих интерфейсов». Начальный. Искусственная жизнь. 12 (4): 513–23. Дои:10.1162 / artl.2006.12.4.513. PMID 16953783. S2CID 5963228.
- ^ Ван Левенгук А. Opera Omnia, seu Arcana Naturae ope Exactissimorum Microscopiorum detecta, Experimentis Variis comprobata, Epistolis ad varios illustres viros J. Arnold et Delphis, A. Beman, Lugdinum Batavorum [Труды природы или тайны природы с помощью микроскопов precisionissimorum были обнаружены и подтверждены множеством экспериментов, Послания к различным прославленным людям доблести Дж. Арнольд и Дельфи, А. Беман, Лугдина Йорк 1719-1730 гг.] (на латыни). Цитируется в Герлах Д. (2009). Geschichte der Mikroskopie. Франкфурт-на-Майне, Германия: Верлаг Харри Дойч. ISBN 978-3-8171-1781-9.
- ^ Коэн WD (1982). «Цитоморфная система безъядерных эритроцитов не млекопитающих». Протоплазма. 113: 23–32. Дои:10.1007 / BF01283036. S2CID 41287948.
- ^ Харрис Х (1999). Рождение клетки. Нью-Хейвен: Издательство Йельского университета. ISBN 978-0-300-07384-3.
- ^ Браун Р. (1866 г.). «Об органах и способе оплодотворения орхидексов и асклепиадей». Разные ботанические работы I: 511–514.
- ^ а б Кремер Т. (1985). Von der Zellenlehre zur Chromosomentheorie. Берлин, Гейдельберг, Нью-Йорк, Токио: Springer Verlag. ISBN 978-3-540-13987-4. Онлайн-версия здесь
дальнейшее чтение
- Goldman RD, Gruenbaum Y, Moir RD, Shumaker DK, Spann TP (март 2002 г.). «Ядерные ламины: строительные блоки ядерной архитектуры». Гены и развитие. 16 (5): 533–47. Дои:10.1101 / gad.960502. PMID 11877373.
- Обзорная статья о ядерных ламинах, объясняющая их структуру и различные роли
- Герлих Д., Кутай Ю. (1999). «Транспорт между ядром клетки и цитоплазмой». Ежегодный обзор клеточной биологии и биологии развития. 15: 607–60. Дои:10.1146 / annurev.cellbio.15.1.607. PMID 10611974.
- Обзорная статья о ядерном транспорте, объясняет принципы механизма и различные пути переноса.
- Ламонд А.И., Эрншоу WC (апрель 1998 г.). «Структура и функции в ядре» (PDF). Наука. 280 (5363): 547–53. CiteSeerX 10.1.1.323.5543. Дои:10.1126 / science.280.5363.547. PMID 9554838.
- Обзорная статья о ядре, объясняющая структуру хромосом внутри органеллы и описывающая ядрышко и другие субъядерные тела.
- Pennisi E (август 2004 г.). «Эволюционная биология. Рождение ядра». Наука. 305 (5685): 766–8. Дои:10.1126 / science.305.5685.766. PMID 15297641. S2CID 83769250.
- Обзорная статья об эволюции ядра, объясняющая ряд различных теорий.
- Поллард Т.Д., Эрншоу В.К. (2004). Клеточная биология. Филадельфия: Сондерс. ISBN 978-0-7216-3360-2.
- Учебник университетского уровня по клеточной биологии. Содержит информацию о структуре и функциях ядра, включая ядерный транспорт и субъядерные домены.
внешняя ссылка
| Библиотечные ресурсы о Ядро клетки |
- "Ядро". MBInfo.
- «Узнайте о клеточном ядре». cellnucleus.com. Веб-сайт, посвященный структуре и функциям ядра, факультета онкологии Университета Альберты.
- Бикмор В. «База данных ядерных белков». Отдел генетических исследований человека Совета медицинских исследований. Информация о ядерных компонентах.
- "Коллекция Ядра". Библиотека изображений и видео. Американское общество клеточной биологии. Архивировано из оригинал 12 ноября 2006 г. содержит рецензируемые неподвижные изображения и видеоклипы, иллюстрирующие ядро.
- Галл Дж. Дж., Макинтош Дж. Р. (ред.). «Секция ядерной оболочки и ядерного импорта». Основные статьи по клеточной биологии. Архивировано из оригинал 17 ноября 2006 г. содержит оцифрованные комментарии и ссылки на основополагающие исследовательские работы по ядру. Опубликовано в Интернете в Библиотека изображений и видео из Американское общество клеточной биологии
- «Цитоплазматические паттерны, генерируемые человеческими антителами». AntibodyPatterns.com. Архивировано из оригинал 2 января 2007 г.