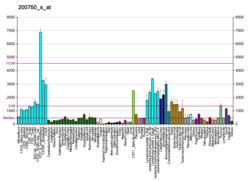
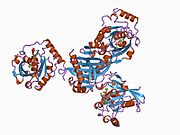
Ран (белок) - Ran (protein)
Ран (РАs-связанный Nядерный белок), также известный как GTP-связывающий ядерный белок Ran это белок что у людей кодируется RAN ген. Ran - это небольшой белок размером 25 кДа, который участвует в транспорте внутрь и наружу. ядро клетки в течение межфазный а также участвует в митоз. Он является членом Рас надсемейство.[5][6][7]
Ран - это маленький белок G что важно для транслокации РНК и белков через ядерный поровый комплекс. Белок Ran также участвует в контроле синтеза ДНК и развития клеточного цикла, поскольку мутации в Ran нарушают синтез ДНК.[8]
Функция
Выполнить цикл

Ран существует в клетке в двух нуклеотидно-связанных формах: ВВП -связанный и GTP -граница. RanGDP преобразуется в RanGTP под действием RCC1, то фактор обмена нуклеотидов для Ран. RCC1 также известен как RanGEF (фактор обмена нуклеотидов Ran Guanine). Рана присуща GTPase -активность активируется через взаимодействие с Ран Белок, активирующий ГТФазу (RanGAP), чему способствует образование комплекса с Ran-связывающим белком (RanBP). Активация GTPase приводит к превращению RanGTP в RanGDP, тем самым замыкая цикл Ran.
Ran может свободно диффундировать внутри клетки, но поскольку RCC1 и RanGAP расположены в разных местах клетки, концентрация RanGTP и RanGDP также различается локально, создавая градиенты концентрации, которые действуют как сигналы для других клеточных процессов. RCC1 привязан к хроматин и поэтому расположен внутри ядро. RanGAP - это цитоплазматический в дрожжах и связаны с ядерная оболочка у растений и животных. В клетках млекопитающих это СУМО модифицированы и прикреплены к цитоплазматической стороне ядерный поровый комплекс через взаимодействие с нуклеопорин РАНБП2 (Nup358). Это различие в расположении дополнительных белков в цикле Ran приводит к высокому соотношению RanGTP к RanGDP внутри ядра и обратно низкому отношению RanGTP к RanGDP вне ядра. В дополнение к градиенту состояния Ran, связанного с нуклеотидами, существует градиент самого белка с более высокой концентрацией Ran в ядре, чем в цитоплазме. Цитоплазматический RanGDP импортируется в ядро небольшим белком NUTF2 (Nuclear Transport Factor 2), где RCC1 может затем катализировать обмен GDP на GTP на Ran.
Роль в ядерном транспорте во время межфазной границы

Ран участвует в транспортировке белков через ядерную оболочку, взаимодействуя с кариоферины и изменение их способности связывать или высвобождать молекулы груза. Грузовые белки, содержащие сигнал ядерной локализации (NLS) связаны importins и транспортируется в ядро. Внутри ядра RanGTP связывается с importin и высвобождает импортный груз. Груз, который должен попасть из ядра в цитоплазму, связывается с экспорт в тройном комплексе с RanGTP. При гидролизе RanGTP до RanGDP вне ядра комплекс диссоциирует, и экспортный груз высвобождается.
Роль в митозе
Во время митоза цикл Ran участвует в митотическое веретено сборка и повторная сборка ядерной оболочки после разделения хромосом.[9][10] В течение профаза, крутой градиент отношения RanGTP-RanGDP в ядерных порах разрушается, поскольку ядерная оболочка становится негерметичной и разбирается. Концентрация RanGTP остается высокой около хромосомы как RCC1, фактор обмена нуклеотидов, остается прикрепленным к хроматин.[11] RanBP2 (Nup358) и RanGAP перемещаются в кинетохоры где они облегчают прикрепление волокон веретена к хромосомам. Более того, RanGTP способствует сборке веретена с помощью механизмов, аналогичных механизмам ядерного транспорта: активность факторов сборки веретена, таких как NuMA и TPX2 ингибируется связыванием с импортинами. Высвобождая импортины, RanGTP активирует эти факторы и, следовательно, способствует сборке митотическое веретено. В телофаза, Гидролиз RanGTP и обмен нуклеотидов необходимы для слияние пузырьков при реформировании ядерных оболочек дочерних ядер.
Ран и рецептор андрогенов
РАН - это рецептор андрогенов (AR) коактиватор (ARA24), который по-разному связывается с разными длинами полиглутамин внутри рецептора андрогенов. Экспансия полиглутаминовых повторов в AR связана с спинальная и бульбарная мышечная атрофия (Болезнь Кеннеди). RAN-коактивация AR уменьшается с расширением полиглутамина внутри AR, и эта слабая коактивация может привести к частичной нечувствительности к андрогенам во время развития спинальной и бульбарной мышечной атрофии.[12][13]
Взаимодействия
Ран был показан взаимодействовать с:
Регулирование
Выражение Рана - это подавленный посредством микроРНК miR-10a.[32]
Смотрите также
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000132341 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000029430 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Мур М.С., Блобель Г. (май 1994 г.). «G-белок, участвующий в ядерно-цитоплазматическом транспорте: роль Ran». Trends Biochem. Наука. 19 (5): 211–6. Дои:10.1016/0968-0004(94)90024-8. PMID 7519373.
- ^ Avis JM, Clarke PR (октябрь 1996 г.). «Ран, ГТФаза, участвующая в ядерных процессах: ее регуляторы и эффекторы». J. Cell Sci. 109 (10): 2423–7. PMID 8923203.
- ^ Дассо М., Пу RT (август 1998 г.). "Ядерный транспорт: управляет Ран?". Являюсь. J. Hum. Genet. 63 (2): 311–6. Дои:10.1086/301990. ЧВК 1377330. PMID 9683621.
- ^ Sazer S, Dasso M (апрель 2000 г.). «Бегущее десятиборье: несколько ролей Ран». J. Cell Sci. 113 (7): 1111–8. PMID 10704362.
- ^ Gruss OJ, Vernos I (сентябрь 2004 г.). «Механизм сборки шпинделя: функции Ран и его целевой TPX2». J. Cell Biol. 166 (7): 949–55. Дои:10.1083 / jcb.200312112. ЧВК 2172015. PMID 15452138.
- ^ Чичарелло М., Мангиакасале Р., Лавиа П. (август 2007 г.). «Пространственный контроль митоза с помощью GTPase Ran». Клетка. Мол. Life Sci. 64 (15): 1891–914. Дои:10.1007 / s00018-007-6568-2. PMID 17483873. S2CID 8687055.
- ^ Карасо-Салас Р. Э., Гуаргуаглини Г., Грусс О. Дж., Сегреф А., Карсенти Е., Маттай И. В. (июль 1999 г.). «Генерация GTP-связанной Ran с помощью RCC1 необходима для индуцированного хроматином образования митотического веретена». Природа. 400 (6740): 178–81. Bibcode:1999Натура 400..178С. Дои:10.1038/22133. PMID 10408446. S2CID 4417176.
- ^ Сяо П.В., Линь Д.Л., Накао Р., Чанг С. (июль 1999 г.). «Связь болезни нейронов Кеннеди с ARA24, первым идентифицированным коактиватором, связанным с полиглутаминовой областью рецептора андрогенов». J. Biol. Chem. 274 (29): 20229–34. Дои:10.1074 / jbc.274.29.20229. PMID 10400640.
- ^ Sampson ER, Yeh SY, Chang HC, Tsai MY, Wang X, Ting HJ, Chang C (2001). «Идентификация и характеристика корегуляторов, связанных с рецептором андрогенов в клетках рака простаты». J. Biol. Regul. Гомеост. Агенты. 15 (2): 123–9. PMID 11501969.
- ^ а б c Плафкер К., Макара И.Г. (2000). «Облегчение ядерно-цитоплазматического перемещения Ran-связывающего белка RanBP1». Мол. Клетка. Биол. 20 (10): 3510–21. Дои:10.1128 / MCB.20.10.3510-3521.2000. ЧВК 85643. PMID 10779340.
- ^ Кутай У., Изаурральде Э., Бишофф Ф.Р., Маттай И.В., Гёрлих Д. (1997). «Доминантно-отрицательные мутанты импортина-бета блокируют множественные пути импорта и экспорта через комплекс ядерных пор». EMBO J. 16 (6): 1153–63. Дои:10.1093 / emboj / 16.6.1153. ЧВК 1169714. PMID 9135132.
- ^ Percipalle P, Кларксон WD, Кент HM, Rhodes D, Stewart M (1997). «Молекулярные взаимодействия между гетеродимером импортина альфа / бета и белками, участвующими в импорте ядерного белка позвоночных». J. Mol. Биол. 266 (4): 722–32. Дои:10.1006 / jmbi.1996.0801. PMID 9102465.
- ^ Ройг Дж., Михайлов А., Белхам С., Авруч Дж. (2002). «Nercc1, киназа семейства NIMA млекопитающих, связывает Ran GTPase и регулирует митотическую прогрессию». Genes Dev. 16 (13): 1640–58. Дои:10.1101 / gad.972202. ЧВК 186374. PMID 12101123.
- ^ Cushman I, Bowman BR, Sowa ME, Lichtarge O, Quiocho FA, Moore MS (2004). «Вычислительная и биохимическая идентификация сайта связывания комплекса ядерной поры на носителе ядерного транспорта NTF2». J. Mol. Биол. 344 (2): 303–10. Дои:10.1016 / j.jmb.2004.09.043. PMID 15522285.
- ^ Стюарт М., Кент Х.М., Маккой А.Дж. (1998). «Структурная основа для молекулярного распознавания между ядерным транспортным фактором 2 (NTF2) и GDP-связанной формой Ras-семейства GTPase Ran». J. Mol. Биол. 277 (3): 635–46. Дои:10.1006 / jmbi.1997.1602. PMID 9533885.
- ^ а б Стеггерда С.М., Паскаль Б.М. (2000). «Белок Mog1 млекопитающих является фактором высвобождения гуаниновых нуклеотидов для Ran». J. Biol. Chem. 275 (30): 23175–80. Дои:10.1074 / jbc.C000252200. PMID 10811801.
- ^ а б Рен М., Вильямарин А., Ши А., Кутавас Э, Мур М. С., Локурцио М., Кларк В., Оппенгейм Д. Д., Д'Эстахио П., Раш М.Г. (1995). «Отдельные домены Ran GTPase взаимодействуют с различными факторами, регулируя импорт ядерного белка и процессинг РНК». Мол. Клетка. Биол. 15 (4): 2117–24. Дои:10.1128 / MCB.15.4.2117. ЧВК 230439. PMID 7891706.
- ^ Hillig RC, Renault L, Vetter IR, Drell T, Wittinghofer A, Becker J (1999). «Кристаллическая структура rna1p: новая складка для белка, активирующего GTPase». Мол. Клетка. 3 (6): 781–91. Дои:10.1016 / S1097-2765 (01) 80010-1. PMID 10394366.
- ^ Becker J, Melchior F, Gerke V, Bischoff FR, Ponstingl H, Wittinghofer A (1995). «РНК1 кодирует активирующий ГТФазу белок, специфичный для Gsp1p, гомолога Ran / TC4 Saccharomyces cerevisiae». J. Biol. Chem. 270 (20): 11860–5. Дои:10.1074 / jbc.270.20.11860. PMID 7744835.
- ^ Bischoff FR, Klebe C, Kretschmer J, Wittinghofer A, Ponstingl H (1994). «RanGAP1 индуцирует ГТФазную активность ядерного Ras-родственного Ran». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 91 (7): 2587–91. Bibcode:1994PNAS ... 91.2587B. Дои:10.1073 / pnas.91.7.2587. ЧВК 43414. PMID 8146159.
- ^ Рено Л., Кульман Дж., Хенкель А., Виттинггофер А. (2001). «Структурные основы обмена гуаниновых нуклеотидов на Ran регулятором конденсации хромосом (RCC1)». Клетка. 105 (2): 245–55. Дои:10.1016 / S0092-8674 (01) 00315-4. PMID 11336674. S2CID 12827419.
- ^ Адзума Y, Рено Л., Гарсия-Ранеа Х.А., Валенсия А, Нисимото Т, Виттингхофер А (1999). «Модель взаимодействия ran-RCC1 с использованием биохимических и стыковочных экспериментов». J. Mol. Биол. 289 (4): 1119–30. Дои:10.1006 / jmbi.1999.2820. PMID 10369786.
- ^ Чук Ю.М., Блобель Г. (1999). «Структура ядерного транспортного комплекса кариоферин-бета2-Ran x GppNHp». Природа. 399 (6733): 230–7. Bibcode:1999Натура.399..230C. Дои:10.1038/20375. PMID 10353245. S2CID 4413233.
- ^ а б Шамшер МК, Плоски Дж., Раду А. (2002). «Кариоферин бета 2B участвует в экспорте мРНК из ядра». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 99 (22): 14195–9. Bibcode:2002PNAS ... 9914195S. Дои:10.1073 / pnas.212518199. ЧВК 137860. PMID 12384575.
- ^ Тикенброк Л., Крамер Дж., Веттер И.Р., Мюллер О. (2002). «Область спиральной спирали (аминокислоты 129-250) белка-супрессора опухолей аденоматозного полипоза кишечной палочки (APC). Его структура и его взаимодействие с областью поддержания хромосомы 1 (Crm-1)». J. Biol. Chem. 277 (35): 32332–8. Дои:10.1074 / jbc.M203990200. PMID 12070164.
- ^ Форнерод М, Оно М, Йошида М, Маттай И.В. (1997). «CRM1 - это рецептор экспорта для сигналов ядерного экспорта, богатых лейцином». Клетка. 90 (6): 1051–60. Дои:10.1016 / S0092-8674 (00) 80371-2. PMID 9323133. S2CID 15119502.
- ^ Браунуэлл AM, Макара И.Г. (2002). «Экспортин-5, новый кариоферин, опосредует ядерный экспорт двухцепочечных РНК-связывающих белков». J. Cell Biol. 156 (1): 53–64. Дои:10.1083 / jcb.200110082. ЧВК 2173575. PMID 11777942.
- ^ Ørom UA, Nielsen FC, Lund AH (2008). «MicroRNA-10a связывает 5'UTR мРНК рибосомного белка и усиливает их трансляцию». Mol Cell. 30 (4): 460–71. Дои:10.1016 / j.molcel.2008.05.001. PMID 18498749.
внешняя ссылка
- ран + GTP-связывание + белок в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Патель СС. «Анимация факторов ядерного переноса, включая Ран (1 из 2 страниц)». Анимация по ядерному транспорту. Получено 2008-06-12.
- Патель СС. «Анимация факторов ядерного переноса, включая Ран (2 из 2 страниц)». Анимация по ядерному транспорту. Получено 2008-06-12.