Нуклеопорин - Nucleoporin
| Нуклеопорин 133/155, N-концевой | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Этот домен имеет структуру бета-винта с 7 лопастями (PDB 1XKS). | |||||||||
| Идентификаторы | |||||||||
| Символ | Nucleoporin_N | ||||||||
| Pfam | PF08801 | ||||||||
| ИнтерПро | IPR014908 | ||||||||
| SCOP2 | 1XKS / Объем / СУПФАМ | ||||||||
| |||||||||
| Нуклеопорин 133/155, С-концевой (ACE2) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
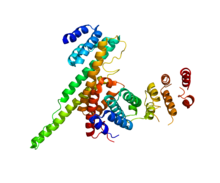 NUP133 (этот домен; справа) взаимодействует с NUP107 (PDB 3CQC). | |||||||||||
| Идентификаторы | |||||||||||
| Символ | Нуклеопорин_С | ||||||||||
| Pfam | PF03177 | ||||||||||
| ИнтерПро | IPR007187 | ||||||||||
| |||||||||||
| FG повтор | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | Nucleoporin_FG | ||||||||
| Pfam | PF13634 | ||||||||
| Pfam клан | CL0647 | ||||||||
| ИнтерПро | IPR025574 | ||||||||
| |||||||||
Нуклеопорины представляют собой семейство белков, которые являются составляющими строительными блоками ядерная пора комплекс (NPC).[1] В ядерный поровый комплекс массивная конструкция, встроенная в ядерная оболочка в местах слияния внутренней и внешней ядерных мембран, образуя ворота, которые регулируют поток макромолекулы между ядро клетки и цитоплазма. Ядерные поры обеспечивают пассивный и облегченный перенос молекул через ядерная оболочка. Нуклеопорины, семейство из около 30 белков, являются основными компонентами ядерная пора комплекс в эукариотический клетки. Нуклеопорин 62 - самый многочисленный член этого семейства.[2] Нуклеопорины способны переносить молекулы через ядерную оболочку с очень высокой скоростью. Один NPC может каждую минуту переносить 60 000 белковых молекул через ядерную оболочку.[3]
Функция
Нуклеопорины опосредуют транспорт макромолекулы между ядро клетки и цитоплазма в эукариоты. Некоторые члены семейства нуклеопоринов образуют структурную основу комплекса ядерных пор. Однако нуклеопорины в основном функционируют за счет взаимодействия с транспортными молекулами, известными как кариоферины, также известный как Kaps[4] Эти кариоферины взаимодействуют с нуклеопоринами, которые содержат повторяющиеся последовательности аминокислоты фенилаланин (F) и глицин (G) Пептидные повторы FG.[5] При этом кариоферины могут перемещать свой груз через ядерную оболочку. Нуклеопорины необходимы только для транспорта больших гидрофильных молекул с массой более 40 кДа, поскольку молекулы меньшего размера проходят через ядерные поры через пассивная диффузия. Нуклеопорины играют важную роль в транспорте мРНК из ядра в цитоплазму после транскрипция.[6] В зависимости от их функции определенные нуклеопорины локализуются либо на цитозольной, либо на нуклеоплазматической стороне комплекса ядерных пор. Другие нуклеопорины могут быть найдены с обеих сторон. Недавно было показано, что нуклеопорины FG имеют специфические эволюционно консервативные особенности, закодированные в их последовательностях, которые позволяют понять, как они регулируют транспорт молекул через ядерная пора комплекс (NPC).[7][8]
Структура
Нуклеопорины объединяются с образованием ядерный поровый комплекс, восьмиугольное кольцо, пересекающее ядерную оболочку. Кольцо состоит из восьми субкомплексов каркаса с двумя структурными слоями COPII -подобное покрытие, состоящее из нескольких белков, выстилающих поры. От цитоплазмы до нуклеоплазмы три слоя кольцевого комплекса называются кольцами цитоплазмы, внутренней поры и нуклеоплазмы соответственно. Различные наборы белков связываются с любым кольцом, и некоторые трансмембранные белки закрепляют сборку на липидном бислое.[9]
В субкомплексе каркаса и цитоплазма, и кольца нуклеоплазмы состоят из Y-комплексов, белкового комплекса, построенного, среди прочего, из NUP133 и NUP107. На каждом конце каждого из восьми каркасов есть два Y-комплекса, добавляющих до 32 комплексов на пору.[9] Взаимосвязь кривизны мембраны ядерной поры с Y-комплексами может рассматриваться как аналогия образования почкующихся пузырьков, покрытых COPII.[3] Белки, выстилающие внутреннюю пору, составляют комплекс NUP62.[9]
На стороне нуклеоплазмы дополнительные белки, связанные с кольцом, образуют «ядерную корзину», комплекс, способный связывать нуклеопорин с ядерная пластинка и даже в определенные части генома.[9] Цитоплазматический конец менее развит, с восемью филаментами, выступающими в цитоплазму. Похоже, они не играют никакой роли в ядерном импорте.[10]
Мембранные нуклеопорины связаны как с каркасом, так и с ядерной мембраной. Некоторые из них, как GP210, пересечь всю мембрану, другие (например, NUP98 ) действуют как гвозди со структурными частями для облицовки, а также с частями, которые врезаются в мембрану.[9] Ранее считалось, что NUP98 является FG-нуклеопорином, пока не было продемонстрировано, что «FG» в нем имеет складку в виде спиральной спирали.[9]
Некоторые нуклеопорины содержат FG-повторы. Названный в честь фенилаланин и глицин, FG-повторы малы гидрофобный сегменты, которые разбивают длинные отрезки гидрофильный аминокислоты. Эти гибкие детали в разложенном виде или беспорядочный сегменты без фиксированной конструкции.[11] Они образуют массу цепочек, которые позволяют более мелким молекулам диффундировать, но исключают крупные гидрофильные макромолекулы. Эти большие молекулы способны пересекать ядерную пору, только если они сопровождаются сигнальной молекулой, которая временно взаимодействует с сегментом FG-повтора нуклеопорина. FG-нуклеопорины также содержат глобулярную часть, которая служит якорем для прикрепления к комплексу ядерных пор.[3]
Было показано, что нуклеопорины образуют различные субкомплексы друг с другом. Наиболее распространенным из этих комплексов является комплекс nup62, который представляет собой сборку, состоящую из NUP62, NUP58, NUP54 и NUP45.[12] Другой пример такого комплекса - комплекс Y (NUP107-160), состоящий из множества различных нуклеопоринов. Комплекс НУП107-160 локализован на кинетохоры и играет роль в митоз.[13]
Эволюция
Многие структурные нуклеопорины содержат соленоидные белковые домены, домены, состоящие из повторов, которые могут быть сложены вместе как объемные строительные блоки. Есть бета-винт домен, похожий на WD40 повторяет и, что еще более интересно, уникальные типы альфа соленоид (пучки спиралей) повторы, которые образуют собственный класс, наследственные коатомеры (ACE). На сегодняшний день идентифицировано два класса ACE. ACE1 - это 28-спиральный домен, обнаруженный во многих нуклеопротеинах каркаса, а также SEC31, компонент COPII. ACE2, показанный в информационном окне, обнаружен в дрожжах Nup157 / Nup170 (человеческий Nup155) и Nup133. В любом случае общие домены, как следует из их названий, указывают на общее происхождение как внутри нуклеопротеидов, так и между нуклеопротеинами и котамерами.[14]
Все живые эукариоты разделяют многие важные компоненты NPC, что указывает на то, что у их общего предка присутствует полный комплекс.[15]
Транспортный механизм
Нуклеопорины регулируют транспорт макромолекул через ядерная оболочка через взаимодействие с молекулами-переносчиками кариоферины. Кариоферины будут связываться со своим грузом и обратимо взаимодействовать с FG-повторами нуклеопоринов. Кариоферины и их груз передаются между FG-повторами, пока они не диффундируют вниз по градиенту их концентрации и через комплекс ядерных пор. Кариоферины могут служить импортин (транспортировка белков в ядро) или экспорт (транспортировка белков из ядра).[3] Кариоферины выпускают свой груз за счет Ран, а G протеин. Ran достаточно мал, чтобы диффундировать через ядерные поры вниз по градиенту концентрации, не взаимодействуя с нуклеопоринами. Ран будет привязан к GTP или ВВП и имеет способность изменять сродство кариоферина к своему грузу. Внутри ядра RanGTP заставляет импортин кариоферин изменять конформацию, позволяя высвобождать его груз. RanGTP также может связываться с экспортными кариоферинами и проходить через ядерную пору. Как только он достиг цитозоля, RanGTP может быть гидролизован до RanGDP, позволяя высвободить груз экспортина.[16]
Патология
Несколько заболеваний были связаны с патологиями нуклеопоринов, в частности сахарный диабет, первичный билиарный цирроз, болезнь Паркинсона и Болезнь Альцгеймера. Было показано, что сверхэкспрессия генов, кодирующих различные нуклеопорины, связана с образованием злокачественных опухолей. опухоли.
Было показано, что нуклеопорины очень чувствительны к глюкоза концентрация меняется. Поэтому у людей, страдающих диабетом, часто наблюдается повышенная гликозилирование нуклеопоринов, особенно нуклеопорин 62.[2]
Аутоиммунный такие условия как антитела против p62, которые ингибируют комплексы p62, связаны с первичный билиарный цирроз который разрушает желчные протоки печени.[12]
Снижение продукции комплекса p62 характерно для многих нейродегенеративные заболевания. Модификация промотора p62 путем окисления коррелирует с Болезнь Альцгеймера, болезнь Хантингтона, и болезнь Паркинсона среди других нейродегенеративных расстройств.[17]
Повышенное выражение NUP88 ген, который кодирует нуклеопорин 88, обычно встречается при предраковых дисплазиях и злокачественных новообразованиях. новообразования.[18]
Белок нуклеопорин аладин является составной частью ядерная пора сложный. Мутации в аладин ген несут ответственность за синдром тройного А, аутосомный рецессивный нейроэндокринологический болезнь. Мутантный аладин вызывает селективный отказ импорт ядерного белка и гиперчувствительность к окислительный стресс.[19] Импорт Ремонт ДНК белки апратаксин и ДНК-лигаза I выборочно снижается, и это может повысить уязвимость клетки ДНК к окислительному стрессу, вызванному ущерб которые вызывают гибель клеток.[19]
Примеры
Каждый отдельный нуклеопорин назван в соответствии с его молекулярной массой (в килодальтон ). Ниже приведены несколько примеров белков семейства нуклеопоринов:
- NUP35, NUP37, NUP43, NUP50
- NUP54, NUP62, NUP85, NUP88, NUP93, NUP98
- NUP107, NUP133, NUP153, NUP155, NUP160, NUP188
- NUP205, NUP210, NUP214
использованная литература
- ^ Doye V, Hurt E (июнь 1997 г.). «От нуклеопоринов до ядерно-поровых комплексов». Текущее мнение в области клеточной биологии. 9 (3): 401–11. Дои:10.1016 / S0955-0674 (97) 80014-2. PMID 9159086.
- ^ а б Хан И, О ES, Кудлоу Дж. Э. (август 2000 г.). «Реакция состояния O-связанной модификации N-ацетилглюкозамина белка ядерных пор p62 на внеклеточную концентрацию глюкозы». Биохимический журнал. 350, Пет. 1: 109–14. Дои:10.1042/0264-6021:3500109. ЧВК 1221231. PMID 10926833.
- ^ а б c d Лодиш Х (2013). Молекулярная клеточная биология (Седьмое изд.). Нью-Йорк: Worth Publ. ISBN 978-1-4292-3413-9.
- ^ Аллен Н.П., Патель С.С., Хуанг Л., Чолкли Р.Дж., Бурлингейм А., Лутцманн М., Hurt EC, Рексач М. (декабрь 2002 г.). «Расшифровка сетей белковых взаимодействий в комплексе ядерных пор». Молекулярная и клеточная протеомика. 1 (12): 930–46. Дои:10.1074 / mcp.t200012-mcp200. PMID 12543930.
- ^ Петерс Р. (2006). Введение в ядерно-цитоплазматический транспорт: молекулы и механизмы. Методы молекулярной биологии. 322. С. 235–58. Дои:10.1007/978-1-59745-000-3_17. PMID 16739728.
- ^ Марфори М., Минотт А., Эллис Дж. Дж., Мехди А. М., Сондерс Н. Ф., Курми П. М., Форвуд Дж. К., Боден М., Кобе Б. (сентябрь 2011 г.). «Молекулярная основа специфичности ядерного импорта и предсказания ядерной локализации». Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 1813 (9): 1562–77. Дои:10.1016 / j.bbamcr.2010.10.013. PMID 20977914.
- ^ Пейро М., Сохейлипур М., Ли Б.Л., Мофрад М.Р. (ноябрь 2015 г.). «Эволюционно сохраненные особенности последовательности регулируют формирование сети FG в центре ядерного порового комплекса». Научные отчеты. 5: 15795. Bibcode:2015НатСР ... 515795П. Дои:10.1038 / srep15795. ЧВК 4635341. PMID 26541386.
- ^ Андо Д., Колвин М., Рексач М., Гопинатан А. (2013-09-16). «Кластеризация физических мотивов внутри изначально неупорядоченных последовательностей нуклеопоринов выявляет универсальные функциональные особенности». PLOS ONE. 8 (9): e73831. Bibcode:2013PLoSO ... 873831A. Дои:10.1371 / journal.pone.0073831. ЧВК 3774778. PMID 24066078.
- ^ а б c d е ж Бек, Мартин; Hurt, Ed (21 декабря 2016 г.). «Ядерный поровый комплекс: понимание его функции через структурное понимание». Обзоры природы Молекулярная клеточная биология. 18 (2): 73–89. Дои:10.1038 / nrm.2016.147. PMID 27999437. S2CID 35394962. Получено 10 апреля 2019.
- ^ Вальтер, ТС; Пикерсгилл, HS; Кордес, ВК; Гольдберг, МВт; Аллен, Т. Д.; Mattaj, IW; Форнерод, М. (8 июля 2002 г.). «Цитоплазматические нити комплекса ядерной поры незаменимы для селективного импорта ядерного белка». Журнал клеточной биологии. 158 (1): 63–77. Дои:10.1083 / jcb.200202088. ЧВК 2173022. PMID 12105182.
- ^ Деннинг Д., Патель С., Уверский В., Финк А., Рексач М. (2003). «Нарушение в комплексе ядерной поры: области повторов FG нуклеопоринов изначально развернуты». Proc Natl Acad Sci USA. 100 (5): 2450–5. Bibcode:2003ПНАС..100.2450Д. Дои:10.1073 / pnas.0437902100. ЧВК 151361. PMID 12604785.
- ^ а б Миячи К., Хэнкинс Р.В., Мацусима Х., Кикучи Ф., Иномата Т, Хоригоме Т, Сибата М., Онодзука Й., Уэно Й, Хашимото Е., Хаяси Н., Сибуя А., Амаки С., Миякава Х (май 2003 г.). «Профиль и клиническое значение антител против ядерной оболочки, обнаруженных у пациентов с первичным билиарным циррозом: многоцентровое исследование». Журнал аутоиммунитета. 20 (3): 247–54. Дои:10.1016 / S0896-8411 (03) 00033-7. PMID 12753810.
- ^ Loïodice I, Alves A, Rabut G, Van Overbeek M, Ellenberg J, Sibarita JB, Doye V (июль 2004 г.). «Весь комплекс Nup107-160, включая трех новых членов, нацелен как единое целое на кинетохоры в митозе». Молекулярная биология клетки. 15 (7): 3333–44. Дои:10.1091 / mbc.E03-12-0878. ЧВК 452587. PMID 15146057.
- ^ Уиттл, младший; Schwartz, TU (9 октября 2009 г.). «Архитектурные нуклеопорины Nup157 / 170 и Nup133 структурно связаны и происходят от второго предкового элемента». Журнал биологической химии. 284 (41): 28442–52. Дои:10.1074 / jbc.M109.023580. ЧВК 2788893. PMID 19674973.
- ^ Neumann, N; Лундин, Д; Пул, AM (8 октября 2010 г.). «Сравнительное геномное свидетельство полного комплекса ядерных пор у последнего общего предка эукариот». PLOS ONE. 5 (10): e13241. Bibcode:2010PLoSO ... 513241N. Дои:10.1371 / journal.pone.0013241. ЧВК 2951903. PMID 20949036.
- ^ Avis JM, Clarke PR (октябрь 1996 г.). «Ран, ГТФаза, участвующая в ядерных процессах: ее регуляторы и эффекторы». Журнал клеточной науки. 109 (Pt 10): 2423–7. PMID 8923203.
- ^ Du Y, Wooten MC, Wooten MW (август 2009 г.). «Окислительное повреждение промоторной области SQSTM1 / p62 является общим для нейродегенеративного заболевания». Нейробиология болезней. 35 (2): 302–10. Дои:10.1016 / j.nbd.2009.05.015. ЧВК 2718328. PMID 19481605.
- ^ «Ген Entrez: нуклеопорин NUP88 88 кДа»
- ^ а б Хирано М., Фурия Й, Асаи Х, Ясуи А., Уэно С. (февраль 2006 г.). «ALADINI482S вызывает селективную недостаточность импорта ядерного белка и гиперчувствительность к окислительному стрессу при синдроме тройного А». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 103 (7): 2298–303. Bibcode:2006PNAS..103.2298H. Дои:10.1073 / pnas.0505598103. ЧВК 1413683. PMID 16467144.
внешние ссылки
- Нуклеопорин в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Нуклеопорин (Поиск InterPro)
