ДНК - DNA - Wikipedia


Дезоксирибонуклеиновая кислота (/dяˈɒksɪˌраɪбoʊНью-Джерсиuˌkляɪk,-ˌkлeɪ-/ (![]() Слушать);[1] ДНК) это молекула состоит из двух полинуклеотид цепи, которые наматываются друг на друга, образуя двойная спираль несущий генетический инструкции по развитию, функционированию, росту и воспроизведение из всех известных организмы и много вирусы. ДНК и рибонуклеиновая кислота (РНК) являются нуклеиновые кислоты. Наряду с белки, липиды и сложные углеводы (полисахариды ), нуклеиновые кислоты являются одним из четырех основных типов макромолекулы которые необходимы для всех известных форм жизнь.
Слушать);[1] ДНК) это молекула состоит из двух полинуклеотид цепи, которые наматываются друг на друга, образуя двойная спираль несущий генетический инструкции по развитию, функционированию, росту и воспроизведение из всех известных организмы и много вирусы. ДНК и рибонуклеиновая кислота (РНК) являются нуклеиновые кислоты. Наряду с белки, липиды и сложные углеводы (полисахариды ), нуклеиновые кислоты являются одним из четырех основных типов макромолекулы которые необходимы для всех известных форм жизнь.
Две цепи ДНК известны как полинуклеотиды поскольку они состоят из более простых мономерный единицы называются нуклеотиды.[2][3] Каждый нуклеотид состоит из одного из четырех азотсодержащий азотистые основания (цитозин [C], гуанин [ГРАММ], аденин [A] или тимин [T]), а сахар называется дезоксирибоза, а фосфатная группа. Нуклеотиды соединены друг с другом в цепочку посредством ковалентные связи (известная как фосфо-диэфирная связь) между сахаром одного нуклеотида и фосфатом следующего, что приводит к чередованию сахарно-фосфатный остов. Азотистые основания двух отдельных полинуклеотидных цепей связаны вместе, согласно базовая пара правила (A с T и C с G), с водородные связи сделать двухцепочечную ДНК. Дополнительные азотистые основания делятся на две группы: пиримидины и пурины. В ДНК пиримидины - это тимин и цитозин; пурины - это аденин и гуанин.
Обе нити двухцепочечной ДНК хранят одно и то же. биологическая информация. Эта информация воспроизведен как и когда две нити разделятся. Большая часть ДНК (более 98% у человека) некодирование, что означает, что эти разделы не служат шаблонами для белковые последовательности. Две цепи ДНК движутся в противоположных направлениях друг к другу и, таким образом, являются антипараллельный. К каждому сахару присоединен один из четырех типов азотистых оснований (неофициально, базы). Это последовательность из этих четырех азотистых оснований вдоль остова, который кодирует генетическую информацию. РНК нити создаются с использованием нитей ДНК в качестве шаблона в процессе, называемом транскрипция, где основания ДНК заменяются соответствующими основаниями, за исключением случая тимина (T), для которого РНК заменяет урацил (U).[4] Под генетический код, эти цепи РНК определяют последовательность аминокислоты внутри белков в процессе, называемом перевод.
Внутри эукариотических клеток ДНК организована в длинные структуры, называемые хромосомы. До типичного деление клеток эти хромосомы дублируются в процессе Репликация ДНК, обеспечивая полный набор хромосом для каждой дочерней клетки. Эукариотические организмы (животные, растения, грибы и протисты ) хранят большую часть своей ДНК внутри ядро клетки в качестве ядерная ДНК, а некоторые в митохондрии в качестве митохондриальная ДНК или в хлоропласты в качестве хлоропластная ДНК.[5] В отличие, прокариоты (бактерии и археи ) хранят свою ДНК только в цитоплазма, в круговые хромосомы. В хромосомах эукариот хроматин белки, такие как гистоны, сжать и организовать ДНК. Эти уплотняющие структуры направляют взаимодействия между ДНК и другими белками, помогая контролировать, какие части ДНК транскрибируются.
Характеристики

ДНК - это длинный полимер сделаны из повторяющихся единиц, называемых нуклеотиды, каждая из которых обычно обозначается одной буквой: A, T, C или G.[6][7] Структура ДНК динамична по длине, она способна скручиваться в узкие петли и другие формы.[8] У всех видов он состоит из двух спиральных цепей, связанных друг с другом посредством водородные связи. Обе цепи намотаны вокруг одной оси и имеют одинаковый шаг 34ангстремы (Å) (3,4нанометры ). Пара цепочек имеет радиус 10 ангстрем (1,0 нанометр).[9] Согласно другому исследованию, при измерении в другом растворе длина цепи ДНК составляла от 22 до 26 ангстрем (от 2,2 до 2,6 нанометров), а длина одной нуклеотидной единицы - 3,3 Å (0,33 нм).[10] Хотя каждый отдельный нуклеотид очень мал, полимер ДНК может быть очень большим и содержать сотни миллионов нуклеотидов, например, в хромосома 1. Хромосома 1 - самая большая человеческая хромосома около 220 миллионов пар оснований, и в распрямленном состоянии будет иметь длину 85 мм.[11]
ДНК обычно существует не как одна нить, а как пара нитей, которые крепко скреплены вместе.[9][12] Эти две длинные пряди наматываются друг на друга в форме двойная спираль. Нуклеотид содержит как сегмент позвоночник молекулы (которая удерживает цепь вместе) и азотистое основание (который взаимодействует с другой цепью ДНК в спирали). Нуклеарное основание, связанное с сахаром, называется нуклеозид, а основание, связанное с сахаром и одной или несколькими фосфатными группами, называется нуклеотид. А биополимер состоящий из нескольких связанных нуклеотидов (как в ДНК), называется полинуклеотид.[13]
Основа цепи ДНК состоит из чередующихся фосфат и сахар группы.[14] Сахар в ДНК 2-дезоксирибоза, который является пентоза (пять-углерод ) сахар. Сахара объединены фосфатными группами, которые образуют фосфодиэфирные связи между третьим и пятым углеродом атомы смежных сахарных колец. Они известны как 3'-конец (три простых конца), и 5'-конец (пять основных концевых) атомов углерода, причем основной символ используется для отличия этих атомов углерода от атомов основания, с которым дезоксирибоза образует гликозидная связь. Следовательно, любая цепь ДНК обычно имеет один конец, на котором есть фосфатная группа, присоединенная к 5'-углеродному углероду рибозы (5'-фосфорил), и другой конец, на котором есть свободная гидроксильная группа, присоединенная к 3'-углеродному атому рибозы. рибоза (3 'гидроксил). Ориентация атомов углерода 3 'и 5' вдоль сахарно-фосфатной цепи обеспечивает направленность (иногда называемая полярностью) каждой цепи ДНК. В двойная спираль нуклеиновой кислоты, направление нуклеотидов в одной цепи противоположно их направлению в другой цепи: цепи антипараллельный. Говорят, что асимметричные концы нитей ДНК имеют направленность пяти основных концов (5 ') и трех основных концов (3'), причем 5 'конец имеет концевую фосфатную группу, а 3' конец - концевую гидроксильную группу. Одно важное различие между ДНК и РНК сахар, при этом 2-дезоксирибоза в ДНК заменяется альтернативным пентозным сахаром рибоза в РНК.[12]
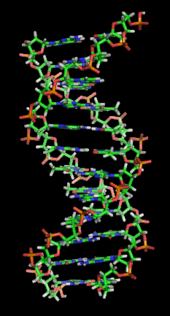
Двойная спираль ДНК стабилизируется в основном двумя силами: водородные связи между нуклеотидами и основание взаимодействие между ароматный азотистые основания.[16] Четыре основания, обнаруженные в ДНК: аденин (А), цитозин (С), гуанин (G) и тимин (Т). Эти четыре основания присоединены к сахарному фосфату с образованием полного нуклеотида, как показано для аденозинмонофосфат. Аденин соединяется с тимином, а гуанин - с цитозином, образуя A-T и G-C. пар оснований.[17][18]
Классификация нуклеооснований
Основания подразделяются на два типа: пурины, A и G, которые соединены пяти- и шестичленными гетероциклические соединения, а пиримидины, шестичленные кольца C и T.[12] Пятое пиримидиновое азотистое основание, урацил (U) обычно занимает место тимина в РНК и отличается от тимина отсутствием метильная группа на его кольце. Помимо РНК и ДНК, многие искусственные аналоги нуклеиновых кислот были созданы для изучения свойств нуклеиновых кислот или для использования в биотехнологии.[19]
Неканонические основы
Модифицированные основания встречаются в ДНК. Первым из них был признан 5-метилцитозин, который был найден в геном из Микобактерии туберкулеза в 1925 г.[20] Причина наличия этих неканонических оснований в бактериальных вирусах (бактериофаги ) заключается в том, чтобы избежать рестрикционные ферменты присутствует в бактериях. Эта ферментная система действует, по крайней мере, частично как молекулярная иммунная система, защищающая бактерии от заражения вирусами.[21] Модификации оснований цитозина и аденина, наиболее распространенных и модифицированных оснований ДНК, играют жизненно важную роль в эпигенетический контроль экспрессии генов у растений и животных.[22]
Список неканонических оснований, обнаруженных в ДНК
Известно, что в ДНК встречается ряд неканонических оснований.[23] Большинство из них являются модификациями канонических оснований плюс урацил.
- Изменено Аденозин
- N6-карбамоил-метиладенин
- N6-метиаденин
- Изменено Гуанин
- 7-деазагуанин
- 7-метилгуанин
- Изменено Цитозин
- N4-метилцитозин
- 5-карбоксилцитозин
- 5-формилцитозин
- 5-гликозилгидроксиметилцитозин
- 5-гидроксицитозин
- 5-метилцитозин
- Изменено Тимидин
- α-глутамитимидин
- α-Putrescinylthymine
- Урацил и модификации
- База J
- Урацил
- 5-дигидроксипентаурацил
- 5-гидроксиметилдезоксиурацил
- Другие
- Дезоксиархеозин
- 2,6-диаминопурин

Канавки
Двойные спиральные нити образуют основу ДНК. Другая двойная спираль может быть обнаружена в промежутках или канавках между прядями. Эти пустоты соседствуют с парами оснований и могут обеспечивать сайт привязки. Поскольку пряди не расположены симметрично относительно друг друга, канавки имеют неодинаковый размер. Одна канавка, большая канавка, равна 22ангстремы (Å), а другая, малая бороздка, имеет ширину 12 Å.[24] Ширина большой канавки означает, что края оснований более доступны в большой канавке, чем в малой канавке. В результате такие белки, как факторы транскрипции которые могут связываться с конкретными последовательностями в двухцепочечной ДНК, обычно контактируют со сторонами оснований, открытыми в большой бороздке.[25] Эта ситуация варьируется в необычных формах ДНК внутри клетки. (Смотри ниже), но большие и второстепенные бороздки всегда называются, чтобы отразить различия в размерах, которые можно было бы увидеть, если ДНК скрутить обратно в обычную B-форму.
Базовая пара
В двойной спирали ДНК каждый тип азотистых оснований на одной цепи связывается только с одним типом азотистых оснований на другой цепи. Это называется дополнительный базовая пара. Форма пуринов водородные связи к пиримидинам, причем аденин связывается только с тимином по двум водородным связям, а цитозин связывается только с гуанином по трем водородным связям. Такое расположение двух нуклеотидов, связывающихся вместе через двойную спираль, называется парой оснований Уотсона-Крика. ДНК с высоким GC-контент более стабильна, чем ДНК с низким содержанием GC. Пара оснований Хугстина - редкий вариант спаривания оснований.[26] Поскольку водородные связи не ковалентный, их можно относительно легко сломать и снова соединить. Таким образом, две нити ДНК в двойной спирали могут быть разорваны, как застежка-молния, под действием механической силы или большой силы. температура.[27] В результате такой комплементарности пар оснований вся информация в двухцепочечной последовательности спирали ДНК дублируется на каждой цепи, что жизненно важно для репликации ДНК. Это обратимое и специфическое взаимодействие между комплементарными парами оснований имеет решающее значение для всех функций ДНК в организмах.[7]
 |
 |
Как отмечалось выше, большинство молекул ДНК на самом деле представляют собой две полимерные нити, спирально связанные нековалентными связями; этот двухцепочечный (дцДНК) структура поддерживается в основном за счет взаимодействий при укладке оснований внутри нитей, которые наиболее сильны для стеков G, C. Две цепи могут разделиться - процесс, известный как плавление - с образованием двух одноцепочечных ДНК (оцДНК) молекул. Плавление происходит при высокой температуре, низком содержании соли и высоком pH (низкий pH также плавит ДНК, но поскольку ДНК нестабильна из-за кислотной депуринизации, низкий pH используется редко).
Стабильность формы дцДНК зависит не только от содержания GC (% пар оснований G, C), но также от последовательности (поскольку укладка зависит от последовательности), а также длины (более длинные молекулы более стабильны). Стабильность можно измерить разными способами; распространенным способом является «температура плавления», которая представляет собой температуру, при которой 50% молекул ds превращаются в молекулы ss; температура плавления зависит от ионной силы и концентрации ДНК. В результате как процент пар оснований GC, так и общая длина двойной спирали ДНК определяют силу ассоциации между двумя цепями ДНК. Длинные спирали ДНК с высоким содержанием GC имеют более сильно взаимодействующие цепи, тогда как короткие спирали с высоким содержанием AT имеют более слабые взаимодействующие цепи.[28] В биологии части двойной спирали ДНК, которые необходимо легко разделять, такие как TATAAT Прибновый ящик в некоторых промоутеры, как правило, имеют высокое содержание AT, благодаря чему нити легче отделить друг от друга.[29]
В лаборатории силу этого взаимодействия можно измерить, найдя температуру, необходимую для разрыва половины водородных связей, их температура плавления (также называемый Тм ценить). Когда все пары оснований в двойной спирали ДНК плавятся, цепи разделяются и существуют в растворе как две полностью независимые молекулы. Эти одноцепочечные молекулы ДНК не имеют единой общей формы, но некоторые конформации более стабильны, чем другие.[30]
Смысл и антисмысл
А Последовательность ДНК называется "смысловой" последовательностью, если она такая же, как у информационная РНК копия, которая переводится в белок.[31] Последовательность на противоположной цепи называется «антисмысловой» последовательностью. Как смысловые, так и антисмысловые последовательности могут существовать в разных частях одной и той же цепи ДНК (т.е. обе цепи могут содержать как смысловые, так и антисмысловые последовательности). Как у прокариот, так и у эукариот продуцируются антисмысловые последовательности РНК, но функции этих РНК не совсем ясны.[32] Одно из предположений состоит в том, что антисмысловые РНК участвуют в регуляции экспрессия гена через спаривание оснований РНК-РНК.[33]
Несколько последовательностей ДНК у прокариот и эукариот и многое другое в плазмиды и вирусы, стирают различие между смысловыми и антисмысловыми цепями, имея перекрывающиеся гены.[34] В этих случаях некоторые последовательности ДНК выполняют двойную функцию, кодируя один белок при считывании вдоль одной цепи и второй белок при считывании в противоположном направлении вдоль другой цепи. В бактерии, это перекрытие может быть вовлечено в регуляцию транскрипции генов,[35] в то время как у вирусов перекрывающиеся гены увеличивают объем информации, которая может быть закодирована в небольшом вирусном геноме.[36]
Суперспирализация
ДНК можно скрутить, как веревку, в процессе, называемом Суперспирализация ДНК. Когда ДНК находится в «расслабленном» состоянии, нить обычно окружает ось двойной спирали каждые 10,4 пары оснований, но если ДНК скручена, нити становятся более плотными или более свободными.[37] Если ДНК скручена в направлении спирали, это положительная суперспирализация, и основания удерживаются вместе более плотно. Если они скручены в противоположном направлении, это отрицательная сверхспирализация, и основания легче распадаются. В природе большая часть ДНК имеет небольшую отрицательную суперспирализацию, которая вызывается ферменты называется топоизомеразы.[38] Эти ферменты также необходимы для снятия скручивающих напряжений, возникающих в цепях ДНК во время таких процессов, как транскрипция и Репликация ДНК.[39]

Альтернативные структуры ДНК
ДНК существует во многих возможных конформации которые включают А-ДНК, B-ДНК и Z-ДНК формы, хотя только B-ДНК и Z-ДНК непосредственно наблюдались в функциональных организмах.[14] Конформация, которую принимает ДНК, зависит от уровня гидратации, последовательности ДНК, количества и направления суперспирализации, химических модификаций оснований, типа и концентрации металла. ионы, и наличие полиамины в растворе.[40]
Первые опубликованные отчеты об А-ДНК Рентгенограммы - а также B-ДНК - использовали анализы, основанные на Паттерсон трансформируется это предоставило лишь ограниченное количество структурной информации для ориентированных волокон ДНК.[41][42] Затем Уилкинс предложил альтернативный анализ. и другие., в 1953 г. in vivo Рентгеновские дифракционные картины рассеяния B-ДНК высокогидратированных волокон ДНК в единицах квадратов Функции Бесселя.[43] В том же журнале Джеймс Уотсон и Фрэнсис Крик представили свои молекулярное моделирование анализ дифрактограмм ДНК, чтобы предположить, что структура была двойной спиралью.[9]
Хотя Форма B-ДНК чаще всего встречается в клетках,[44] это не четко определенная конформация, а семейство родственных конформаций ДНК[45] которые возникают при высоком уровне гидратации клеток. Соответствующие им картины дифракции рентгеновских лучей и рассеяния характерны для молекулярных паракристаллы со значительной степенью беспорядка.[46][47]
По сравнению с B-ДНК форма A-ДНК шире правша спиральная, с неглубокой широкой малой бороздкой и более узкой и глубокой большой бороздкой. Форма A встречается в нефизиологических условиях в частично дегидратированных образцах ДНК, тогда как в клетке она может продуцироваться в гибридных парах ДНК и цепей РНК, а также в комплексах фермент-ДНК.[48][49] Сегменты ДНК, основания которых были химически модифицированы метилирование может претерпеть более сильное изменение экстерьера и принять Z форма. Здесь нити вращаются вокруг оси спирали по левой спирали, противоположной более распространенной форме B.[50] Эти необычные структуры могут распознаваться специфическими белками, связывающими Z-ДНК, и могут участвовать в регуляции транскрипции.[51] Исследование 2020 года пришло к выводу, что ДНК стала правосторонней из-за ионизации космические лучи.[52]
Альтернативная химия ДНК
На протяжении многих лет, экзобиологи предложили существование теневая биосфера, постулируемая микробная биосфера Земли, в которой используются радикально отличные от известных в настоящее время биохимические и молекулярные процессы. Одним из предложений было существование форм жизни, использующих мышьяк вместо фосфора в ДНК. Отчет 2010 г. о возможности бактерия GFAJ-1, было объявлено,[53][54] хотя исследования были оспорены,[54][55] и данные свидетельствуют о том, что бактерия активно предотвращает включение мышьяка в основную цепь ДНК и другие биомолекулы.[56]
Квадруплексные конструкции
На концах линейных хромосом расположены специализированные участки ДНК, называемые теломеры. Основная функция этих областей - позволить клетке реплицировать концы хромосом с помощью фермента теломераза, поскольку ферменты, которые обычно реплицируют ДНК, не могут копировать крайние 3'-концы хромосом.[57] Эти специализированные хромосомные колпачки также помогают защитить концы ДНК и остановить Ремонт ДНК системы в клетке от обработки их как повреждения, которое необходимо исправить.[58] В человеческие клетки, теломеры обычно представляют собой отрезки одноцепочечной ДНК, содержащие несколько тысяч повторов простой последовательности TTAGGG.[59]
Эти богатые гуанином последовательности могут стабилизировать концы хромосом, образуя структуры, состоящие из наборов из четырех оснований, а не обычные пары оснований, обнаруживаемые в других молекулах ДНК. Здесь четыре гуаниновых основания, известные как гуаниновая тетрада, сформируйте плоскую тарелку. Эти плоские блоки с четырьмя базами затем складываются друг на друга, образуя устойчивый G-квадруплекс структура.[61] Эти структуры стабилизированы водородными связями между краями оснований и хелатирование иона металла в центре каждой четырехосновной единицы.[62] Также могут быть сформированы другие структуры, с центральным набором из четырех оснований, исходящих либо из одной нити, сложенной вокруг оснований, либо из нескольких разных параллельных нитей, каждая из которых вносит одну основу в центральную структуру.
В дополнение к этим сложенным друг другу структурам теломеры также образуют большие петлевые структуры, называемые петлями теломер или Т-петлями. Здесь одноцепочечная ДНК закручивается в длинный круг, стабилизированный белками, связывающими теломеры.[63] В самом конце Т-петли одноцепочечная теломерная ДНК удерживается на участке двухцепочечной ДНК цепью теломер, разрушая двухспиральную ДНК и спаривание оснований с одной из двух цепей. Этот трехцепочечный конструкция называется петлей смещения или D-петля.[61]
 |  |
| Одно отделение | Несколько веток |
Разветвленная ДНК
В ДНК истирание возникает, когда некомплементарные области существуют на конце другой комплементарной двойной цепи ДНК. Однако разветвленная ДНК может возникать, если вводится третья цепь ДНК, и она содержит соседние области, способные гибридизоваться с потрепанными областями ранее существовавшей двойной цепи. Хотя простейший пример разветвленной ДНК включает только три цепи ДНК, также возможны комплексы, включающие дополнительные цепи и несколько ответвлений.[64] Разветвленная ДНК может использоваться в нанотехнологии чтобы построить геометрические фигуры, см. раздел использование в технологии ниже.
Искусственные основы
Было синтезировано несколько искусственных азотистых оснований, которые были успешно включены в аналог ДНК из восьми оснований, названный ДНК Хатимодзи. Названные S, B, P и Z, эти искусственные основания способны связываться друг с другом предсказуемым образом (S – B и P – Z), поддерживать структуру двойной спирали ДНК и транскрибироваться в РНК. Их существование подразумевает, что нет ничего особенного в четырех естественных азотистых основаниях, которые возникли на Земле.[65][66]
Химические модификации и измененная упаковка ДНК
 |  |  |
| цитозин | 5-метилцитозин | тимин |
Базовые модификации и упаковка ДНК
На экспрессию генов влияет то, как ДНК упакована в хромосомах в структуру, называемую хроматин. Модификации оснований могут быть вовлечены в упаковку, при этом участки с низкой экспрессией генов или без них обычно содержат высокие уровни метилирование из цитозин базы. Упаковка ДНК и ее влияние на экспрессию генов также может происходить за счет ковалентных модификаций гистон белковое ядро, вокруг которого ДНК обернута в структуре хроматина или же путем ремоделирования, осуществляемого комплексами ремоделирования хроматина (см. Ремоделирование хроматина ). Далее, перекрестные помехи между метилированием ДНК и модификацией гистонов, поэтому они могут согласованно влиять на экспрессию хроматина и генов.[67]
Например, метилирование цитозина производит 5-метилцитозин, что важно для X-инактивация хромосом.[68] Средний уровень метилирования варьируется между организмами - червь Caenorhabditis elegans отсутствует метилирование цитозина, в то время как позвоночные имеют более высокие уровни, до 1% их ДНК содержит 5-метилцитозин.[69] Несмотря на важность 5-метилцитозина, он может дезаминировать чтобы оставить тиминовое основание, поэтому метилированные цитозины особенно склонны к мутации.[70] Другие модификации оснований включают метилирование аденина в бактериях, наличие 5-гидроксиметилцитозин в мозг,[71] и гликозилирование урацила для производства "J-основы" в кинетопластиды.[72][73]
Повреждать

ДНК может быть повреждена многими видами мутагены, которые меняют Последовательность ДНК. Мутагены включают окислители, алкилирующие агенты а также высокоэнергетические электромагнитное излучение Такие как ультрафиолетовый свет и Рентгеновские лучи. Тип повреждения ДНК зависит от типа мутагена. Например, ультрафиолетовый свет может повредить ДНК, производя димеры тимина, которые представляют собой сшивки между пиримидиновыми основаниями.[75] С другой стороны, окислители, такие как свободные радикалы или же пероксид водорода вызывают множественные формы повреждений, включая модификации оснований, особенно гуанозина, и двухцепочечные разрывы.[76] Типичная человеческая клетка содержит около 150 000 оснований, поврежденных окислением.[77] Из этих окислительных повреждений наиболее опасными являются двухцепочечные разрывы, так как они трудно поддаются ремонту и могут вызывать точечные мутации, вставки, удаления из последовательности ДНК, и хромосомные транслокации.[78] Эти мутации могут вызывать рак. Из-за ограничений, присущих механизмам восстановления ДНК, если люди проживут достаточно долго, у всех в конечном итоге разовьется рак.[79][80] Повреждения ДНК, которые встречающиеся в природе из-за нормальных клеточных процессов, которые производят активные формы кислорода, также часто происходит гидролитическая активность клеточной воды и т. д. Хотя большая часть этих повреждений восстанавливается, в любой клетке могут оставаться некоторые повреждения ДНК, несмотря на действие процессов восстановления. Эти оставшиеся повреждения ДНК накапливаются с возрастом в постмитотических тканях млекопитающих. Это накопление, по-видимому, является важной первопричиной старения.[81][82][83]
Многие мутагены помещаются в пространство между двумя соседними парами оснований, это называется вставка. Большинство интеркаляторов ароматный и плоские молекулы; примеры включают этидиум бромид, акридины, дауномицин, и доксорубицин. Чтобы интеркалятор поместился между парами оснований, основания должны разделяться, искажая цепи ДНК за счет раскручивания двойной спирали. Это подавляет как транскрипцию, так и репликацию ДНК, вызывая токсичность и мутации.[84] В результате интеркаляторы ДНК могут быть канцерогены, а в случае талидомида - тератоген.[85] Другие, такие как бензо [а] эпоксид пирендиола и афлатоксин образуют ДНК-аддукты, которые вызывают ошибки в репликации.[86] Тем не менее, из-за их способности ингибировать транскрипцию и репликацию ДНК, другие аналогичные токсины также используются в химиотерапия подавлять быстрорастущие рак клетки.[87]
Биологические функции

ДНК обычно бывает линейной хромосомы в эукариоты, и круговые хромосомы в прокариоты. Набор хромосом в клетке составляет ее геном; то человеческий геном имеет приблизительно 3 миллиарда пар оснований ДНК, организованных в 46 хромосом.[88] Информация, переносимая ДНК, хранится в последовательность кусочков ДНК, называемых гены. Передача инфекции генетической информации в генах достигается за счет комплементарного спаривания оснований. Например, при транскрипции, когда клетка использует информацию в гене, последовательность ДНК копируется в комплементарную последовательность РНК за счет притяжения между ДНК и правильными нуклеотидами РНК. Обычно эта копия РНК затем используется для сопоставления белковая последовательность в процессе, называемом перевод, которое зависит от одинакового взаимодействия между нуклеотидами РНК. Альтернативно клетка может просто копировать свою генетическую информацию в процессе, называемом репликацией ДНК. Подробности этих функций описаны в других статьях; здесь основное внимание уделяется взаимодействиям между ДНК и другими молекулами, которые обеспечивают функцию генома.
Гены и геномы
Геномная ДНК плотно и упорядоченно упакована в процессе, называемом Конденсация ДНК, чтобы соответствовать небольшому доступному объему ячейки. У эукариот ДНК расположена в ядро клетки, с небольшими количествами в митохондрии и хлоропласты. У прокариот ДНК удерживается в теле неправильной формы в цитоплазме, называемом нуклеоид.[89] Генетическая информация в геноме хранится в генах, и полный набор этой информации в организме называется его генотип. Ген - это единица наследственность и представляет собой область ДНК, которая влияет на определенную характеристику организма. Гены содержат открытая рамка чтения что можно переписать, и регуляторные последовательности Такие как промоутеры и усилители, которые контролируют транскрипцию открытой рамки считывания.
Во многих разновидность, лишь небольшая часть от общей последовательности геном кодирует белок. Например, только около 1,5% генома человека состоит из белков, кодирующих экзоны, при этом более 50% ДНК человека состоит из некодирующих повторяющиеся последовательности.[90] Причины наличия такого количества некодирующая ДНК в геномах эукариот и необычайные различия в размер генома, или же C-значение среди видов представляют собой давнюю загадку, известную как "Загадка значения C ".[91] Однако некоторые последовательности ДНК, не кодирующие белок, могут кодировать функциональные некодирующая РНК молекулы, которые участвуют в регуляция экспрессии генов.[92]

Некоторые некодирующие последовательности ДНК играют структурную роль в хромосомах. Теломеры и центромеры обычно содержат мало генов, но важны для функции и стабильности хромосом.[58][94] Распространенной формой некодирующей ДНК у человека является псевдогены, которые являются копиями генов, отключенных в результате мутации.[95] Эти последовательности обычно просто молекулярные. окаменелости, хотя иногда они могут служить сырыми генетический материал для создания новых генов в процессе дупликация гена и расхождение.[96]
Транскрипция и перевод
Ген - это последовательность ДНК, которая содержит генетическую информацию и может влиять на фенотип организма. Внутри гена последовательность оснований вдоль цепи ДНК определяет информационная РНК последовательность, которая затем определяет одну или несколько белковых последовательностей. Связь между нуклеотидными последовательностями генов и аминокислота последовательность белков определяется правилами перевод, известный под общим названием генетический код. Генетический код состоит из трехбуквенных «слов», называемых кодоны образованный из последовательности из трех нуклеотидов (например, ACT, CAG, TTT).
При транскрипции кодоны гена копируются в информационную РНК посредством РНК-полимераза. Эта копия РНК затем декодируется рибосома который считывает последовательность РНК путем спаривания оснований информационной РНК с переносить РНК, несущий в себе аминокислоты. Поскольку имеется 4 основания в трехбуквенных комбинациях, существует 64 возможных кодона (43 комбинации). Они кодируют двадцать стандартные аминокислоты, давая большинству аминокислот более одного возможного кодона. Есть также три «стоповых» или «бессмысленных» кодона, обозначающих конец кодирующей области; это кодоны TAA, TGA и TAG.
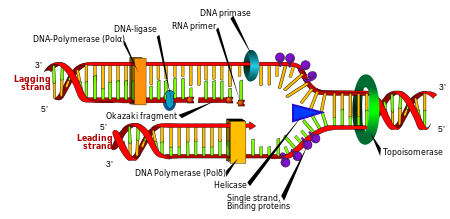
Репликация
Деление клеток необходим для роста организма, но когда клетка делится, она должна реплицировать ДНК в своем геноме, чтобы две дочерние клетки имели ту же генетическую информацию, что и их родительские. Двухцепочечная структура ДНК обеспечивает простой механизм для Репликация ДНК. Здесь две нити разделяются, а затем каждая нить комплементарная ДНК последовательность воссоздается фермент называется ДНК-полимераза. Этот фермент создает комплементарную цепь, находя правильное основание посредством комплементарного спаривания оснований и прикрепляя его к исходной цепи. Поскольку ДНК-полимеразы могут удлинять цепь ДНК только в направлении от 5 'до 3', для копирования антипараллельных цепей двойной спирали используются различные механизмы.[97] Таким образом, основание на старой нити определяет, какое основание появится на новой нити, и в итоге клетка получит идеальную копию своей ДНК.
Внеклеточные нуклеиновые кислоты
Голая внеклеточная ДНК (еДНК), большая часть которой высвобождается в результате гибели клеток, почти повсеместна в окружающей среде. Его концентрация в почве может достигать 2 мкг / л, а в естественной водной среде может достигать 88 мкг / л.[98] Для еДНК были предложены различные возможные функции: она может участвовать в горизонтальный перенос генов;[99] он может обеспечить питательными веществами;[100] и он может действовать как буфер для набора или титрования ионов или антибиотиков.[101] Внеклеточная ДНК действует как функциональный компонент внеклеточного матрикса в биопленки нескольких видов бактерий. Он может действовать как фактор распознавания, регулирующий прикрепление и распространение определенных типов клеток в биопленке;[102] это может способствовать образованию биопленки;[103] и это может способствовать физической прочности биопленки и устойчивости к биологическому стрессу.[104]
Внеклеточная ДНК плода находится в крови матери и может быть секвенирован для определения большого количества информации о развивающемся плоде.[105]
Под именем экологическая ДНК eDNA все чаще используется в естественных науках в качестве инструмента исследования для экология, мониторинг перемещений и присутствия видов в воде, воздухе или на суше, а также оценка биоразнообразия территории.[106][107]
Взаимодействие с белками
Все функции ДНК зависят от взаимодействия с белками. Эти белковые взаимодействия может быть неспецифическим, или белок может специфически связываться с одной последовательностью ДНК. Ферменты также могут связываться с ДНК, и из них особенно важны полимеразы, которые копируют последовательность оснований ДНК при транскрипции и репликации ДНК.
ДНК-связывающие белки

Структурные белки, связывающие ДНК, являются хорошо изученными примерами неспецифических взаимодействий ДНК-белок. Внутри хромосом ДНК находится в комплексах со структурными белками. Эти белки организуют ДНК в компактную структуру, называемую хроматин. У эукариот эта структура включает связывание ДНК с комплексом небольших основных белков, называемых гистоны, в то время как у прокариот задействовано несколько типов белков.[108][109] Гистоны образуют дискообразный комплекс, называемый нуклеосома, который содержит два полных витка двухцепочечной ДНК, обернутой вокруг своей поверхности. Эти неспецифические взаимодействия образуются через основные остатки в гистонах, что делает ионные связи к кислой сахарно-фосфатной основе ДНК и, таким образом, в значительной степени не зависят от последовательности оснований.[110] Химические модификации этих основных аминокислотных остатков включают: метилирование, фосфорилирование, и ацетилирование.[111] Эти химические изменения изменяют силу взаимодействия между ДНК и гистонами, делая ДНК более или менее доступной для факторы транскрипции и изменение скорости транскрипции.[112] Другие неспецифические ДНК-связывающие белки в хроматине включают белки группы с высокой подвижностью, которые связываются с изогнутой или искаженной ДНК.[113] Эти белки важны для изгиба массивов нуклеосом и их упорядочения в более крупные структуры, составляющие хромосомы.[114]
Отдельной группой ДНК-связывающих белков являются ДНК-связывающие белки, которые специфически связывают одноцепочечную ДНК. У людей репликация белок А является наиболее изученным членом этого семейства и используется в процессах разделения двойной спирали, включая репликацию ДНК, рекомбинацию и репарацию ДНК.[115] Эти связывающие белки, по-видимому, стабилизируют одноцепочечную ДНК и защищают ее от образования стебель-петли или быть униженным нуклеазы.

Напротив, другие белки эволюционировали, чтобы связываться с определенными последовательностями ДНК. Наиболее интенсивно изучаются различные факторы транскрипции, которые являются белками, регулирующими транскрипцию. Каждый фактор транскрипции связывается с одним конкретным набором последовательностей ДНК и активирует или ингибирует транскрипцию генов, которые имеют эти последовательности, близкие к их промоторам. Факторы транскрипции делают это двумя способами. Во-первых, они могут связываться с РНК-полимеразой, ответственной за транскрипцию, либо напрямую, либо через другие белки-медиаторы; это определяет местонахождение полимеразы на промоторе и позволяет ей начать транскрипцию.[117] Альтернативно, факторы транскрипции могут связывать ферменты которые модифицируют гистоны на промоторе. This changes the accessibility of the DNA template to the polymerase.[118]
As these DNA targets can occur throughout an organism's genome, changes in the activity of one type of transcription factor can affect thousands of genes.[119] Consequently, these proteins are often the targets of the преобразование сигнала processes that control responses to environmental changes or клеточная дифференциация and development. The specificity of these transcription factors' interactions with DNA come from the proteins making multiple contacts to the edges of the DNA bases, allowing them to "read" the DNA sequence. Most of these base-interactions are made in the major groove, where the bases are most accessible.[25]

DNA-modifying enzymes
Nucleases and ligases
Нуклеазы находятся ферменты that cut DNA strands by catalyzing the гидролиз из фосфодиэфирные связи. Nucleases that hydrolyse nucleotides from the ends of DNA strands are called экзонуклеазы, пока endonucleases cut within strands. The most frequently used nucleases in molecular biology являются эндонуклеазы рестрикции, which cut DNA at specific sequences. For instance, the EcoRV enzyme shown to the left recognizes the 6-base sequence 5′-GATATC-3′ and makes a cut at the horizontal line. In nature, these enzymes protect бактерии против фаг infection by digesting the phage DNA when it enters the bacterial cell, acting as part of the restriction modification system.[121] In technology, these sequence-specific nucleases are used in молекулярное клонирование и Дактилоскопия ДНК.
Enzymes called DNA ligases can rejoin cut or broken DNA strands.[122] Ligases are particularly important in отстающая прядь DNA replication, as they join together the short segments of DNA produced at the replication fork into a complete copy of the DNA template. Они также используются в Ремонт ДНК и генетическая рекомбинация.[122]
Topoisomerases and helicases
Topoisomerases are enzymes with both nuclease and ligase activity. These proteins change the amount of суперспирализация in DNA. Some of these enzymes work by cutting the DNA helix and allowing one section to rotate, thereby reducing its level of supercoiling; the enzyme then seals the DNA break.[38] Other types of these enzymes are capable of cutting one DNA helix and then passing a second strand of DNA through this break, before rejoining the helix.[123] Topoisomerases are required for many processes involving DNA, such as DNA replication and transcription.[39]
Helicases are proteins that are a type of молекулярный мотор. They use the chemical energy in nucleoside triphosphates, преимущественно аденозинтрифосфат (ATP), to break hydrogen bonds between bases and unwind the DNA double helix into single strands.[124] These enzymes are essential for most processes where enzymes need to access the DNA bases.
Polymerases
Polymerases находятся ферменты that synthesize polynucleotide chains from nucleoside triphosphates. The sequence of their products is created based on existing polynucleotide chains—which are called шаблоны. These enzymes function by repeatedly adding a nucleotide to the 3′ гидроксил group at the end of the growing polynucleotide chain. As a consequence, all polymerases work in a 5′ to 3′ direction.[125] в активный сайт of these enzymes, the incoming nucleoside triphosphate base-pairs to the template: this allows polymerases to accurately synthesize the complementary strand of their template. Polymerases are classified according to the type of template that they use.
In DNA replication, DNA-dependent ДНК-полимеразы make copies of DNA polynucleotide chains. To preserve biological information, it is essential that the sequence of bases in each copy are precisely complementary to the sequence of bases in the template strand. Many DNA polymerases have a корректура Мероприятия. Here, the polymerase recognizes the occasional mistakes in the synthesis reaction by the lack of base pairing between the mismatched nucleotides. If a mismatch is detected, a 3′ to 5′ экзонуклеаза activity is activated and the incorrect base removed.[126] In most organisms, DNA polymerases function in a large complex called the ответственный that contains multiple accessory subunits, such as the Зажим ДНК или же геликасы.[127]
RNA-dependent DNA polymerases are a specialized class of polymerases that copy the sequence of an RNA strand into DNA. Они включают обратная транскриптаза, который является популярный enzyme involved in the infection of cells by ретровирусы, и теломераза, which is required for the replication of telomeres.[57][128] For example, HIV reverse transcriptase is an enzyme for AIDS virus replication.[128] Telomerase is an unusual polymerase because it contains its own RNA template as part of its structure. It synthesizes теломеры на концах хромосом. Telomeres prevent fusion of the ends of neighboring chromosomes and protect chromosome ends from damage.[58]
Transcription is carried out by a DNA-dependent РНК-полимераза that copies the sequence of a DNA strand into RNA. To begin transcribing a gene, the RNA polymerase binds to a sequence of DNA called a promoter and separates the DNA strands. It then copies the gene sequence into a информационная РНК transcript until it reaches a region of DNA called the терминатор, where it halts and detaches from the DNA. As with human DNA-dependent DNA polymerases, РНК-полимераза II, the enzyme that transcribes most of the genes in the human genome, operates as part of a large белковый комплекс with multiple regulatory and accessory subunits.[129]
Генетическая рекомбинация
 |
 |

A DNA helix usually does not interact with other segments of DNA, and in human cells, the different chromosomes even occupy separate areas in the nucleus called "хромосомные территории ".[131] This physical separation of different chromosomes is important for the ability of DNA to function as a stable repository for information, as one of the few times chromosomes interact is in chromosomal crossover which occurs during половое размножение, когда генетическая рекомбинация происходит. Chromosomal crossover is when two DNA helices break, swap a section and then rejoin.
Recombination allows chromosomes to exchange genetic information and produces new combinations of genes, which increases the efficiency of естественный отбор and can be important in the rapid evolution of new proteins.[132] Genetic recombination can also be involved in DNA repair, particularly in the cell's response to double-strand breaks.[133]
The most common form of chromosomal crossover is гомологичная рекомбинация, where the two chromosomes involved share very similar sequences. Non-homologous recombination can be damaging to cells, as it can produce хромосомные транслокации и генетические аномалии. The recombination reaction is catalyzed by enzymes known as recombinases, Такие как RAD51.[134] The first step in recombination is a double-stranded break caused by either an эндонуклеаза or damage to the DNA.[135] A series of steps catalyzed in part by the recombinase then leads to joining of the two helices by at least one Холлидей Джанкшн, in which a segment of a single strand in each helix is annealed to the complementary strand in the other helix. The Holliday junction is a tetrahedral junction structure that can be moved along the pair of chromosomes, swapping one strand for another. The recombination reaction is then halted by cleavage of the junction and re-ligation of the released DNA.[136] Only strands of like polarity exchange DNA during recombination. There are two types of cleavage: east-west cleavage and north–south cleavage. The north–south cleavage nicks both strands of DNA, while the east–west cleavage has one strand of DNA intact. The formation of a Holliday junction during recombination makes it possible for genetic diversity, genes to exchange on chromosomes, and expression of wild-type viral genomes.
Эволюция
DNA contains the genetic information that allows all forms of life to function, grow and reproduce. However, it is unclear how long in the 4-billion-year история жизни DNA has performed this function, as it has been proposed that the earliest forms of life may have used RNA as their genetic material.[137][138] RNA may have acted as the central part of early cell metabolism as it can both transmit genetic information and carry out катализ как часть рибозимы.[139] This ancient Мир РНК where nucleic acid would have been used for both catalysis and genetics may have influenced the эволюция of the current genetic code based on four nucleotide bases. This would occur, since the number of different bases in such an organism is a trade-off between a small number of bases increasing replication accuracy and a large number of bases increasing the catalytic efficiency of ribozymes.[140] However, there is no direct evidence of ancient genetic systems, as recovery of DNA from most fossils is impossible because DNA survives in the environment for less than one million years, and slowly degrades into short fragments in solution.[141] Claims for older DNA have been made, most notably a report of the isolation of a viable bacterium from a salt crystal 250 million years old,[142] but these claims are controversial.[143][144]
Building blocks of DNA (аденин, гуанин, и связанные Органические молекулы ) may have been formed extraterrestrially in космическое пространство.[145][146][147] Complex DNA and РНК органические соединения из жизнь, включая урацил, цитозин, и тимин, have also been formed in the laboratory under conditions mimicking those found in космическое пространство, using starting chemicals, such as пиримидин, нашел в метеориты. Pyrimidine, like полициклические ароматические углеводороды (PAHs), the most carbon-rich chemical found in the вселенная, may have been formed in красные гиганты or in interstellar космическая пыль and gas clouds.[148]
Uses in technology
Генная инженерия
Methods have been developed to purify DNA from organisms, such as phenol-chloroform extraction, and to manipulate it in the laboratory, such as restriction digests и полимеразной цепной реакции. Современное биология и биохимия make intensive use of these techniques in recombinant DNA technology. Рекомбинантная ДНК is a man-made DNA sequence that has been assembled from other DNA sequences. Они могут быть transformed into organisms in the form of плазмиды or in the appropriate format, by using a вирусный вектор.[149] В генетически модифицированный organisms produced can be used to produce products such as recombinant белки, используется в медицинские исследования,[150] or be grown in сельское хозяйство.[151][152]
ДНК-профилирование
Судмедэксперты can use DNA in кровь, сперма, кожа, слюна или же hair found at a место преступления to identify a matching DNA of an individual, such as a perpetrator.[153] This process is formally termed ДНК-профилирование, также называемый Дактилоскопия ДНК. In DNA profiling, the lengths of variable sections of repetitive DNA, such as short tandem repeats и minisatellites, are compared between people. This method is usually an extremely reliable technique for identifying a matching DNA.[154] However, identification can be complicated if the scene is contaminated with DNA from several people.[155] DNA profiling was developed in 1984 by British geneticist Sir Алек Джеффрис,[156] and first used in forensic science to convict Colin Pitchfork in the 1988 Enderby murders дело.[157]
The development of forensic science and the ability to now obtain genetic matching on minute samples of blood, skin, saliva, or hair has led to re-examining many cases. Evidence can now be uncovered that was scientifically impossible at the time of the original examination. Combined with the removal of the двойная опасность law in some places, this can allow cases to be reopened where prior trials have failed to produce sufficient evidence to convince a jury. People charged with serious crimes may be required to provide a sample of DNA for matching purposes. The most obvious defense to DNA matches obtained forensically is to claim that cross-contamination of evidence has occurred. This has resulted in meticulous strict handling procedures with new cases of serious crime.
DNA profiling is also used successfully to positively identify victims of mass casualty incidents,[158] bodies or body parts in serious accidents, and individual victims in mass war graves, via matching to family members.
DNA profiling is also used in ДНК-тестирование на отцовство to determine if someone is the biological parent or grandparent of a child with the probability of parentage is typically 99.99% when the alleged parent is biologically related to the child. Нормальный Секвенирование ДНК methods happen after birth, but there are new methods to test paternity while a mother is still pregnant.[159]
DNA enzymes or catalytic DNA
Дезоксирибозимы, also called DNAzymes or catalytic DNA, were first discovered in 1994.[160] They are mostly single stranded DNA sequences isolated from a large pool of random DNA sequences through a combinatorial approach called in vitro selection or systematic evolution of ligands by exponential enrichment (SELEX). DNAzymes catalyze variety of chemical reactions including RNA-DNA cleavage, RNA-DNA ligation, amino acids phosphorylation-dephosphorylation, carbon-carbon bond formation, etc. DNAzymes can enhance catalytic rate of chemical reactions up to 100,000,000,000-fold over the uncatalyzed reaction.[161] The most extensively studied class of DNAzymes is RNA-cleaving types which have been used to detect different metal ions and designing therapeutic agents. Several metal-specific DNAzymes have been reported including the GR-5 DNAzyme (lead-specific),[160] the CA1-3 DNAzymes (copper-specific),[162] the 39E DNAzyme (uranyl-specific) and the NaA43 DNAzyme (sodium-specific).[163] The NaA43 DNAzyme, which is reported to be more than 10,000-fold selective for sodium over other metal ions, was used to make a real-time sodium sensor in cells.
Биоинформатика
Биоинформатика involves the development of techniques to store, data mine, search and manipulate biological data, including DNA последовательность нуклеиновой кислоты данные. These have led to widely applied advances in Информатика, особенно string searching algorithms, машинное обучение, и теория баз данных.[164] String searching or matching algorithms, which find an occurrence of a sequence of letters inside a larger sequence of letters, were developed to search for specific sequences of nucleotides.[165] The DNA sequence may be выровнен with other DNA sequences to identify homologous sequences and locate the specific мутации that make them distinct. These techniques, especially multiple sequence alignment, are used in studying филогенетический relationships and protein function.[166] Data sets representing entire genomes' worth of DNA sequences, such as those produced by the Проект "Геном человека", are difficult to use without the annotations that identify the locations of genes and regulatory elements on each chromosome. Regions of DNA sequence that have the characteristic patterns associated with protein- or RNA-coding genes can be identified by поиск генов algorithms, which allow researchers to predict the presence of particular генные продукты and their possible functions in an organism even before they have been isolated experimentally.[167] Entire genomes may also be compared, which can shed light on the evolutionary history of particular organism and permit the examination of complex evolutionary events.
ДНК-нанотехнологии

Нанотехнология ДНК использует уникальные молекулярное распознавание properties of DNA and other nucleic acids to create self-assembling branched DNA complexes with useful properties.[168] DNA is thus used as a structural material rather than as a carrier of biological information. This has led to the creation of two-dimensional periodic lattices (both tile-based and using the ДНК оригами method) and three-dimensional structures in the shapes of многогранники.[169] Nanomechanical devices и algorithmic self-assembly have also been demonstrated,[170] and these DNA structures have been used to template the arrangement of other molecules such as gold nanoparticles и стрептавидин белки.[171]
History and anthropology
Because DNA collects mutations over time, which are then inherited, it contains historical information, and, by comparing DNA sequences, geneticists can infer the evolutionary history of organisms, their филогения.[172] This field of phylogenetics is a powerful tool in эволюционная биология. If DNA sequences within a species are compared, population geneticists can learn the history of particular populations. This can be used in studies ranging from экологическая генетика к антропология.
Хранение информации
DNA as a устройство хранения for information has enormous potential since it has much higher storage density compared to electronic devices. However, high costs, extremely slow read and write times (задержка памяти ), and insufficient надежность has prevented its practical use.[173][174]
История

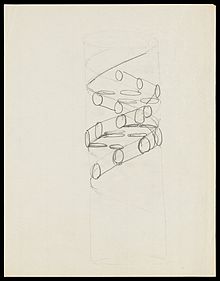
DNA was first isolated by the Swiss physician Фридрих Мишер who, in 1869, discovered a microscopic substance in the гной of discarded surgical bandages. As it resided in the nuclei of cells, he called it "nuclein".[175][176] В 1878 г. Альбрехт Коссель isolated the non-protein component of "nuclein", nucleic acid, and later isolated its five primary азотистые основания.[177][178]
В 1909 г. Phoebus Levene identified the base, sugar, and phosphate nucleotide unit of the RNA (then named "yeast nucleic acid").[179][180][181] In 1929, Levene identified deoxyribose sugar in "thymus nucleic acid" (DNA).[182] Levene suggested that DNA consisted of a string of four nucleotide units linked together through the phosphate groups ("tetranucleotide hypothesis"). Levene thought the chain was short and the bases repeated in a fixed order.In 1927, Николай Кольцов proposed that inherited traits would be inherited via a "giant hereditary molecule" made up of "two mirror strands that would replicate in a semi-conservative fashion using each strand as a template".[183][184] В 1928 г. Фредерик Гриффит в его эксперимент обнаружил, что черты of the "smooth" form of Пневмококк could be transferred to the "rough" form of the same bacteria by mixing killed "smooth" bacteria with the live "rough" form.[185][186] This system provided the first clear suggestion that DNA carries genetic information.
In 1933, while studying virgin морской еж яйца Жан Браше suggested that DNA is found in the ядро клетки и это РНК is present exclusively in the цитоплазма. At the time, "yeast nucleic acid" (RNA) was thought to occur only in plants, while "thymus nucleic acid" (DNA) only in animals. The latter was thought to be a tetramer, with the function of buffering cellular pH.[187][188]
В 1937 г. William Astbury produced the first X-ray diffraction patterns that showed that DNA had a regular structure.[189]
В 1943 г. Освальд Эйвери, along with co-workers Colin MacLeod и Маклин Маккарти, identified DNA as the transforming principle, supporting Griffith's suggestion (Avery–MacLeod–McCarty experiment ).[190] DNA's role in heredity was confirmed in 1952 when Альфред Херши и Martha Chase в Эксперимент Херши – Чейза showed that DNA is the генетический материал из enterobacteria phage T2.[191]

Late in 1951, Фрэнсис Крик начал работать с James Watson на Кавендишская лаборатория в пределах Кембриджский университет. In February 1953, Линус Полинг и Robert Corey proposed a model for nucleic acids containing three intertwined chains, with the phosphates near the axis, and the bases on the outside.[192] In May 1952, Raymond Gosling a graduate student working under the supervision of Розалинд Франклин took an дифракция рентгеновских лучей image, labeled as "Photo 51 ",[193] at high hydration levels of DNA. This photo was given to Watson and Crick by Морис Уилкинс and was critical to their obtaining the correct structure of DNA. Franklin told Crick and Watson that the backbones had to be on the outside. Before then, Linus Pauling, and Watson and Crick, had erroneous models with the chains inside and the bases pointing outwards. Her identification of the космическая группа for DNA crystals revealed to Crick that the two DNA strands were антипараллельный.[194]
In February 1953, Watson and Crick completed their model, which is now accepted as the first correct model of the double-helix of ДНК. On 28 February 1953 Crick interrupted patrons' lunchtime at Орел паб in Cambridge to announce that he and Watson had "discovered the secret of life".[195]
In the 25 April 1953 issue of the journal Природа, were published a series of five articles giving the Watson and Crick double-helix structure DNA, and evidence supporting it.[196] The structure was reported in a letter titled "MOLECULAR STRUCTURE OF NUCLEIC ACIDS A Structure for Deoxyribose Nucleic Acid", in which they said, "It has not escaped our notice that the specific pairing we have postulated immediately suggests a possible copying mechanism for the genetic material."[9] Followed by a letter from Franklin and Gosling, which was the first publication of their own X-ray diffraction data, and of their original analysis method.[42][197] Then followed a letter by Wilkins, and two of his colleagues, which contained an analysis of in vivo B-DNA X-ray patterns, and supported the presence in vivo of the Watson and Crick structure.[43]
In 1962, after Franklin's death, Watson, Crick, and Wilkins jointly received the Нобелевская премия по физиологии и медицине.[198] Nobel Prizes are awarded only to living recipients. A debate continues about who should receive credit for the discovery.[199]
In an influential presentation in 1957, Crick laid out the центральная догма молекулярной биологии, which foretold the relationship between DNA, RNA, and proteins, and articulated the "adaptor hypothesis".[200] Final confirmation of the replication mechanism that was implied by the double-helical structure followed in 1958 through the Meselson–Stahl experiment.[201] Further work by Crick and co-workers showed that the genetic code was based on non-overlapping triplets of bases, called кодоны, позволяя Har Gobind Khorana, Роберт В. Холли, и Маршалл Уоррен Ниренберг to decipher the genetic code.[202] These findings represent the birth of molecular biology.[203]
Смотрите также
- Аутосома – Any chromosome other than a sex chromosome
- Comparison of nucleic acid simulation software
- Кристаллография – scientific study of crystal structure
- DNA-encoded chemical library
- Микрочип ДНК
- Генетическое расстройство – Health problem caused by one or more abnormalities in the genome
- Genetic genealogy – The use of DNA testing in combination with traditional genealogical methods to infer relationships between individuals and find ancestors
- Гаплотип – Group of genes from one parent
- Мейоз – Type of cell division in sexually-reproducing organisms used to produce gametes
- Обозначение нуклеиновой кислоты – Universal notation using the Roman characters A, C, G, and T to call the four DNA nucleotides
- Последовательность нуклеиновой кислоты – Succession of nucleotides in a nucleic acid
- Пангенезис - бывшая теория о том, что наследование основывалось на частицах со всех частей тела
- Фосфорамидит
- Рибосомная ДНК
- Southern blot
- Методы рассеяния рентгеновских лучей
- Xeno nucleic acid
Рекомендации
- ^ "deoxyribonucleic acid". Словарь Merriam-Webster.
- ^ Альбертс Б., Джонсон А., Льюис Дж, Рафф М., Робертс К., Уолтер П. (2014). Molecular Biology of the Cell (6-е изд.). Гирлянда. п. Chapter 4: DNA, Chromosomes and Genomes. ISBN 978-0-8153-4432-2. В архиве из оригинала 14 июля 2014 г.
- ^ Purcell A. «ДНК». Основы биологии. В архиве из оригинала от 5 января 2017 года.
- ^ "Uracil". Genome.gov. Получено 21 ноября 2019.
- ^ Russell P (2001). iGenetics. New York: Benjamin Cummings. ISBN 0-8053-4553-1.
- ^ Saenger W (1984). Principles of Nucleic Acid Structure. Нью-Йорк: Springer-Verlag. ISBN 0-387-90762-9.
- ^ а б Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Peter W (2002). Molecular Biology of the Cell (Четвертое изд.). Нью-Йорк и Лондон: Наука о гирляндах. ISBN 0-8153-3218-1. OCLC 145080076. В архиве из оригинала от 1 ноября 2016 г.
- ^ Irobalieva RN, Fogg JM, Catanese DJ, Catanese DJ, Sutthibutpong T, Chen M, Barker AK, Ludtke SJ, Harris SA, Schmid MF, Chiu W, Zechiedrich L (October 2015). "Structural diversity of supercoiled DNA". Nature Communications. 6: 8440. Bibcode:2015NatCo...6.8440I. Дои:10.1038/ncomms9440. ISSN 2041-1723. ЧВК 4608029. PMID 26455586.
- ^ а б c d Уотсон Дж. Д., Крик Ф. Х. (апрель 1953 г.). «Молекулярная структура нуклеиновых кислот; структура нуклеиновой кислоты дезоксирибозы» (PDF). Природа. 171 (4356): 737–38. Bibcode:1953 г., природа. 171..737 Вт. Дои:10.1038 / 171737a0. ISSN 0028-0836. PMID 13054692. S2CID 4253007. В архиве (PDF) from the original on 4 February 2007.
- ^ Mandelkern M, Elias JG, Eden D, Crothers DM (October 1981). "The dimensions of DNA in solution". Журнал молекулярной биологии. 152 (1): 153–61. Дои:10.1016/0022-2836(81)90099-1. ISSN 0022-2836. PMID 7338906.
- ^ Gregory SG, Barlow KF, McLay KE, Kaul R, Swarbreck D, Dunham A, et al. (Май 2006 г.). «Последовательность ДНК и биологическая аннотация хромосомы 1 человека». Природа. 441 (7091): 315–21. Bibcode:2006Натура.441..315Г. Дои:10.1038 / природа04727. PMID 16710414.
- ^ а б c Berg J, Tymoczko J, Stryer L (2002). Биохимия. W.H. Фримен и компания. ISBN 0-7167-4955-6.
- ^ IUPAC-IUB Commission on Biochemical Nomenclature (CBN) (December 1970). "Abbreviations and Symbols for Nucleic Acids, Polynucleotides and their Constituents. Recommendations 1970". Биохимический журнал. 120 (3): 449–54. Дои:10.1042/bj1200449. ISSN 0306-3283. ЧВК 1179624. PMID 5499957. Архивировано из оригинал 5 февраля 2007 г.
- ^ а б Ghosh A, Bansal M (April 2003). "A glossary of DNA structures from A to Z". Acta Crystallographica Раздел D. 59 (Pt 4): 620–26. Дои:10.1107/S0907444903003251. ISSN 0907-4449. PMID 12657780.
- ^ Создано из PDB 1D65
- ^ Yakovchuk P, Protozanova E, Frank-Kamenetskii MD (2006). "Base-stacking and base-pairing contributions into thermal stability of the DNA double helix". Исследования нуклеиновых кислот. 34 (2): 564–74. Дои:10.1093/nar/gkj454. ISSN 0305-1048. ЧВК 1360284. PMID 16449200.
- ^ Tropp BE (2012). Молекулярная биология (4-е изд.). Sudbury, Mass.: Jones and Barlett Learning. ISBN 978-0-7637-8663-2.
- ^ Carr S (1953). "Watson-Crick Structure of DNA". Мемориальный университет Ньюфаундленда. В архиве from the original on 19 July 2016. Получено 13 июля 2016.
- ^ Verma S, Eckstein F (1998). "Modified oligonucleotides: synthesis and strategy for users". Ежегодный обзор биохимии. 67: 99–134. Дои:10.1146/annurev.biochem.67.1.99. ISSN 0066-4154. PMID 9759484.
- ^ Johnson TB, Coghill RD (1925). "Pyrimidines. CIII. The discovery of 5-methylcytosine in tuberculinic acid, the nucleic acid of the tubercle bacillus". Журнал Американского химического общества. 47: 2838–44. Дои:10.1021/ja01688a030. ISSN 0002-7863.
- ^ Weigele P, Raleigh EA (October 2016). "Biosynthesis and Function of Modified Bases in Bacteria and Their Viruses". Химические обзоры. 116 (20): 12655–12687. Дои:10.1021/acs.chemrev.6b00114. ISSN 0009-2665. PMID 27319741.
- ^ Kumar S, Chinnusamy V, Mohapatra T (2018). "Epigenetics of Modified DNA Bases: 5-Methylcytosine and Beyond". Границы генетики. 9: 640. Дои:10.3389/fgene.2018.00640. ISSN 1664-8021. ЧВК 6305559. PMID 30619465.
- ^ Carell T, Kurz MQ, Müller M, Rossa M, Spada F (April 2018). "Non-canonical Bases in the Genome: The Regulatory Information Layer in DNA". Angewandte Chemie. 57 (16): 4296–4312. Дои:10.1002/anie.201708228. PMID 28941008.
- ^ Wing R, Drew H, Takano T, Broka C, Tanaka S, Itakura K, Dickerson RE (October 1980). "Crystal structure analysis of a complete turn of B-DNA". Природа. 287 (5784): 755–58. Bibcode:1980Natur.287..755W. Дои:10.1038/287755a0. PMID 7432492. S2CID 4315465.
- ^ а б Pabo CO, Sauer RT (1984). "Protein-DNA recognition". Ежегодный обзор биохимии. 53: 293–321. Дои:10.1146/annurev.bi.53.070184.001453. PMID 6236744.
- ^ Nikolova EN, Zhou H, Gottardo FL, Alvey HS, Kimsey IJ, Al-Hashimi HM (2013). "A historical account of Hoogsteen base-pairs in duplex DNA". Биополимеры. 99 (12): 955–68. Дои:10.1002/bip.22334. ЧВК 3844552. PMID 23818176.
- ^ Clausen-Schaumann H, Rief M, Tolksdorf C, Gaub HE (April 2000). "Mechanical stability of single DNA molecules". Биофизический журнал. 78 (4): 1997–2007. Bibcode:2000BpJ....78.1997C. Дои:10.1016/S0006-3495(00)76747-6. ЧВК 1300792. PMID 10733978.
- ^ Chalikian TV, Völker J, Plum GE, Breslauer KJ (July 1999). "A more unified picture for the thermodynamics of nucleic acid duplex melting: a characterization by calorimetric and volumetric techniques". Труды Национальной академии наук Соединенных Штатов Америки. 96 (14): 7853–58. Bibcode:1999PNAS...96.7853C. Дои:10.1073/pnas.96.14.7853. ЧВК 22151. PMID 10393911.
- ^ deHaseth PL, Helmann JD (June 1995). "Open complex formation by Escherichia coli RNA polymerase: the mechanism of polymerase-induced strand separation of double helical DNA". Molecular Microbiology. 16 (5): 817–24. Дои:10.1111/j.1365-2958.1995.tb02309.x. PMID 7476180. S2CID 24479358.
- ^ Isaksson J, Acharya S, Barman J, Cheruku P, Chattopadhyaya J (December 2004). "Single-stranded adenine-rich DNA and RNA retain structural characteristics of their respective double-stranded conformations and show directional differences in stacking pattern" (PDF). Биохимия. 43 (51): 15996–6010. Дои:10.1021/bi048221v. PMID 15609994. В архиве (PDF) from the original on 10 June 2007.
- ^ Designation of the two strands of DNA В архиве 24 апреля 2008 г. Wayback Machine JCBN/NC-IUB Newsletter 1989. Retrieved 7 May 2008
- ^ Hüttenhofer A, Schattner P, Polacek N (May 2005). "Non-coding RNAs: hope or hype?". Тенденции в генетике. 21 (5): 289–97. Дои:10.1016/j.tig.2005.03.007. PMID 15851066.
- ^ Munroe SH (November 2004). "Diversity of antisense regulation in eukaryotes: multiple mechanisms, emerging patterns". Журнал клеточной биохимии. 93 (4): 664–71. Дои:10.1002/jcb.20252. PMID 15389973. S2CID 23748148.
- ^ Makalowska I, Lin CF, Makalowski W (February 2005). "Overlapping genes in vertebrate genomes". Вычислительная биология и химия. 29 (1): 1–12. Дои:10.1016/j.compbiolchem.2004.12.006. PMID 15680581.
- ^ Johnson ZI, Chisholm SW (November 2004). "Properties of overlapping genes are conserved across microbial genomes". Геномные исследования. 14 (11): 2268–72. Дои:10.1101/gr.2433104. ЧВК 525685. PMID 15520290.
- ^ Lamb RA, Horvath CM (August 1991). "Diversity of coding strategies in influenza viruses". Тенденции в генетике. 7 (8): 261–66. Дои:10.1016/0168-9525(91)90326-L. ЧВК 7173306. PMID 1771674.
- ^ Benham CJ, Mielke SP (2005). "DNA mechanics" (PDF). Ежегодный обзор биомедицинской инженерии. 7: 21–53. Дои:10.1146/annurev.bioeng.6.062403.132016. PMID 16004565. S2CID 1427671.
- ^ а б Champoux JJ (2001). "DNA topoisomerases: structure, function, and mechanism" (PDF). Ежегодный обзор биохимии. 70: 369–413. Дои:10.1146/annurev.biochem.70.1.369. PMID 11395412. S2CID 18144189.
- ^ а б Wang JC (June 2002). «Клеточные роли топоизомераз ДНК: молекулярная перспектива». Обзоры природы Молекулярная клеточная биология. 3 (6): 430–40. Дои:10.1038 / nrm831. PMID 12042765. S2CID 205496065.
- ^ Basu HS, Feuerstein BG, Zarling DA, Shafer RH, Marton LJ (October 1988). "Recognition of Z-RNA and Z-DNA determinants by polyamines in solution: experimental and theoretical studies". Журнал биомолекулярной структуры и динамики. 6 (2): 299–309. Дои:10.1080/07391102.1988.10507714. PMID 2482766.
- ^ Franklin RE, Gosling RG (6 March 1953). "The Structure of Sodium Thymonucleate Fibres I. The Influence of Water Content" (PDF). Acta Crystallogr. 6 (8–9): 673–77. Дои:10.1107/S0365110X53001939. В архиве (PDF) из оригинала от 9 января 2016 г.
Franklin RE, Gosling RG (1953). "The structure of sodium thymonucleate fibres. II. The cylindrically symmetrical Patterson function" (PDF). Acta Crystallogr. 6 (8–9): 678–85. Дои:10.1107/S0365110X53001940. - ^ а б Franklin RE, Gosling RG (April 1953). "Molecular configuration in sodium thymonucleate" (PDF). Природа. 171 (4356): 740–41. Bibcode:1953Natur.171..740F. Дои:10.1038/171740a0. PMID 13054694. S2CID 4268222. В архиве (PDF) from the original on 3 January 2011.
- ^ а б Wilkins MH, Stokes AR, Wilson HR (April 1953). "Molecular structure of deoxypentose nucleic acids" (PDF). Природа. 171 (4356): 738–40. Bibcode:1953Natur.171..738W. Дои:10.1038/171738a0. PMID 13054693. S2CID 4280080. В архиве (PDF) from the original on 13 May 2011.
- ^ Leslie AG, Arnott S, Chandrasekaran R, Ratliff RL (October 1980). "Polymorphism of DNA double helices". Журнал молекулярной биологии. 143 (1): 49–72. Дои:10.1016/0022-2836(80)90124-2. PMID 7441761.
- ^ Baianu IC (1980). "Structural Order and Partial Disorder in Biological systems". Бык. Математика. Биол. 42 (4): 137–41. Дои:10.1007 / BF02462372. S2CID 189888972.
- ^ Хосеманн Р., Багчи Р.Н. (1962). Прямой анализ дифракции на веществе. Амстердам - Нью-Йорк: Издательство Северной Голландии.
- ^ Баяну IC (1978). «Рассеяние рентгеновских лучей частично неупорядоченными мембранными системами» (PDF). Acta Crystallogr A. 34 (5): 751–53. Bibcode:1978AcCrA..34..751B. Дои:10.1107 / S0567739478001540.
- ^ Wahl MC, Sundaralingam M (1997). «Кристаллические структуры дуплексов А-ДНК». Биополимеры. 44 (1): 45–63. Дои:10.1002 / (SICI) 1097-0282 (1997) 44: 1 <45 :: AID-BIP4> 3.0.CO; 2- #. PMID 9097733.
- ^ Лу XJ, Шаккед З., Олсон В.К. (июль 2000 г.). «Конформационные мотивы А-формы в лиганд-связанных структурах ДНК». Журнал молекулярной биологии. 300 (4): 819–40. Дои:10.1006 / jmbi.2000.3690. PMID 10891271.
- ^ Ротенбург С., Ф. Кох-Нольте, Ф. Хааг (декабрь 2001 г.). «Метилирование ДНК и образование Z-ДНК как медиаторы количественных различий в экспрессии аллелей». Иммунологические обзоры. 184: 286–98. Дои:10.1034 / j.1600-065x.2001.1840125.x. PMID 12086319. S2CID 20589136.
- ^ О ДБ, Ким Ю.Г., Рич А. (декабрь 2002 г.). «Z-ДНК-связывающие белки могут действовать как мощные эффекторы экспрессии генов in vivo». Труды Национальной академии наук Соединенных Штатов Америки. 99 (26): 16666–71. Bibcode:2002PNAS ... 9916666O. Дои:10.1073 / pnas.262672699. ЧВК 139201. PMID 12486233.
- ^ Globus N, Blandford RD (20 мая 2020 г.). «Хиральная загадка жизни». Письма в астрофизический журнал. 895 (1): L11. arXiv:2002.12138. Bibcode:2020ApJ ... 895L..11G. Дои:10.3847 / 2041-8213 / ab8dc6. S2CID 211532577.
- ^ Палмер Дж. (2 декабря 2010 г.). «Любящие мышьяк бактерии могут помочь в охоте за инопланетной жизнью». Новости BBC. В архиве из оригинала от 3 декабря 2010 г.. Получено 2 декабря 2010.
- ^ а б Бортман Х (2 декабря 2010 г.). «Бактерии, поедающие мышьяк, открывают новые возможности для инопланетной жизни». Space.com. В архиве из оригинала от 4 декабря 2010 г.. Получено 2 декабря 2010.
- ^ Кацнельсон А. (2 декабря 2010 г.). «Микроб, поедающий мышьяк, может изменить химию жизни». Новости природы. Дои:10.1038 / новости.2010.645. В архиве из оригинала 12 февраля 2012 г.
- ^ Кресси Д. (3 октября 2012 г.). "'Бактерия Arsenic-life все-таки предпочитает фосфор ». Новости природы. Дои:10.1038 / природа.2012.11520. S2CID 87341731.
- ^ а б Грейдер CW, Блэкберн EH (декабрь 1985 г.). «Идентификация специфической активности теломер-терминальной трансферазы в экстрактах Tetrahymena». Клетка. 43 (2 Pt 1): 405–13. Дои:10.1016/0092-8674(85)90170-9. PMID 3907856.
- ^ а б c Наджент К.И., Лундблад В. (апрель 1998 г.). «Обратная транскриптаза теломеразы: компоненты и регуляция». Гены и развитие. 12 (8): 1073–85. Дои:10.1101 / gad.12.8.1073. PMID 9553037.
- ^ Райт В.Е., Тесмер В.М., Хаффман К.Э., Левен С.Д., Шей Дж.В. (ноябрь 1997 г.). «Нормальные человеческие хромосомы имеют длинные теломерные выступы, богатые G, на одном конце». Гены и развитие. 11 (21): 2801–09. Дои:10.1101 / gad.11.21.2801. ЧВК 316649. PMID 9353250.
- ^ Создано из В архиве 17 октября 2016 г. Wayback Machine
- ^ а б Бердж С., Паркинсон Г. Н., Хейзел П., Тодд А. К., Нейдл С. (2006). «Квадруплексная ДНК: последовательность, топология и структура». Исследования нуклеиновых кислот. 34 (19): 5402–15. Дои:10.1093 / нар / gkl655. ЧВК 1636468. PMID 17012276.
- ^ Паркинсон Г.Н., Ли М.П., Нейдл С. (июнь 2002 г.). «Кристаллическая структура параллельных квадруплексов теломерной ДНК человека». Природа. 417 (6891): 876–80. Bibcode:2002Натура.417..876П. Дои:10.1038 / природа755. PMID 12050675. S2CID 4422211.
- ^ Гриффит Дж. Д., Комо Л., Розенфилд С., Стансель Р. М., Бьянки А., Мосс Х., де Ланге Т. (май 1999 г.). «Теломеры млекопитающих заканчиваются большой дуплексной петлей». Клетка. 97 (4): 503–14. CiteSeerX 10.1.1.335.2649. Дои:10.1016 / S0092-8674 (00) 80760-6. PMID 10338214. S2CID 721901.
- ^ Seeman NC (ноябрь 2005 г.). «ДНК позволяет контролировать структуру материи в наномасштабе». Ежеквартальные обзоры биофизики. 38 (4): 363–71. Дои:10.1017 / S0033583505004087. ЧВК 3478329. PMID 16515737.
- ^ Уоррен М. (21 февраля 2019 г.). «Четыре новых буквы ДНК - двойной алфавит жизни». Природа. 566 (7745): 436. Bibcode:2019Natur.566..436W. Дои:10.1038 / d41586-019-00650-8. PMID 30809059.
- ^ Хошика С., Леал Н.А., Ким М.Дж., Ким М.С., Каралкар Н.Б., Ким Г.Дж. и др. (22 февраля 2019 г.). «ДНК и РНК Хатимодзи: генетическая система с восемью строительными блоками (платный доступ)». Наука. 363 (6429): 884–887. Bibcode:2019Научный ... 363..884H. Дои:10.1126 / science.aat0971. ЧВК 6413494. PMID 30792304.
- ^ Ху Кью, Розенфельд MG (2012). «Эпигенетическая регуляция эмбриональных стволовых клеток человека». Границы генетики. 3: 238. Дои:10.3389 / fgene.2012.00238. ЧВК 3488762. PMID 23133442.
- ^ Клозе Р.Дж., Берд А.П. (февраль 2006 г.). «Метилирование геномной ДНК: метка и ее медиаторы». Тенденции в биохимических науках. 31 (2): 89–97. Дои:10.1016 / j.tibs.2005.12.008. PMID 16403636.
- ^ Птица А (январь 2002 г.). «Паттерны метилирования ДНК и эпигенетическая память». Гены и развитие. 16 (1): 6–21. Дои:10.1101 / gad.947102. PMID 11782440.
- ^ Уолш С.П., Сюй Г.Л. (2006). «Метилирование цитозина и репарация ДНК». Актуальные темы микробиологии и иммунологии. 301: 283–315. Дои:10.1007/3-540-31390-7_11. ISBN 3-540-29114-8. PMID 16570853.
- ^ Kriaucionis S, Heintz N (май 2009 г.). «Основание ядерной ДНК 5-гидроксиметилцитозин присутствует в нейронах Пуркинье и в мозге». Наука. 324 (5929): 929–30. Bibcode:2009Наука ... 324..929K. Дои:10.1126 / science.1169786. ЧВК 3263819. PMID 19372393.
- ^ Рател Д., Раванат Дж. Л., Бергер Ф., Вион Д. (март 2006 г.). «N6-метиладенин: другое метилированное основание ДНК». BioEssays. 28 (3): 309–15. Дои:10.1002 / bies.20342. ЧВК 2754416. PMID 16479578.
- ^ Гоммерс-Ампт Дж. Х., Ван Леувен Ф., де Бир А. Л., Флигентхарт Дж. Ф., Диздароглу М., Ковалак Дж. А., Крейн П. Ф., Борст П. (декабрь 1993 г.). «Бета-D-глюкозил-гидроксиметилурацил: новое модифицированное основание, присутствующее в ДНК паразитических простейших T. brucei». Клетка. 75 (6): 1129–36. Дои:10.1016 / 0092-8674 (93) 90322-Н. PMID 8261512. S2CID 24801094.
- ^ Создано из PDB 1JDG
- ^ Дуки Т., Рейно-Анжелен А., Кадет Дж., Сейдж Е. (август 2003 г.). «Фотопродукты бипиримидина, а не окислительные повреждения, являются основным типом повреждений ДНК, участвующих в генотоксическом эффекте солнечного УФА-излучения». Биохимия. 42 (30): 9221–26. Дои:10.1021 / bi034593c. PMID 12885257.
- ^ Кадет Дж., Делатур Т., Дуки Т., Гаспаруто Д., Пуже Дж. П., Раванат Дж. Л., Саувайго С. (март 1999 г.). «Гидроксильные радикалы и повреждение оснований ДНК». Мутационные исследования. 424 (1–2): 9–21. Дои:10.1016 / S0027-5107 (99) 00004-4. PMID 10064846.
- ^ Бекман КБ, Эймс Б.Н. (август 1997 г.). «Окислительный распад ДНК». Журнал биологической химии. 272 (32): 19633–36. Дои:10.1074 / jbc.272.32.19633. PMID 9289489.
- ^ Валери К., Повирк Л.Ф. (сентябрь 2003 г.). "Регуляция и механизмы репарации двухцепочечных разрывов у млекопитающих". Онкоген. 22 (37): 5792–812. Дои:10.1038 / sj.onc.1206679. PMID 12947387.
- ^ Джонсон Дж. (28 декабря 2010 г.). «Выявление доисторических опухолей и дебаты». Нью-Йорк Таймс. В архиве из оригинала от 24 июня 2017 г.
Если бы мы прожили достаточно долго, рано или поздно все мы заболели бы раком.
- ^ Альбертс Б., Джонсон А., Льюис Дж. И др. (2002). «Предотвратимые причины рака». Молекулярная биология клетки (4-е изд.). Нью-Йорк: Наука Гарланд. ISBN 0-8153-4072-9. В архиве из оригинала от 2 января 2016 г.
Невзирая на обстоятельства, следует ожидать некоторую неснижаемую фоновую заболеваемость раком: мутаций невозможно полностью избежать, потому что они являются неизбежным следствием фундаментальных ограничений точности репликации ДНК, как обсуждалось в главе 5. Если бы человек мог жить долго Достаточно того, что по крайней мере одна из его или ее клеток неизбежно накопит набор мутаций, достаточных для развития рака.
- ^ Бернштейн Х, Пейн CM, Бернштейн С, Гарвал Х, Дворак К. (2008). «Рак и старение как последствия неремонтированного повреждения ДНК». В Kimura H, Suzuki A (ред.). Новое исследование повреждений ДНК. Нью-Йорк: Nova Science Publishers. С. 1–47. ISBN 978-1-60456-581-2. В архиве из оригинала 25 октября 2014 г.
- ^ Hoeijmakers JH (октябрь 2009 г.). «Повреждение ДНК, старение и рак». Медицинский журнал Новой Англии. 361 (15): 1475–85. Дои:10.1056 / NEJMra0804615. PMID 19812404.
- ^ Фрейтас А.А., де Магальяйнс Дж. П. (2011). «Обзор и оценка теории старения повреждения ДНК». Мутационные исследования. 728 (1–2): 12–22. Дои:10.1016 / j.mrrev.2011.05.001. PMID 21600302.
- ^ Фергюсон Л. Р., Денни В. А. (сентябрь 1991 г.). «Генетическая токсикология акридинов». Мутационные исследования. 258 (2): 123–60. Дои:10.1016 / 0165-1110 (91) 90006-Н. PMID 1881402.
- ^ Стивенс Т.Д., Бунде С.Дж., Филлмор Б.Дж. (июнь 2000 г.). «Механизм действия в тератогенезе талидомида». Биохимическая фармакология. 59 (12): 1489–99. Дои:10.1016 / S0006-2952 (99) 00388-3. PMID 10799645.
- ^ Джеффри AM (1985). «Модификация ДНК химическими канцерогенами». Фармакология и терапия. 28 (2): 237–72. Дои:10.1016/0163-7258(85)90013-0. PMID 3936066.
- ^ Braña MF, Cacho M, Gradillas A, de Pascual-Teresa B, Ramos A (ноябрь 2001 г.). «Интеркаляторы как противоопухолевые препараты». Текущий фармацевтический дизайн. 7 (17): 1745–80. Дои:10.2174/1381612013397113. PMID 11562309.
- ^ Вентер Дж. К., Адамс, доктор медицины, Майерс Э. У., Ли П. У., Фреска Р. Дж., Саттон Г. Г. и др. (Февраль 2001 г.). «Последовательность генома человека». Наука. 291 (5507): 1304–51. Bibcode:2001Научный ... 291.1304V. Дои:10.1126 / science.1058040. PMID 11181995.
- ^ Танбихлер М., Ван С.К., Шапиро Л. (октябрь 2005 г.). «Бактериальный нуклеоид: высокоорганизованная и динамичная структура». Журнал клеточной биохимии. 96 (3): 506–21. Дои:10.1002 / jcb.20519. PMID 15988757.
- ^ Вольфсберг Т.Г., Макэнтайр Дж., Шулер Г.Д. (февраль 2001 г.). «Путеводитель по проекту генома человека». Природа. 409 (6822): 824–26. Bibcode:2001 Натур.409..824Вт. Дои:10.1038/35057000. PMID 11236998.
- ^ Грегори Т.Р. (январь 2005 г.). «Загадка ценности С у растений и животных: обзор параллелей и призыв к партнерству». Анналы ботаники. 95 (1): 133–46. Дои:10.1093 / aob / mci009. ЧВК 4246714. PMID 15596463.
- ^ Бирни Э, Стаматояннопулос Ж.А., Дутта А., Гиго Р., Джингерас Т.Р., Маргулис Э.Х. и др. (Июнь 2007 г.). «Идентификация и анализ функциональных элементов в 1% генома человека в рамках пилотного проекта ENCODE». Природа. 447 (7146): 799–816. Bibcode:2007Натура.447..799Б. Дои:10.1038 / природа05874. ЧВК 2212820. PMID 17571346.
- ^ Создано из PDB 1MSW В архиве 6 января 2008 г. Wayback Machine
- ^ Pidoux AL, Allshire RC (март 2005 г.). «Роль гетерохроматина в функции центромеры». Философские труды Лондонского королевского общества. Серия B, Биологические науки. 360 (1455): 569–79. Дои:10.1098 / rstb.2004.1611. ЧВК 1569473. PMID 15905142.
- ^ Харрисон П.М., Хеги Х., Баласубраманиан С., Ласкомб Н.М., Бертон П., Эчолс Н., Джонсон Т., Герштейн М. (февраль 2002 г.). «Молекулярные окаменелости в геноме человека: идентификация и анализ псевдогенов в хромосомах 21 и 22». Геномные исследования. 12 (2): 272–80. Дои:10.1101 / гр.207102. ЧВК 155275. PMID 11827946.
- ^ Харрисон П.М., Герштейн М. (май 2002 г.). «Изучение геномов через эоны: семейства белков, псевдогены и эволюция протеома». Журнал молекулярной биологии. 318 (5): 1155–74. Дои:10.1016 / S0022-2836 (02) 00109-2. PMID 12083509.
- ^ Альба М (2001). «Репликативные ДНК-полимеразы». Геномная биология. 2 (1): ОБЗОРЫ 3002. Дои:10.1186 / gb-2001-2-1-reviews3002. ЧВК 150442. PMID 11178285.
- ^ Тани К., Насу М. (2010). «Роль внеклеточной ДНК в бактериальных экосистемах». В Кикучи Ю., Рыкова Е.Ю. (ред.). Внеклеточные нуклеиновые кислоты. Springer. стр.25 –38. ISBN 978-3-642-12616-1.
- ^ Власов В.В., Лактионов П.П., Рыкова Е.Ю. (июль 2007 г.). «Внеклеточные нуклеиновые кислоты». BioEssays. 29 (7): 654–67. Дои:10.1002 / bies.20604. PMID 17563084. S2CID 32463239.
- ^ Финкель С.Е., Кольтер Р. (ноябрь 2001 г.). «ДНК как питательное вещество: новая роль гомологов генов бактериальной компетентности». Журнал бактериологии. 183 (21): 6288–93. Дои:10.1128 / JB.183.21.6288-6293.2001. ЧВК 100116. PMID 11591672.
- ^ Mulcahy H, Charron-Mazenod L, Lewenza S (ноябрь 2008 г.). «Внеклеточная ДНК хелатирует катионы и индуцирует устойчивость к антибиотикам в биопленках Pseudomonas aeruginosa». Патогены PLOS. 4 (11): e1000213. Дои:10.1371 / journal.ppat.1000213. ЧВК 2581603. PMID 19023416.
- ^ Берн С., Кисела Д. Т., Брун Ю. В. (август 2010 г.). «Внеклеточная ДНК бактерий препятствует оседанию подвижных клеток-потомков внутри биопленки». Молекулярная микробиология. 77 (4): 815–29. Дои:10.1111 / j.1365-2958.2010.07267.x. ЧВК 2962764. PMID 20598083.
- ^ Whitchurch CB, Tolker-Nielsen T, Ragas PC, Mattick JS (февраль 2002 г.). «Внеклеточная ДНК, необходимая для образования бактериальной биопленки». Наука. 295 (5559): 1487. Дои:10.1126 / science.295.5559.1487. PMID 11859186.
- ^ Ху В., Ли Л., Шарма С., Ван Дж., Макхарди И., Люкс Р., Ян З., Хе Икс, Гимзевски Дж. К., Ли Й, Ши В. (2012). «ДНК создает и укрепляет внеклеточный матрикс в биопленках Myxococcus xanthus, взаимодействуя с экзополисахаридами». PLOS ONE. 7 (12): e51905. Bibcode:2012PLoSO ... 751905H. Дои:10.1371 / journal.pone.0051905. ЧВК 3530553. PMID 23300576.
- ^ Хуэй Л., Бьянки Д.В. (февраль 2013 г.). «Последние достижения в пренатальном исследовании генома человеческого плода». Тенденции в генетике. 29 (2): 84–91. Дои:10.1016 / j.tig.2012.10.013. ЧВК 4378900. PMID 23158400.
- ^ Фут А.Д., Томсен П.Ф., Свегаард С., Уолберг М., Килгаст Дж., Кин Л.А. и др. (2012). «Изучение возможности использования ДНК окружающей среды (еДНК) для генетического мониторинга морских млекопитающих». PLOS ONE. 7 (8): e41781. Bibcode:2012PLoSO ... 741781F. Дои:10.1371 / journal.pone.0041781. ЧВК 3430683. PMID 22952587.
- ^ «Исследователи обнаруживают наземных животных с помощью ДНК в близлежащих водоемах».
- ^ Sandman K, Pereira SL, Reeve JN (декабрь 1998 г.). «Разнообразие прокариотических хромосомных белков и происхождение нуклеосом». Клеточные и молекулярные науки о жизни. 54 (12): 1350–64. Дои:10.1007 / с000180050259. PMID 9893710. S2CID 21101836.
- ^ Dame RT (май 2005 г.). «Роль нуклеоид-ассоциированных белков в организации и уплотнении бактериального хроматина». Молекулярная микробиология. 56 (4): 858–70. Дои:10.1111 / j.1365-2958.2005.04598.x. PMID 15853876. S2CID 26965112.
- ^ Люгер К., Мэдер А.В., Ричмонд Р.К., Сарджент Д.Ф., Ричмонд Т.Дж. (сентябрь 1997 г.). «Кристаллическая структура ядерной частицы нуклеосомы при разрешении 2,8 A». Природа. 389 (6648): 251–60. Bibcode:1997Натура.389..251Л. Дои:10.1038/38444. PMID 9305837. S2CID 4328827.
- ^ Jenuwein T, Allis CD (август 2001 г.). «Перевод гистонового кода» (PDF). Наука. 293 (5532): 1074–80. Дои:10.1126 / science.1063127. PMID 11498575. S2CID 1883924. В архиве (PDF) из оригинала от 8 августа 2017 года.
- ^ Ито Т (2003). «Сборка и ремоделирование нуклеосом». Актуальные темы микробиологии и иммунологии. 274: 1–22. Дои:10.1007/978-3-642-55747-7_1. ISBN 978-3-540-44208-0. PMID 12596902.
- ^ Томас Джо (август 2001 г.). «HMG1 и 2: архитектурные ДНК-связывающие белки». Сделки биохимического общества. 29 (Pt 4): 395–401. Дои:10.1042 / BST0290395. PMID 11497996.
- ^ Гроссчедл Р., Гизе К., Пагель Дж. (Март 1994 г.). «Белки домена HMG: архитектурные элементы сборки нуклеопротеиновых структур». Тенденции в генетике. 10 (3): 94–100. Дои:10.1016/0168-9525(94)90232-1. PMID 8178371.
- ^ Iftode C, Даниэли Y, Боровец JA (1999). «Репликационный белок А (RPA): эукариотический SSB». Критические обзоры в биохимии и молекулярной биологии. 34 (3): 141–80. Дои:10.1080/10409239991209255. PMID 10473346.
- ^ Создано из PDB 1LMB В архиве 6 января 2008 г. Wayback Machine
- ^ Майерс Л.С., Корнберг Р.Д. (2000). «Медиатор регуляции транскрипции». Ежегодный обзор биохимии. 69: 729–49. Дои:10.1146 / annurev.biochem.69.1.729. PMID 10966474.
- ^ Шпигельман Б.М., Генрих Р. (октябрь 2004 г.). «Биологический контроль с помощью регулируемых транскрипционных коактиваторов». Клетка. 119 (2): 157–67. Дои:10.1016 / j.cell.2004.09.037. PMID 15479634.
- ^ Ли З, Ван Калькар С., Цюй С., Кавени В.К., Чжан М.К., Рен Б. (июль 2003 г.). «Глобальная регуляторная роль транскрипции c-Myc в клетках лимфомы Беркитта». Труды Национальной академии наук Соединенных Штатов Америки. 100 (14): 8164–69. Bibcode:2003ПНАС..100.8164Л. Дои:10.1073 / pnas.1332764100. ЧВК 166200. PMID 12808131.
- ^ Создано из PDB 1RVA В архиве 6 января 2008 г. Wayback Machine
- ^ Бикл Т.А., Крюгер Д.Х. (июнь 1993 г.). «Биология рестрикции ДНК». Микробиологические обзоры. 57 (2): 434–50. Дои:10.1128 / MMBR.57.2.434-450.1993. ЧВК 372918. PMID 8336674.
- ^ а б Доэрти AJ, Suh SW (ноябрь 2000 г.). «Структурная и механистическая консервация в ДНК-лигазах». Исследования нуклеиновых кислот. 28 (21): 4051–58. Дои:10.1093 / nar / 28.21.4051. ЧВК 113121. PMID 11058099.
- ^ Шеффлер А. Дж., Бергер Дж. М. (декабрь 2005 г.). «Последние достижения в понимании взаимосвязи структура-функция в механизме топоизомеразы типа II». Сделки биохимического общества. 33 (Pt 6): 1465–70. Дои:10.1042 / BST20051465. PMID 16246147.
- ^ Tuteja N, Tuteja R (май 2004 г.). «Распутывание ДНК-геликаз. Мотив, структура, механизм и функция» (PDF). Европейский журнал биохимии. 271 (10): 1849–63. Дои:10.1111 / j.1432-1033.2004.04094.x. PMID 15128295.
- ^ Джойс CM, Steitz TA (ноябрь 1995 г.). «Полимеразные структуры и функции: вариации на тему?». Журнал бактериологии. 177 (22): 6321–29. Дои:10.1128 / jb.177.22.6321-6329.1995. ЧВК 177480. PMID 7592405.
- ^ Hubscher U, Maga G, Spadari S (2002). «Эукариотические ДНК-полимеразы» (PDF). Ежегодный обзор биохимии. 71: 133–63. Дои:10.1146 / annurev.biochem.71.090501.150041. PMID 12045093. S2CID 26171993.
- ^ Джонсон А, О'Доннелл М (2005). «Репликазы клеточной ДНК: компоненты и динамика на вилке репликации». Ежегодный обзор биохимии. 74: 283–315. Дои:10.1146 / annurev.biochem.73.011303.073859. PMID 15952889.
- ^ а б Tarrago-Litvak L, Andréola ML, Nevinsky GA, Sarih-Cottin L, Litvak S (май 1994 г.). «Обратная транскриптаза ВИЧ-1: от энзимологии к терапевтическому вмешательству». Журнал FASEB. 8 (8): 497–503. Дои:10.1096 / fasebj.8.8.7514143. PMID 7514143. S2CID 39614573.
- ^ Мартинес Э. (декабрь 2002 г.). «Мультибелковые комплексы в транскрипции эукариотических генов». Молекулярная биология растений. 50 (6): 925–47. Дои:10.1023 / А: 1021258713850. PMID 12516863. S2CID 24946189.
- ^ Создано из PDB 1M6G В архиве 10 января 2010 г. Wayback Machine
- ^ Кремер Т., Кремер С. (апрель 2001 г.). «Хромосомные территории, ядерная архитектура и регуляция генов в клетках млекопитающих». Природа Обзоры Генетика. 2 (4): 292–301. Дои:10.1038/35066075. PMID 11283701. S2CID 8547149.
- ^ Пал С., Папп Б., Леркер М.Дж. (май 2006 г.). «Комплексный взгляд на эволюцию белка». Природа Обзоры Генетика. 7 (5): 337–48. Дои:10.1038 / nrg1838. PMID 16619049. S2CID 23225873.
- ^ О'Дрисколл М., Джегго, штат Пенсильвания (январь 2006 г.). «Роль восстановления двухцепочечных разрывов - выводы из генетики человека». Природа Обзоры Генетика. 7 (1): 45–54. Дои:10.1038 / nrg1746. PMID 16369571. S2CID 7779574.
- ^ Vispé S, Defais M (октябрь 1997 г.). «Белок Rad51 млекопитающих: гомолог RecA с плейотропными функциями». Биохимия. 79 (9–10): 587–92. Дои:10.1016 / S0300-9084 (97) 82007-X. PMID 9466696.
- ^ Нил MJ, Кини S (июль 2006 г.). «Уточнение механики обмена нити ДНК при мейотической рекомбинации». Природа. 442 (7099): 153–58. Bibcode:2006Натура.442..153Н. Дои:10.1038 / природа04885. ЧВК 5607947. PMID 16838012.
- ^ Дикман М.Дж., Инглстон С.М., Седельникова С.Е., Рафферти Дж.Б., Ллойд Р.Г., Грасби Дж.А., Хорнби Д.П. (ноябрь 2002 г.). «Резольвазома RuvABC». Европейский журнал биохимии. 269 (22): 5492–501. Дои:10.1046 / j.1432-1033.2002.03250.x. PMID 12423347. S2CID 39505263.
- ^ Джойс Г.Ф. (июль 2002 г.). «Древность эволюции на основе РНК». Природа. 418 (6894): 214–21. Bibcode:2002Натура.418..214J. Дои:10.1038 / 418214a. PMID 12110897. S2CID 4331004.
- ^ Оргель Л.Е. (2004). «Пребиотическая химия и происхождение мира РНК». Критические обзоры в биохимии и молекулярной биологии. 39 (2): 99–123. CiteSeerX 10.1.1.537.7679. Дои:10.1080/10409230490460765. PMID 15217990.
- ^ Давенпорт RJ (май 2001 г.). «Рибозимы. Копирование в мире РНК». Наука. 292 (5520): 1278a – 1278. Дои:10.1126 / science.292.5520.1278a. PMID 11360970. S2CID 85976762.
- ^ Сатмари Э. (апрель 1992 г.). «Каков оптимальный размер генетического алфавита?». Труды Национальной академии наук Соединенных Штатов Америки. 89 (7): 2614–18. Bibcode:1992PNAS ... 89.2614S. Дои:10.1073 / pnas.89.7.2614. ЧВК 48712. PMID 1372984.
- ^ Линдал Т. (апрель 1993 г.). «Неустойчивость и распад первичной структуры ДНК». Природа. 362 (6422): 709–15. Bibcode:1993Натура.362..709L. Дои:10.1038 / 362709a0. PMID 8469282. S2CID 4283694.
- ^ Вриланд Р.Х., Розенцвейг В.Д., Пауэрс Д.В. (октябрь 2000 г.). «Выделение галотолерантной бактерии возрастом 250 миллионов лет из первичного кристалла соли». Природа. 407 (6806): 897–900. Bibcode:2000Натура407..897В. Дои:10.1038/35038060. PMID 11057666. S2CID 9879073.
- ^ Хебсгаард МБ, Филлипс М.Дж., Виллерслев Э. (май 2005 г.). «Геологически древняя ДНК: факт или артефакт?». Тенденции в микробиологии. 13 (5): 212–20. Дои:10.1016 / j.tim.2005.03.010. PMID 15866038.
- ^ Никль, округ Колумбия, Learn GH, Rain MW, Mullins JI, Mittler JE (январь 2002 г.). «Удивительно современная ДНК для« бактерии »возрастом 250 миллионов лет. Журнал молекулярной эволюции. 54 (1): 134–37. Bibcode:2002JMolE..54..134N. Дои:10.1007 / s00239-001-0025-х. PMID 11734907. S2CID 24740859.
- ^ Каллахан М.П., Смит К.Э., Кливз Х.Дж., Ружичка Дж., Стерн Дж.С., Главин Д.П., House CH, Дворкин JP (август 2011 г.). «Углеродистые метеориты содержат широкий спектр внеземных азотистых оснований». Труды Национальной академии наук Соединенных Штатов Америки. 108 (34): 13995–98. Bibcode:2011PNAS..10813995C. Дои:10.1073 / pnas.1106493108. ЧВК 3161613. PMID 21836052.
- ^ Steigerwald J (8 августа 2011 г.). «Исследователи НАСА: строительные блоки ДНК могут быть созданы в космосе». НАСА. В архиве из оригинала от 23 июня 2015 г.. Получено 10 августа 2011.
- ^ ScienceDaily Staff (9 августа 2011 г.). «Строительные блоки ДНК могут быть созданы в космосе, - свидетельствуют данные НАСА». ScienceDaily. В архиве из оригинала 5 сентября 2011 г.. Получено 9 августа 2011.
- ^ Марлер Р. (3 марта 2015 г.). «НАСА Эймс воспроизводит строительные блоки жизни в лаборатории». НАСА. В архиве из оригинала 5 марта 2015 г.. Получено 5 марта 2015.
- ^ Гофф С.П., Берг П. (декабрь 1976 г.). «Создание гибридных вирусов, содержащих сегменты ДНК фага SV40 и лямбда, и их размножение в культивируемых клетках обезьян». Клетка. 9 (4 PT 2): 695–705. Дои:10.1016/0092-8674(76)90133-1. PMID 189942. S2CID 41788896.
- ^ Худебин Л.М. (2007). «Трансгенные животные модели в биомедицинских исследованиях». Обзоры и протоколы Target Discovery и Validation. Методы молекулярной биологии. 360. С. 163–202. Дои:10.1385/1-59745-165-7:163. ISBN 978-1-59745-165-9. PMID 17172731.
- ^ Дэниэл Х., Дхингра А (апрель 2002 г.). «Мультигенная инженерия: рассвет новой захватывающей эры в биотехнологии». Текущее мнение в области биотехнологии. 13 (2): 136–41. Дои:10.1016 / S0958-1669 (02) 00297-5. ЧВК 3481857. PMID 11950565.
- ^ Работа D (ноябрь 2002 г.). «Биотехнология растений в сельском хозяйстве». Биохимия. 84 (11): 1105–10. Дои:10.1016 / S0300-9084 (02) 00013-5. PMID 12595138.
- ^ Кертис С., Херевард Дж. (29 августа 2017 г.). «От места преступления до зала суда: путешествие образца ДНК». Разговор. В архиве из оригинала 22 октября 2017 г.. Получено 22 октября 2017.
- ^ Коллинз А., Мортон Н. Э. (июнь 1994 г.). «Отношения правдоподобия для идентификации ДНК». Труды Национальной академии наук Соединенных Штатов Америки. 91 (13): 6007–11. Bibcode:1994PNAS ... 91.6007C. Дои:10.1073 / пнас.91.13.6007. ЧВК 44126. PMID 8016106.
- ^ Вейр Б.С., Триггс С.М., Старлинг Л., Стоуэлл Л.И., Уолш К.А., Баклтон Дж. (Март 1997 г.). «Интерпретация смесей ДНК» (PDF). Журнал судебной медицины. 42 (2): 213–22. Дои:10.1520 / JFS14100J. PMID 9068179. S2CID 14511630.
- ^ Джеффрис А.Дж., Уилсон В., Тейн С.Л. (1985). «Индивидуальные« отпечатки пальцев »ДНК человека». Природа. 316 (6023): 76–79. Bibcode:1985Натура.316 ... 76J. Дои:10.1038 / 316076a0. PMID 2989708. S2CID 4229883.
- ^ Колин Вилы - первое обвинение в убийстве на основании доказательств ДНК также оправдывает главного подозреваемого Forensic Science Service, доступ 23 декабря 2006 г.
- ^ «ДНК-идентификация при массовых смертельных исходах». Национальный институт юстиции. Сентябрь 2006 г. Архивировано с оригинал 12 ноября 2006 г.
- ^ «Тесты крови на отцовство, которые работают на ранних сроках беременности» New York Times 20 июня 2012 г. В архиве 24 июня 2017 г. Wayback Machine
- ^ а б Брейкер Р.Р., Джойс Г.Ф. (декабрь 1994 г.). «Фермент ДНК, расщепляющий РНК». Химия и биология. 1 (4): 223–29. Дои:10.1016/1074-5521(94)90014-0. PMID 9383394.
- ^ Чандра М., Сачдева А., Сильверман С.К. (октябрь 2009 г.). «ДНК-катализируемый гидролиз ДНК, специфичный для последовательности». Природа Химическая Биология. 5 (10): 718–20. Дои:10.1038 / nchembio.201. ЧВК 2746877. PMID 19684594.
- ^ Карми Н., Шульц Л.А., Брейкер Р.Р. (декабрь 1996 г.). «Отбор саморасщепляющихся ДНК in vitro». Химия и биология. 3 (12): 1039–46. Дои:10.1016 / S1074-5521 (96) 90170-2. PMID 9000012.
- ^ Тораби С.Ф., Ву П., МакГи К.Э., Чен Л., Хван К., Чжэн Н., Ченг Дж., Лу Ий (май 2015 г.). «Выбор in vitro натрий-специфического ДНКзима и его применение во внутриклеточном зондировании». Труды Национальной академии наук Соединенных Штатов Америки. 112 (19): 5903–08. Bibcode:2015ПНАС..112.5903Т. Дои:10.1073 / pnas.1420361112. ЧВК 4434688. PMID 25918425.
- ^ Baldi P, Брунак С (2001). Биоинформатика: подход машинного обучения. MIT Press. ISBN 978-0-262-02506-5. OCLC 45951728.
- ^ Гасфилд Д. (15 января 1997 г.). Алгоритмы на строках, деревьях и последовательностях: информатика и вычислительная биология. Издательство Кембриджского университета. ISBN 978-0-521-58519-4.
- ^ Sjölander K (январь 2004 г.). «Филогеномный вывод молекулярной функции белков: достижения и проблемы». Биоинформатика. 20 (2): 170–79. CiteSeerX 10.1.1.412.943. Дои:10.1093 / биоинформатика / bth021. PMID 14734307.
- ^ Mount DM (2004). Биоинформатика: анализ последовательности и генома (2-е изд.). Колд-Спринг-Харбор, Нью-Йорк: Лаборатория Колд-Спринг-Харбор. ISBN 0-87969-712-1. OCLC 55106399.
- ^ Ротемунд П.В. (март 2006 г.). «Складывание ДНК для создания наноразмерных форм и узоров» (PDF). Природа. 440 (7082): 297–302. Bibcode:2006Натура.440..297R. Дои:10.1038 / природа04586. PMID 16541064. S2CID 4316391.
- ^ Андерсен Э.С., Донг М., Нильсен М.М., Ян К., Субрамани Р., Мамдух В., Голас М.М., Сандер Б., Старк Х., Оливейра К.Л., Педерсен Дж. С., Биркедал В., Бесенбахер Ф., Готельф К. В., Кьемс Дж. (Май 2009 г.). «Самостоятельная сборка наноразмерного бокса ДНК с управляемой крышкой». Природа. 459 (7243): 73–76. Bibcode:2009Натура 459 ... 73А. Дои:10.1038 / природа07971. HDL:11858 / 00-001M-0000-0010-9362-B. PMID 19424153. S2CID 4430815.
- ^ Ishitsuka Y, Ha T (май 2009 г.). «ДНК-нанотехнология: наномашина оживает». Природа Нанотехнологии. 4 (5): 281–82. Bibcode:2009НатНа ... 4..281И. Дои:10.1038 / nnano.2009.101. PMID 19421208.
- ^ Алдай Ф.А., Палмер А.Л., Слейман Х.Ф. (сентябрь 2008 г.). «Сборка материалов с использованием ДНК в качестве руководства». Наука. 321 (5897): 1795–99. Bibcode:2008Научный ... 321.1795A. Дои:10.1126 / science.1154533. PMID 18818351. S2CID 2755388.
- ^ Рэй Г.А. (2002). «Знакомство с ветвями древа жизни с помощью ДНК». Геномная биология. 3 (1): ОБЗОРЫ0001. Дои:10.1186 / gb-2001-3-1-reviews0001. ЧВК 150454. PMID 11806830.
- ^ Panda D, Molla KA, Baig MJ, Swain A, Behera D, Dash M (май 2018 г.). «ДНК как устройство для хранения цифровой информации: надежда или шумиха?». 3 Биотехнологии. 8 (5): 239. Дои:10.1007 / s13205-018-1246-7. ЧВК 5935598. PMID 29744271.
- ^ Акрам Ф., Хак И.Ю., Али Х., Лагари А.Т. (октябрь 2018 г.). «Тенденции хранения цифровых данных в ДНК: обзор». Отчеты по молекулярной биологии. 45 (5): 1479–1490. Дои:10.1007 / s11033-018-4280-у. PMID 30073589. S2CID 51905843.
- ^ Мишер Ф (1871). "Ueber die chemische Zusammensetzung der Eiterzellen" [О химическом составе гнойных клеток]. Medicinisch-chemische Untersuchungen (на немецком). 4: 441–60.
Ich habe mich daher später mit meinen Versuchen an die ganzen Kerne gehalten, die Trennung der Körper, die ich einstweilen ohne weiteres Präjudiz als lösliches und unlösliches Nuclein bezeichnen will, einem günstigelassend Material ünem günstigelassend Material ürper. (Поэтому в своих экспериментах я впоследствии ограничился целым ядром, оставив более благоприятному материалу разделение веществ, которое в настоящее время, без дальнейших предубеждений, я буду обозначать как растворимый и нерастворимый ядерный материал («нуклеин»).
- ^ Дахм Р. (январь 2008 г.). «Открытие ДНК: Фридрих Мишер и первые годы исследований нуклеиновых кислот». Генетика человека. 122 (6): 565–81. Дои:10.1007 / s00439-007-0433-0. PMID 17901982. S2CID 915930.
- ^ Видеть:
- Коссель А (1879). "Ueber Nucleïn der Hefe" [О нуклеине в дрожжах]. Zeitschrift für Physiologische Chemie (на немецком). 3: 284–91.
- Коссель А (1880 г.). "Ueber Nucleïn der Hefe II" [О нуклеине в дрожжах, Часть 2]. Zeitschrift für Physiologische Chemie (на немецком). 4: 290–95.
- Коссель А (1881). "Ueber die Verbreitung des Hypoxanthins im Thier- und Pflanzenreich" [О распределении гипоксантинов в царстве животных и растений]. Zeitschrift für Physiologische Chemie (на немецком). 5: 267–71.
- Коссель А (1881). Trübne KJ (ред.). Untersuchungen über die Nucleine und ihre Spaltungsprodukte [Исследования нуклеина и продуктов его расщепления] (на немецком). Страсбург, Германия. п. 19.
- Коссель А (1882). «Убер Ксантин и Гипоксантин» [О ксантине и гипоксантине]. Zeitschrift für Physiologische Chemie. 6: 422–31.
- Альбрек Коссель (1883) "Zur Chemie des Zellkerns" В архиве 17 ноября 2017 в Wayback Machine (О химии клеточного ядра), Zeitschrift für Physiologische Chemie, 7 : 7–22.
- Коссель А. (1886 г.). "Weitere Beiträge zur Chemie des Zellkerns" [Дальнейшие вклады в химию ядра клетки]. Zeitschrift für Physiologische Chemie (на немецком). 10: 248–64.
На стр. 264, Коссель прозорливо заметил: Der Erforschung der Quantitativen Verhältnisse der vier stickstoffreichen Basen, der Abhängigkeit ihrer Menge von den Physiologischen Zuständen der Zelle, verspricht wichtige Aufschlüsse Physiology über die-element. (Изучение количественных соотношений четырех азотистых оснований [и] зависимости их количества от физиологического состояния клетки - обещает важное понимание фундаментальных физиолого-химических процессов.)
- ^ Джонс ME (сентябрь 1953 г.). "Альбрехт Коссель, биографический очерк". Йельский журнал биологии и медицины. 26 (1): 80–97. ЧВК 2599350. PMID 13103145.
- ^ Левен PA, Джейкобс WA (1909). «Über Inosinsäure». Berichte der Deutschen Chemischen Gesellschaft (на немецком). 42: 1198–203. Дои:10.1002 / cber.190904201196.
- ^ Левен PA, Джейкобс WA (1909). "Über die Hefe-Nucleinsäure". Berichte der Deutschen Chemischen Gesellschaft (на немецком). 42 (2): 2474–78. Дои:10.1002 / cber.190904202148.
- ^ Левен П. (1919). «Строение нуклеиновой кислоты дрожжей». J Biol Chem. 40 (2): 415–24.
- ^ Коэн Дж. С., Португалия FH (1974). «Поиск химического строения ДНК» (PDF). Коннектикут Медицина. 38 (10): 551–52, 554–57. PMID 4609088.
- ^ Кольцов предположил, что генетическая информация клетки закодирована в длинной цепи аминокислот. Видеть:
- Кольцов, Н. К. (12 декабря 1927 г.). Физико-химические основы морфологии [Физико-химические основы морфологии] (Речь). 3-е Всесоюзное совещание зоологов, анатомов и гистологов. Ленинград, СССР.
- Печатается на: Кольцов, Н. К. (1928). "Физико-химические основы морфологии" [Физико-химические основы морфологии]. Успехи экспериментальной биологии (Успехи экспериментальной биологии) серия B (на русском). 7 (1): ?.
- Перепечатано на немецком языке как: Кольцов Н.К. (1928). "Physikalisch-chemische Grundlagen der Morphologie" [Физико-химические основы морфологии]. Biologisches Zentralblatt (на немецком). 48 (6): 345–69.
- В 1934 году Кольцов утверждал, что белки, содержащие генетическую информацию клетки, воспроизводятся. Видеть: Кольцов Н. (октябрь 1934 г.). «Строение хромосом в слюнных железах дрозофилы». Наука. 80 (2075): 312–13. Bibcode:1934Sci .... 80..312K. Дои:10.1126 / science.80.2075.312. PMID 17769043.
Со страницы 313: «Я думаю, что размер хромосом в слюнных железах [дрозофилы] определяется умножением генонемы. Этим термином я обозначаю осевую нить хромосомы, в которой генетики определяют линейную комбинацию генов; … В нормальной хромосоме обычно есть только одна генонема; до деления клетки эта генонема разделилась на две цепи ».
- ^ Сойфер В.Н. (сентябрь 2001 г.). «Последствия политической диктатуры для российской науки». Природа Обзоры Генетика. 2 (9): 723–29. Дои:10.1038/35088598. PMID 11533721. S2CID 46277758.
- ^ Гриффит Ф (январь 1928 г.). «Значение типов пневмококков». Журнал гигиены. 27 (2): 113–59. Дои:10.1017 / S0022172400031879. ЧВК 2167760. PMID 20474956.
- ^ Лоренц М.Г., Ваккернагель В. (сентябрь 1994 г.). «Бактериальный перенос генов путем естественной генетической трансформации в окружающей среде». Микробиологические обзоры. 58 (3): 563–602. Дои:10.1128 / MMBR.58.3.563-602.1994. ЧВК 372978. PMID 7968924.
- ^ Браше Дж. (1933). "Исследования по синтезу тимонуклеарного кулона по развитию де л'оэф д'Орсен". Archives de Biologie (на итальянском). 44: 519–76.
- ^ Буриан Р. (1994). "Цитохимическая эмбриология Жана Браше: связь с обновлением биологии во Франции?" (PDF). В Debru C, Gayon J, Picard JF (ред.). Les Sciences Biologiques et Medicales во Франции 1920–1950. Cahiers pour I'histoire de la recherche. 2. Париж: Издания CNRS. С. 207–20.
- ^ Видеть:
- Эстбери В. Т., Белл Ф. О. (1938). «Некоторые недавние разработки в области рентгеновского исследования белков и родственных структур» (PDF). Симпозиумы Колд-Спринг-Харбор по количественной биологии. 6: 109–21. Дои:10.1101 / sqb.1938.006.01.013. Архивировано из оригинал (PDF) 14 июля 2014 г.
- Эстбери В. Т. (1947). «Рентгенологические исследования нуклеиновых кислот». Симпозиумы Общества экспериментальной биологии (1): 66–76. PMID 20257017. Архивировано из оригинал 5 июля 2014 г.
- ^ Эйвери О. Т., Маклауд К. М., Маккарти М. (февраль 1944 г.). "Исследования химической природы вещества, индуцирующего трансформацию пневмококков: индукция трансформации фракцией дезоксирибонуклеиновой кислоты, выделенной из пневмококка типа III". Журнал экспериментальной медицины. 79 (2): 137–58. Дои:10.1084 / jem.79.2.137. ЧВК 2135445. PMID 19871359.
- ^ Херши А.Д., Чейз М. (май 1952 г.). «Независимые функции вирусного белка и нуклеиновой кислоты в росте бактериофага». Журнал общей физиологии. 36 (1): 39–56. Дои:10.1085 / jgp.36.1.39. ЧВК 2147348. PMID 12981234.
- ^ Полинг Л., Кори Р. Б. (февраль 1953 г.). «Предлагаемая структура нуклеиновых кислот». Труды Национальной академии наук Соединенных Штатов Америки. 39 (2): 84–97. Bibcode:1953ПНАС ... 39 ... 84П. Дои:10.1073 / pnas.39.2.84. ЧВК 1063734. PMID 16578429.
- ^ Рентгенограмма B-ДНК справа от этого связанного изображения В архиве 25 мая 2012 в Archive.today
- ^ Шварц Дж. (2008). В погоне за геном: от Дарвина к ДНК. Кембридж, Массачусетс: Издательство Гарвардского университета.
- ^ Регис Э (2009). Что такое жизнь ?: исследование природы жизни в век синтетической биологии. Оксфорд: Oxford University Press. п. 52. ISBN 978-0-19-538341-6.
- ^ «Двойная спираль ДНК: 50 лет». Архивы природы. Архивировано из оригинал 5 апреля 2015 г.
- ^ «Исходное рентгеновское изображение». Государственная библиотека Орегона. В архиве из оригинала 30 января 2009 г.. Получено 6 февраля 2011.
- ^ "Нобелевская премия по физиологии и медицине 1962 г.". Nobelprize.org.
- ^ Мэддокс Б. (январь 2003 г.). "Двойная спираль и" обиженная героиня "'" (PDF). Природа. 421 (6921): 407–08. Bibcode:2003Натура.421..407М. Дои:10.1038 / природа01399. PMID 12540909. S2CID 4428347. В архиве (PDF) из оригинала 17 октября 2016 г.
- ^ Крик Ф (1955). Заметка для Галстук-клуба РНК (PDF) (Речь). Кембридж, Англия. Архивировано из оригинал (PDF) 1 октября 2008 г.
- ^ Мезельсон М., Шталь Ф.В. (июль 1958 г.). "Репликация ДНК в Escherichia Coli". Труды Национальной академии наук Соединенных Штатов Америки. 44 (7): 671–82. Bibcode:1958ПНАС ... 44..671М. Дои:10.1073 / pnas.44.7.671. ЧВК 528642. PMID 16590258.
- ^ "Нобелевская премия по физиологии и медицине 1968 г.". Nobelprize.org.
- ^ Молитесь L (2008). «Открытие структуры и функции ДНК: Уотсон и Крик». Природное образование. 1 (1): 100.
дальнейшее чтение
- Берри А, Уотсон Дж. (2003). ДНК: секрет жизни. Нью-Йорк: Альфред А. Кнопф. ISBN 0-375-41546-7.
- Калладин CR, Дрю Х.Р., Луизи Б.Ф., Трэверс А.А. (2003). Понимание ДНК: молекула и как она работает. Амстердам: Elsevier Academic Press. ISBN 0-12-155089-3.
- Карина Д., Клейтон Дж (2003). 50 лет ДНК. Бейзингстоук: Пэлгрейв Макмиллан. ISBN 1-4039-1479-6.
- Джадсон HF (1979). Восьмой день творения: создатели революции в биологии (2-е изд.). Лабораторный пресс Колд Спринг-Харбор. ISBN 0-671-22540-5.
- Olby RC (1994). Путь к двойной спирали: открытие ДНК. Нью-Йорк: Dover Publications. ISBN 0-486-68117-3., впервые опубликовано в октябре 1974 года Макмилланом, с предисловием Фрэнсиса Крика; полный учебник ДНК, пересмотренный в 1994 году с 9-страничным постскриптумом
- Миклас Д (2003). Наука о ДНК: первый курс. Колд Спринг Харбор Пресс. ISBN 978-0-87969-636-8.
- Ридли М (2006). Фрэнсис Крик: первооткрыватель генетического кода. Ашленд, Огайо: Выдающиеся жизни, книги Атласа. ISBN 0-06-082333-X.
- Olby RC (2009). Фрэнсис Крик: биография. Плейнвью, Нью-Йорк: Лаборатория Колд-Спринг-Харбор. ISBN 978-0-87969-798-3.
- Розенфельд I (2010). ДНК: графический путеводитель по молекуле, потрясшей мир. Издательство Колумбийского университета. ISBN 978-0-231-14271-7.
- Шульц М., Cannon Z (2009). Материал жизни: графическое руководство по генетике и ДНК. Хилл и Ван. ISBN 978-0-8090-8947-5.
- Стент GS, Уотсон Дж (1980). Двойная спираль: личный отчет об открытии структуры ДНК. Нью-Йорк: Нортон. ISBN 0-393-95075-1.
- Уотсон Дж (2004). ДНК: секрет жизни. Случайный дом. ISBN 978-0-09-945184-6.
- Уилкинс М (2003). Третий человек двойной спирали автобиография Мориса Уилкинса. Кембридж, Англия: University Press. ISBN 0-19-860665-6.
внешняя ссылка
| Библиотечные ресурсы о ДНК |
- ДНК в Керли
- Прогнозирование сайта связывания ДНК на белке
- ДНК - игра с двойной спиралью С официального сайта Нобелевской премии
- ДНК под электронным микроскопом
- Учебный центр Dolan DNA
- Двойная спираль: 50 лет ДНК, Природа
- Протеопедия ДНК
- Протеопедия Forms_of_DNA
- ENCODE Thread Explorer ENCODE домашняя страница. Природа
- Двойная спираль 1953–2003 гг. Национальный центр биотехнологического образования
- Модули генетического образования для учителей – ДНК с самого начала Методическое пособие
- PDB Молекула месяца ДНК
- Ключ к химии наследственности найден Нью-Йорк Таймс Июнь 1953 года. Первое освещение в американской газете открытия структуры ДНК.
- Olby R (Январь 2003 г.). «Тихий дебют двойной спирали». Природа. 421 (6921): 402–05. Bibcode:2003Натура.421..402O. Дои:10.1038 / природа01397. PMID 12540907.
- ДНК с самого начала Еще один сайт Центра изучения ДНК, посвященный ДНК, генам и наследственности от Менделя до проекта генома человека.
- Реестр личных бумаг Фрэнсиса Крика за 1938 - 2007 гг. в библиотеке специальных коллекций Мандевиля, Калифорнийский университет в Сан-Диего
- Семистраничное рукописное письмо, которое Крик отправил своему 12-летнему сыну Майклу в 1953 году с описанием структуры ДНК. Видеть Медаль Крика уходит с молотка, Природа, 5 апреля 2013 г.

