Энхансер РНК - Enhancer RNA
Энхансерные РНК (эРНК) представляют собой класс относительно коротких некодирующая РНК молекул (50-2000 нуклеотидов), транскрибируемых из последовательности ДНК усилитель регионы. Впервые они были обнаружены в 2010 году с помощью общегеномных методов, таких как РНК-последовательность и ChIP-seq.[1] эРНК можно подразделить на два основных класса: 1D-эРНК и 2D-эРНК, которые различаются в первую очередь по размеру, полиаденилирование состояние и транскрипционная направленность.[2] Экспрессия данной эРНК, по-видимому, коррелирует с активностью соответствующего ей усилитель в зависимости от контекста. Все больше данных свидетельствует о том, что эРНК активно играют роль в транскрипционная регуляция в СНГ И в транс, и хотя механизмы их действия остаются неясными, было предложено несколько моделей.[2]
Открытие
Усилители как сайты экстрагенных транскрипция были первоначально обнаружены в ходе полногеномных исследований, которые идентифицировали энхансеры как общие области РНК-полимераза II (РНК pol II) связывание и некодирующая РНК транскрипция.[3][1] Уровень взаимодействия РНК pol II с энхансером и образования РНК-транскрипта оказался сильно различающимся среди этих первоначальных исследований. Использование явного хроматин сигнатурные пики, значительная часть (~ 70%) экстрагенный РНК Pol II Было обнаружено, что сайты начала транскрипции перекрываются усилитель сайты в мышиный макрофаги.[3] Из 12 000 нейронный усилители в мышь геном, было обнаружено, что почти 25% сайтов связывают РНК Pol II и генерировать стенограммы.[4] Эти эРНК, в отличие от информационных РНК (мРНК), не подвергались модификации посредством полиаденилирование, как правило, были короткими, некодирующими и транскрибировались в двух направлениях. Более поздние исследования показали транскрипцию другого типа эРНК, генерируемых посредством однонаправленной транскрипции, которые были длиннее и содержали поли Хвост.[5] Кроме того, уровни эРНК коррелировали с мРНК уровни поблизости гены, предполагая потенциальную регуляторную и функциональную роль этих некодирующих усилитель РНК молекулы.[1]
Биогенез
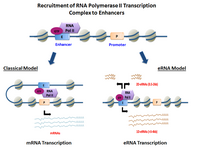
Резюме
эРНК транскрибируются с Последовательности ДНК вверх по течению и вниз по течению из экстрагенный усилитель регионы.[6] Ранее несколько моделей усилители продемонстрировали способность напрямую нанимать РНК Pol II и вообще факторы транскрипции и образуют пре-инициирующий комплекс (ПОС) до сайт начала транскрипции на промоутер из гены. В определенных ячейка типы, активированные усилители продемонстрировали способность набирать РНК Pol II а также предоставить шаблон для активных транскрипция своих местных последовательности.[3][1]
В зависимости от направленности транскрипция, усилитель регионы генерируют два разных типа некодирующих стенограммы, 1D-эРНК и 2D-эРНК. Природа пре-инициации сложна и специфична. факторы транскрипции набран в усилитель может контролировать тип генерируемых эРНК. После транскрипция, большинство эРНК остается в ядро.[7] В целом эРНК очень нестабильны и активно деградируют под действием ядерной энергии. экзосома. Не все усилители транскрибируются, с нетранскрибируемыми усилители значительно превосходит количество записанных на порядок десятков тысяч в каждом конкретном случае ячейка тип.[3]
1D эРНК
В большинстве случаев однонаправленный транскрипция из усилитель регионы генерируют длинные (> 4 т.п.н.) и полиаденилированные эРНК. Усилители которые генерируют полиА + эРНК, имеют более низкий H3K4me1 / me3 в их хроматин сигнатуры, чем 2D-эРНК.[5] ПолиА + эРНК отличаются от длинных мультиэксонных поли-транскриптов (меРНК), которые генерируются транскрипция инициирование при внутригенных усилители. Эти длинные некодирующие РНК, которые точно отражают хозяина ген Структура за исключением альтернативного первого экзон, демонстрируют слабый кодовый потенциал.[8] В результате полиА + 1D-эРНК могут представлять собой смешанную группу РНК с истинным энхансером и мультиэксонных РНК.
2D эРНК
Двунаправленный транскрипция в усилитель сайты генерируют сравнительно более короткие (0,5-2 т.п.н.) и неполиаденилированные эРНК. Усилители которые генерируют полиА-эРНК, имеют хроматин сигнатура с более высоким соотношением H3K4me1 / me3, чем 1D-эРНК. В целом, усилитель транскрипция и производство двунаправленных эРНК демонстрируют сильную корреляцию усилитель деятельность на транскрипция гена.[9]
Предлагаемые механизмы функционирования

Представления о том, что не все усилители транскрибируются одновременно, и что эРНК транскрипция коррелирует со специфической активностью энхансера, что подтверждает идею о том, что отдельные эРНК несут различные и соответствующие биологические функции.[2] Однако до сих пор нет консенсус о функциональном значении эРНК. Кроме того, эРНК могут легко разрушаться через экзосомы и бессмысленный распад, что ограничивает их потенциал как важных регуляторов транскрипции.[10] На сегодняшний день предложены четыре основные модели функции эРНК:[2] каждый поддерживается разными линиями экспериментальный свидетельство.
Транскрипционный шум
Поскольку многочисленные исследования показали, что РНК Pol II можно найти на очень большом количестве экстрагенный регионов, возможно, что эРНК просто представляют собой продукт случайного «протекающего» транскрипция и не имеют функционального значения.[3] Таким образом, неспецифическая активность РНК Pol II позволит экстрагенный транскрипционный шум на сайтах, где хроматин уже находится в открытом и транскрипционно компетентном состоянии. Это могло бы объяснить даже тканеспецифическую экспрессию эРНК.[11] поскольку открытые участки также зависят от ткани.
Транскрипционно-зависимые эффекты
РНК Pol II -опосредованный ген транскрипция вызывает локальное открытие хроматин государство за счет набора гистоновые ацетилтрансферазы и другие гистон модификаторы, способствующие эухроматин формирование. Было высказано предположение, что наличие этих ферменты может также вызвать открытие хроматин в усилитель регионы, которые обычно находятся в отдаленных местах, но могут быть привлечены для нацеливания гены через зацикливание ДНК.[12] Таким образом, в этой модели эРНК экспрессируются в ответ на РНК Pol II транскрипция и поэтому не несут биологический функция.
Функциональная активность в снг
В то время как две предыдущие модели предполагали, что эРНК не являются функционально значимыми, этот механизм утверждает, что эРНК являются функциональными. молекулы эта выставка СНГ Мероприятия. В этой модели эРНК могут локально рекрутировать регулирующий белки на их собственном сайте синтеза. Подтверждая эту гипотезу, расшифровки стенограммы, происходящие из усилители перед Циклин D1 считается, что ген служит адаптерами для набора гистоновые ацетилтрансферазы. Было обнаружено, что истощение этих эРНК приводит к Циклин D1 подавление транскрипции.[7]
Функциональная активность в транс
Последняя модель предполагает транскрипционный регуляция эРНК на расстоянии хромосомный локации. За счет дифференцированного набора белок комплексы, эРНК могут влиять на транскрипционный компетенция конкретных места. Evf-2 представляет собой хороший пример такого транс регуляторная эРНК, поскольку она может индуцировать экспрессию Dlx2, что, в свою очередь, может увеличивать активность Dlx5 и Dlx6 усилители.[13] Транс-действующий эРНК также могут работать в СНГ, наоборот.
Экспериментальное обнаружение
Обнаружение эРНК произошло сравнительно недавно (2010 г.) и стало возможным благодаря использованию общегеномных методов исследования, таких как Секвенирование РНК (РНК-последовательность ) и иммунопреципитация-секвенирование хроматина (ChIP-seq ).[1] РНК-последовательность позволяет прямую идентификацию эРНК путем сопоставления обнаруженного транскрипта с соответствующим усилитель последовательность через биоинформатический анализы.[14] ChIP-seq представляет собой менее прямой способ оценки усилитель транскрипция но также может предоставить важную информацию в виде конкретной хроматин знаки связаны с активными усилители.[15] Хотя некоторые данные остаются противоречивыми, в литературе существует консенсус о том, что лучшая комбинация посттрансляционных модификаций гистонов при активном усилители сделан из H2AZ, H3K27ac, и высокое соотношение H3K4me1 к H3K4me3.[15][16][17] ЧИП также можно проводить эксперименты с антитела которые признают РНК Pol II, которые можно найти на сайтах активных транскрипция.[3] Экспериментальное обнаружение эРНК затруднено их низкой эндогенный стабильность, предоставленная экзосома деградация и бессмысленный распад.[10] Продолжительный анализ с помощью высокопроизводительное секвенирование техника - еще один способ обнаружения эРНК. Прецизионное последовательное секвенирование (PRO-seq) позволяет обнаруживать РНК, которые активно транскрибируются, и имеет разрешение до одной пары оснований.[18] Тем не менее, тот факт, что эРНК, как правило, экспрессируются из активных усилители может сделать их обнаружение полезным инструментом для различения активных и неактивных усилители.
Последствия для развития и болезни
Доказательства того, что эРНК вызывают последующие эффекты на эффективность активации энхансера и транскрипции гена предполагает его функциональные возможности и потенциальную важность. фактор транскрипции p53 было продемонстрировано связывание усилитель областей и генерировать эРНК в p53 -зависимая манера.[19] В рак, p53 играет центральную роль в подавление опухоли так как мутации из ген показаны в 50% случаев опухоли.[20] Эти p53 -граница усилитель области (p53BERs) взаимодействуют с множеством локальных и дистальных ген цели, вовлеченные в ячейка распространение и выживание. Кроме того, показано, что эРНК, генерируемые активацией p53BERs, необходимы для эффективного транскрипция из p53 цель гены, что указывает на вероятную важную регуляторную роль эРНК в подавление опухоли и рак.
Вариации в усилители были замешаны в человеческих болезнь но терапевтический подход к манипулированию усилитель активность в настоящее время невозможна. С появлением эРНК как важных компонентов в усилитель активность, мощная терапевтический инструменты, такие как РНКи может предоставить многообещающие пути к нарушению экспрессии генов.
Рекомендации
- ^ а б c d е Kim TK, Hemberg M, Gray JM, Costa AM, Bear DM, Wu J, Harmin DA, Laptewicz M, Barbara-Haley K, Kuersten S, Markenscoff-Papadimitriou E, Kuhl D, Bito H, Worley PF, Kreiman G, Greenberg ME (май 2010 г.). «Широко распространенная транскрипция энхансеров, регулирующих активность нейронов». Природа. 465 (7295): 182–7. Дои:10.1038 / природа09033. ЧВК 3020079. PMID 20393465.
- ^ а б c d Натоли Г, Андрау Дж. К. (2012). «Некодирующая транскрипция на энхансерах: общие принципы и функциональные модели». Ежегодный обзор генетики. 46: 1–19. Дои:10.1146 / annurev-genet-110711-155459. PMID 22905871.
- ^ а б c d е ж Де Санта Ф, Бароцци I, Миттон Ф, Гислетти С., Поллетти С., Туси Б.К., Мюллер Х., Рагусси Дж., Вей С.Л., Натоли Дж. (Май 2010 г.). Мэттик Дж. С. (ред.). «Большая часть сайтов транскрипции экстрагенной РНК pol II перекрывается энхансерами». PLoS Биология. 8 (5): e1000384. Дои:10.1371 / journal.pbio.1000384. ЧВК 2867938. PMID 20485488.
- ^ Хайнцман Н.Д., Стюарт Р.К., Хон Джи, Фу Й., Чинг К.В., Хокинс Р.Д., Баррера Л.О., Ван Калкар С., Ку Си, Чинг К.А., Ван В., Вен З., Грин Р.Д., Кроуфорд Г.Э., Рен Б. (март 2007 г.). «Отчетливые и предсказуемые сигнатуры хроматина промоторов и энхансеров транскрипции в геноме человека». Природа Генетика. 39 (3): 311–8. Дои:10,1038 / ng1966. PMID 17277777.
- ^ а б Koch F, Fenouil R, Gut M, Cauchy P, Albert TK, Zacarias-Cabeza J, Spicuglia S, de la Chapelle AL, Heidemann M, Hintermair C, Eick D, Gut I, Ferrier P, Andrau JC (июль 2011 г.). «Платформы инициации транскрипции и рекрутирование GTF на тканеспецифичных энхансерах и промоторах». Структурная и молекулярная биология природы. 18 (8): 956–63. Дои:10.1038 / nsmb.2085. PMID 21765417.
- ^ Федосеева Д.М., Кретова О.В., Чуриков Н.А. (2012). «Молекулярный анализ энхансерных РНК и модификаций хроматина в области их синтеза в клетках дрозофилы, обладающих генетическими конструкциями». Доклады. Биохимия и биофизика. 442: 7–11. Дои:10.1134 / S1607672912010012. PMID 22419084.
- ^ а б Ван Икс, Араи С., Сонг Икс, Райхарт Д., Ду К., Паскуаль Г., Темпст П., Розенфельд М.Г., Гласс С.К., Курокава Р. (июль 2008 г.). «Индуцированные нкРНК аллостерически модифицируют РНК-связывающие белки в цис-системе, чтобы ингибировать транскрипцию». Природа. 454 (7200): 126–30. Дои:10.1038 / природа06992. ЧВК 2823488. PMID 18509338.
- ^ Ковальчик М.С., Хьюз Дж. Р., Гаррик Д., Линч М. Д., Шарп Дж. А., Слоан-Стэнли Дж. А., Макгоуэн С. Дж., Де Гобби М., Хоссейни М., Верниммен Д., Браун Дж. М., Грей NE, Коллавин Л., Гиббонс Р. Дж., Флинт Дж., Тейлор С. , Пряжка В.Дж., Милн Т.А., Вуд РГ, Хиггс Д.Р. (февраль 2012 г.). «Внутригенные энхансеры действуют как альтернативные промоторы». Молекулярная клетка. 45 (4): 447–58. Дои:10.1016 / j.molcel.2011.12.021. PMID 22264824.
- ^ Ван Д., Гарсия-Бассет И., Беннер К., Ли В., Су Х, Чжоу Ю., Цю Дж, Лю В., Кайкконен М.Ю., Охги К.А., Гласс С.К., Розенфельд М.Г., Фу XD (май 2011 г.) «Перепрограммирование транскрипции с помощью различных классов энхансеров, функционально определяемых эРНК». Природа. 474 (7351): 390–4. Дои:10.1038 / природа10006. ЧВК 3117022. PMID 21572438.
- ^ а б Wyers F, Rougemaille M, Badis G, Rousselle JC, Dufour ME, Boulay J, Régnault B, Devaux F, Namane A, Séraphin B, Libri D, Jacquier A (июнь 2005 г.). «Транскрипты Cryptic pol II деградируют с помощью пути контроля ядерного качества с участием новой поли (A) полимеразы». Клетка. 121 (5): 725–37. Дои:10.1016 / j.cell.2005.04.030. PMID 15935759.
- ^ Рен Б. (май 2010 г.). «Транскрипция: энхансеры создают некодирующую РНК». Природа. 465 (7295): 173–4. Дои:10.1038 / 465173a. PMID 20463730.
- ^ Обрдлик А., Кукалев А., Луве Е., Фарранц А. К., Капуто Л., Percipalle P (октябрь 2008 г.). «Гистонацетилтрансфераза PCAF связывается с актином и hnRNP U для транскрипции РНК-полимеразы II». Молекулярная и клеточная биология. 28 (20): 6342–57. Дои:10.1128 / MCB.00766-08. ЧВК 2577438. PMID 18710935.
- ^ Фенг Дж., Би Си, Кларк Б.С., Мэди Р., Шах П., Кохц Дж. Д. (июнь 2006 г.). «Некодирующая РНК Evf-2 транскрибируется из ультраконсервативной области Dlx-5/6 и функционирует как коактиватор транскрипции Dlx-2». Гены и развитие. 20 (11): 1470–84. Дои:10.1101 / gad.1416106. ЧВК 1475760. PMID 16705037.
- ^ Ван З., Герштейн М., Снайдер М. (январь 2009 г.). «RNA-Seq: революционный инструмент для транскриптомики». Обзоры природы. Генетика. 10 (1): 57–63. Дои:10.1038 / nrg2484. ЧВК 2949280. PMID 19015660.
- ^ а б Барски А., Куддапах С., Цуй К., Ро Т.Ю., Шонес Д.Э., Ван З., Вей Г., Чепелев И., Чжао К. (май 2007 г.). «Профилирование с высоким разрешением метилирования гистонов в геноме человека». Клетка. 129 (4): 823–37. Дои:10.1016 / j.cell.2007.05.009. PMID 17512414.
- ^ Мелгар М.Ф., Коллинз Ф.С., Сетупати П. (ноябрь 2011 г.). «Открытие активных энхансеров посредством двунаправленной экспрессии коротких транскриптов». Геномная биология. 12 (11): R113. Дои:10.1186 / gb-2011-12-11-r113. ЧВК 3334599. PMID 22082242.
- ^ Creyghton MP, Cheng AW, Welstead GG, Kooistra T, Carey BW, Steine EJ, Hanna J, Lodato MA, Frampton GM, Sharp PA, Boyer LA, Young RA, Jaenisch R (декабрь 2010 г.). «Гистон H3K27ac отделяет активные усилители от ожидаемых и предсказывает состояние развития». Труды Национальной академии наук Соединенных Штатов Америки. 107 (50): 21931–6. Дои:10.1073 / pnas.1016071107. ЧВК 3003124. PMID 21106759.
- ^ Махат ДБ, Квак Х, Бут GT, Джонкерс И.Х., Данко К.Г., Патель Р.К., Уотерс СТ, Мансон К., Core LJ, Лис Дж. Т. (август 2016 г.). «Картирование активных РНК-полимераз с разрешением пар оснований по всему геному с использованием прецизионного анализа ядер (PRO-seq)». Протоколы природы. 11 (8): 1455–76. Дои:10.1038 / nprot.2016.086. ЧВК 5502525. PMID 27442863.
- ^ Melo CA, Drost J, Wijchers PJ, van de Werken H, de Wit E, Oude Vrielink JA, Elkon R, Melo SA, Léveillé N, Kalluri R, de Laat W., Agami R (февраль 2013 г.). «еРНК необходимы для р53-зависимой энхансерной активности и транскрипции гена». Молекулярная клетка. 49 (3): 524–35. Дои:10.1016 / j.molcel.2012.11.021. PMID 23273978.
- ^ Vousden KH, Lu X (август 2002). «Живи или дай умереть: реакция клетки на p53» (PDF). Обзоры природы. Рак. 2 (8): 594–604. Дои:10.1038 / nrc864. PMID 12154352.
