Передача РНК - Transfer RNA

| тРНК | |
|---|---|
| Идентификаторы | |
| Символ | т |
| Рфам | RF00005 |
| Прочие данные | |
| РНК тип | ген, тРНК |
| PDB структуры | PDBe 3icq, 1asy, 1asz, 1il2, 2tra, 3tra, 486d, 1fir, 1yfg, 3eph, 3epj, 3epk, 3epl, 1efw, 1c0a, 2ake, 2azx, 2dr2, 1f7u, 1f7v, 3foz, 2hgp, 2j00, 2j08 2v46, 2v48, 2wdg, 2wdh, 2wdk, 2wdm, 2wh1 |
А переносить РНК (сокращенно тРНК и ранее назывался мРНК, за растворимая РНК[1]) это адаптер молекула состоит из РНК, обычно от 76 до 90 нуклеотиды в длину,[2] который служит физической связью между мРНК и аминокислота последовательность белков. Переносная РНК делает это путем переноса аминокислоты в белковый синтетический аппарат клетки (рибосома ) по указанию комплементарного распознавания 3-нуклеотидной последовательности (кодон ) в информационная РНК (мРНК) 3-нуклеотидной последовательностью (антикодоном) тРНК. Таким образом, тРНК являются необходимым компонентом перевод, биологический синтез новых белки в соответствии с генетический код.
Обзор
В то время как конкретная нуклеотидная последовательность мРНК определяет, какой аминокислоты включены в белковый продукт гена, из которого транскрибируется мРНК, роль тРНК состоит в том, чтобы указать, какая последовательность из генетического кода соответствует какой аминокислоте.[3] МРНК кодирует белок как серию смежных кодонов, каждый из которых распознается определенной тРНК. Один конец тРНК соответствует генетический код в трехнуклеотидной последовательности, называемой антикодон. Антикодон образует три дополнительный пар оснований с кодон в мРНК при биосинтезе белка. На другом конце тРНК находится ковалентное присоединение к аминокислоте, соответствующей последовательности антикодона. Каждый тип молекулы тРНК может быть присоединен только к одному типу аминокислот, поэтому каждый организм имеет много типов тРНК. Поскольку генетический код содержит несколько кодонов, которые определяют одну и ту же аминокислоту, существует несколько молекул тРНК, несущих разные антикодоны, которые несут одну и ту же аминокислоту. 3 ’конец катализируется ферментами, называемыми аминоацил тРНК синтетазы. Во время синтеза белка тРНК с присоединенными аминокислотами доставляются в рибосома белками, называемыми коэффициенты удлинения, которые способствуют ассоциации тРНК с рибосомой, синтезу нового полипептида и транслокации (перемещению) рибосомы вдоль мРНК. Если антикодон тРНК совпадает с мРНК, другая тРНК уже связаны с рибосомой переносит растущую полипептидную цепь с ее 3 ’конца на аминокислоту, присоединенную к 3’ концу вновь доставленной тРНК, реакция, катализируемая рибосомой. Большое количество отдельных нуклеотидов в молекуле тРНК может быть химически модифицированный, часто метилирование или же дезамидирование. Эти необычные основания иногда влияют на взаимодействие тРНК с рибосомы и иногда встречаются в антикодон для изменения свойств пары оснований.[4]
Структура
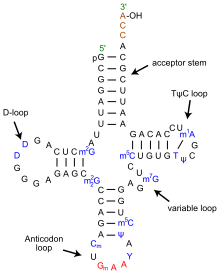
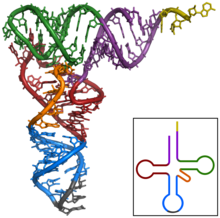
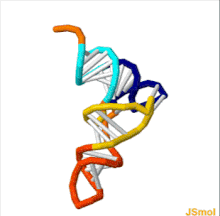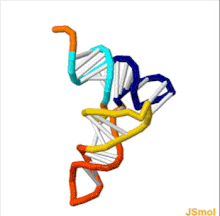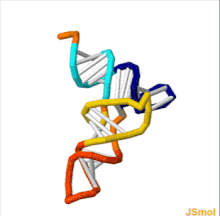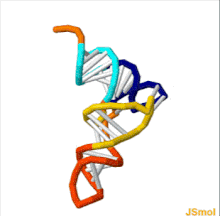
Структура тРНК может быть разложена на ее первичная структура, это вторичная структура (обычно визуализируется как структура клеверного листа), и это третичная структура[6] (все тРНК имеют аналогичную L-образную трехмерную структуру, которая позволяет им вписываться в п и А сайты рибосома ). Структура клеверного листа становится трехмерной L-образной структурой за счет коаксиального набора спиралей, что является обычным Третичная структура РНК Длина каждого плеча, а также `` диаметр '' петли в молекуле тРНК варьируются от вида к виду.[6][7]Структура тРНК состоит из следующего:
- А 5'-концевой фосфат группа.
- Акцепторный стержень представляет собой стержень из 7-9 пар оснований (п.н.), образованный спариванием оснований 5'-концевого нуклеотида с 3'-концевым нуклеотидом (который содержит 3'-концевую группу CCA, используемую для присоединения амино кислота). В общем, такие 3'-концевые тРНК-подобные структуры обозначаются как 'геномные теги '. Акцепторный стержень может содержать пары оснований, отличные от Watson-Crick.[6][8]
- Хвост CCA - это цитозин -цитозин-аденин последовательность на 3'-конце молекулы тРНК. Аминокислота, загруженная на тРНК посредством аминоацил тРНК синтетазы, чтобы сформировать аминоацил-тРНК, ковалентно связана с 3'-гидроксильной группой на хвосте CCA.[9] Эта последовательность важна для распознавания тРНК ферментами и важна для трансляции.[10][11] У прокариот последовательность CCA транскрибируется в некоторых последовательностях тРНК. В большинстве прокариотических тРНК и эукариотических тРНК последовательность CCA добавляется во время процессинга и поэтому не появляется в гене тРНК.[12]
- В Рука D представляет собой ножку длиной от 4 до 6 пар оснований, оканчивающуюся петлей, которая часто содержит дигидроуридин.[6]
- Плечо антикодона представляет собой ножку из 5 п.н., петля которой содержит антикодон.[6] Первичная структура тРНК 5'-к-3 'содержит антикодон, но в обратном порядке, поскольку для чтения мРНК от 5'-к-3' требуется направленность 3'-к-5 '.
- В Т рука представляет собой ствол длиной от 4 до 5 пар оснований, содержащий последовательность TΨC, где Ψ - это псевдоуридин, модифицированный уридин.[6]
- Базы, которые были изменены, особенно метилирование (например. тРНК (гуанин-N7 -) - метилтрансфераза ), встречаются в нескольких положениях по всей тРНК. Первое основание антикодона или положение колебания иногда изменяется на инозин (получено из аденина), Queuosine (производное от гуанина), уридин-5-оксиуксусная кислота (производное от урацила), 5-метиламинометил-2-тиоуридин (производное от урацила) или лизидин (получено из цитозина).[13]
Антикодон
An антикодон[14] единица из трех нуклеотиды соответствующие трем основаниям мРНК кодон. Каждая тРНК имеет отличную последовательность триплета антикодона, которая может образовывать 3 дополнительный пар оснований к одному или нескольким кодонам аминокислоты. Некоторые антикодоны сочетаются с более чем одним кодоном из-за спаривание базовых колебаний. Часто первый нуклеотид антикодона не обнаруживается на мРНК: инозин, которые могут водородная связь к более чем одному основанию в соответствующей позиции кодона.[4]:29.3.9 В генетический код, обычно одна аминокислота определяется всеми четырьмя возможностями третьего положения или, по крайней мере, обоими пиримидины и пурины; например, аминокислота глицин кодируется последовательностями кодонов GGU, GGC, GGA и GGG. Другие модифицированные нуклеотиды также могут появляться в первой позиции антикодона, иногда известной как «позиция колебания», что приводит к незначительным изменениям генетического кода, как, например, в митохондрии.[15]На клетку требуется 61 тип тРНК, чтобы обеспечить взаимно однозначное соответствие между молекулами тРНК и кодонами, которые определяют аминокислоты, поскольку существует 61 смысловой кодон стандартного генетического кода. Однако многие клетки имеют менее 61 типа тРНК, потому что основание вобуляции способно связываться с несколькими, хотя не обязательно со всеми, кодонами, которые определяют конкретную аминокислоту. Для однозначной трансляции всех 61 смыслового кодона требуется не менее 31 тРНК.[3][16]
Аминоацилирование
Аминоацилирование представляет собой процесс добавления аминоацильной группы к соединению. Он ковалентно связывает аминокислота к CCA 3'-концу молекулы тРНК. каждая тРНК аминоациклирована (или заряжен) с определенной аминокислотой аминоацил тРНК синтетаза. Обычно существует одна аминоацил тРНК синтетаза для каждой аминокислоты, несмотря на то, что может быть более одной тРНК и более одного антикодона для аминокислоты. Распознавание соответствующей тРНК синтетазами не опосредуется исключительно антикодоном, и акцепторный стержень часто играет важную роль.[17]Реакция:
У некоторых организмов может отсутствовать одна или несколько аминофосфат-тРНК-синтетаз. Это приводит к зарядке тРНК химически родственной аминокислотой, и при использовании фермента или ферментов тРНК модифицируется для правильного заряда. Например, Helicobacter pylori отсутствует глутамил-тРНК-синтетаза. Таким образом, глутамат-тРНК-синтетаза заряжает тРНК-глутамин (тРНК-Gln) с глутамат. Затем амидотрансфераза превращает кислотную боковую цепь глутамата в амид, образуя правильно заряженную gln-тРНК-Gln.
Связывание с рибосомой
В рибосома имеет три сайта связывания для молекул тРНК, которые охватывают пространство между двумя рибосомные субъединицы: the А (аминоацил),[19] P (пептидил), и E (выход) сайты. Кроме того, рибосома имеет два других сайта для связывания тРНК, которые используются во время мРНК декодирования или во время инициирования синтез белка. Это сайт T (названный коэффициент удлинения Tu ) и я сайт (инициация).[20][21] Условно сайты связывания тРНК обозначены сайтом на малая рибосомная субъединица в списке первым, а сайт в большая рибосомная субъединица занял второе место. Например, сайт A часто пишется A / A, сайт P - P / P, а сайт E - E / E.[20] Связывающие белки, такие как L27, L2, L14, L15, L16 в A- и P-сайтах, были определены A. P. Czernilofsky et al. Путем аффинного мечения. (Proc. Natl. Акад. Sci, СШАС. 230–234, 1974).
По завершении инициации трансляции первая аминоацил тРНК располагается в сайте P / P и готова к циклу элонгации, описанному ниже. Во время элонгации трансляции тРНК сначала связывается с рибосомой как часть комплекса с фактором элонгации Tu (EF-Tu ) или его эукариотический (eEF-1 ) или архейный аналог. Этот начальный сайт связывания тРНК называется сайтом A / T. На сайте A / T половина A-сайта находится в малая рибосомная субъединица где находится сайт декодирования мРНК. Сайт декодирования мРНК - это место, где мРНК кодон зачитывается во время перевода. Половина Т-образного узла находится в основном на большая рибосомная субъединица где EF-Tu или eEF-1 взаимодействует с рибосомой. После завершения декодирования мРНК аминоацил-тРНК связывается в сайте A / A и готова к следующему этапу. пептидная связь с присоединенной к нему аминокислотой. Пептидил-тРНК, которая переносит растущий полипептид на аминоацил-тРНК, связанную в сайте A / A, связана в сайте P / P. После образования пептидной связи тРНК в сайте P / P деацилируется или имеет свободный 3 ’конец, а тРНК в сайте A / A несет растущую полипептидную цепь. Чтобы обеспечить следующий цикл элонгации, тРНК затем перемещаются через сайты связывания гибридных A / P и P / E, прежде чем завершить цикл и находиться в сайтах P / P и E / E. После того как тРНК A / A и P / P переместились в сайты P / P и E / E, мРНК также переместилась на одну кодон и сайт A / T свободен, готов к следующему раунду декодирования мРНК. Затем тРНК, связанная в сайте E / E, покидает рибосому.
Сайт P / I на самом деле первым связывается с аминоацил тРНК, которая доставляется фактором инициации, называемым IF2 в бактериях.[21] Однако существование сайта P / I у эукариот или архей рибосомы еще не подтверждено. Белок P-сайта L27 был определен с помощью аффинной маркировки E. Collatz и A.P. Czernilofsky (FEBS Lett., Vol. 63, с. 283–286, 1976).
гены тРНК
Организмы различаются по количеству тРНК. гены в их геном. Например, нематода червь C. elegans, обычно используемый модельный организм в генетика учится, имеет 29 647 [22] гены в его ядерный геном, из которых 620 кодируют тРНК.[23][24] Расцветающие дрожжи Saccharomyces cerevisiae имеет 275 генов тРНК в своем геноме.
В геноме человека, который, по оценкам января 2013 года, насчитывает около 20 848 генов, кодирующих белок [25] всего существует 497 ядерных генов, кодирующих молекулы цитоплазматической тРНК, и 324 производных тРНК псевдогены - гены тРНК, как считается, больше не функционируют[26] (хотя было показано, что псевдотРНК участвуют в устойчивость к антибиотикам у бактерий).[27] Регионы в ядерной хромосомы, очень сходные по последовательности с генами митохондриальной тРНК, также были идентифицированы (тРНК-двойники).[28] Эти двойники тРНК также считаются частью ядерная митохондриальная ДНК (гены перенесены из митохондрий в ядро).[28][29]
Как и у всех эукариот, существует 22 митохондриальный гены тРНК[30] в людях. Мутации в некоторых из этих генов были связаны с тяжелыми заболеваниями, такими как Синдром MELAS.
Гены цитоплазматической тРНК можно разделить на 49 семейств в соответствии с их антикодонными характеристиками. Эти гены находятся на всех хромосомах, кроме 22-й и Y-хромосомы. Наблюдается высокая кластеризация на 6р (140 генов тРНК), а также на 1 хромосоме.[26]
В HGNC в сотрудничестве с базой данных геномных тРНК (GtRNAdb ) и эксперты в этой области утвердили уникальные названия человеческих генов, кодирующих тРНК.
Эволюция
Верхняя половина тРНК (состоящая из Т-плеча и акцепторного стержня с 5'-концевой фосфатной группой и 3'-концевой CCA-группой) и нижняя половина (состоящая из D-плеча и антикодонного плеча) являются независимыми единицами в структуре. а также в функции. Верхняя половина могла развиться первой, включая 3'-концевую геномную метку, которая изначально могла иметь помеченные тРНК-подобные молекулы для репликации на ранних стадиях. Мир РНК. Нижняя половина могла развиться позже как расширение, например поскольку синтез белка начался в мире РНК и превратил его в мир рибонуклеопротеинов (Мир RNP ). Этот предлагаемый сценарий называется гипотеза геномного тега. Фактически, тРНК и тРНК-подобные агрегаты имеют важное каталитическое влияние (т. Е. Как рибозимы ) на репликации еще сегодня. Эти роли можно рассматривать как «молекулярные (или химические) окаменелости 'мира РНК.[31]
Геномное содержание тРНК является отличительной чертой геномов среди биологических сфер жизни: археи представляют собой простейшую ситуацию с точки зрения содержания геномной тРНК с одинаковым числом копий генов, бактерии имеют промежуточную ситуацию, а эукарии представляют собой наиболее сложную ситуацию.[32] Eukarya представляет не только большее количество генов тРНК, чем два других царства, но также высокую вариабельность числа копий генов среди разных изоакцепторов, и эта сложность, по-видимому, связана с дупликациями генов тРНК и изменениями в антикодонной специфичности.[нужна цитата ].
Эволюция числа копий гена тРНК у разных видов была связана с появлением специфических ферментов модификации тРНК (уридинметилтрансферазы у бактерий и аденозиндезаминазы у эукарий), которые увеличивают способность декодирования данной тРНК.[32] Например, тРНКAla кодирует четыре различных изоакцептора тРНК (AGC, UGC, GGC и CGC). У Eukarya изоакцепторы AGC чрезвычайно обогащены числом копий гена по сравнению с остальными изоакцепторами, и это коррелирует с его модификацией A-to-I его основания колебания. Та же тенденция была показана для большинства аминокислот эукариальных видов. Действительно, эффект этих двух модификаций тРНК также проявляется в систематической ошибке использования кодонов. Высокоэкспрессируемые гены, по-видимому, обогащены кодонами, которые используют исключительно кодоны, которые будут декодироваться этими модифицированными тРНК, что предполагает возможную роль этих кодонов - и, следовательно, этих модификаций тРНК - в эффективности трансляции.[32]
фрагменты, происходящие от тРНК
Фрагменты, происходящие от тРНК (или tRF), представляют собой короткие молекулы, которые появляются после расщепления зрелых тРНК или транскрипта-предшественника.[33][34][35][36] И цитоплазматические, и митохондриальные тРНК могут продуцировать фрагменты.[нужна цитата ] Существует по крайней мере четыре структурных типа tRF, которые, как полагают, происходят из зрелых тРНК, включая относительно длинные половинки тРНК и короткие 5’-tRF, 3’-tRF и i-tRF.[33][37] ТРНК-предшественник может быть расщеплен с образованием молекул из 5’-лидерной или 3’-концевой последовательности. Ферменты расщепления включают ангиогенин, дайсер, РНКазу Z и РНКазу P.[33][34] Особенно в случае ангиогенина, tRF имеют характерно необычный циклический фосфат на своем 3 ’конце и гидроксильную группу на 5’ конце.[38] tRFs, кажется, играют роль в РНК-интерференция, особенно в подавлении ретровирусов и ретротранспозонов, которые используют тРНК в качестве праймера для репликации. ПолутРНК, расщепляемые ангиогенин также известны как тиРНК. Биогенез более мелких фрагментов, в том числе тех, которые функционируют как пиРНК, менее понятны.[39]
tRFs имеют несколько зависимостей и ролей; такие как демонстрация значительных различий между полами, расами и статусом болезни.[нужна цитата ] Функционально они могут быть загружены на Ago и действовать через пути РНКи,[35][37][40] участвуют в образовании стрессовых гранул,[41] вытеснить мРНК из РНК-связывающих белков[42] или запретить перевод.[43] На системном или организменном уровне четыре типа tRF обладают разнообразным спектром активности. Функционально tRF связаны с вирусной инфекцией,[44] рак,[37] распространение клеток [38] а также с эпигенетической трансгенерационной регуляцией метаболизма.[45]
tRFs не ограничиваются людьми и, как было показано, существуют во многих организмах.[37][46][47][48]
Для желающих узнать больше о tRF доступны два онлайн-инструмента: структура для интерактивного исследования митохондриальный и пнеясный тФрагменты РНК (MINTbase )[49] и реляционная база данных Тперевод рСвязанные с АН Fфрагменты (tRFdb ).[50] MINTbase также предоставляет схему именования для именования tRF, называемых tRF-номерные знаки (или MINTcodes), который не зависит от генома; схема сжимает последовательность РНК в более короткую строку.
Сконструированные тРНК
Искусственные супрессорные тРНК-удлинители используются для включения неприродные аминокислоты на бессмысленных кодонах, помещенных в кодирующую последовательность гена. Сконструированные инициаторные тРНК (тРНКfMet2 с антикодоном CUA, кодируемым встретил ген) были использованы для инициирования перевод в янтаре стоп-кодон UAG. Этот тип сконструированной тРНК называется подавитель бессмыслицы тРНК, потому что она подавляет сигнал остановки трансляции, который обычно возникает в кодонах UAG. Янтарная инициатор тРНК вставляет метионин[51] и глютамин[52] на кодонах UAG, которым предшествует сильный Последовательность Шайна-Далгарно. Исследование янтарной тРНК инициатора показало, что она ортогональна обычному стартовому кодону AUG, не обнаруживая никаких обнаруживаемых событий инициации трансляции вне мишени в геномно перекодированном Кишечная палочка напряжение.[51]
биогенез тРНК
В эукариотический клетки, тРНК записано к РНК-полимераза III как пре-тРНК в ядре.[53]РНК-полимераза III распознает две высококонсервативные нижестоящие промоторные последовательности: 5'-внутреннюю контрольную область (5'-ICR, D-контрольную область или A-бокс) и 3'-ICR (T-контрольную область или B-бокс) внутри тРНК. гены.[2][54][55]Первый промотор начинается на +8 зрелых тРНК, а второй промотор расположен на 30–60 нуклеотидов ниже первого промотора. Транскрипция заканчивается после четырех или более отрезков. тимидины.[2][55]
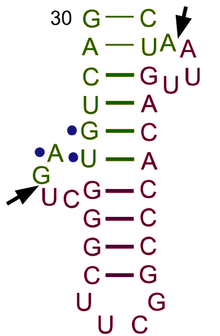
Пре-тРНК претерпевают обширные модификации внутри ядра. Некоторые пре-тРНК содержат интроны которые сращиваются или разрезаются с образованием функциональной молекулы тРНК;[56] у бактерий этисращивание, тогда как у эукариот и археи они удаляются путем сплайсинга тРНК эндонуклеазы.[57] Эукариотическая пре-тРНК содержит мотив структуры выпуклость-спираль-выпуклость (BHB), который важен для распознавания и точного сплайсинга интрона тРНК эндонуклеазами.[58] Положение и структура этого мотива эволюционно сохраняются. Однако некоторые организмы, такие как одноклеточные водоросли, имеют неканоническое положение BHB-мотива, а также 5'- и 3'-концы сплайсированной интронной последовательности.[58]5 'последовательность удаляется РНКаза P,[59] тогда как конец 3 'удаляется тРНКаза Z фермент.[60]Заметным исключением является Археон Nanoarchaeum equitans, который не содержит фермента РНКазы P и имеет промотор, расположенный таким образом, что транскрипция начинается на 5'-конце зрелой тРНК.[61]Нестандартный 3 'хвост CCA добавлен нуклеотидилтрансфераза.[62]Прежде чем тРНК экспортируется в цитоплазма автор: Los1 /Xpo-t,[63][64] тРНК аминоацилированный.[65]Порядок обработки событий не сохраняется. Например, в дрожжи, сплайсинг осуществляется не в ядре, а на цитоплазматической стороне митохондриальный мембраны.[66]
История
Существование тРНК было впервые предположено Фрэнсис Крик, основанный на предположении, что должна существовать молекула-адаптер, способная опосредовать перевод алфавита РНК в алфавит белка. Пол С Замечник и Махлон Хогланд обнаружил тРНК [67] Значительные исследования структуры были проведены в начале 1960-х гг. Алекс Рич и Дон Каспар, два исследователя из Бостона, группа Жака Фреско в Университет Принстона и объединенное Королевство группа в Королевский колледж Лондона.[68] В 1965 г. Роберт В. Холли из Корнелл Университет сообщил о первичной структуре и предложил три вторичные структуры.[69] тРНК была впервые кристаллизована в Мэдисоне, штат Висконсин, Робертом М. Боком.[70] Строение клеверного листа было установлено несколькими другими исследованиями в последующие годы.[71] и был окончательно подтвержден с помощью Рентгеновская кристаллография учится в 1974 году. Две независимые группы, Ким Сун-Хоу работая под Александр Рич и британская группа во главе с Аарон Клуг, опубликовал те же результаты кристаллографии в течение года.[72][73]
Смотрите также
Рекомендации
- ^ Plescia OJ, Palczuk NC, Cora-Figueroa E, Mukherjee A, Braun W. (октябрь 1965 г.). «Производство антител к растворимой РНК (мРНК)». Труды Национальной академии наук Соединенных Штатов Америки. 54 (4): 1281–1285. Bibcode:1965ПНАС ... 54.1281П. Дои:10.1073 / pnas.54.4.1281. ЧВК 219862. PMID 5219832.
- ^ а б c Sharp SJ, Schaack J, Cooley L, Burke DJ, Söll D (1985). «Структура и транскрипция генов тРНК эукариот». CRC Критические обзоры в биохимии. 19 (2): 107–144. Дои:10.3109/10409238509082541. PMID 3905254.
- ^ а б Крик Ф.Х. (декабрь 1968 г.). «Происхождение генетического кода». Журнал молекулярной биологии. 38 (3): 367–379. Дои:10.1016/0022-2836(68)90392-6. PMID 4887876.
- ^ а б Страйер Л., Берг Дж. М., Тимочко Дж. Л. (2002). Биохимия (5-е изд.). Сан-Франциско: В. Х. Фриман. ISBN 978-0-7167-4955-4.
- ^ РНК% 28тРНК% 29 «Трансферная РНК (тРНК)» Проверять
| url =ценить (помощь). Proteopedia.org. Получено 7 ноября 2018. - ^ а б c d е ж Ито Й, Сэкинэ С., Суэцугу С., Йокояма С. (июль 2013 г.). «Третичная структура бактериальной тРНК селеноцистеина». Исследования нуклеиновых кислот. 41 (13): 6729–6738. Дои:10.1093 / nar / gkt321. ЧВК 3711452. PMID 23649835.
- ^ Гуденбур Дж. М., Пан Т. (29 октября 2006 г.). «Разнообразие генов тРНК у эукариот». Исследования нуклеиновых кислот. 34 (21): 6137–6146. Дои:10.1093 / нар / gkl725. ЧВК 1693877. PMID 17088292.
- ^ Ян М., Роджерс М.Дж., Сёлль Д. (июль 1991 г.). «Антикодон и акцепторные нуклеотиды ствола в тРНК (Gln) являются основными элементами распознавания глутаминил-тРНК синтетазы E. coli». Природа. 352 (6332): 258–260. Bibcode:1991Натура.352..258J. Дои:10.1038 / 352258a0. PMID 1857423. S2CID 4263705.
- ^ Ибба М., Солл Д. (июнь 2000 г.). «Синтез аминоацил-тРНК». Ежегодный обзор биохимии. 69 (1): 617–650. Дои:10.1146 / annurev.biochem.69.1.617. PMID 10966471.
- ^ Спринцл М, Крамер Ф (1979). «-C-C-A конец тРНК и его роль в биосинтезе белка». Прогресс в исследованиях нуклеиновых кислот и молекулярной биологии. 22: 1–69. Дои:10.1016 / s0079-6603 (08) 60798-9. ISBN 978-0-12-540022-0. PMID 392600.
- ^ Грин Р., Ноллер Х.Ф. (1997). «Рибосомы и трансляция». Ежегодный обзор биохимии. 66: 679–716. Дои:10.1146 / annurev.biochem.66.1.679. PMID 9242921.
- ^ Эби М., Киршнер Дж., Чен Дж. Ю., Виджайрагхаван Ю., Якобсон А., Мартин Н. К., Абельсон Дж. И др. (Сентябрь 1990 г.). «Выделение чувствительного к температуре мутанта с измененной нуклеотидилтрансферазой тРНК и клонирование гена, кодирующего нуклеотидилтрансферазу тРНК в дрожжах Saccharomyces cerevisiae». Журнал биологической химии. 265 (27): 16216–16220. PMID 2204621.
- ^ Макклоски Дж. А., Нисимура С. (ноябрь 1977 г.). «Модифицированные нуклеозиды в транспортной РНК». Отчеты о химических исследованиях. 10 (11): 403–410. Дои:10.1021 / ar50119a004.
- ^ Felsenfeld G, Cantoni GL (май 1964 г.). «Использование исследований термической денатурации для исследования последовательности оснований сериновой мРНК дрожжей». Труды Национальной академии наук Соединенных Штатов Америки. 51 (5): 818–826. Bibcode:1964ПНАС ... 51..818Ф. Дои:10.1073 / пнас.51.5.818. ЧВК 300168. PMID 14172997.
- ^ Suzuki T, Suzuki T (июнь 2014 г.). «Полный ландшафт посттранскрипционных модификаций митохондриальных тРНК млекопитающих». Исследования нуклеиновых кислот. 42 (11): 7346–7357. Дои:10.1093 / нар / gku390. ЧВК 4066797. PMID 24831542.
- ^ Лодиш Х, Берк А., Мацудаира П., Кайзер Калифорния, Кригер М., Скотт М. П., Зипурски С. Л., Дарнелл Дж. (2004). Молекулярная биология клетки. WH Freeman: Нью-Йорк. 5-е изд.[ISBN отсутствует ][страница нужна ]
- ^ Шиммель П., Гиге Р., Морас Д., Йокояма С. (октябрь 1993 г.). «Рабочий код РНК для аминокислот и возможная связь с генетическим кодом». Труды Национальной академии наук Соединенных Штатов Америки. 90 (19): 8763–8768. Bibcode:1993ПНАС ... 90.8763С. Дои:10.1073 / пнас.90.19.8763. ЧВК 47440. PMID 7692438.
- ^ Дункл Дж. А., Ван Л., Фельдман МБ, Пулк А., Чен В. Б., Капрал Дж. Дж., Ноэске Дж., Ричардсон Дж. С., Бланшар СК, Кейт Дж. Х. (май 2011 г.). «Структуры бактериальной рибосомы в классическом и гибридном состояниях связывания тРНК». Наука. 332 (6032): 981–984. Bibcode:2011Sci ... 332..981D. Дои:10.1126 / science.1202692. ЧВК 3176341. PMID 21596992.
- ^ Коневега А.Л., Соболева Н.Г., Махно В.И., Семенков Ю.П., Винтермейер В., Роднина М.В., Катунин В.И. (январь 2004 г.). «Пуриновые основания в положении 37 тРНК стабилизируют кодон-антикодонное взаимодействие в рибосомном сайте А посредством стэкинга и Mg2 + -зависимых взаимодействий». РНК. 10 (1): 90–101. Дои:10.1261 / rna.5142404. ЧВК 1370521. PMID 14681588.
- ^ а б Агиррезабала X, Фрэнк Дж. (Август 2009 г.). «Элонгация при трансляции как динамическое взаимодействие между рибосомой, тРНК и факторами элонгации EF-G и EF-Tu». Ежеквартальные обзоры биофизики. 42 (3): 159–200. Дои:10.1017 / S0033583509990060. ЧВК 2832932. PMID 20025795.
- ^ а б Аллен Г.С., Завьялов А., Гурски Р., Эренберг М., Франк Дж. (Июнь 2005 г.). «Крио-ЭМ структура комплекса инициации трансляции из Escherichia coli». Клетка. 121 (5): 703–712. Дои:10.1016 / j.cell.2005.03.023. PMID 15935757. S2CID 16146867.
- ^ Веб-сайт WormBase, http://www.wormbase.org, выпуск WS187, дата 25 января 2008 г.
- ^ Спит Дж., Лоусон Д. (январь 2006 г.). «Обзор структуры гена». WormBook: 1–10. Дои:10.1895 / wormbook.1.65.1. ЧВК 4781370. PMID 18023127.
- ^ Хартвелл Л.Х., Худ Л., Голдберг М.Л., Рейнольдс А.Е., Сильвер Л.М., Верес Р.К. (2004). Генетика: от генов к геномам 2-е изд. МакГроу-Хилл: Нью-Йорк. п. 264.
- ^ Выпуск ансамбля 70 - январь 2013 г. http://www.ensembl.org/Homo_sapiens/Info/StatsTable?db=core В архиве 2013-12-15 на Wayback Machine
- ^ а б Lander ES, Linton LM, Birren B, Nusbaum C, Zody MC, Baldwin J и др. (Международный консорциум по секвенированию генома человека) (февраль 2001 г.). "Начальная последовательность и анализ человеческого генома" (PDF). Природа. 409 (6822): 860–921. Bibcode:2001Натура.409..860л. Дои:10.1038/35057062. PMID 11237011.
- ^ Роджерс Т.Э., Атаиде С.Ф., Дэйр К., Кац А., Сево С., Рой Х., Ибба М. (2012). «Псевдо-тРНК модулирует устойчивость к антибиотикам у Bacillus cereus». PLOS ONE. 7 (7): e41248. Bibcode:2012PLoSO ... 741248R. Дои:10.1371 / journal.pone.0041248. ЧВК 3399842. PMID 22815980.
- ^ а б Telonis AG, Loher P, Kirino Y, Rigoutsos I (2014). «Ядерные и митохондриальные тРНК-двойники в геноме человека». Границы генетики. 5: 344. Дои:10.3389 / fgene.2014.00344. ЧВК 4189335. PMID 25339973.
- ^ Рамос А., Барбена Е., Матеиу Л., дель Мар Гонсалес М., Майрал К., Лима М., Монтьель Р., Алуха М. П., Сантос С. и др. (Ноябрь 2011 г.). «Ядерные вставки митохондриального происхождения: обновление базы данных и полезность в исследованиях рака». Митохондрия. 11 (6): 946–953. Дои:10.1016 / j.mito.2011.08.009. PMID 21907832.
- ^ Там же. п. 529.
- ^ Нэнси Мейзелс и Алан М. Вайнер: Гипотеза геномных тегов - что молекулярные окаменелости говорят нам об эволюции тРНК, в: Мир РНК, второе издание. 1999 Лабораторный пресс Колд Спринг Харбор ISBN 978-0-87969-561-3/99, PDF
- ^ а б c Новоа Э.М., Павон-Этернод М, Пан Т., Рибас де Пуплана Л. (март 2012 г.). «Роль модификаций тРНК в структуре генома и использовании кодонов». Клетка. 149 (1): 202–213. Дои:10.1016 / j.cell.2012.01.050. PMID 22464330. S2CID 16487609.
- ^ а б c Гебетсбергер Дж., Полацек Н. (декабрь 2013 г.). «Нарезка тРНК для увеличения функционального разнообразия нкРНК». РНК Биология. 10 (12): 1798–1806. Дои:10.4161 / rna.27177. ЧВК 3917982. PMID 24351723.
- ^ а б Шигемацу М, Хонда С, Кирино Y (2014). «Трансферная РНК как источник малой функциональной РНК». Журнал молекулярной биологии и молекулярной визуализации. 1 (2): 8. ЧВК 4572697. PMID 26389128.
- ^ а б Собала А., Хутвагнер Г. (2011). «Перенос фрагментов, производных от РНК: происхождение, процессинг и функции» (PDF). Междисциплинарные обзоры Wiley: РНК. 2 (6): 853–862. Дои:10.1002 / wrna.96. HDL:10453/18187. PMID 21976287. S2CID 206554146.
- ^ Ким С.П., Хутвагнер Г. (ноябрь 2015 г.). «Фрагменты, производные тРНК (tRF): новые роли древней РНК в регуляции экспрессии генов». Жизнь. 5 (4): 1638–1651. Дои:10.3390 / life5041638. ЧВК 4695841. PMID 26703738.
- ^ а б c d Кумар П., Анайя Дж., Мудунури С.Б., Датта А. (октябрь 2014 г.). «Мета-анализ фрагментов РНК, полученных из тРНК, показывает, что они эволюционно консервативны и связываются с белками AGO для распознавания конкретных мишеней РНК». BMC Биология. 12: 78. Дои:10.1186 / s12915-014-0078-0. ЧВК 4203973. PMID 25270025.
- ^ а б Honda S, Loher P, Shigematsu M, Palazzo JP, Suzuki R, Imoto I, Rigoutsos I, Kirino Y (июль 2015 г.). «Половинки тРНК, зависимые от половых гормонов, увеличивают пролиферацию клеток при раке груди и простаты». Труды Национальной академии наук Соединенных Штатов Америки. 112 (29): E3816 – E3825. Bibcode:2015PNAS..112E3816H. Дои:10.1073 / pnas.1510077112. ЧВК 4517238. PMID 26124144.
- ^ Schorn, AJ; Мартиенссен, Р. (октябрь 2018 г.). «Тай-брейк: хозяин и ретротранспозоны играют тРНК». Тенденции в клеточной биологии. 28 (10): 793–806. Дои:10.1016 / j.tcb.2018.05.006. ЧВК 6520983. PMID 29934075.
- ^ Шигемацу М, Кирино Ю. (2015). "Произведенная тРНК короткая некодирующая РНК как взаимодействующие партнеры белков аргонавта". Регуляция генов и системная биология. 9: 27–33. Дои:10.4137 / GRSB.S29411. ЧВК 4567038. PMID 26401098.
- ^ Эмара М.М., Иванов П., Хикман Т., Даура Н., Тисдейл С., Кедерша Н., Ху Г.Ф., Андерсон П. (апрель 2010 г.). «Ангиогенин-индуцированная тРНК-индуцированная стресс-индуцированная РНК способствует сборке стресс-индуцированных гранул». Журнал биологической химии. 285 (14): 10959–10968. Дои:10.1074 / jbc.M109.077560. ЧВК 2856301. PMID 20129916.
- ^ Goodarzi H, Liu X, Nguyen HC, Zhang S, Fish L, Tavazoie SF (май 2015 г.). «Фрагменты, полученные из эндогенной тРНК, подавляют прогрессирование рака молочной железы через смещение YBX1». Клетка. 161 (4): 790–802. Дои:10.1016 / j.cell.2015.02.053. ЧВК 4457382. PMID 25957686.
- ^ Иванов П., Эмара М.М., Виллен Дж., Гиги С.П., Андерсон П. (август 2011 г.). «Ангиогенин-индуцированные фрагменты тРНК ингибируют инициацию трансляции». Молекулярная клетка. 43 (4): 613–623. Дои:10.1016 / j.molcel.2011.06.022. ЧВК 3160621. PMID 21855800.
- ^ Селицкий С.Р., Баран-Гейл Дж., Хонда М, Ямане Д., Масаки Т., Фаннин Е.Е., Герра Б., Ширасаки Т., Шимаками Т., Канеко С., Ланфорд Р.Э., Лимон С.М., Сетупати П. (январь 2015 г.). «При хронических гепатитах B и C количество малых РНК, происходящих из тРНК, увеличивается и их больше, чем у микроРНК». Научные отчеты. 5: 7675. Bibcode:2015НатСР ... 5Э7675С. Дои:10.1038 / srep07675. ЧВК 4286764. PMID 25567797.
- ^ Шарма У., Конин С.К., Ши Дж.М., Боскович А., Дерр А.Г., Бинг XY, Беллинни С., Кучукурал А, Серра Р.В., Сан Ф, Сонг Л., Кароне Б.Р., Риччи Э.П., Ли XZ, Фокье Л., Мур М.Дж., Салливан Р. , Мелло CC, Гарбер М., Рандо О.Дж. (январь 2016 г.). «Биогенез и функция фрагментов тРНК во время созревания и оплодотворения сперматозоидов у млекопитающих». Наука. 351 (6271): 391–396. Bibcode:2016Научный ... 351..391S. Дои:10.1126 / science.aad6780. ЧВК 4888079. PMID 26721685.
- ^ Касас Э, Цай Дж, Нил Дж. Д. (2015). «Характеристика циркулирующих фрагментов РНК-производных РНК у крупного рогатого скота». Границы генетики. 6: 271. Дои:10.3389 / fgene.2015.00271. ЧВК 4547532. PMID 26379699.
- ^ Хиросе Y, Икеда К.Т., Норо Э., Хираока К., Томита М., Канаи А. (июль 2015 г.). «Точное картирование и динамика фрагментов, происходящих от тРНК (tRF), в развитии Triops cancriformis (креветка-головастик)». BMC Genetics. 16: 83. Дои:10.1186 / s12863-015-0245-5. ЧВК 4501094. PMID 26168920.
- ^ Караискос С., Накви А.С., Суонсон К.Е., Григорьев А. (сентябрь 2015 г.). «Возрастная модуляция фрагментов тРНК у дрозофилы и их потенциальных мишеней». Биология Директ. 10: 51. Дои:10.1186 / s13062-015-0081-6. ЧВК 4572633. PMID 26374501.
- ^ Пляцика В., Лохер П., Телонис А.Г., Ригуцос I. (август 2016 г.). «MINTbase: платформа для интерактивного исследования митохондриальных и ядерных фрагментов тРНК». Биоинформатика. 32 (16): 2481–2489. Дои:10.1093 / биоинформатика / btw194. ЧВК 4978933. PMID 27153631.
- ^ Кумар П., Мудунури С.Б., Анайя Дж., Датта А. (январь 2015 г.). «tRFdb: база данных для фрагментов транспортной РНК». Исследования нуклеиновых кислот. 43 (Проблема с базой данных): D141-5. Дои:10.1093 / нар / gku1138. ЧВК 4383946. PMID 25392422.
- ^ а б Винсент Р.М., Райт Б.В., Яшке Р.Р. (апрель 2019 г.). "Измерение ортогональности тРНК инициатора янтаря в геномно перекодированном организме". Синтетическая биология ACS. 8 (4): 675–685. Дои:10.1021 / acssynbio.9b00021. PMID 30856316.
- ^ Говиндан А., Миряла С., Мондал С., Варшней Ю. (ноябрь 2018 г.). «Разработка систем анализа для декодирования янтарных кодонов на этапах инициации и удлинения микобактерий». Журнал бактериологии. 200 (22). Дои:10.1128 / jb.00372-18. ЧВК 6199473. PMID 30181124.
- ^ Белый RJ (март 1997 г.). «Регулирование РНК-полимераз I и III с помощью белка ретинобластомы: механизм контроля роста?». Тенденции в биохимических науках. 22 (3): 77–80. Дои:10.1016 / S0968-0004 (96) 10067-0. PMID 9066256.
- ^ Шарп С., Дингерманн Т., Зелл Д. (сентябрь 1982 г.). «Минимальные внутригенные последовательности, необходимые для стимуляции транскрипции гена тРНК эукариот». Исследования нуклеиновых кислот. 10 (18): 5393–5406. Дои:10.1093 / nar / 10.18.5393. ЧВК 320884. PMID 6924209.
- ^ а б Dieci G, Fiorino G, Castelnuovo M, Teichmann M, Pagano A (декабрь 2007 г.). «Расширяющийся транскриптом РНК-полимеразы III». Тенденции в генетике. 23 (12): 614–622. Дои:10.1016 / j.tig.2007.09.001. HDL:11381/1706964. PMID 17977614.
- ^ Tocchini-Valentini GD, Fruscoloni P, Tocchini-Valentini GP (декабрь 2009 г.). «Обработка претРНК, содержащей несколько интронов». Труды Национальной академии наук Соединенных Штатов Америки. 106 (48): 20246–20251. Bibcode:2009ПНАС..10620246Т. Дои:10.1073 / pnas.0911658106. ЧВК 2787110. PMID 19910528.
- ^ Абельсон Дж., Тротта К.Р., Ли Х. (май 1998 г.). «сплайсинг тРНК». Журнал биологической химии. 273 (21): 12685–12688. Дои:10.1074 / jbc.273.21.12685. PMID 9582290.
- ^ а б Сома А (2014). «Циркулярно пермутированные гены тРНК: их экспрессия и значение для их физиологической значимости и развития». Границы генетики. 5: 63. Дои:10.3389 / fgene.2014.00063. ЧВК 3978253. PMID 24744771.
- ^ Франк Д. Н., Пейс Н. Р. (1998). «Рибонуклеаза P: единство и разнообразие рибозима, обрабатывающего тРНК». Ежегодный обзор биохимии. 67 (1): 153–180. Дои:10.1146 / annurev.biochem.67.1.153. PMID 9759486.
- ^ Себальос М., Виоке А (2007). «тРНКаза Z». Буквы о белках и пептидах. 14 (2): 137–145. Дои:10.2174/092986607779816050. PMID 17305600.
- ^ Рандау Л., Шредер И., Зелл Д. (май 2008 г.). «Жизнь без РНКазы Р». Природа. 453 (7191): 120–123. Bibcode:2008Натура.453..120р. Дои:10.1038 / природа06833. PMID 18451863. S2CID 3103527.
- ^ Вайнер AM (октябрь 2004 г.). «Созревание тРНК: полимеризация РНК без матрицы нуклеиновой кислоты». Текущая биология. 14 (20): R883-5. Дои:10.1016 / j.cub.2004.09.069. PMID 15498478.
- ^ Кутай У., Липовски Г, Изаурральде Э., Бишофф Ф.Р., Шварцмайер П, Хартманн Э., Герлих Д. (февраль 1998 г.). «Идентификация тРНК-специфического ядерного рецептора экспорта». Молекулярная клетка. 1 (3): 359–369. Дои:10.1016 / S1097-2765 (00) 80036-2. PMID 9660920.
- ^ Arts GJ, Fornerod M, Mattaj IW (март 1998 г.). «Идентификация ядерного рецептора экспорта для тРНК». Текущая биология. 8 (6): 305–314. Дои:10.1016 / S0960-9822 (98) 70130-7. PMID 9512417. S2CID 17803674.
- ^ Arts GJ, Kuersten S, Romby P, Ehresmann B, Mattaj IW (декабрь 1998 г.). «Роль exportin-t в селективном ядерном экспорте зрелых тРНК». Журнал EMBO. 17 (24): 7430–7441. Дои:10.1093 / emboj / 17.24.7430. ЧВК 1171087. PMID 9857198.
- ^ Ёсихиса Т., Юноки-Эсаки К., Охшима К., Танака Н., Эндо Т. (август 2003 г.). «Возможность сплайсинга цитоплазматической пре-тРНК: дрожжевая эндонуклеаза сплайсинга тРНК в основном локализуется в митохондриях». Молекулярная биология клетки. 14 (8): 3266–3279. Дои:10.1091 / mbc.E02-11-0757. ЧВК 181566. PMID 12925762.
- ^ http://www.jbc.org/content/280/40/e37
- ^ Кларк Б.Ф. (октябрь 2006 г.). «Кристаллическая структура тРНК» (PDF). Журнал биологических наук. 31 (4): 453–457. Дои:10.1007 / BF02705184. PMID 17206065. S2CID 19558731.
- ^ Холли Р.В., Апгар Дж., Эверетт Г.А., Мэдисон Дж. Т., Маркизи М., Меррилл С.Х., Пенсвик Дж. Р., Замир А. (март 1965 г.). «Структура рибонуклеиновой кислоты». Наука. 147 (3664): 1462–1465. Bibcode:1965Научный ... 147.1462H. Дои:10.1126 / science.147.3664.1462. PMID 14263761. S2CID 40989800.
- ^ "Некролог". Нью-Йорк Таймс. 4 июля 1991 г.
- ^ "Нобелевская премия по физиологии и медицине 1968 г.". Нобелевский фонд. Получено 2007-07-28.
- ^ Ladner JE, Jack A, Robertus JD, Brown RS, Rhodes D, Clark BF, Klug A (ноябрь 1975 г.). «Структура дрожжевой РНК-переносчика фенилаланина при разрешении 2,5 А». Труды Национальной академии наук Соединенных Штатов Америки. 72 (11): 4414–4418. Bibcode:1975PNAS ... 72.4414L. Дои:10.1073 / пнас.72.11.4414. ЧВК 388732. PMID 1105583.
- ^ Ким С.Х., Куигли Дж. Дж., Саддат Ф., Макферсон А., Снеден Д., Ким Дж. Дж., Вайнциерл Дж., Рич А. (январь 1973 г.). «Трехмерная структура дрожжевой РНК-переносчика фенилаланина: укладка полинуклеотидной цепи». Наука. 179 (4070): 285–288. Bibcode:1973Sci ... 179..285K. Дои:10.1126 / science.179.4070.285. PMID 4566654. S2CID 28916938.