Цитрат-синтаза - Citrate synthase
В фермент цитрат-синтаза E.C. 2.3.3.1 (ранее 4.1.3.7)] существует почти во всех живых клетках и выступает в качестве стимулирующего фермента на первом этапе цикл лимонной кислоты (или же Цикл Кребса ).[5] Цитратсинтаза локализована в эукариотический ячейки в митохондриальный матрикс, но кодируется ядерным ДНК а не митохондриальный. Он синтезируется с использованием цитоплазматических рибосомы, затем транспортируется в митохондриальный матрикс.
Цитратсинтаза обычно используется в качестве количественного маркера фермента для выявления интактных митохондрии. Максимальная активность цитрат-синтазы свидетельствует о митохондриальном составе скелетных мышц.[6] Максимальную активность можно увеличить на тренировка на выносливость или же высокоинтенсивная интервальная тренировка,[6] но максимальная активность увеличивается больше при высокоинтенсивных интервальных тренировках.[7]
Цитрат-синтаза катализирует то реакция конденсации двухуглеродного ацетат остаток от ацетилкофермент А и молекула четырехуглеродного оксалоацетат сформировать шестиуглеродный цитрат:[5]
- ацетил-КоА + оксалоацетат + ЧАС2О → цитрат + CoA-SH
Оксалоацетат регенерируется после завершения одного цикла цикла Кребса.
Оксалоацетат - это первый субстрат, связывающийся с ферментом. Это побуждает фермент изменять свою конформацию и создает сайт связывания для ацетил-КоА. Только когда этот цитрил-КоА образовался, другое конформационное изменение вызовет тиоэфир гидролиз и высвобождают кофермент А. Это гарантирует, что энергия, высвобождаемая при расщеплении тиоэфирной связи, будет управлять конденсацией.
Структура

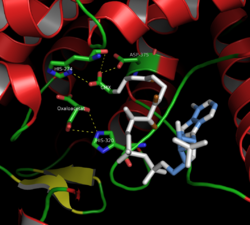
Активный сайт цитрат-синтазы (закрытая форма)
437 аминокислотных остатков цитратсинтазы организованы в две основные субъединицы, каждая из которых состоит из 20 альфа-спиралей. Эти альфа-спирали составляют примерно 75% цитрат-синтазы. третичная структура, в то время как остальные остатки в основном составляют нерегулярные продолжения структуры, за исключением одного бета-листа из 13 остатков. Между этими двумя субъединицами существует единственная щель, содержащая активный сайт. В нем могут быть обнаружены два сайта связывания: один зарезервирован для цитрата или оксалоацетата, а другой - для кофермента A. Активный сайт содержит три ключевых остатка: His274, His320 и Asp375, которые обладают высокой избирательностью во взаимодействии с субстратами.[8]На соседних изображениях показана третичная структура цитрат-синтазы в ее открытой и закрытой форме. Фермент переходит из открытого в закрытый при добавлении одного из его субстратов (например, оксалоацетата).[9]
Функция
| Цитрат (Si) -синтаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 2.3.3.1 | ||||||||
| Количество CAS | 9027-96-7 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Механизм
Цитрат-синтаза имеет три ключевых аминокислоты в его активный сайт (известный как каталитическая триада ), которые катализируют превращение ацетил-КоА [ЧАС3CC (= O) -SCoA] и оксалоацетат [−О2CCH2С (= O) CO2−] в цитрат [−О2CCH2С (ОН) (СО2−) CH2CO2−] и H − SCoA в альдольная конденсация реакция. Это преобразование начинается с отрицательно заряженного атома кислорода боковой цепи карбоксилата Asp-375, который депротонирует альфа-углеродный атом ацетил-КоА с образованием енолят-аниона, который, в свою очередь, нейтрализуется протонированием His-274 с образованием энол промежуточный [H2С = С (ОН) -SCoA]. В этот момент неподеленная пара электронов эпсилон-азота на His-274, образованная на последнем этапе, отрывает протон гидроксиленола с преобразованием енолятного аниона, который инициирует нуклеофильный атака на карбонильный углерод оксалоацетата [−О2CCH2С (= O) CO2−] которые в свою очередь депротонировать эпсилон-атом азота His-320. Этот нуклеофильное присоединение приводит к образованию цитроил-КоА [−О2CCH2CH (CO2−) CH2C (= O) -SCoA]. В этот момент молекула воды депротонируется эпсилон-атомом азота His-320 и гидролиз инициирован. Одна из неподеленных пар кислорода нуклеофильно атакует карбонил углерод цитроил-КоА. Это образует тетраэдрический промежуточный продукт и приводит к выбросу -SCoA при преобразовании карбонила. -SCoA протонируется с образованием HSCoA. Наконец, гидроксил, добавленный к карбонилу на предыдущем этапе, депротонируется и цитрат [−О2CCH2С (ОН) (СО2−) CH2CO2−] сформирован.[10]

Торможение
Фермент ингибируется высокими соотношениями АТФ:ADP и НАДН:НАД, поскольку высокие концентрации АТФ и НАДН показывают, что клетка имеет высокий запас энергии. Это также ингибируется сукцинил-КоА и пропионил-КоА, который похож на ацетил-КоА и действует как конкурентный ингибитор ацетил-КоА и неконкурентный ингибитор оксалоацетата.[11] Цитрат ингибирует реакцию и является примером ингибирования продукта. Ингибирование цитрат-синтазы аналогами ацетил-КоА также хорошо задокументировано и использовалось для доказательства существования единственного активного сайта. Эти эксперименты показали, что этот единственный сайт чередуется между двумя формами, которые участвуют в активности лигазы и гидролазы соответственно.[9] Этот белок может использовать морфеин модель аллостерическая регуляция.[12]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000062485 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000005683 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б Виганд G, Ремингтон SJ (1986). «Цитрат-синтаза: структура, контроль и механизм». Ежегодный обзор биофизики и биофизической химии. 15: 97–117. Дои:10.1146 / annurev.bb.15.060186.000525. PMID 3013232.
- ^ а б Гиллен Дж. Б., Мартин Б. Дж., Макиннис М. Дж., Скелли Л. Е., Тарнопольский М. А., Гибала М. Дж. (2016). «Двенадцать недель спринтерских интервальных тренировок улучшают показатели кардиометаболического здоровья, аналогично традиционным тренировкам на выносливость, несмотря на пятикратное сокращение объема упражнений и времени». PLOS One. 11 (4): e0154075. Дои:10.1371 / journal.pone.0154075. ЧВК 4846072. PMID 27115137.
- ^ Макиннис MJ, Zacharewicz E, Martin BJ, Haikalis ME, Skelly LE, Tarnopolsky MA, Murphy RM, Gibala MJ (2017). «Превосходная митохондриальная адаптация скелетных мышц человека после перерыва в работе по сравнению с непрерывной ездой на велосипеде на одной ноге, соответствующей общей работе». Журнал физиологии. 595 (9): 2955–2968. Дои:10.1113 / JP272570. ЧВК 5407978. PMID 27396440.
- ^ Goodsell D (1 сентября 2007 г.). «Цитрат-синтаза». Молекула месяца. Банк данных белков RCSB. Дои:10.2210 / rcsb_pdb / mom_2007_9.; PDB: 1CSC, 5CSC, 5CTS
- ^ а б Байер Э., Бауэр Б., Эггерер Х. (ноябрь 1981 г.). «Данные исследований ингибиторов конформационных изменений цитрат-синтазы». Европейский журнал биохимии / FEBS. 120 (1): 155–60. Дои:10.1111 / j.1432-1033.1981.tb05683.x. PMID 7308213.
- ^ Кокс Д.Л., Нельсон М.М. (2005). Принципы биохимии Ленингера (4-е изд.). Нью-Йорк: W.H. Фримен. стр.608−9. ISBN 978-0-7167-4339-2.
- ^ Смит, Коллин М .; Уильямсон, Джон Р. (1971-10-15). «Ингибирование цитрат-синтазы сукцинил-КоА и другими метаболитами». Письма FEBS. 18 (1): 35–38. Дои:10.1016/0014-5793(71)80400-3. ISSN 0014-5793. PMID 11946076. S2CID 43002983.
- ^ Селвуд Т., Джаффе Е.К. (март 2012 г.). «Динамические диссоциирующие гомоолигомеры и контроль функции белка». Архивы биохимии и биофизики. 519 (2): 131–43. Дои:10.1016 / j.abb.2011.11.020. ЧВК 3298769. PMID 22182754.
внешняя ссылка
- Цитрат + синтаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- PDBe-KB предоставляет обзор всей структурной информации, доступной в PDB для цитрат-синтазы человека, митохондриальной