Пируватдегидрогеназный комплекс - Pyruvate dehydrogenase complex - Wikipedia

Пируватдегидрогеназный комплекс (PDC) представляет собой комплекс трех ферменты что обращает пируват в ацетил-КоА процессом, называемым декарбоксилирование пирувата.[1] Затем ацетил-КоА можно использовать в цикл лимонной кислоты выполнять клеточное дыхание, и этот комплекс связывает гликолиз метаболический путь к цикл лимонной кислоты. Декарбоксилирование пирувата также известно как «реакция пируватдегидрогеназы», поскольку оно также включает окисление пирувата.[2]
Этот мультиферментный комплекс структурно и функционально связан с оксоглутаратдегидрогеназа и мультифермент оксокислотной дегидрогеназы с разветвленной цепью комплексы.
Реакция
Реакция, катализируемая комплексом пируватдегидрогеназы:
| пируват | пируватдегидрогеназный комплекс | ацетил-КоА | |
 |  | ||
| CoA-SH + НАД+ | CO2 + НАДН + ЧАС+ | ||
 | |||
Структура
| Ферменты | Аббревиатура | Кофакторы | # субъединицы прокариот | # субъединицы эукариоты |
|---|---|---|---|---|
| пируватдегидрогеназа (EC 1.2.4.1 ) | E1 | TPP (тиаминпирофосфат) | 24 | 30 |
| дигидролипоил трансацетилаза (EC 2.3.1.12 ) | E2 | липоат кофермент А | 24 | 60 |
| дигидролипоилдегидрогеназа (EC 1.8.1.4 ) | E3 | FAD НАД+ | 12 | 12 |
Пируватдегидрогеназа (E1)
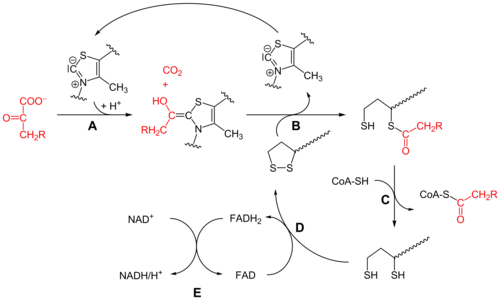
Первоначально, пируват и пирофосфат тиамина (ТЭС или витамин B1 ) связаны пируватдегидрогеназа субъединицы.[1] В тиазолий кольцо ТЭС находится в цвиттерионный форма, и анионный Углерод C2 осуществляет нуклеофильную атаку на карбонил C2 (кетон) пирувата. Образующийся гемитиоацеталь подвергается декарбоксилирование для получения эквивалента ацильного аниона (см. циангидрин или альдегид-дитиан умполунг химия, а также бензоиновая конденсация ). Этот анион атакует S1 окисленных липоатов, которые присоединены к лизин остаток. В открытии кольца SN2-подобный механизм, S2 замещается как сульфидный или сульфгидрильный фрагмент. Последующий коллапс тетраэдрического гемитиоацеталя выбрасывает тиазол, высвобождая кофактор TPP и генерируя тиоацетат на S1 липоата. Процесс, катализируемый E1, является лимитирующей стадией всего комплекса пируватдегидрогеназы.
Дигидролипоил трансацетилаза (E2)
На этом этапе липоаттиоэфирная функциональность перемещается в дигидролипоил трансацетилаза (E2) активный сайт,[1] где реакция трансацилирования переносит ацетил из "качающейся руки" липоила в тиол кофермент А. Это производит ацетил-КоА, который высвобождается из ферментного комплекса и впоследствии попадает в цикл лимонной кислоты. E2 также может быть известен как липоамидредуктаза-трансацетилаза.
Дигидролипоилдегидрогеназа (E3)
В дигидролипоат, все еще связанный с остатком лизина в комплексе, затем мигрирует в дигидролипоилдегидрогеназа (E3) активный сайт,[1] где он подвергается флавин -опосредованное окисление, идентичное по химии дисульфид изомераза. Первый, FAD окисляет дигидролипоат обратно до состояния покоя липоата, производя FADH2. Затем НАД+ кофактор окисляет FADH2 обратно в состояние покоя FAD, производя NADH.
Структурные различия между видами
PDC - это большой комплекс, состоящий из нескольких копий 3 или 4 субъединиц в зависимости от вида.
Грамотрицательные бактерии
В Грамотрицательный бактерии, например кишечная палочка, PDC состоит из центрального кубического ядра, состоящего из 24 молекул дигидролипоил трансацетилаза (E2). До 24 копий пируватдегидрогеназа (E1) и 12 молекул дигидролипоилдегидрогеназа (E3) привязаны к внешней стороне ядра E2.[3]
Грамположительные бактерии и эукариоты
Напротив, в Грамположительный бактерии (например, Bacillus stearothermophilus ) и эукариот центральное ядро PDC содержит 60 молекул E2, расположенных в виде икосаэдра.
Эукариоты также содержат 12 копий дополнительного корового белка, E3-связывающий белок (E3BP). Точное местонахождение E3BP не совсем понятно. Крио-электронная микроскопия установила, что E3BP связывается с каждой из граней икосаэдра у дрожжей.[4] Однако было высказано предположение, что он заменяет эквивалентное количество молекул E2 в ядре PDC крупного рогатого скота.
До 60 молекул E1 или E3 могут связываться с ядром E2 грамположительных бактерий - связывание является взаимоисключающим. У эукариот E1 специфически связывается с E2, в то время как E3 ассоциируется с E3BP. Считается, что присутствует до 30 ферментов E1 и 6 E3, хотя точное количество молекул может варьироваться. in vivo и часто отражает метаболические потребности рассматриваемой ткани.
Регулирование
Пируватдегидрогеназа ингибируется при увеличении одного или нескольких из трех следующих соотношений: АТФ /ADP, НАДН / НАД+ и ацетил-КоА /CoA.
У эукариот PDC строго регулируется собственными специфическими киназа пируватдегидрогеназы (PDK) и пируватдегидрогеназа фосфатаза (PDP), деактивируя и активируя его соответственно.[5]
- PDK фосфорилаты три конкретных серин остатки на E1 с разным сродством. Фосфорилирование любого из них (с использованием АТФ ) делает E1 (и, как следствие, весь комплекс) неактивным.[5]
- Дефосфорилирование E1 PDP восстанавливает комплексную активность.[5]
Продукты реакции действуют как аллостерические ингибиторы PDC, потому что они активируют PDK. Субстраты, в свою очередь, ингибируют PDK, реактивируя PDC.
В течение голодание, PDK увеличивается в количестве в большинстве тканей, включая скелетные мышцы, через увеличенный транскрипция гена. В тех же условиях количество PDP уменьшается. Результирующее ингибирование PDC предотвращает катаболизм глюкозы и других тканей в мышцах и других тканях. глюконеогенез прекурсоры. Обмен веществ сдвигается в сторону утилизация жира, в то время как распад мышечного белка для обеспечения предшественников глюконеогенеза сводится к минимуму, а доступная глюкоза сохраняется для использования мозг.
Кальций ионы играют роль в регуляции PDC в мышечной ткани, потому что они активируют PDP, стимулируя гликолиз при попадании в цитозоль - во время сокращение мышц. Некоторые продукты этой транскрипции высвобождают H2 в мышцы. Это может со временем привести к распаду ионов кальция.
Локализация декарбоксилирования пирувата
В эукариотический клетки декарбоксилирование пирувата происходит внутри митохондриального матрикса после транспорта субстрата, пирувата, из цитозоль. Транспорт пирувата в митохондрии осуществляется через транспортный белок пируваттранслоказа. Пируваттранслоказа транспортирует пируват симпортом с протоном и, следовательно, является активный, потребляя энергия.[нужна цитата ]. Альтернативные источники говорят, что «транспорт пирувата через внешнюю митохондриальную мембрану, по-видимому, легко осуществляется через большие неселективные каналы, такие как зависимые от напряжения анионные каналы, которые обеспечивают пассивную диффузию »и перенос через внутреннюю митохондриальную мембрану опосредуется митохондриальным переносчиком пирувата 1 (MPC1) и митохондриальный переносчик пирувата 2 (MPC2) [6].
При попадании в митохондрии пируват декарбоксилируется с образованием ацетил-КоА. Эта необратимая реакция задерживает ацетил-КоА в митохондриях (ацетил-КоА может транспортироваться из митохондриального матрикса только в условиях высокого содержания оксалоацетата через цитратный челнок, промежуточное звено TCA, которое обычно мало). Диоксид углерода, образующийся в результате этой реакции, неполярный и маленькие, и могут диффундировать из митохондрий и из клетки.
В прокариоты, у которых нет митохондрий, эта реакция либо осуществляется в цитозоле, либо не происходит вовсе.
Клиническая значимость
Дефицит пируватдегидрогеназы может быть результатом мутации любого из ферментов или кофакторов. Его первичный клинический результат: лактоацидоз.[7]
Смотрите также
Рекомендации
- ^ а б c d DeBrosse, Suzanne D .; Керр, Дуглас С. (01.01.2016), Сането, Рассел П.; Парих, Сумит; Коэн, Брюс Х. (ред.), «Глава 12 - Дефицит пируватдегидрогеназного комплекса», Примеры использования митохондрий, Бостон: Academic Press, стр. 93–101, Дои:10.1016 / b978-0-12-800877-5.00012-7, ISBN 978-0-12-800877-5, получено 2020-11-16
- ^ Дж. М. Берг; Ю. Л. Тимочко, Л. Страйер (2007). Биохимия (6 изд.). Фримен. ISBN 978-0-7167-8724-2.CS1 maint: несколько имен: список авторов (связь)
- ^ Изард Т., Эйварссон А., Аллен М.Д., Вестфаль А.Х., Перхам Р.Н., де Кок А., Хол В.Г. (1999). «Принципы квазиэквивалентности и евклидовой геометрии управляют сборкой кубических и додекаэдрических ядер комплексов пируватдегидрогеназы». Proc. Natl. Акад. Sci. Соединенные Штаты Америки. 96 (4): 1240–1245. Bibcode:1999PNAS ... 96.1240I. Дои:10.1073 / pnas.96.4.1240. ЧВК 15447. PMID 9990008. [1]
- ^ Stoops, JK, Cheng, RH, Yazdi, MA, Maeng, CY, Schroeter, JP, Klueppelberg, U., Kolodziej, SJ, Baker, TS, Reed, LJ (1997) Об уникальной структурной организации пируватдегидрогеназы Saccharomyces cerevisiae сложный. J. Biol. Chem. 272, 5757-5764.
- ^ а б c Пелли, Джон У. (01.01.2012), Пелли, Джон У. (ред.), «6 - Гликолиз и окисление пирувата», Комплексный обзор биохимии Эльзевьера (второе издание), Филадельфия: W.B. Сондерс, стр. 49–55, Дои:10.1016 / b978-0-323-07446-9.00006-4, ISBN 978-0-323-07446-9, получено 2020-11-16
- ^ Раттер, Джаред (23 января 2013 г.). «Долгий и извилистый путь к митохондриальному переносчику пирувата». Рак и метаболизм. Дои:10.1186/2049-3002-1-6. PMID 24280073.
- ^ «Дефицит пируватдегидрогеназы». Домашний справочник по генетике. Получено 17 марта, 2013.
внешняя ссылка
- https://web.archive.org/web/20070405211049/http://www.dentistry.leeds.ac.uk/biochem/MBWeb/mb1/part2/krebs.htm#animat1 - анимация общего механизма PDC (ссылка вверху справа) на Университет Лидса
- Пируват + дегидрогеназа + комплекс в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
3D конструкции
- Чжоу, H .; Маккарти, Б .; О'Коннор, М .; Reed, J .; Ступс, К. (декабрь 2001 г.). «Замечательная структурная и функциональная организация пируватдегидрогеназных комплексов эукариот». Труды Национальной академии наук Соединенных Штатов Америки. 98 (26): 14802–14807. Bibcode:2001PNAS ... 9814802Z. Дои:10.1073 / pnas.011597698. ISSN 0027-8424. ЧВК 64939. PMID 11752427., бык почка пируватдегидрогеназный комплекс
- Yu, X .; Hiromasa, Y .; Tsen, H .; Ступс, К .; Roche, E .; Чжоу, Х. (январь 2008 г.). «Структуры ядер комплекса пируватдегидрогеназы человека: высококонсервативный каталитический центр с гибкими N-концевыми доменами». Структура. 16 (1): 104–114. Дои:10.1016 / j.str.2007.10.024. ISSN 0969-2126. ЧВК 4807695. PMID 18184588., человеческие полноразмерные и усеченные ядра E2 (tE2) PDC, выраженные в Кишечная палочка
АТФ ADP АТФ ADP + + 2 ×  2 ×  2 × 3-фосфоглицерат 2 ×  2 × 2-фосфоглицерат 2 ×  2 × Фосфоенолпируват 2 ×  ADP АТФ 2 × Пируват 2 × |





