Циангидрин - Cyanohydrin
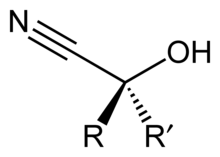
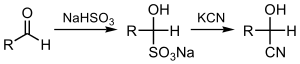
А циангидрин это функциональная группа нашел в органические соединения в котором циано и гидроксигруппа присоединены к одному и тому же атому углерода. Общая формула R2C (OH) CN, где R - H, алкил, или же арил. Цианогидрины являются промышленно важными прекурсорами карбоновые кислоты и немного аминокислоты. Цианогидрины могут быть образованы циангидриновая реакция, который включает лечение кетон или альдегид с цианистый водород (HCN) в присутствии избыточного количества цианид натрия (NaCN) в качестве катализатора:[1]
- RR’C = O + HCN → RR’C (OH) CN
В этой реакции нуклеофильный CN− ион атакует электрофильный карбонильный углерод в кетоне с последующим протонированием HCN, тем самым регенерируя цианид анион. Цианогидрины также получают замещением сульфит цианистыми солями:[2]
Цианогидрины являются промежуточными продуктами в Синтез аминокислот Strecker. В водной кислоте они гидролизуются до α-гидроксикислота.
Ацетонциангидрины
Ацетонциангидрин, (CH3)2C (OH) CN - циангидрин ацетон. Он образуется как промежуточный продукт в промышленном производстве метилметакрилат.[3] В лаборатории эта жидкость служит источником HCN, который неудобно летуч.[4] Таким образом, ацетонциангидрин можно использовать для получения других циангидринов, для превращения HCN в Майкл акцепторы, а для формилирование из арены. Обработка циангидрина гидрид лития дает безводный цианид лития:
Препаративные методы
Цианогидрины сначала были получены добавлением HCN и катализатора (основания или фермента) к соответствующему карбонилу.[5] В лабораторных условиях использование HCN (токсичного) в значительной степени не поощряется, по этой причине ведутся поиски других менее опасных реагентов для цианирования. Образование HCN in situ может происходить с использованием таких предшественников, как ацетонциангидрин. В качестве альтернативы, цианосилильные производные, такие как TMS-CN, позволяют как цианирование, так и защиту за одну стадию без необходимости в HCN.[6] Сообщалось об аналогичных процедурах, основанных на образовании сложного эфира, фосфата и карбоната.[7][8][9]

Другие циангидрины
Манделонитрил, с формулой C6ЧАС5CH (OH) CN, в небольших количествах содержится в косточках некоторых фруктов.[2] Известны родственные цианогенные гликозиды, такие как амигдалин.[1]
Гликолонитрил, также называемый гидроксиацетонитрилом или циангидрином формальдегида, представляет собой органическое соединение с формулой HOCH2CN. Это простейший циангидрин, полученный из формальдегид.[10]

гликолонитрил

ацетонциангидрин

манделонитрил
Смотрите также
Рекомендации
- ^ а б Дэвид Т. Моури (1948). «Приготовление нитрилов». Chem. Ред. 42 (2): 189–283. Дои:10.1021 / cr60132a001. PMID 18914000.
- ^ а б Corson, B.B .; Dodge, R.A .; Harris, S.A .; Йеу, Дж. С. (1941). «Миндальная кислота». Органический синтез.; Коллективный объем, 1, п. 336
- ^ Уильям Бауэр-младший «Метакриловая кислота и производные» в Энциклопедии промышленной химии Ульмана 2002, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a16_441. Дата публикации статьи в Интернете: 15 июня 2000 г.
- ^ Арутюнян, С.А. Энциклопедия реагентов для органического синтеза "ацетонциангидрин" 2001, John Wiley & Sons. Дои:10.1002 / 047084289X.ra014
- ^ Север, М .; Усанов, Д.Л .; Янг, К. Льюис, катализируемый кислотой асимметричный синтез циангидрина. Chem. Ред. 2008, 108 (12), 5146–5226. DOI: 10.1021 / cr800255k.
- ^ Lidy, W .; Sundermeyer, W. Spaltungsreaktionen Des Trimethylsilylcyanids, Eine Neue Darstellungsmethode Für O- (Trimethylsilyl) Cyanhydrine. Chem. Бер. 1973, 106 (2), 587–593. DOI: 10.1002 / cber.19731060224
- ^ Scholl, M .; Lim, C.K .; Fu, G.C. Удобное и эффективное преобразование альдегидов в ацилированные циангидрины с использованием цианида трибутилолова в качестве катализатора. J. Org. Chem. 1995, 60 (19), 6229–6231. DOI: 10.1021 / jo00124a052.
- ^ Yoneda, R .; Harusawa, S .; Курихара, Т. Цианофосфат: эффективное промежуточное соединение для хемоселективного превращения карбонильных соединений в нитрилы. J. Org. Chem. 1991, 56 (5), 1827–1832. DOI: 10.1021 / jo00005a031.
- ^ Juhl, M .; Петерсен, А. Р .; Ли, Ж.-В. Синтез циангидрина с участием CO2 и простые итерационные реакции гомологации. Chem. - A Eur. J. 2020. DOI: 10.1002 / chem.202003623.
- ^ Годри, Р. (1955). «Гликолонитрил». Органический синтез.; Коллективный объем, 3, п. 436
внешняя ссылка
- ИЮПАК Золотая книга определение циангидринов [1]