Аминокислота - Amino acid

Аминокислоты находятся органические соединения которые содержат амин (–NH2) и карбоксил (–COOH) функциональные группы вместе с боковая цепь (Группа R) специфична для каждой аминокислоты.[1][2] Ключ элементы аминокислоты являются углерод (С), водород (ЧАС), кислород (O) и азот (N), хотя в боковых цепях некоторых аминокислот присутствуют и другие элементы. Известно около 500 встречающихся в природе аминокислот (хотя только 20 встречаются в генетический код ) и их можно классифицировать по-разному.[3] По расположению основных структурных функциональных групп их можно классифицировать как альфа- (α-), бета- (β-), гамма- (γ-) или дельта- (δ-) аминокислоты; другие категории относятся к полярность, pH уровень и тип группы боковой цепи (алифатический, ациклический, ароматный, содержащий гидроксил или же сера, так далее.). В виде белки, аминокислота остатки образуют второй по величине компонент (воды самый большой) из человеческих мышцы и другие ткани.[4] Помимо своей роли остатков в белках, аминокислоты участвуют в ряде процессов, таких как нейротрансмиттер транспорт и биосинтез.
В биохимия, аминокислоты, которые имеют аминогруппу, присоединенную к (альфа) углерод атом, следующий за карбоксильной группой, имеет особое значение. Они известны как 2-, альфа-, или же α-аминокислоты (общий формула ЧАС2NCHRCOOH в большинстве случаев,[а] где R - органический заместитель известный как "боковая цепь ");[5] часто термин «аминокислота» используется для обозначения именно этих. Они включают 22 протеиногенный ("белковые") аминокислоты,[6][7][8] которые объединяются в пептид цепочки («полипептиды»), чтобы сформировать строительные блоки огромного множества белки.[9] Это все L-стереоизомеры ("левша " изомеры ), хотя несколько D-аминокислоты («правые») встречаются в бактериальные конверты, как нейромодулятор (D-серин ), а в некоторых антибиотики.[10]
Двадцать протеиногенных аминокислот кодируются непосредственно триплетом кодоны в генетический код и известны как «стандартные» аминокислоты. Два других («нестандартные» или «неканонические») являются селеноцистеин (присутствует во многих прокариоты как и большинство эукариоты, но не кодируется напрямую ДНК ), и пирролизин (встречается только в некоторых археи и один бактерия ). Пирролизин и селеноцистеин кодируются через вариантные кодоны; например, селеноцистеин кодируется стоп-кодон и Элемент SECIS.[11][12][13] N-формилметионин (которая часто является исходной аминокислотой белков бактерий, митохондрии, и хлоропласты ) обычно рассматривается как форма метионин а не как отдельная протеиногенная аминокислота. Кодон–тРНК комбинации, не встречающиеся в природе, также могут использоваться для «расширить» генетический код и образуют новые белки, известные как аллопротеины включение непротеиногенные аминокислоты.[14][15][16]
Многие важные протеиногенные и непротеиногенные аминокислоты выполняют биологические функции. Например, в человеческий мозг, глутамат (стандартный глютаминовая кислота ) и гамма-аминомасляная кислота («ГАМК», нестандартная гамма-аминокислота) являются, соответственно, основными возбуждающие и тормозные нейротрансмиттеры.[17] Гидроксипролин, основной компонент соединительная ткань коллаген, синтезируется из пролин. Глицин является биосинтетическим предшественником порфирины используется в красные кровяные тельца. Карнитин используется в липидный транспорт. Девять протеиногенных аминокислот называются "существенный "для людей, потому что они не могут быть произведены из других соединения человеческим телом и поэтому должны приниматься в пищу. Другие могут быть условно существенный для определенного возраста или состояния здоровья. Незаменимые аминокислоты также могут различаться между разновидность.[b] Из-за своего биологического значения аминокислоты важны для питания и обычно используются в пищевые добавки, удобрения, подача, и пищевые технологии. Промышленное использование включает производство наркотики, биоразлагаемый пластик, и хиральные катализаторы.
История
Первые несколько аминокислот были открыты в начале 19 века.[18][19] В 1806 году французские химики Луи-Николя Воклен и Пьер Жан Робике выделил соединение в спаржа который впоследствии был назван аспарагин, первая открытая аминокислота.[20][21] Цистин был открыт в 1810 г.,[22] хотя его мономер, цистеин, оставался неоткрытым до 1884 года.[21][23] Глицин и лейцин были открыты в 1820 году.[24] Последняя из 20 общих аминокислот, которые были открыты, была треонин в 1935 г. Уильям Камминг Роуз, который также определил незаменимые аминокислоты и установили минимальные суточные потребности всех аминокислот для оптимального роста.[25][26]
Единство химической категории было признано Wurtz в 1865 году, но он не дал ей особого названия.[27] Первое использование термина «аминокислота» на английском языке датируется 1898 годом.[28] а немецкий термин, Aminosäure, использовался ранее.[29] Было обнаружено, что белки выделяют аминокислоты после ферментативного переваривания или кислоты. гидролиз. В 1902 г. Эмиль Фишер и Франц Хофмайстер независимо предположил, что белки образуются из многих аминокислот, в результате чего связи образуются между аминогруппой одной аминокислоты с карбоксильной группой другой, что приводит к линейной структуре, которую Фишер назвал "пептид ".[30]
Общая структура
В структуре, показанной вверху страницы, р представляет боковая цепь специфичен для каждой аминокислоты. В углерод атом рядом с карбоксильная группа называется α – углерод. Аминокислоты, содержащие аминогруппа связанные непосредственно с альфа-углеродом, называются альфа-аминокислоты.[31] К ним относятся такие аминокислоты, как пролин которые содержат вторичные амины, которые раньше часто называли иминокислотами.[32][33][34]
Изомерия
Альфа-аминокислоты являются наиболее распространенной формой, встречающейся в природе, но только когда они встречаются в L-изомер. Альфа-углерод - это хиральный атом углерода, за исключением глицин, который имеет два неразличимых атома водорода на альфа-углероде.[35] Следовательно, все альфа-аминокислоты, кроме глицин может существовать в любом из двух энантиомеры, называется L или же D аминокислоты (относительная конфигурация), которые являются зеркальным отображением друг друга (смотрите также Хиральность ). Пока L-аминокислоты представляют собой все аминокислоты, содержащиеся в белки при трансляции в рибосоме, D-аминокислоты содержатся в некоторых белках, вырабатываемых ферментом после перевод и транспортировка в эндоплазматический ретикулум, как у экзотических морских организмов, таких как конусные улитки.[36] Они также являются многочисленными компонентами пептидогликан клеточные стенки бактерий,[37] и D-серин может действовать как нейротрансмиттер в мозгу.[38] D-аминокислоты используются в рацемическая кристаллография для создания центросимметричных кристаллов, которые (в зависимости от белка) могут позволить более легкое и надежное определение структуры белка.[39] В L и D Соглашение о конфигурации аминокислот относится не к оптической активности самой аминокислоты, а скорее к оптической активности изомера глицеральдегид из которой эта аминокислота теоретически может быть синтезирована (D-глицеральдегид правовращающий; L-глицеральдегид является левовращающим). (S) и (р) указатели используются для обозначения абсолютная конфигурация. Почти все аминокислоты в белках (S) на α-углероде, причем цистеин существование (р) и глицин не-хиральный.[40] Боковая цепь цистеина находится в том же геометрическом положении, что и другие аминокислоты, но р/S терминология перевернута, потому что сера имеет более высокий атомный номер по сравнению с кислородом карбоксильной группы, который дает боковой цепи более высокий приоритет по правилам Кана-Ингольда-Прелога, тогда как атомы в большинстве других боковых цепей придают им более низкий приоритет по сравнению с карбоксильной группой.[41]
Боковые цепи
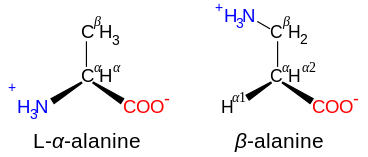
Аминокислоты обозначаются как α-, когда атом азота присоединен к атому углерода, соседнему с карбоксильной группой: в этом случае соединение содержит субструктуру N – C – CO.2. Аминокислоты с субструктурой N – C – C – CO2 классифицируются как β-аминокислоты. γ-Аминокислоты содержат субструктуру N – C – C – C – CO2, и так далее.[42]
Аминокислоты обычно классифицируют по характеристики их боковой цепи на четыре группы. Боковая цепь может превращать аминокислоту в слабая кислота или слабая база, а гидрофил если боковая цепь полярный или гидрофоб если это неполярный.[35] Фраза "аминокислоты с разветвленной цепью "или BCAA относится к аминокислотам, имеющим алифатический боковые цепи, которые являются линейными; это лейцин, изолейцин, и валин. Пролин единственный протеиногенный аминокислота, боковая группа которой связана с α-аминогруппой и, таким образом, также является единственной протеиногенной аминокислотой, содержащей вторичный амин в этом положении.[35] Таким образом, с химической точки зрения пролин представляет собой иминовая кислота, поскольку в нем отсутствует первичная аминогруппа,[43] хотя он по-прежнему классифицируется как аминокислота в современной биохимической номенклатуре[44] и может также называться "N-алкилированная альфа-аминокислота ».[45]
Цвиттерионы

В водном растворе аминокислоты существуют в двух формах (как показано справа), в молекулярной форме и цвиттерион формы в равновесии друг с другом. Две формы сосуществуют в диапазоне pH. пK1 − 2 к пK2 + 2, который для глицина равен pH 0–12. Соотношение концентраций двух изомеров не зависит от pH. Значение этого отношения не может быть определено экспериментально.
Поскольку все аминокислоты содержат функциональные группы аминов и карбоновых кислот, они амфипротический.[35] В pH = pK1 (примерно 2,2) будет равная концентрация видов NH+
3CH (R) CO
2ЧАС и NH+
3CH (R) CO−
2 и в pH = pK2 (примерно 10) будет равная концентрация видов NH+
3CH (R) CO−
2 и NH
2CH (R) CO−
2. Отсюда следует, что нейтральная молекула и цвиттерион фактически являются единственными видами, присутствующими при биологическом pH.[46]
Принято считать, что концентрация цвиттер-иона намного больше, чем концентрация нейтральной молекулы на основе сравнений с известным pK ценности амины и карбоновые кислоты.
Изоэлектрическая точка

При значениях pH между двумя pKа значений цвиттерион преобладает, но сосуществует в динамическое равновесие с небольшим количеством чистых отрицательных и чистых положительных ионов. Точно посередине между двумя pKа значений, следовое количество чистых отрицательных и следовых количеств чистых положительных ионов точно уравновешивается, так что средний чистый заряд всех присутствующих форм равен нулю.[47] Этот pH известен как изоэлектрическая точка пя, так что пя = 1/2(пKа1 + pKа2). Для аминокислот с заряженными боковыми цепями pKа боковой цепи. Таким образом, для аспартата или глутамата с отрицательными боковыми цепями pя = 1/2(пKа1 + pKа (R)), где pKа (R) боковая цепь pKа. Цистеин также имеет потенциально отрицательную боковую цепь с pKа (R) = 8,14, поэтому pя следует рассчитывать как для аспартата и глутамата, даже если боковая цепь не имеет значительного заряда при физиологическом pH. Для гистидина, лизина и аргинина с положительными боковыми цепями pя = 1/2(пKа (R) + pKа2). Аминокислоты имеют нулевую подвижность при электрофорезе в их изоэлектрической точке, хотя это поведение чаще используется для пептидов и белков, чем для отдельных аминокислот. Цвиттерионы имеют минимальную растворимость в их изоэлектрической точке, и некоторые аминокислоты (в частности, с неполярными боковыми цепями) могут быть выделены путем осаждения из воды путем доведения pH до требуемой изоэлектрической точки.
Возникновение и функции в биохимии
Протеиногенные аминокислоты
Аминокислоты - структурные единицы (мономеры ), из которых состоят белки. Они объединяются в короткие полимер сети под названием пептиды или более длинные цепи, называемые полипептиды или же белки. Эти полимеры являются линейными и неразветвленными, каждая аминокислота в цепи присоединена к двум соседним аминокислотам. Процесс создания белков, кодируемых генетическим материалом ДНК / РНК, называется перевод и включает в себя поэтапное добавление аминокислот к растущей белковой цепи посредством рибозим это называется рибосома.[48] Порядок, в котором добавляются аминокислоты, читается в генетический код из мРНК шаблон, который является РНК копия одного из гены.
Двадцать две аминокислоты естественным образом включены в полипептиды и называются протеиногенный или натуральные аминокислоты.[35] Из них 20 кодируются универсальным генетический код. Остальные 2, селеноцистеин и пирролизин, включены в белки с помощью уникальных синтетических механизмов. Селеноцистеин включается, когда транслируемая мРНК включает Элемент SECIS, что заставляет кодон UGA кодировать селеноцистеин вместо стоп-кодон.[49] Пирролизин используется некоторыми метаногенный археи в ферментах, которые они используют для производства метан. Он кодируется кодоном UAG, который обычно является стоп-кодоном у других организмов.[50] За этим кодоном UAG следует Нисходящая последовательность PYLIS.[51]
Несколько независимых эволюционных исследований с использованием различных типов данных предположили, что Gly, Ala, Asp, Val, Ser, Pro, Glu, Leu, Thr могут принадлежать к группе аминокислот, составляющих ранний генетический код, тогда как Cys, Met , Tyr, Trp, His, Phe могут принадлежать к группе аминокислот, которые позже составили дополнения генетического кода.[52][53][54][55]
Непротеиногенные аминокислоты
Помимо 22 протеиногенные аминокислоты, много не протеиногенный аминокислоты известны. Их либо нет в белках (например, карнитин, ГАМК, левотироксин ) или не производятся напрямую и изолированно стандартным клеточным оборудованием (например, гидроксипролин и селенометионин ).
Непротеиногенные аминокислоты, которые содержатся в белках, образованы посттрансляционная модификация, которая является модификацией после трансляции во время синтеза белка. Эти модификации часто важны для функции или регуляции белка. Например, карбоксилирование из глутамат позволяет лучше связывать катионы кальция,[56] и коллаген содержит гидроксипролин, образуемый гидроксилирование из пролин.[57] Другой пример - образование гипузин в фактор инициации перевода EIF5A путем модификации остатка лизина.[58] Такие модификации могут также определять локализацию белка, например, добавление длинных гидрофобных групп может вызвать связывание белка с фосфолипид мембрана.[59]
Некоторые непротеиногенные аминокислоты не обнаруживаются в белках. Примеры включают 2-аминоизомасляная кислота и нейротрансмиттер гамма-аминомасляная кислота. Непротеиногенные аминокислоты часто встречаются в качестве промежуточных продуктов в метаболические пути для стандартных аминокислот - например, орнитин и цитруллин происходят в цикл мочевины, часть аминокислоты катаболизм (Смотри ниже).[60] Редким исключением из доминирования α-аминокислот в биологии является β-аминокислота. бета-аланин (3-аминопропановая кислота), которая используется у растений и микроорганизмов при синтезе пантотеновая кислота (витамин B5), компонент кофермент А.[61]
D-Аминокислоты в естественном изобилии
Этот раздел должен быть обновлено. (Июль 2019) |
Несмотря на то что D-изомеры редко встречаются в живых организмах, грамицидин представляет собой полипептид, состоящий из смеси D- и L-аминокислоты.[62] Другие соединения, содержащие D-аминокислоты тироцидин и валиномицин. Эти соединения разрушают стенки бактериальных клеток, особенно в Грамположительный бактерии. По состоянию на 2011 г.[Обновить], всего 837 D-аминокислоты были обнаружены в Swiss-Prot база данных из 187 миллионов проанализированных аминокислот.[63]
Нестандартные аминокислоты
20 аминокислот, которые кодируются непосредственно кодонами универсального генетический код называются стандарт или же канонический аминокислоты. Модифицированная форма метионина (N-формилметионин ) часто включается вместо метионина в качестве исходной аминокислоты белков в бактериях, митохондриях и хлоропластах. Другие аминокислоты называются нестандартный или же неканонический. Большинство нестандартных аминокислот также не являются протеиногенными (т.е.они не могут быть включены в белки во время трансляции), но две из них являются протеиногенными, так как они могут трансляционно включаться в белки, используя информацию, не закодированную в универсальном генетическом коде.
Две нестандартные протеиногенные аминокислоты: селеноцистеин (присутствует у многих неэукариот, а также у большинства эукариот, но не кодируется непосредственно ДНК) и пирролизин (встречается только в некоторых археи и один бактерия ). Включение этих нестандартных аминокислот происходит редко. Например, 25 белков человека включают в свою первичную структуру селеноцистеин,[64] и структурно охарактеризованные ферменты (селеноферменты) используют селеноцистеин в качестве каталитического часть на их активных сайтах.[65] Пирролизин и селеноцистеин кодируются вариантными кодонами. Например, селеноцистеин кодируется стоп-кодон и Элемент SECIS.[11][12][13]
В питании человека

Попадая в организм человека из пищи, 20 стандартных аминокислот либо используются для синтеза белков, других биомолекул, либо окисляются до мочевина и углекислый газ как источник энергии.[66] Путь окисления начинается с удаления аминогруппы трансаминаза; аминогруппа затем подается в цикл мочевины. Другой продукт переамидирования - это кетокислота что входит в цикл лимонной кислоты.[67] Глюкогенные аминокислоты также может быть преобразован в глюкозу через глюконеогенез.[68] Из 20 стандартных аминокислот девять (Его, Иль, Лея, Lys, Встретились, Phe, Thr, Trp и Вал ) называются незаменимые аминокислоты поскольку тело человека не можешь синтезировать их от других соединения на уровне, необходимом для нормального роста, поэтому их нужно получать из пищи.[69][70][71] Кроме того, цистеин, тирозин, и аргинин считаются полузаменимыми аминокислотами, а таурин - полуосновной аминосульфоновой кислотой у детей. Метаболические пути, по которым синтезируются эти мономеры, еще не полностью разработаны.[72][73] Необходимые количества также зависят от возраста и состояния здоровья человека, поэтому трудно сделать общие выводы о диетических потребностях в некоторых аминокислотах. Диетическое воздействие нестандартных аминокислот BMAA был связан с нейродегенеративными заболеваниями человека, включая ALS.[74][75]
• PA: фосфатидная кислота
• mTOR: механистическая мишень рапамицина
• AMP: аденозинмонофосфат
• ATP: аденозинтрифосфат
• АМПК: АМФ-активированная протеинкиназа
• PGC ‐ 1α: гамма-коактиватор рецептора, активируемого пролифератором пероксисом,-1α
• S6K1: p70S6 киназа
• 4EBP1: фактор инициации трансляции эукариот 4E-связывающий белок 1
• eIF4E: фактор инициации трансляции эукариот 4E
• RPS6: рибосомальный белок S6
• eEF2: фактор элонгации эукариот 2
• RE: упражнения с сопротивлением; EE: упражнения на выносливость
• Мио: миофибрилла; Мито: митохондриальный
• AA: аминокислоты
• HMB: β-гидрокси β-метилмасляная кислота
• ↑ означает активацию
• Τ означает запрет
Небелковые функции
У людей небелковые аминокислоты также играют важную роль в качестве промежуточные продукты метаболизма, например, в биосинтезе нейротрансмиттер гамма-аминомасляная кислота (ГАМК). Многие аминокислоты используются для синтеза других молекул, например:
- Триптофан является предшественником нейромедиатора серотонин.[82]
- Тирозин (и его предшественник фенилаланин) являются предшественниками катехоламин нейротрансмиттеры дофамин, адреналин и норэпинефрин и различные следы аминов.
- Фенилаланин является предшественником фенэтиламин и тирозин у людей. В растениях он является предшественником различных фенилпропаноиды, которые важны для метаболизма растений.
- Глицин является предшественником порфирины Такие как гем.[83]
- Аргинин является предшественником оксид азота.[84]
- Орнитин и S-аденозилметионин являются предшественниками полиамины.[85]
- Аспартат, глицин, и глутамин являются предшественниками нуклеотиды.[86] Однако не все функции других распространенных нестандартных аминокислот известны.
Некоторые нестандартные аминокислоты используются в качестве защита от травоядных в растениях.[87] Например, канаванин является аналогом аргинин это можно найти во многих бобовые,[88] и в особо крупных количествах в Канавалия гладиата (фасоль меча).[89] Эта аминокислота защищает растения от хищников, таких как насекомые, и может вызывать болезни у людей, если некоторые виды бобовых употребляются без обработки.[90] Небелковая аминокислота мимозин содержится в других видах бобовых, в частности Leucaena leucocephala.[91] Это соединение является аналогом тирозин и может отравить животных, которые пасутся на этих растениях.
Использование в промышленности
Аминокислоты используются в различных отраслях промышленности, но в основном они используются в качестве добавок к корма для животных. Это необходимо, поскольку многие из основных компонентов этих кормов, такие как соевые бобы, либо у них низкие уровни, либо отсутствуют некоторые незаменимые аминокислоты: лизин, метионин, треонин и триптофан являются наиболее важными в производстве этих кормов.[92] В этой промышленности аминокислоты также используются для хелатирования катионов металлов с целью улучшения абсорбции минералов из добавок, которые могут потребоваться для улучшения здоровья или продуктивности этих животных.[93]
В пищевая промышленность также является основным потребителем аминокислот, в частности, глютаминовая кислота, который используется как усилитель вкуса,[94] и аспартам (1-метиловый эфир аспартилфенилаланина) в качестве низкокалорийного заменитель сахара.[95] Технология, аналогичная той, которая используется для кормления животных, используется в индустрии питания человека для облегчения симптомов дефицита минералов, таких как анемия, путем улучшения абсорбции минералов и уменьшения негативных побочных эффектов от добавок неорганических минералов.[96]
Хелатирующая способность аминокислот использовалась в удобрениях для сельского хозяйства, чтобы облегчить доставку минералов к растениям, чтобы исправить недостаток минералов, такой как хлороз железа. Эти удобрения также используются для предотвращения возникновения недостатков и улучшения общего состояния растений.[97] Оставшаяся продукция аминокислот используется в синтезе наркотики и косметика.[92]
Аналогичным образом производные некоторых аминокислот используются в фармацевтической промышленности. Они включают 5-HTP (5-гидрокситриптофан), используемый для экспериментального лечения депрессии,[98] L-ДОПА (L-дигидроксифенилаланин) для Болезнь Паркинсона лечение,[99] и эфлорнитин препарат, подавляющий орнитиндекарбоксилаза и используется при лечении сонная болезнь.[100]
Расширенный генетический код
С 2001 года 40 неприродных аминокислот были добавлены в белок путем создания уникального кодона (перекодирования) и соответствующей пары трансфер-РНК: аминоацил-тРНК-синтетаза, чтобы кодировать его с различными физико-химическими и биологическими свойствами для использования в качестве инструмент для изучения структура белка и функционировать или создавать новые или улучшенные белки.[14][15]
Нулломеры
Нулломеры - это кодоны, которые теоретически кодируют аминокислоту, однако в природе существует избирательное предубеждение против использования этого кодона в пользу другого, например, бактерии предпочитают использовать CGA вместо AGA для кодирования аргинина.[101] Это создает некоторые последовательности, которые не появляются в геноме. Эту характеристику можно использовать для создания новых селективных противораковых препаратов.[102] и предотвратить перекрестное заражение образцов ДНК, полученных при расследовании преступлений.[103]
Химические строительные блоки
Аминокислоты важны как недорогие сырье. Эти соединения используются в синтез хирального пула в качестве энантиомерно чистый строительные блоки.[104]
Аминокислоты были исследованы как предшественники хиральные катализаторы, например, для асимметричных гидрирование реакции, хотя коммерческих приложений не существует.[105]
Биоразлагаемый пластик
Аминокислоты считались компонентами биоразлагаемых полимеров, которые находят применение в качестве экологически чистый упаковка и в медицине в доставки лекарств и строительство протезные имплантаты.[106] Интересный пример таких материалов - полиаспартат, водорастворимый биоразлагаемый полимер, который может найти применение в одноразовых подгузники и сельское хозяйство.[107] Благодаря своей растворимости и способности хелат ионы металлов, полиаспартат также используется в качестве биоразлагаемого антибиотика.масштабирование агент и замедлитель коррозии.[108][109] Кроме того, ароматическая аминокислота тирозин рассматривается как возможная замена фенолы Такие как бисфенол А в производстве поликарбонаты.[110]
Синтез

Химический синтез
Коммерческое производство аминокислот обычно зависит от мутантных бактерий, которые перепроизводят отдельные аминокислоты, используя глюкозу в качестве источника углерода. Некоторые аминокислоты производятся путем ферментативного превращения синтетических промежуточных продуктов. 2-аминотиазолин-4-карбоновая кислота является промежуточным звеном в одном промышленном синтезе L-цистеин Например. Аспарагиновая кислота производится добавлением аммиака к фумарат используя лиазу.[111]
Биосинтез
В растениях азот сначала ассимилируется в органические соединения в виде глутамат, образованный из альфа-кетоглутарата и аммиака в митохондрии. Для других аминокислот растения используют трансаминазы переместить аминогруппу с глутамата на другую альфа-кетокислоту. Например, аспартатаминотрансфераза превращает глутамат и оксалоацетат в альфа-кетоглутарат и аспартат.[112] Другие организмы также используют трансаминазы для синтеза аминокислот.
Нестандартные аминокислоты обычно образуются путем модификации стандартных аминокислот. Например, гомоцистеин формируется через путь транссульфурации или деметилированием метионина через промежуточный метаболит S-аденозилметионин,[113] пока гидроксипролин сделано пост-переводная модификация из пролин.[114]
Микроорганизмы а растения синтезируют много необычных аминокислот. Например, некоторые микробы производят 2-аминоизомасляная кислота и лантионин, который представляет собой производное аланина с сульфидной мостиковой связью. Обе эти аминокислоты содержатся в пептидных лантибиотики Такие как аламетицин.[115] Однако у растений 1-аминоциклопропан-1-карбоновая кислота представляет собой небольшую дизамещенную циклическую аминокислоту, которая является ключевым промежуточным продуктом в производстве растительного гормона. этилен.[116]
Реакции
Аминокислоты вступают в реакции, ожидаемые от составляющих функциональных групп.[117][118]
Образование пептидной связи

Поскольку как аминовая, так и карбоксильная группы аминокислот могут реагировать с образованием амидных связей, одна молекула аминокислоты может реагировать с другой и соединяться посредством амидной связи. Этот полимеризация аминокислот - вот что создает белки. Этот реакция конденсации дает вновь сформированный пептидная связь и молекула воды. В клетках эта реакция не происходит напрямую; вместо этого аминокислота сначала активируется присоединением к переносить РНК молекула через сложный эфир связь. Эта аминоацил-тРНК продуцируется в АТФ -зависимая реакция, осуществляемая аминоацил тРНК синтетаза.[119] Эта аминоацил-тРНК затем является субстратом для рибосома, который катализирует атаку аминогруппы удлиненной белковой цепи на сложноэфирную связь.[120] В результате этого механизма все белки, производимые рибосомами, синтезируются, начиная с их N-конце и двигаясь к их C-терминал.
Однако не все пептидные связи образуются таким образом. В некоторых случаях пептиды синтезируются специфическими ферментами. Например, трипептид глутатион является важной частью защиты клеток от окислительного стресса. Этот пептид синтезируется в два этапа из свободных аминокислот.[121] На первом этапе гамма-глутамилцистеин синтетаза конденсируется цистеин и глютаминовая кислота через пептидную связь, образованную между карбоксилом боковой цепи глутамата (гамма-углерод этой боковой цепи) и аминогруппой цистеина. Затем этот дипептид конденсируется с глицин к глутатионсинтетаза с образованием глутатиона.[122]
В химии пептиды синтезируются с помощью множества реакций. Один из наиболее часто используемых в твердофазный пептидный синтез использует ароматические оксимные производные аминокислот в качестве активированных единиц. Их добавляют последовательно к растущей пептидной цепи, которая прикреплена к твердой полимерной подложке.[123] Библиотеки пептидов используются при открытии лекарств через высокопроизводительный скрининг.[124]
Комбинация функциональных групп позволяет аминокислотам быть эффективными полидентатными лигандами для хелатов металл-аминокислота.[125]Множественные боковые цепи аминокислот также могут вступать в химические реакции.
Катаболизм

* Глюкогенный, с продуктами, имеющими способность образовывать глюкоза к глюконеогенез
* Кетогенный, с продуктами, не имеющими способности образовывать глюкозу. Эти продукты все еще можно использовать для кетогенез или же липидный синтез.
* Аминокислоты катаболизируются как в глюкогенные, так и в кетогенные продукты.
Аминокислоты должны сначала выйти из органелл и клеток в кровоток через переносчики аминокислот, поскольку группы амина и карбоновой кислоты обычно ионизируются. Распад аминокислоты, происходящий в печени и почках, часто включает: дезаминирование перемещая свою аминогруппу в альфа-кетоглутарат, образуя глутамат. В этом процессе участвуют трансаминазы, часто такие же, как те, которые используются при аминировании во время синтеза. У многих позвоночных аминогруппа затем удаляется через цикл мочевины и выводится в виде мочевина. Однако расщепление аминокислот может привести к мочевая кислота или аммиак. Например, сериндегидратаза превращает серин в пируват и аммиак.[86] После удаления одной или нескольких аминогрупп остаток молекулы иногда можно использовать для синтеза новых аминокислот или для получения энергии, вводя гликолиз или цикл лимонной кислоты, как показано на изображении справа.
Комплексообразование
Аминокислоты - бидентатные лиганды, образующие аминокислотные комплексы переходных металлов.[127]
Физико-химические свойства аминокислот
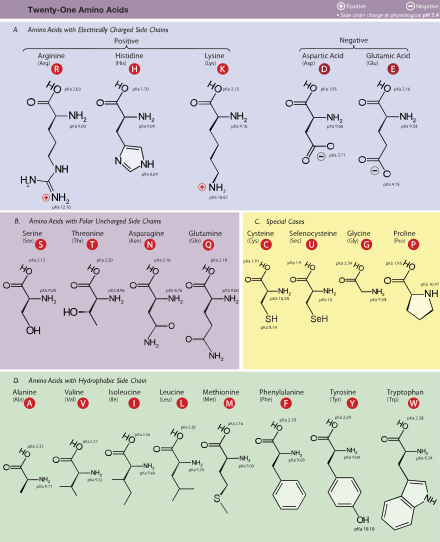
CA. 20 канонических аминокислот можно классифицировать по их свойствам. Важными факторами являются плата, гидрофильность или же гидрофобность, размер и функциональные группы.[35] Эти свойства влияют структура белка и белок-белковые взаимодействия. Водорастворимые белки обычно имеют гидрофобные остатки (Лея, Иль, Вал, Phe, и Trp ) похоронен в середине белка, тогда как гидрофильные боковые цепи подвергаются воздействию водного растворителя. (Обратите внимание, что в биохимия, остаток относится к конкретному мономер в пределах полимерная цепь из полисахарид, белок или же нуклеиновая кислота.) интегральные мембранные белки имеют тенденцию иметь наружные кольца открытых гидрофобный аминокислоты, которые закрепляют их в липидный бислой. Немного белки периферической мембраны имеют на своей поверхности участок гидрофобных аминокислот, который фиксируется на мембране. Подобным образом белки, которые должны связываться с положительно заряженными молекулами, имеют поверхности, богатые отрицательно заряженными аминокислотами, такими как глутамат и аспартат, в то время как белки, связывающиеся с отрицательно заряженными молекулами, имеют поверхности, богатые положительно заряженными цепями, такими как лизин и аргинин. Например, лизин и аргинин сильно обогащены регионы низкой сложности белков, связывающих нуклеиновые кислоты.[55] Есть разные шкалы гидрофобности аминокислотных остатков.[128]
Некоторые аминокислоты обладают особыми свойствами, например: цистеин, которые могут образовывать ковалентные дисульфидные связи к другим остаткам цистеина, пролин что формирует цикл к основному полипептиду, и глицин это более гибкий, чем другие аминокислоты.
Кроме того, глицин и пролин сильно обогащены регионы низкой сложности эукариотических и прокариотических белков, тогда как противоположное (недостаточно представленное) наблюдается для высокореактивных, сложных или гидрофобных аминокислот, таких как цистеин, фенилаланин, триптофан, метионин, валин, лейцин, изолейцин.[55][129][130]
Многие белки подвергаются целому ряду посттрансляционные модификации, в результате чего к боковым цепям аминокислот присоединяются дополнительные химические группы. Некоторые модификации могут давать гидрофобные липопротеины,[131] или гидрофильный гликопротеины.[132] Этот тип модификации позволяет обратимое нацеливание белка на мембрану. Например, добавление и удаление жирной кислоты пальмитиновая кислота к остаткам цистеина в некоторых сигнальных белках заставляет белки прикрепляться, а затем отсоединяться от клеточных мембран.[133]
Таблица стандартных сокращений аминокислот и свойств
| Аминокислота | Буквенный код | Боковая цепь | Гидропатия индекс[134] | Молярная поглощающая способность[135] | Молекулярная масса | Изобилие белков (%)[136] | Стандартное генетическое кодирование, Обозначение ИЮПАК | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 | 1 | Учебный класс | Полярность[137] | Заряд при pH 7.4[137] | Длина волны, λМаксимум (нм) | Коэффициент, ε (мМ−1·см−1) | |||||
| Аланин | Ала | А | Алифатический | Неполярный | Нейтральный | 1.8 | 89.094 | 8.76 | GCN | ||
| Аргинин | Arg | р | Базовый | Базовый полярный | Положительный | −4.5 | 174.203 | 5.78 | MGR, CGY (кодирующие кодоны также могут выражаться: CGN, AGR) | ||
| Аспарагин | Asn | N | Амид | Полярный | Нейтральный | −3.5 | 132.119 | 3.93 | AAY | ||
| Аспарагиновая кислота | Жерех | D | Кислота | Кислый полярный | Отрицательный | −3.5 | 133.104 | 5.49 | Гей | ||
| Цистеин | Cys | C | Серная | Неполярный | Нейтральный | 2.5 | 250 | 0.3 | 121.154 | 1.38 | UGY |
| Глутамин | Gln | Q | Амид | Полярный | Нейтральный | −3.5 | 146.146 | 3.9 | МАШИНА | ||
| Глютаминовая кислота | Glu | E | Кислота | Кислый полярный | Отрицательный | −3.5 | 147.131 | 6.32 | GAR | ||
| Глицин | Gly | грамм | Алифатический | Неполярный | Нейтральный | −0.4 | 75.067 | 7.03 | GGN | ||
| Гистидин | Его | ЧАС | Базовый ароматический | Базовый полярный | Положительно, 10% Нейтрально, 90% | −3.2 | 211 | 5.9 | 155.156 | 2.26 | CAY |
| Изолейцин | Иль | я | Алифатический | Неполярный | Нейтральный | 4.5 | 131.175 | 5.49 | AUH | ||
| Лейцин | Лея | L | Алифатический | Неполярный | Нейтральный | 3.8 | 131.175 | 9.68 | YUR, CUY (кодирующие кодоны также могут быть выражены: CUN, UUR) | ||
| Лизин | Lys | K | Базовый | Базовый полярный | Положительный | −3.9 | 146.189 | 5.19 | AAR | ||
| Метионин | Встретились | M | Серная | Неполярный | Нейтральный | 1.9 | 149.208 | 2.32 | AUG | ||
| Фенилаланин | Phe | F | Ароматный | Неполярный | Нейтральный | 2.8 | 257, 206, 188 | 0.2, 9.3, 60.0 | 165.192 | 3.87 | UUY |
| Пролин | Pro | п | Циклический | Неполярный | Нейтральный | −1.6 | 115.132 | 5.02 | CCN | ||
| Серин | Сер | S | Гидроксильный | Полярный | Нейтральный | −0.8 | 105.093 | 7.14 | UCN, AGY | ||
| Треонин | Thr | Т | Гидроксильный | Полярный | Нейтральный | −0.7 | 119.119 | 5.53 | ACN | ||
| Триптофан | Trp | W | Ароматный | Неполярный | Нейтральный | −0.9 | 280, 219 | 5.6, 47.0 | 204.228 | 1.25 | UGG |
| Тирозин | Тюр | Y | Ароматный | Полярный | Нейтральный | −1.3 | 274, 222, 193 | 1.4, 8.0, 48.0 | 181.191 | 2.91 | UAY |
| Валин | Вал | V | Алифатический | Неполярный | Нейтральный | 4.2 | 117.148 | 6.73 | ПИСТОЛЕТ | ||
Две дополнительные аминокислоты у некоторых видов кодируются кодоны которые обычно интерпретируются как стоп-кодоны:
| 21 и 22 аминокислоты | 3 буквы | 1 буква | Молекулярная масса |
|---|---|---|---|
| Селеноцистеин | Сек | U | 168.064 |
| Пирролизин | Пыл | О | 255.313 |
В дополнение к конкретным кодам аминокислот, заполнители используются в случаях, когда химический или же кристаллографический анализ пептида или белка не может окончательно определить идентичность остатка. Они также используются для обобщения консервативная последовательность белка мотивы. Использование отдельных букв для обозначения наборов аналогичных остатков аналогично использованию коды сокращений для вырожденных оснований.[138][139]
| Неопределенные аминокислоты | 3 буквы | 1 буква | Аминокислоты включены | Кодоны включены |
|---|---|---|---|---|
| Любые / неизвестные | Хаа | Икс | Все | NNN |
| Аспарагин или аспарагиновая кислота | Asx | B | D, N | РЭЙ |
| Глутамин или глутаминовая кислота | Glx | Z | E, Q | SAR |
| Лейцин или изолейцин | Xle | J | Я, Л | YTR, ATH, CTY (кодирующие кодоны также могут выражаться: CTN, ATH, TTR; MTY, YTR, ATA; MTY, HTA, YTG) |
| Гидрофобный | Φ | V, I, L, F, W, Y, M | НТН, ТАЙ, ТГГ | |
| Ароматный | Ω | F, W, Y, H | YWY, TTY, TGG (кодирующие кодоны также могут быть выражены: TWY, CAY, TGG) | |
| Алифатический (неароматический) | Ψ | V, I, L, M | VTN, TTR (кодирующие кодоны также могут быть выражены: NTR, VTY) | |
| Маленький | π | P, G, A, S | BCN, RGY, GGR | |
| Гидрофильный | ζ | S, T, H, N, Q, E, D, K, R | VAN, WCN, CGN, AGY (кодоны также могут быть выражены: VAN, WCN, MGY, CGP) | |
| Положительно заряженный | + | K, R, H | ARR, CRY, CGR | |
| Отрицательно заряженный | − | D, E | GAN |
Unk иногда используется вместо Хаа, но менее стандартен.
Кроме того, многие нестандартные аминокислоты иметь определенный код. Например, несколько пептидных препаратов, таких как Бортезомиб и MG132, находятся искусственно синтезированный и сохранить свои защитные группы, у которых есть определенные коды. Бортезомиб - это Pyz –Phe – boroLeu, а MG132 - Z –Leu – Leu – Leu – al. Чтобы помочь в анализе структуры белка, фотореактивные аналоги аминокислот доступны. К ним относятся фотолейцин (pLeu) и фотометионин (pMet).[140]
Химический анализ
Общий азот органического вещества в основном формируется аминогруппами белков. Общий азот по Кьельдалю (ТКН ) является показателем азота, широко используемым при анализе (сточных) воды, почвы, пищевых продуктов, кормов и органических веществ в целом. Как следует из названия, Метод Кьельдаля применяется. Доступны более чувствительные методы.[141][142]
Смотрите также
Примечания
- ^ Пролин является исключением из этой общей формулы. В нем отсутствует NH2 группа из-за циклизация боковой цепи и известен как иминовая кислота; он попадает в категорию аминокислот со специальной структурой.
- ^ Например, жвачные животные например, коровы получают ряд аминокислот через микробы в первые две камеры желудка.
Рекомендации
- ^ Нельсон Д.Л., Кокс М.М. (2005). Принципы биохимии (4-е изд.). Нью-Йорк: У. Х. Фриман. ISBN 0-7167-4339-6.
- ^ "аминокислота". Кембриджские словари онлайн. Издательство Кембриджского университета. 2015 г.. Получено 3 июля 2015.
- ^ Вагнер I, Муссо Х (ноябрь 1983 г.). «Новые природные аминокислоты». Angewandte Chemie International Edition на английском языке. 22 (11): 816–828. Дои:10.1002 / anie.198308161.

- ^ Латам М.С. (1997). «Глава 8. Состав тела, функции питания, обмена веществ и энергии». Питание человека в развивающихся странах. Серия продуктов питания и питания - № 29. Рим: Продовольственная и сельскохозяйственная организация Объединенных Наций.
- ^ Кларк, Джим (август 2007 г.). «Введение в аминокислоты». Chemguide. Получено 4 июля 2015.
- ^ Якубке Х, Севальд Н (2008). "Аминокислоты". Пептиды от А до Я: краткая энциклопедия. Германия: Wiley-VCH. п. 20. ISBN 9783527621170 - через Google Книги.
- ^ Pollegioni L, Servi S, ред. (2012). Неестественные аминокислоты: методы и протоколы. Методы молекулярной биологии. 794. Humana Press. п. v. Дои:10.1007/978-1-61779-331-8. ISBN 978-1-61779-331-8. OCLC 756512314. S2CID 3705304.
- ^ Хертвек С (октябрь 2011 г.). «Биосинтез и заряд пирролизина, 22-й генетически кодируемой аминокислоты». Angewandte Chemie International Edition. 50 (41): 9540–9541. Дои:10.1002 / anie.201103769. PMID 21796749.

- ^ "Глава 1: Белки - рабочие молекулы организма". Структуры жизни. Национальный институт общих медицинских наук. 27 октября 2011 г.. Получено 20 мая 2008.
- ^ Михал Г., Шомбург Д., ред. (2012). Биохимические пути: атлас биохимии и молекулярной биологии (2-е изд.). Оксфорд: Wiley-Blackwell. п. 5. ISBN 978-0-470-14684-2.
- ^ а б Тьонг Х (2008). Моделирование электростатического вклада в сворачивание и связывание белков (Кандидатская диссертация). Государственный университет Флориды. п. 1 сноска.
- ^ а б Стюарт Л., Бургин А.Б. (2005). Атта-Ур-Рахман, Springer BA, Caldwell GW (ред.). "Полный синтез генов: будущее генетического матрикса". Границы дизайна и открытия лекарств. Издательство Bentham Science. 1: 299. Дои:10.2174/1574088054583318. ISBN 978-1-60805-199-1. ISSN 1574-0889.
- ^ а б Эльзановский А., Остелл Дж. (7 апреля 2008 г.). "Генетические коды". Национальный центр биотехнологической информации (NCBI). Получено 10 марта 2010.
- ^ а б Се Дж., Шульц П.Г. (декабрь 2005 г.). «Добавление аминокислот в генетический репертуар». Современное мнение в области химической биологии. 9 (6): 548–554. Дои:10.1016 / j.cbpa.2005.10.011. PMID 16260173.
- ^ а б Ван К., Пэрриш А. Р., Ван Л. (март 2009 г.). «Расширение генетического кода для биологических исследований». Химия и биология. 16 (3): 323–336. Дои:10.1016 / j.chembiol.2009.03.001. ЧВК 2696486. PMID 19318213.
- ^ Саймон М (2005). Новые вычисления: акцент на биоинформатике. Нью-Йорк: AIP Press / Springer Science + Business Media. стр.105–106. ISBN 978-0-387-22046-8.
- ^ Петров О.А. (декабрь 2002 г.). «ГАМК и глутамат в мозге человека». Нейробиолог. 8 (6): 562–573. Дои:10.1177/1073858402238515. PMID 12467378. S2CID 84891972.
- ^ Викери HB, Шмидт CL (1931). «История открытия аминокислот». Chem. Rev. 9 (2): 169–318. Дои:10.1021 / cr60033a001.
- ^ Хансен С. (май 2015 г.). "Die Entdeckung der proteinogenen Aminosäuren von 1805 в Париже до 1935 года в Иллинойсе" (PDF) (на немецком). Берлин. Архивировано из оригинал (PDF) 1 декабря 2017 г.
- ^ Воклен LN, Робике PJ (1806). «Открытие нового принципа растения в Asparagus sativus». Annales de Chimie. 57: 88–93.
- ^ а б Анфинсен CB, Эдсалл Дж. Т., Ричардс FM (1972). Достижения в химии белков. Нью-Йорк: Academic Press. стр.99, 103. ISBN 978-0-12-034226-6.
- ^ Волластон WH (1810 г.). «О кистозном оксиде, новом виде мочевого камня». Философские труды Королевского общества. 100: 223–230. Дои:10.1098 / рстл.1810.0015. S2CID 110151163.
- ^ Бауман Э. (1884). «Убер-цистин и цистеин». Z Physiol Chem. 8 (4): 299–305. Архивировано из оригинал 14 марта 2011 г.. Получено 28 марта 2011.
- ^ Браконно HM (1820 г.). "Sur la conversion des matières animales en nouvelles elements par le moyen de l'acide sulfique". Annales de Chimie et de Physique. 2-я серия. 13: 113–125.
- ^ Саймони Р.Д., Хилл Р.Л., Воган М. (сентябрь 2002 г.). «Открытие аминокислоты треонина: работа Уильяма К. Роуза [классическая статья]». Журнал биологической химии. 277 (37): E25. PMID 12218068.
- ^ Маккой RH, Мейер CE, Роуз WC (1935). "Эксперименты по кормлению смесями высокоочищенных аминокислот. VIII. Выделение и идентификация новой незаменимой аминокислоты". Журнал биологической химии. 112: 283–302.
- ^ Ментен, П. Dictionnaire de chimie: Une Approche étymologique et Historique. Де Бёк, Брюссель. связь.
- ^ Харпер Д. "амино-". Интернет-словарь этимологии. Получено 19 июля 2010.
- ^ Паал С. (1894 г.). "Ueber die Einwirkung von Phenyl ‐ i ‐ cyanat auf organische Aminosäuren". Berichte der Deutschen Chemischen Gesellschaft. 27: 974–979. Дои:10.1002 / cber.189402701205. Архивировано из оригинал 25 июля 2020 г.
- ^ Fruton JS (1990). «Глава 5 - Эмиль Фишер и Франц Хофмайстер». Контрасты в научном стиле: исследовательские группы в области химических и биохимических наук. 191. Американское философское общество. С. 163–165. ISBN 978-0-87169-191-0.
- ^ «Альфа-аминокислота». Медицинский словарь Merriam-Webster.com. Merriam-Webster Inc.
- ^ Пролин в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- ^ Мэттс Р.Л. (2005). "Аминокислоты". Биохимия 5753: Принципы биохимии. Архивировано из оригинал 18 января 2008 г.. Получено 3 января 2015.
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "Иминокислоты ". Дои:10.1351 / goldbook.I02959
- ^ а б c d е ж Крейтон TH (1993). "Глава 1". Белки: строение и молекулярные свойства. Сан-Франциско: В. Х. Фриман. ISBN 978-0-7167-7030-5.
- ^ Писаревич К., Мора Д., Пфлюгер ФК, Филдс, Великобритания, Мари Ф. (май 2005 г.). «Полипептидные цепи, содержащие D-гамма-гидроксивалин». Журнал Американского химического общества. 127 (17): 6207–6215. Дои:10.1021 / ja050088m. PMID 15853325.
- ^ ван Хейенорт Дж (март 2001 г.). «Формирование гликановых цепей при синтезе бактериального пептидогликана». Гликобиология. 11 (3): 25R – 36R. Дои:10.1093 / гликоб / 11.3.25R. PMID 11320055. S2CID 46066256.
- ^ Волоскер Х., Думин Э., Балан Л, Фолтын В.Н. (июль 2008 г.). "D-Аминокислоты в головном мозге: D-серин в нейротрансмиссии и нейродегенерации ». Журнал FEBS. 275 (14): 3514–3526. Дои:10.1111 / j.1742-4658.2008.06515.x. PMID 18564180.
- ^ Мэтьюз Б.В. (июнь 2009 г.). «Рацемическая кристаллография - легкие кристаллы и легкие структуры: что не нравится?». Белковая наука. 18 (6): 1135–1138. Дои:10.1002 / pro.125. ЧВК 2774423. PMID 19472321.
- ^ Хатем С.М. (2006). «Газохроматографическое определение энантиомеров аминокислот в табаке и винах в бутылках». Университет Гиссена. Архивировано из оригинал 22 января 2009 г.. Получено 17 ноября 2008.
- ^ Митчелл Б. (2019). Клеточная и молекулярная биология. Электронные научные ресурсы. С. 294–29 5. ISBN 9781839474460.
- ^ «Номенклатура и символика аминокислот и пептидов». Совместная комиссия IUPAC-IUB по биохимической номенклатуре. 1983. Архивировано с оригинал 9 октября 2008 г.. Получено 17 ноября 2008.
- ^ Джодиди С.Л. (1 марта 1926 г.). «Формольное титрование некоторых аминокислот». Журнал Американского химического общества. 48 (3): 751–753. Дои:10.1021 / ja01414a033.
- ^ Либек С., изд. (1992). Биохимическая номенклатура и сопутствующие документы (2-е изд.). Портленд Пресс. С. 39–69. ISBN 978-1-85578-005-7.
- ^ Смит А.Д. (1997). Оксфордский словарь биохимии и молекулярной биологии. Оксфорд: Издательство Оксфордского университета. п. 535. ISBN 978-0-19-854768-6. OCLC 37616711.
- ^ Симмонс WJ, Мейзенберг G (2006). Принципы медицинской биохимии. Мосби Эльзевьер. п.19. ISBN 978-0-323-02942-1.
- ^ Феннема О.Р. (19 июня 1996 г.). Пищевая химия, 3-е изд.. CRC Press. С. 327–328. ISBN 978-0-8247-9691-4.
- ^ Роднина М.В., Берингер М., Винтермейер В. (январь 2007 г.). «Как рибосомы образуют пептидные связи». Тенденции в биохимических науках. 32 (1): 20–26. Дои:10.1016 / j.tibs.2006.11.007. PMID 17157507.
- ^ Дрисколл DM, Copeland PR (2003). «Механизм и регуляция синтеза селенопротеидов». Ежегодный обзор питания. 23 (1): 17–40. Дои:10.1146 / annurev.nutr.23.011702.073318. PMID 12524431.
- ^ Кшицкий Я.А. (декабрь 2005 г.). «Прямое генетическое кодирование пирролизина». Текущее мнение в микробиологии. 8 (6): 706–712. Дои:10.1016 / j.mib.2005.10.009. PMID 16256420.
- ^ Теобальд-Дитрих А., Гиже Р., Рудингер-Тирион Дж. (2005). «Доказательства существования в мРНК элемента шпильки, ответственного за рибосомозависимую вставку пирролизина в белки». Биохимия. 87 (9–10): 813–817. Дои:10.1016 / j.biochi.2005.03.006. PMID 16164991.
- ^ Трифонов Е.Н. (декабрь 2000 г.). «Согласованный временной порядок аминокислот и эволюция триплетного кода». Ген. 261 (1): 139–151. Дои:10.1016 / S0378-1119 (00) 00476-5.
- ^ Хиггс П.Г., Пудриц Р.Э. (июнь 2009 г.). «Термодинамическая основа синтеза пребиотических аминокислот и природа первого генетического кода». Астробиология. 9 (5): 483–90. Дои:10.1089 / аст.2008.0280. PMID 19566427.
- ^ Chaliotis A, Vlastaridis P, Mossialos D, Ibba M, Becker HD, Stathopoulos C, Amoutzias GD (февраль 2017 г.). «Сложная эволюционная история аминоацил-тРНК синтетаз». Исследования нуклеиновых кислот. 45 (3): 1059–1068. Дои:10.1093 / нар / gkw1182. ЧВК 5388404. PMID 28180287.
- ^ а б c Нтунтуми С., Властаридис П., Моссиалос Д., Статопулос С., Илиопулос I, Промпонас В. и др. (Ноябрь 2019 г.). «Области низкой сложности в белках прокариот выполняют важные функциональные роли и являются высококонсервативными». Исследования нуклеиновых кислот. 47 (19): 9998–10009. Дои:10.1093 / нар / gkz730. ЧВК 6821194. PMID 31504783.
- ^ Вермеер С (март 1990 г.). «Гамма-карбоксиглутамат-содержащие белки и витамин К-зависимая карбоксилаза». Биохимический журнал. 266 (3): 625–636. Дои:10.1042 / bj2660625. ЧВК 1131186. PMID 2183788.
- ^ Бхаттачарджи А., Бансал М. (март 2005 г.). «Структура коллагена: тройная спираль Мадраса и текущий сценарий». IUBMB Life. 57 (3): 161–172. Дои:10.1080/15216540500090710. PMID 16036578.
- ^ Park MH (февраль 2006 г.). «Посттрансляционный синтез аминокислоты, производной полиамина, гипузина, в эукариотическом факторе инициации трансляции 5A (eIF5A)». Журнал биохимии. 139 (2): 161–169. Дои:10.1093 / jb / mvj034. ЧВК 2494880. PMID 16452303.
- ^ Бленис Дж., Реш, доктор медицины (декабрь 1993 г.). «Субклеточная локализация, определяемая ацилированием и фосфорилированием белков». Текущее мнение в области клеточной биологии. 5 (6): 984–989. Дои:10.1016 / 0955-0674 (93) 90081-Z. PMID 8129952.
- ^ Курис Э., Николис I, Мойнар С., Осовска С., Зеррук Н., Беназет С., Синобер Л. (ноябрь 2005 г.). «Почти все о цитруллине у млекопитающих». Аминокислоты. 29 (3): 177–205. Дои:10.1007 / s00726-005-0235-4. PMID 16082501. S2CID 23877884.
- ^ Коксон К.М., Чакауйя Э., Оттенхоф Х.Х., Уитни Х.М., Бланделл Т.Л., Абелл С., Смит АГ (август 2005 г.). «Биосинтез пантотената у высших растений». Сделки Биохимического Общества. 33 (Пт 4): 743–746. Дои:10.1042 / BST0330743. PMID 16042590.
- ^ Кетчем Р.Р., Ху В., Кросс Т.А. (сентябрь 1993 г.). «Конформация грамицидина А с высоким разрешением в липидном бислое с помощью твердотельного ЯМР». Наука. 261 (5127): 1457–1460. Bibcode:1993Научный ... 261.1457K. Дои:10.1126 / science.7690158. PMID 7690158.
- ^ Хури Г.А., Балибан РК, Floudas CA (Сентябрь 2011 г.). «Статистика посттрансляционных модификаций в масштабе протеома: частотный анализ и курирование базы данных swiss-prot». Научные отчеты. 1 (90): 90. Bibcode:2011НатСР ... 1E..90K. Дои:10.1038 / srep00090. ЧВК 3201773. PMID 22034591.
- ^ Крюков Г.В., Кастеллано С., Новоселов С.В., Лобанов А.В., Зехтаб О, Гиго Р., Гладышев В.Н. (май 2003 г.). «Характеристика селенопротеомов млекопитающих». Наука. 300 (5624): 1439–1443. Bibcode:2003Наука ... 300,1439K. Дои:10.1126 / science.1083516. PMID 12775843.
- ^ Громер С., Уриг С., Беккер К. (январь 2004 г.). «Тиоредоксиновая система - от науки к клинике». Обзоры медицинских исследований. 24 (1): 40–89. Дои:10.1002 / med.10051. PMID 14595672.
- ^ Саками В., Харрингтон Х (1963). «Аминокислотный обмен». Ежегодный обзор биохимии. 32 (1): 355–398. Дои:10.1146 / annurev.bi.32.070163.002035. PMID 14144484.
- ^ Brosnan JT (апрель 2000 г.). «Глутамат на стыке обмена аминокислот и углеводов». Журнал питания. 130 (Приложение 4S): 988S – 990S. Дои:10.1093 / jn / 130.4.988S. PMID 10736367.
- ^ Молодой В.Р., Аджами А.М. (сентябрь 2001 г.). «Глютамин: император или его одежда?». Журнал питания. 131 (9 дополнений): 2449S – 2459S, 2486S – 2487S. Дои:10.1093 / jn / 131.9.2449S. PMID 11533293.
- ^ Молодой В.Р. (август 1994 г.). «Потребности взрослых в аминокислотах: аргументы в пользу серьезного пересмотра текущих рекомендаций». Журнал питания. 124 (8 Прил.): 1517S – 1523S. Дои:10.1093 / jn / 124.suppl_8.1517S. PMID 8064412.
- ^ Fürst P, Stehle P (июнь 2004 г.). «Какие основные элементы необходимы для определения потребности человека в аминокислотах?». Журнал питания. 134 (6 доп.): 1558S – 1565S. Дои:10.1093 / jn / 134.6.1558S. PMID 15173430.
- ^ Ридс П.Дж. (июль 2000 г.). «Незаменимые и незаменимые аминокислоты для человека». Журнал питания. 130 (7): 1835–1840 гг. Дои:10.1093 / jn / 130.7.1835S. PMID 10867060.
- ^ Имура К., Окада А. (январь 1998 г.). «Аминокислотный обмен в педиатрических больных». Питание. 14 (1): 143–148. Дои:10.1016 / S0899-9007 (97) 00230-X. PMID 9437700.
- ^ Лоуренсу Р., Камило М.Э. (2002). «Таурин: условно незаменимая аминокислота для человека? Обзор здоровья и болезней». Nutricion Hospitalaria. 17 (6): 262–270. PMID 12514918.
- ^ Holtcamp W (март 2012 г.). «Возникающая наука о BMAA: способствуют ли цианобактерии нейродегенеративным заболеваниям?». Перспективы гигиены окружающей среды. 120 (3): A110 – A116. Дои:10.1289 / ehp.120-a110. ЧВК 3295368. PMID 22382274.
- ^ Кокс PA, Дэвис Д.А., Маш, округ Колумбия, Metcalf JS, Banack SA (январь 2016 г.). «Воздействие токсина окружающей среды на пищу вызывает нейрофибриллярные сплетения и отложения амилоида в головном мозге». Труды: Биологические науки.. 283 (1823): 20152397. Дои:10.1098 / rspb.2015.2397. ЧВК 4795023. PMID 26791617.
- ^ а б Брук М.С., Уилкинсон Д.Дж., Филлипс Б.Э., Перес-Шиндлер Дж., Филп А., Смит К., Атертон П.Дж. (январь 2016 г.). «Гомеостаз и пластичность скелетных мышц в молодости и старении: влияние питания и упражнений». Acta Physiologica. 216 (1): 15–41. Дои:10.1111 / apha.12532. ЧВК 4843955. PMID 26010896.
- ^ Lipton JO, Sahin M (октябрь 2014 г.). «Неврология mTOR». Нейрон. 84 (2): 275–291. Дои:10.1016 / j.neuron.2014.09.034. ЧВК 4223653. PMID 25374355.
Рисунок 2: Путь передачи сигналов mTOR - ^ а б Филлипс С.М. (май 2014 г.). «Краткий обзор важнейших процессов мышечной гипертрофии, вызванной физической нагрузкой». Спортивная медицина. 44 (Приложение 1): S71 – S77. Дои:10.1007 / s40279-014-0152-3. ЧВК 4008813. PMID 24791918.
- ^ Бродли К.Дж. (март 2010 г.). «Сосудистые эффекты следовых аминов и амфетаминов». Фармакология и терапия. 125 (3): 363–375. Дои:10.1016 / j.pharmthera.2009.11.005. PMID 19948186.
- ^ Lindemann L, Hoener MC (май 2005 г.). «Возрождение следовых аминов, вдохновленное новым семейством GPCR». Тенденции в фармакологических науках. 26 (5): 274–281. Дои:10.1016 / j.tips.2005.03.007. PMID 15860375.
- ^ Ван Х, Ли Дж, Донг Дж, Юэ Дж (февраль 2014 г.). «Эндогенные субстраты CYP2D мозга». Европейский журнал фармакологии. 724: 211–218. Дои:10.1016 / j.ejphar.2013.12.025. PMID 24374199.
- ^ Савельева К.В., Чжао С., Погорелов В.М., Раджан И., Ян Ц., Куллинан Э., Ланторн Т.Х. (2008). Бартоломуччи А. (ред.). «Генетическое нарушение обоих генов триптофангидроксилазы резко снижает уровень серотонина и влияет на поведение моделей, чувствительных к антидепрессантам». PLOS ONE. 3 (10): e3301. Bibcode:2008PLoSO ... 3.3301S. Дои:10.1371 / journal.pone.0003301. ЧВК 2565062. PMID 18923670.
- ^ Шемин Д., Риттенберг Д. (декабрь 1946 г.). «Биологическое использование глицина для синтеза протопорфирина гемоглобина». Журнал биологической химии. 166 (2): 621–625. PMID 20276176.
- ^ Tejero J, Biswas A, Wang ZQ, Page RC, Haque MM, Hemann C, Zweier JL, Misra S, Stuehr DJ (ноябрь 2008 г.). «Стабилизация и характеристика промежуточного соединения гемоксигруппы в индуцибельной синтазе оксида азота». Журнал биологической химии. 283 (48): 33498–33507. Дои:10.1074 / jbc.M806122200. ЧВК 2586280. PMID 18815130.
- ^ Родригес-Касо С., Монтаньес Р., Касканте М., Санчес-Хименес Ф., Медина Массачусетс (август 2006 г.). «Математическое моделирование метаболизма полиаминов у млекопитающих». Журнал биологической химии. 281 (31): 21799–21812. Дои:10.1074 / jbc.M602756200. PMID 16709566.
- ^ а б Страйер Л., Берг Дж. М., Тимочко Дж. Л. (2002). Биохимия (5-е изд.). Нью-Йорк: W.H. Фримен. стр.693–698. ISBN 978-0-7167-4684-3.
- ^ Хилин JW (1969). «Токсичные пептиды и аминокислоты в пищевых продуктах и кормах». Журнал сельскохозяйственной и пищевой химии. 17 (3): 492–496. Дои:10.1021 / jf60163a003.
- ^ Тернер Б. Л., Харборн Дж. Б. (1967). «Распространение канаванина в царстве растений». Фитохимия. 6 (6): 863–866. Дои:10.1016 / S0031-9422 (00) 86033-1.
- ^ Эканаяке С., Ског К., Асп Н.Г. (май 2007 г.). «Содержание канаванина в стручковой фасоли (Canavalia gladiata): анализ и эффект обработки». Пищевая и химическая токсикология. 45 (5): 797–803. Дои:10.1016 / j.fct.2006.10.030. PMID 17187914.
- ^ Розенталь Г.А. (2001). «L-канаванин: аллелохимический инсектицид высших растений». Аминокислоты. 21 (3): 319–330. Дои:10.1007 / s007260170017. PMID 11764412. S2CID 3144019.
- ^ Hammond AC (май 1995 г.). «Токсикоз Leucaena и борьба с ним у жвачных животных». Журнал зоотехники. 73 (5): 1487–1492. Дои:10,2527 / 1995,7351487x. PMID 7665380.[постоянная мертвая ссылка ]
- ^ а б Leuchtenberger W, Huthmacher K, Drauz K (ноябрь 2005 г.). «Биотехнологическое производство аминокислот и производных: современное состояние и перспективы». Прикладная микробиология и биотехнология. 69 (1): 1–8. Дои:10.1007 / s00253-005-0155-y. PMID 16195792. S2CID 24161808.
- ^ Ашмид HD (1993). Роль хелатов аминокислот в питании животных. Вествуд: Публикации Нойеса.
- ^ Гараттини S (апрель 2000 г.). «Глутаминовая кислота, двадцать лет спустя». Журнал питания. 130 (Приложение 4S): 901S – 909S. Дои:10.1093 / jn / 130.4.901S. PMID 10736350.
- ^ Стегинк Л.Д. (июль 1987 г.). «История аспартама: модель для клинических испытаний пищевой добавки». Американский журнал клинического питания. 46 (1 приложение): 204–215. Дои:10.1093 / ajcn / 46.1.204. PMID 3300262.
- ^ Albion Laboratories, Inc. "Веб-сайт Albion Ferrochel". Получено 12 июля 2011.
- ^ Эшмид HD (1986). Внекорневая подкормка растений аминокислотными хелатами. Парк-Ридж: Публикации Нойес.
- ^ Тернер EH, Лофтис JM, Blackwell AD (март 2006 г.). "Серотонин по меню: добавление предшественника серотонина 5-гидрокситриптофана". Фармакология и терапия. 109 (3): 325–338. Дои:10.1016 / j.pharmthera.2005.06.004. PMID 16023217.
- ^ Костшева Р.М., Новак П., Костшева Ю.П., Костшева Р.А., Брус Р. (март 2005 г.). «Особенности L-ДОПА лечение болезни Паркинсона ». Аминокислоты. 28 (2): 157–164. Дои:10.1007 / s00726-005-0162-4. PMID 15750845. S2CID 33603501.
- ^ Heby O, Persson L, Rentala M (август 2007 г.). «Ориентация на ферменты биосинтеза полиамина: многообещающий подход к терапии африканской сонной болезни, болезни Шагаса и лейшманиоза». Аминокислоты. 33 (2): 359–366. Дои:10.1007 / s00726-007-0537-9. PMID 17610127. S2CID 26273053.
- ^ Крус-Вера Л. Р., Магос-Кастро М. А., Замора-Ромо Э., Гуарнерос Г. (2004). «Остановка рибосом и падение пептидил-тРНК во время задержки трансляции в кодонах AGA». Исследования нуклеиновых кислот. 32 (15): 4462–4468. Дои:10.1093 / нар / гх784. ЧВК 516057. PMID 15317870.
- ^ Энди С. (октябрь 2012 г.). «Слишком опасные для природы молекулы убивают раковые клетки». Новый ученый.
- ^ «Смертельные метки ДНК могут уберечь невинных людей от тюрьмы». Новый ученый. 2 мая 2013 г.
- ^ Ханессиан С (1993). «Размышления о тотальном синтезе натуральных продуктов: искусство, ремесло, логика и хиронский подход». Чистая и прикладная химия. 65 (6): 1189–1204. Дои:10.1351 / pac199365061189.
- ^ Blaser HU (1992). «Хиральный пул как источник энантиоселективных катализаторов и вспомогательных веществ». Химические обзоры. 92 (5): 935–952. Дои:10.1021 / cr00013a009.
- ^ Санда Ф, Эндо Т (1999). «Синтезы и функции полимеров на основе аминокислот». Макромолекулярная химия и физика. 200 (12): 2651–2661. Дои:10.1002 / (SICI) 1521-3935 (19991201) 200: 12 <2651 :: AID-MACP2651> 3.0.CO; 2-P.
- ^ Гросс Р.А., Калра Б. (август 2002 г.). «Биоразлагаемые полимеры для окружающей среды». Наука. 297 (5582): 803–807. Bibcode:2002Наука ... 297..803Г. Дои:10.1126 / science.297.5582.803. PMID 12161646.
- ^ Низкий KC, Уиллер AP, Koskan LP (1996). Коммерческая поли (аспарагиновая кислота) и ее использование. Успехи в серии химии. 248. Вашингтон, округ Колумбия.: Американское химическое общество.
- ^ Томбре С.М., Сарваде Б.Д. (2005). «Синтез и биоразлагаемость полиаспарагиновой кислоты: критический обзор». Журнал макромолекулярной науки, часть A. 42 (9): 1299–1315. Дои:10.1080/10601320500189604.
- ^ Бурк С.Л., Кон Дж. (Апрель 2003 г.). "Полимеры на основе аминокислоты L-тирозин: поликарбонаты, полиарилаты и сополимеры с поли (этиленгликолем) ». Расширенные обзоры доставки лекарств. 55 (4): 447–466. Дои:10.1016 / S0169-409X (03) 00038-3. PMID 12706045.
- ^ Драуз К., Грейсон И., Климанн А., Криммер Х., Лейхтенбергер В., Векбекер С. (2006). Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a02_057.pub2.
- ^ Джонс Р.К., Бьюкенен ВВ, Груиссем В. (2000). Биохимия и молекулярная биология растений. Роквилл, Мэриленд: Американское общество физиологов растений. стр.371–372. ISBN 978-0-943088-39-6.
- ^ Броснан Дж. Т., Броснан М. Е. (июнь 2006 г.). «Серосодержащие аминокислоты: обзор». Журнал питания. 136 (6 дополнений): 1636S – 1640S. Дои:10.1093 / jn / 136.6.1636S. PMID 16702333.
- ^ Кивирикко К.И., Пихлаяниеми Т. (1998). «Гидроксилазы коллагена и субъединица протеиндисульфид-изомеразы пролил-4-гидроксилаз». Достижения в энзимологии и смежных областях молекулярной биологии. Достижения в энзимологии и смежных областях молекулярной биологии. 72. С. 325–398. Дои:10.1002 / 9780470123188.ch9. ISBN 9780470123188. PMID 9559057.
- ^ Уитмор Л., Уоллес Б.А. (май 2004 г.). «Анализ состава последовательности пептаибола: значение для синтеза in vivo и формирования каналов». Европейский биофизический журнал. 33 (3): 233–237. Дои:10.1007 / s00249-003-0348-1. PMID 14534753. S2CID 24638475.
- ^ Александр Л., Грирсон Д. (октябрь 2002 г.). «Биосинтез и действие этилена в томате: модель созревания плодов в климактерическом периоде». Журнал экспериментальной ботаники. 53 (377): 2039–2055. Дои:10.1093 / jxb / erf072. PMID 12324528.
- ^ Элмор Д. Т., Барретт Г. К. (1998). Аминокислоты и пептиды. Кембридж, Великобритания: Издательство Кембриджского университета. стр.48 –60. ISBN 978-0-521-46827-5.
- ^ Гаттеридж А., Торнтон Дж. М. (ноябрь 2005 г.). «Понимание каталитического инструментария природы». Тенденции в биохимических науках. 30 (11): 622–629. Дои:10.1016 / j.tibs.2005.09.006. PMID 16214343.
- ^ Ибба М., Сёлль Д. (май 2001 г.). «Возрождение синтеза аминоацил-тРНК». Отчеты EMBO. 2 (5): 382–387. Дои:10.1093 / embo-reports / kve095. ЧВК 1083889. PMID 11375928.
- ^ Lengyel P, Söll D (июнь 1969). «Механизм биосинтеза белка». Бактериологические обзоры. 33 (2): 264–301. Дои:10.1128 / MMBR.33.2.264-301.1969. ЧВК 378322. PMID 4896351.
- ^ Wu G, Fang YZ, Yang S, Lupton JR, Turner ND (март 2004 г.). «Метаболизм глутатиона и его значение для здоровья». Журнал питания. 134 (3): 489–492. Дои:10.1093 / jn / 134.3.489. PMID 14988435.
- ^ Мейстер А. (ноябрь 1988 г.). «Метаболизм глутатиона и его селективная модификация». Журнал биологической химии. 263 (33): 17205–17208. PMID 3053703.
- ^ Карпино Л.А. (1992). «1-Гидрокси-7-азабензотриазол. Эффективная добавка, связывающая пептиды». Журнал Американского химического общества. 115 (10): 4397–4398. Дои:10.1021 / ja00063a082.
- ^ Мараско Д., Перретта Г., Сабателла М., Руво М. (октябрь 2008 г.). «Прошлые и будущие перспективы синтетических пептидных библиотек». Современная наука о белках и пептидах. 9 (5): 447–467. Дои:10.2174/138920308785915209. PMID 18855697.
- ^ Конара С., Гагнона К., Клирфилд А., Томпсон С., Хартл Дж., Эриксон С., Нельсон С. (2010). «Структурное определение и характеристика бис-глицинатов меди и цинка с помощью рентгеновской кристаллографии и масс-спектрометрии». Журнал координационной химии. 63 (19): 3335–3347. Дои:10.1080/00958972.2010.514336.
- ^ Стипанук М.Х. (2006). Биохимические, физиологические и молекулярные аспекты питания человека (2-е изд.). Saunders Elsevier.
- ^ Джхайм Р.Д., Дхаван Р., Арндцен Б.А. (сентябрь 2001 г.). «Использование монооксида углерода и иминов в качестве синтонов, производных пептидов: легкий катализируемый палладием синтез имидазолинов, производных от α-аминокислот». Angewandte Chemie. 40 (17): 3228–3230. Дои:10.1002 / (SICI) 1521-3773 (19980703) 37:12 <1634 :: AID-ANIE1634> 3.0.CO; 2-C. PMID 29712039.
- ^ Урри Д.В. (2004). «Изменение свободной энергии Гиббса для гидрофобной ассоциации: вывод и оценка посредством обратных температурных переходов». Письма по химической физике. 399 (1–3): 177–183. Bibcode:2004CPL ... 399..177U. Дои:10.1016 / S0009-2614 (04) 01565-9.
- ^ Маркотт Э.М., Пеллегрини М., Йейтс Т.О., Айзенберг Д. (октябрь 1999 г.). «Перепись белковых повторов». Журнал молекулярной биологии. 293 (1): 151–60. Дои:10.1006 / jmbi.1999.3136. PMID 10512723.
- ^ Хэрти В., Голдинг, Великобритания (октябрь 2010 г.). Бонен Л. (ред.). «Последовательности низкой сложности и одиночные аминокислотные повторы: не просто« мусорные »пептидные последовательности». Геном. 53 (10): 753–62. Дои:10.1139 / G10-063. PMID 20962881.
- ^ Маги Т., Seabra MC (апрель 2005 г.). «Жировое ацилирование и пренилирование белков: что нового в жире». Текущее мнение в области клеточной биологии. 17 (2): 190–196. Дои:10.1016 / j.ceb.2005.02.003. PMID 15780596.
- ^ Пилобелло К.Т., Махал Л.К. (июнь 2007 г.). «Расшифровка гликокода: сложность и аналитическая задача гликомики». Современное мнение в области химической биологии. 11 (3): 300–305. Дои:10.1016 / j.cbpa.2007.05.002. PMID 17500024.
- ^ Смотрс Ю.Е., Линдер М.Е. (2004). «Пальмитоилирование внутриклеточных сигнальных белков: регуляция и функция». Ежегодный обзор биохимии. 73 (1): 559–587. Дои:10.1146 / annurev.biochem.73.011303.073954. PMID 15189153.
- ^ Кайт Дж., Дулитл Р.Ф. (май 1982 г.). «Простой метод отображения гидропатического характера протеина». Журнал молекулярной биологии. 157 (1): 105–132. CiteSeerX 10.1.1.458.454. Дои:10.1016/0022-2836(82)90515-0. PMID 7108955.
- ^ Фрайфельдер Д. (1983). Физическая биохимия (2-е изд.). В. Х. Фриман и компания. ISBN 978-0-7167-1315-9.[страница нужна ]
- ^ Козловский Л.П. (январь 2017 г.). «Протеом-пя: база данных изоэлектрических точек протеома ". Исследования нуклеиновых кислот. 45 (D1): D1112 – D1116. Дои:10.1093 / нар / gkw978. ЧВК 5210655. PMID 27789699.
- ^ а б Хаусман Р. Э., Купер Г. М. (2004). Клетка: молекулярный подход. Вашингтон, округ Колумбия: ASM Press. п. 51. ISBN 978-0-87893-214-6.
- ^ Aasland R, Abrams C, Ampe C, Ball LJ, Bedford MT, Cesareni G, Gimona M, Hurley JH, Jarchau T., Lehto VP, Lemmon MA, Linding R, Mayer BJ, Nagai M, Sudol M, Walter U, Winder SJ (Февраль 2002 г.). «Нормализация номенклатуры пептидных мотивов как лигандов модульных белковых доменов». Письма FEBS. 513 (1): 141–144. Дои:10.1111 / j.1432-1033.1968.tb00350.x. PMID 11911894.
- ^ Комиссия IUPAC – IUB по биохимической номенклатуре (1972 г.). «Однобуквенное обозначение аминокислотных последовательностей». Чистая и прикладная химия. 31 (4): 641–645. Дои:10.1351 / pac197231040639. PMID 5080161.
- ^ Сучанек М., Радзиковска А., Тиле С. (апрель 2005 г.). «Фото-лейцин и фото-метионин позволяют идентифицировать белок-белковые взаимодействия в живых клетках». Методы природы. 2 (4): 261–267. Дои:10.1038 / nmeth752. PMID 15782218.
- ^ Муньос-Уэрта РФ, Гевара-Гонсалес Р.Г., Контрерас-Медина Л.М., Торрес-Пачеко I, Прадо-Оливарес Дж., Окампо-Веласкес Р.В. (август 2013 г.). «Обзор методов определения статуса азота в растениях: преимущества, недостатки и последние достижения». Датчики. Базель, Швейцария. 13 (8): 10823–43. Дои:10,3390 / с130810823. ЧВК 3812630. PMID 23959242.
- ^ Мартин П.Д., Малли Д.Ф., Мэннинг Г., Фуллер Л. (2002). «Определение содержания органического углерода и азота почвы на уровне поля с помощью спектроскопии в ближней инфракрасной области». Канадский журнал почвоведения: 413–422. Дои:10.4141 / S01-054.
дальнейшее чтение
- Тимочко Ю.Л. (2012). «Состав и структура белков». Биохимия. Нью-Йорк: У. Х. Фриман и компания. С. 28–31. ISBN 9781429229364.
- Дулиттл РФ (1989). «Избыточность в белковых последовательностях». В Fasman GD (ред.). Прогнозирование структуры белка и принципы конформации белка. Нью-Йорк: Пленум Пресс. С. 599–623. ISBN 978-0-306-43131-9. LCCN 89008555.
- Нельсон Д.Л., Кокс М.М. (2000). Принципы биохимии Ленингера (3-е изд.). Стоящие издатели. ISBN 978-1-57259-153-0. LCCN 99049137.
- Meierhenrich U (2008). Аминокислоты и асимметрия жизни (PDF). Берлин: Springer Verlag. ISBN 978-3-540-76885-2. LCCN 2008930865. Архивировано 12 января 2012 года.CS1 maint: BOT: статус исходного URL-адреса неизвестен (связь)
внешняя ссылка
 СМИ, связанные с Аминокислота в Wikimedia Commons
СМИ, связанные с Аминокислота в Wikimedia Commons