O-GlcNAc - O-GlcNAc

О-GlcNAc (Короче для О-связанный GlcNAc или же О-связанный β-N-ацетилглюкозамин) является обратимым ферментативный посттрансляционная модификация что находится на серин и треонин остатки нуклеоцитоплазматических белки. Модификация отличается β-гликозидная связь между гидроксил группа сериновых или треониновых боковых цепей и N-ацетилглюкозамин (GlcNAc). О-GlcNAc отличается от других форм белка гликозилирование: (i) О-GlcNAc не удлиняется и не модифицируется для образования более сложных гликан конструкции, (ii) О-GlcNAc обнаруживается почти исключительно на ядерных и цитоплазматических белках, а не на мембранные белки и секреторные белки, и (iii) О-GlcNAc - это высокодинамичная модификация, которая обновляется быстрее, чем белки, которые она модифицирует. О-GlcNAc сохраняется в многоклеточные животные.[1]

Из-за динамического характера О-GlcNAc и его присутствие на остатках серина и треонина, О-GlcNAcylation похоже на фосфорилирование белков в некоторых отношениях. Пока их около 500 киназы и 150 фосфатазы которые регулируют фосфорилирование белков у человека, есть только 2 фермента, которые регулируют цикл О-GlcNAc: О-GlcNAc трансфераза (OGT) и О-GlcNAcase (OGA) катализируют добавление и удаление О-GlcNAc соответственно.[2] OGT использует UDP-GlcNAc как сахар-донор для сахарного перевода.[3]
Впервые описанная в 1984 году, эта посттрансляционная модификация с тех пор была идентифицирована на более чем 5000 белков.[4][5] Многочисленные функциональные роли для ОСообщалось о -GlcNAцилирования, включая перекрестное взаимодействие с фосфорилированием серина / треонина, регулирующим белок-белковые взаимодействия, изменение структура белка или ферментативная активность, изменяющая белок субклеточная локализация, и модулирование стабильности белка и деградация.[1] Многочисленные компоненты клетки транскрипция оборудование было идентифицировано как модифицированное О-GlcNAc, и многие исследования сообщили о связи между О-GlcNAc, транскрипция и эпигенетика.[6][7] На многие другие клеточные процессы влияют О-GlcNAc, например апоптоз, то клеточный цикл, и стрессовые реакции.[8] Поскольку UDP-GlcNAc является конечным продуктом пути биосинтеза гексозамина, который объединяет аминокислота, углевод, жирная кислота, и нуклеотид метаболизм, было высказано предположение, что О-GlcNAc действует как "датчик питательных веществ "и реагирует на метаболический статус клетки.[9] Нарушение регуляции О-GlcNAc участвует во многих патологиях, включая Болезнь Альцгеймера, рак, сахарный диабет, и нейродегенеративные расстройства.[10]
Открытие

В 1984 году лаборатория Харта исследовала концевые остатки GlcNAc на поверхности тимоциты и лимфоциты. Β-1,4-галактозилтрансфераза коровьего молока, который реагирует с концевыми остатками GlcNAc, был использован для проведения радиоактивной метки UDP- [3H] галактоза. β-элиминация остатков серина и треонина продемонстрировала, что большая часть [3H] галактоза была присоединена к белкам О-гликозидно; хроматография показала, что основным продуктом β-элиминирования был Galβ1-4GlcNAcitol. Нечувствительность к пептид N-гликозидаза лечение предоставило дополнительные доказательства для О-связанный GlcNAc. Проникновение клеток детергентом до радиоактивной метки значительно увеличивало количество [3H] галактоза включалась в Galβ1-4GlcNAcitol, что привело авторов к выводу, что большая часть О-связанные моносахаридные остатки GlcNAc были внутриклеточными.[11]
Механизм

О-GlcNAc - это обычно динамическая модификация, которая может включать и выключать различные белки. Считается, что некоторые остатки конститутивно модифицированы О-GlcNAc.[12][13] В О-Модификация GlcNAc устанавливается OGT в последовательный би-би механизм где сахар-донор, UDP-GlcNAc, сначала связывается с OGT, а затем с белком-субстратом.[14] В О-GlcNAc модификация удаляется OGA в механизме гидролиза с участием анхимерная помощь (катализ с помощью субстрата) с получением немодифицированного белка и GlcNAc.[15] Пока кристаллические структуры были зарегистрированы как для OGT[14] и ОГА,[16][17] точные механизмы, с помощью которых OGT и OGA распознают субстраты, полностью не выяснены. В отличие от N-связанное гликозилирование, для которых гликозилирование происходит в специфическом консенсусная последовательность (Asn-X-Ser / Thr, где X - любая аминокислота, кроме Pro), окончательная консенсусная последовательность не была идентифицирована для О-GlcNAc ,. Следовательно, прогнозирование сайтов О-Модификация GlcNAc является сложной задачей, и для определения сайтов модификации обычно требуется масс-спектрометрии методы. Что касается OGT, исследования показали, что распознавание субстрата регулируется рядом факторов, включая аспартат[18] и аспарагин[19] лестничные мотивы в просвете сверхспирального TPR домен, остатки активного сайта,[20] и адаптерные белки.[21] Поскольку кристаллические структуры показали, что OGT требует, чтобы его подложка находилась в расширенной конформации, было высказано предположение, что OGT отдает предпочтение гибким подложкам.[20] В in vitro В кинетических экспериментах по измерению активности OGT и OGA на панели белковых субстратов было показано, что кинетические параметры для OGT варьируются между различными белками, в то время как кинетические параметры для OGA были относительно постоянными для разных белков. Этот результат предполагает, что OGT является «старшим партнером» в регулировании О-GlcNAc и OGA в первую очередь распознают субстраты через присутствие О-GlcNAc, а не идентичность модифицированного белка.[12]

Обнаружение и характеристика
Существует несколько методов обнаружения присутствия О-GlcNAc и характеризует конкретные модифицированные остатки.
Лектины
Агглютинин зародышей пшеницы, растение лектин, способен распознавать концевые остатки GlcNAc и поэтому часто используется для обнаружения О-GlcNAc. Этот лектин применялся в лектиновая аффинная хроматография для обогащения и обнаружения О-GlcNAc.[22]
Антитела
Сковорода-О-GlcNAc антитела которые признают О-GlcNAc модификации обычно используются независимо от идентичности модифицированного белка. К ним относятся RL2,[23] ан IgG антитело против О-GlcNAцилированный белки комплекса ядерных пор, и CTD110.6,[24] ан IgM антитело против иммуногенного пептида с помощью одного серина О-GlcNAc модификация. Другой ОСообщалось, что -GlcNAc-специфические антитела имеют некоторую зависимость от идентичности модифицированного белка.[25]
Метаболическая маркировка
Многие метаболические химические репортеры были разработаны для идентификации О-GlcNAc. Метаболические химические репортеры, как правило, представляют собой аналоги сахаров, которые несут дополнительную химическую часть, обеспечивающую дополнительную реактивность. Например, перацетилированный GlcNAc (Ac4GlcNAz) является проницаемым для клеток азидо сахар, деэтерифицированный внутриклеточно эстеразы в GlcNAz и превращается в UDP-GlcNAz в пути спасения гексозамина. UDP-GlcNAz может использоваться OGT в качестве донора сахара для получения О-GlcNAz модификация.[26] Затем присутствие азидосахара можно визуализировать с помощью алкин -содержащий биоортогональный химический зонды в реакция азид-алкинового циклоприсоединения. Эти датчики могут включать легко идентифицируемые теги, такие как FLAG пептид, биотин, и молекулы красителя.[26][27] Массовые теги на основе полиэтиленгликоль (ПЭГ) также использовались для измерения О-GlcNAc стехиометрия. Конъюгация молекул ПЭГ 5 кДа приводит к сдвигу массы модифицированных белков - в большей степени. О-GlcNAцилированные белки будут иметь несколько молекул PEG и, таким образом, более медленно мигрировать в гель-электрофорез.[28] Сообщалось о других метаболических химических репортерах, несущих азиды или алкины (обычно в положениях 2 или 6).[29] Вместо аналогов GlcNAc можно использовать аналоги GalNAc, а также UDP-GalNAc находится в равновесии с UDP-GlcNAc в клетках из-за действия UDP-галактоза-4'-эпимераза (GALE). Лечение Ас4Было обнаружено, что GalNAz приводит к усиленной маркировке О-GlcNAc относительно Ac4GlcNAz, возможно, из-за узкого места в UDP-GlcNAc пирофосфорилаза процессинг GlcNAz-1-P в UDP-GlcNAz.[30] Ac3GlcN-β-Ala-NBD-α-1-P (Ac-SATE)2, метаболический химический репортер, который внутриклеточно обрабатывается до меченного флуорофором аналога UDP-GlcNAc, как было показано, обеспечивает одностадийное флуоресцентное мечение О-GlcNAc в живых клетках.[31]
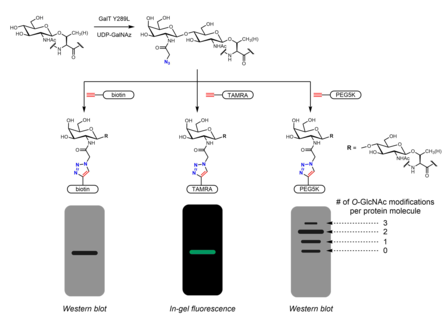
Метаболическая маркировка также может использоваться для идентификации партнеров по связыванию О-GlcNAцилированные белки. В N-ацетильная группа может быть удлиненной, чтобы включать диазирин часть. Обработка клеток перацетилированным фосфатно-защищенным Ас3GlcNDAz-1-P (Ac-SATE)2 приводит к модификации белков с О-GlcNDAz. УФ-облучение затем индуцирует фото сшивание между белками, несущими О-GlcNDaz модификации и взаимодействующие белки.[32]
Некоторые проблемы были выявлены с различными метаболическими химическими репортерами, например, их использование может ингибировать путь биосинтеза гексозамина,[29] они могут не распознаваться OGA и поэтому не могут захватывать О-GlcNAc на велосипеде,[33] или они могут быть включены в модификации гликозилирования помимо О-GlcNAc в секретируемых белках.[34] Метаболические химические репортеры с химическими ручками на N-ацетильное положение может также метить ацетилированные белки поскольку ацетильная группа может быть гидролизована до ацетатных аналогов, которые могут быть использованы для ацетилирования белка.[35]
Химиоферментная маркировка
Химиоферментный маркировка обеспечивает альтернативную стратегию включения ручек для щелкните по химии. Click-IT О-GlcNAc Система ферментной маркировки, разработанная Hsieh-Wilson группа и впоследствии коммерциализирована Invitrogen, использует мутантный фермент GalT Y289L, который способен переносить азидогалактозу (GalNAz) на О-GlcNAc.[27][36] Наличие GalNAz (а значит, и О-GlcNAc) может быть обнаружен с помощью различных алкинсодержащих зондов с идентифицируемыми метками, такими как биотин,[36] молекулы красителя,[27] и ПЭГ.[28]

Биосенсор с резонансным переносом энергии Фёрстера
Был разработан инженерный биосенсор белка, который может обнаруживать изменения в О-GlcNAc уровни с использованием Фёрстеровский резонансный перенос энергии. Этот датчик состоит из четырех компонентов, соединенных вместе в следующем порядке: голубой флуоресцентный белок (CFP), О-GlcNAc-связывающий домен (на основе GafD, чувствительного к лектину β -О-GlcNAc), пептид CKII, который является известным субстратом OGT, и желтый флуоресцентный белок (YFP). На О-GlcNAцилирование пептида CKII, домен GafD связывает О-GlcNAc фрагмент, сближающий домены CFP и YFP и генерирующий сигнал FRET. Генерация этого сигнала обратима и может использоваться для контроля О-GlcNAc динамика в ответ на различные процедуры. Этот датчик может быть генетически закодирован и использоваться в клетках.[37] Добавление последовательности локализации позволяет нацеливать этот О-GlcNAc сенсор к ядру, цитоплазме или плазматической мембране.[38]
Масс-спектрометрии
Биохимические подходы, такие как Вестерн-блоттинг может предоставить подтверждающие доказательства того, что белок модифицирован О-GlcNAc; масс-спектрометрия (МС) может предоставить окончательные доказательства присутствия О-GlcNAc. Гликопротеомический исследования с применением МС способствовали идентификации белков, модифицированных О-GlcNAc.
В качестве О-GlcNAc является субстехиометрическим и ионное подавление происходит в присутствии немодифицированных пептидов, стадия обогащения обычно выполняется перед масс-спектрометрическим анализом. Это может быть выполнено с использованием лектинов, антител или химической маркировки. В О-GlcNAc-модификация лабильна при использовании методов фрагментации, вызванной столкновением, таких как диссоциация, вызванная столкновением (CID) и столкновительная диссоциация при высоких энергиях (HCD), поэтому эти методы по отдельности неприменимы для О-GlcNAc картирование сайта. HCD генерирует фрагментные ионы, характерные для N-ацетилгексозамины, которые можно использовать для определения О-GlcNAcylation статус.[39] Чтобы облегчить картирование сайта с помощью HCD, β-элиминирование с последующим Майкл дополнение с дитиотреитол (BEMAD) можно использовать для преобразования лабильного О-GlcNAc модификация в более стабильную массовую метку. Для BEMAD-картирования О-GlcNAc, образец необходимо обработать фосфататазой, иначе могут быть обнаружены другие посттрансляционные модификации серина / треонина, такие как фосфорилирование.[40] Диссоциация с переносом электрона (ETD) используется для картирования сайтов, поскольку ETD вызывает расщепление пептидного остова, оставляя посттрансляционные модификации, такие как О-GlcNAc неповрежденный.[41]
Традиционные протеомные исследования выполняют тандемный МС о наиболее распространенных видах в масс-спектрах с полным сканированием, что запрещает полную характеристику видов с более низкой численностью. Одна современная стратегия целевой протеомики использует изотопные метки, например дибромид, для маркировки О-GlcNAцилированные белки. Этот метод позволяет алгоритмически обнаруживать виды с низкой численностью, которые затем секвенируются тандемной МС.[42] Направленный тандемный МС и целевое назначение гликопептидов позволяют идентифицировать О-GlcNAцилированные пептидные последовательности. Один примерный зонд состоит из биотиновой аффинной метки, расщепляемого кислотой силана, мотива перекодирования изотопов и алкина.[43][44][45] Однозначное картирование сайта возможно для пептидов только с одним остатком серин / треонин.[46]
Общая процедура для этого метода гликопротеомики, нацеленной на изотопы (IsoTaG), следующая:

- Метаболически метка О-GlcNAc для установки О-GlcNAz на белки
- Воспользуйтесь щелчком по химии, чтобы связать зонд IsoTaG с О-GlcNAz
- Использовать стрептавидин бусинки для обогащения меченых белков
- Обработайте шарики трипсином, чтобы высвободить немодифицированные пептиды.
- Отщепляйте из гранул гликопептиды, перекодированные изотопами, с помощью слабой кислоты.
- Получите полный спектр масс-спектров изотопно перекодированных гликопептидов
- Применить алгоритм для обнаружения уникальной изотопной сигнатуры от зонда
- Выполните тандемную МС для изотопно перекодированных видов для получения аминокислотных последовательностей гликопептида.
- Поиск в базе данных белков идентифицированных последовательностей
Были разработаны другие методологии количественного профилирования О-GlcNAc с использованием дифференциального изотопного мечения.[47] Примеры зондов обычно состоят из биотиновой аффинной метки, расщепляемого линкера (кислотного или фоторасщепляемого), тяжелой или легкой изотопной метки и алкина.[48][49]
Стратегии манипулирования О-GlcNAc
Были разработаны различные химические и генетические стратегии для управления О-GlcNAc, как на протеом на широкой основе и на специфических белках.
Химические методы
Сообщалось о низкомолекулярных ингибиторах как для OGT[50][51] и ОГА[52][53] которые функционируют в клетках или in vivo. Ингибиторы OGT приводят к глобальному снижению О-GlcNAc, в то время как ингибиторы OGA приводят к глобальному увеличению О-GlcNAc; эти ингибиторы не способны модулировать О-GlcNAc на определенных белках.
Подавление пути биосинтеза гексозамина также может снизить О-GlcNAc уровни. Например, аналоги глютамина азасерин и 6-диазо-5-оксо-L-норлейцин (ДОН) может препятствовать GFAT, хотя эти молекулы также могут неспецифически влиять на другие пути.[54]
Синтез белка
Лигирование экспрессированного белка был использован для подготовки О-GlcNAc-модифицированные белки сайт-специфическим образом. Существуют методы твердофазного пептидного синтеза с включением GlcNAc-модифицированного серина, треонина или цистеина.[55][56]
Генетические методы
Сайт-направленный мутагенез

Сайт-направленный мутагенез О-GlcNAc-модифицированные остатки серина или треонина до аланина могут быть использованы для оценки функции О-GlcNAc по определенным остаткам. Поскольку боковая цепь аланина представляет собой метильную группу и, следовательно, не может действовать как О-GlcNAc, эта мутация эффективно навсегда удаляет О-GlcNAc по определенному остатку. Хотя фосфорилирование серина / треонина можно смоделировать с помощью мутагенеза, чтобы аспартат или же глутамат, которые отрицательно заряжены карбоксилат боковых цепей, ни одна из 20 канонических аминокислот в достаточной степени не повторяет свойства О-GlcNAc.[57] Мутагенез триптофана был использован для имитации стерической массы О-GlcNAc, хотя триптофан намного гидрофобнее, чем О-GlcNAc.[58][59] Мутагенез также может нарушать другие посттрансляционные модификации, например, если серин альтернативно фосфорилирован или О-GlcNAcylated, мутагенез аланина навсегда устраняет возможности как фосфорилирования, так и О-GlcNAcylation.
S-GlcNAc
Идентифицировано масс-спектрометрией S-GlcNAc как посттрансляционная модификация остатков цистеина. В пробирке эксперименты показали, что OGT может катализировать образование S-GlcNAc и этот OGA не может гидролизоваться S-GlcNAc.[60] Хотя предыдущий отчет предполагал, что OGA способен гидролизовать тиогликозиды, это было продемонстрировано только на арилтиогликозиде. параграф-нитрофенол-S-GlcNAc; параграф-нитротиофенол является более активированной уходящей группой, чем остаток цистеина.[61] Недавние исследования подтвердили использование S-GlcNAc как ферментативно стабильная структурная модель О-GlcNAc, который может быть включен посредством твердофазного пептидного синтеза или сайт-направленного мутагенеза.[62][57][55][63]
Спроектированный OGT
Слитые конструкции из нанотела и OGT, усеченного TPR, позволяют индуцировать близость, специфичную для белка. О-GlcNAцилирование в клетках. Нанотело может быть направлено на белковые метки, например, GFP, которые слиты с целевым белком, или нанотело может быть направлено на эндогенные белки. Например, нанотело, распознающее C-концевую последовательность EPEA, может направлять ферментативную активность OGT на α-синуклеин.[64]
Функции О-GlcNAc
Апоптоз
Было высказано предположение, что апоптоз, форма контролируемой гибели клеток, регулируется О-GlcNAc. При различных формах рака повышенная ОСообщалось, что уровни -GlcNAc подавляют апоптоз.[65][66] Каспаза-3, каспаза-8, и каспаза-9 как сообщается, были изменены О-GlcNAc. Каспаза-8 модифицируется рядом с сайтами расщепления / активации; ОМодификация -GlcNAc может блокировать расщепление и активацию каспазы-8 из-за стерических затруднений. Фармакологическое снижение О-GlcNAc с 5S-GlcNAc ускоряет активацию каспазы при фармакологическом повышении О-GlcNAc с тиамет-G ингибирует активацию каспазы.[59]
Эпигенетика
Писатели и ластики
Белки, которые регулируют генетику, часто делятся на категории писателей, читателей и стирателей, то есть ферменты, которые устанавливают эпигенетические модификации, белки, распознающие эти модификации, и ферменты, которые удаляют эти модификации.[67] На свидание, О-GlcNAc был обнаружен на ферментах писателя и ластика. О-GlcNAc находится в нескольких местах на EZH2 каталитический метилтрансфераза подразделение PRC2, и считается, что он стабилизирует EZH2 до образования комплекса PRC2 и регулирует активность ди- и три-метилтрансфераз.[68][69] Все три члена Семейство диоксигеназ с транслокацией десять-одиннадцать (ТЕТ) (TET1, TET2, и TET3 ) известны как измененные О-GlcNAc.[70] О-GlcNAc, как предполагалось, вызывает ядерный экспорт TET3, снижая его ферментативную активность, истощая его из ядра.[71] О-GlcNAцилирование HDAC1 связан с повышенным активирующим фосфорилированием HDAC1.[72]
Гистон О-GlcNAцилирование
Гистон белки, основной белковый компонент хроматин, как известно, изменяются О-GlcNAc.[7] О-GlcNAc был идентифицирован на всех гистонах ядра (H2A,[7] H2B,[7] H3,[73] и H4[7]). Наличие О-GlcNAc на гистонах, как предполагается, влияет на транскрипцию генов, а также на другие гистоновые метки, такие как ацетилирование[7] и моноубиквитинирование.[74] TET2 сообщалось, что он взаимодействует с доменом TPR OGT и способствует привлечению OGT к гистонам.[75] Это взаимодействие связано с H2B S112. О-GlcNAc, который, в свою очередь, связан с моноубиквитинированием H2B K120.[74] Фосфорилирование OGT T444 через AMPK Было обнаружено, что ингибирует ассоциацию OGT-хроматин и подавляет H2B S112 О-GlcNAc.[76]
Чувствительность к питательным веществам
Продукт пути биосинтеза гексозамина, UDP-GlcNAc, используется OGT для катализирования добавления О-GlcNAc. Этот путь объединяет информацию о концентрациях различных метаболитов, включая аминокислоты, углеводы, жирные кислоты и нуклеотиды. Следовательно, уровни UDP-GlcNAc чувствительны к уровням клеточных метаболитов. Активность OGT частично регулируется концентрацией UDP-GlcNAc, обеспечивая связь между статусом питательных веществ клетки и О-GlcNAc.[77]
Недостаток глюкозы вызывает снижение уровней UDP-GlcNAc и начальное снижение О-GlcNAc, но, как ни странно, О-GlcNAc позже значительно активируется. Было показано, что это более позднее увеличение зависит от AMPK и p38 MAPK активация, и этот эффект частично связан с увеличением уровня мРНК и белка OGT.[78] Также было высказано предположение, что этот эффект зависит от кальций и CaMKII.[79] Активированный p38 способен рекрутировать OGT на конкретные белковые мишени, в том числе нейрофиламент H; О-GlcNAc модификация нейрофиламента H увеличивает его растворимость.[78] Во время депривации глюкозы гликогенсинтаза изменен О-GlcNAc, который подавляет его активность.[80]
Окислительный стресс
NRF2, а фактор транскрипции связанный с клеточным ответом на оксидативный стресс, косвенно регулируется О-GlcNAc. KEAP1, адаптерный белок для Каллин 3 -зависимый Убиквитинлигаза E3 комплекс, опосредует деградацию NRF2; окислительный стресс приводит к конформационным изменениям в KEAP1, которые подавляют деградацию NRF2. О-GlcNAc-модификация KEAP1 на S104 необходима для эффективного убиквитинирования и последующей деградации NRF2, связывания О-GlcNAc к окислительному стрессу. Недостаток глюкозы приводит к снижению О-GlcNAc и снижает деградацию NRF2. Клетки, экспрессирующие мутант KEAP1 S104A, устойчивы к Эрастин -индуцированный ферроптоз, что соответствует более высокому уровню NRF2 после удаления S104 О-GlcNAc.[81]
Повышенный О-GlcNAc уровни были связаны с уменьшением синтеза печеночный глутатион, важный сотовый антиоксидант. Ацетаминофен передозировка приводит к накоплению сильно окисляющего метаболита НАПКИ в печени, которая детоксифицируется глутатионом. У мышей нокаут OGT оказывает защитное действие против повреждения печени, вызванного ацетаминофеном, в то время как ингибирование OGA с помощью тиамет-G усугубляет повреждение печени, вызванное ацетаминофеном.[82]
Агрегация белков
ОБыло обнаружено, что -GlcNAc замедляет агрегацию белка, хотя общий характер этого явления неизвестен.
Твердофазный синтез пептидов был использован для получения полноразмерного α-синуклеина с О-GlcNAc модификация на T72. Тиофлавин Т анализы агрегации и просвечивающая электронная микроскопия продемонстрировали, что этот модифицированный α-синуклеин не легко образует агрегаты.[56]
Лечение JNPL3 тау у трансгенных мышей с ингибитором OGA было показано увеличение связанный с микротрубочками белок тау О-GlcNAcylation. Иммуногистохимия анализ мозговой ствол выявили снижение образования нейрофибриллярные сплетения. Рекомбинантный О-GlcNAцилированный тау агрегатируется медленнее, чем немодифицированный тау в in vitro тиофлавин S анализ агрегации. Аналогичные результаты были получены для рекомбинантно полученного О-GlcNAцилированная конструкция TAB1 по сравнению с ее немодифицированной формой.[83]
Фосфорилирование белков
Перекрестные помехи
Многие известные сайты фосфорилирования и ОСайты -GlcNA-цилирования расположены рядом или перекрываются.[46] Как белок О-GlcNAцилирование и фосфорилирование происходят по остаткам серина и треонина, эти посттрансляционные модификации могут регулировать друг друга. Например, в CKIIα, S347 О-GlcNAc противодействует фосфорилированию T344.[55] Взаимное ингибирование, т.е. ингибирование фосфорилирования О-GlcNAcylation и О-GlcNAцилирование фосфорилирования наблюдалось на других белках, включая мышиные рецептор эстрогена β,[84] РНК Pol II,[85] тау,[86] p53,[87] КАМКИВ,[88] p65,[89] β-катенин,[90] и α-синуклеин.[56] Положительная кооперативность также наблюдалась между этими двумя посттрансляционными модификациями, т.е. фосфорилирование индуцирует О-GlcNAcylation или О-GlcNAcylation вызывает фосфорилирование. Это было продемонстрировано на MeCP2[28] и HDAC1.[72] В других белках, например, кофилин, фосфорилирование и О-GlcNAcylation, по-видимому, происходят независимо друг от друга.[91]
В некоторых случаях изучаются терапевтические стратегии для регулирования О-GlcNAcylation, чтобы иметь последующий эффект на фосфорилирование. Например, подъем тау О-GlcNAcylation может иметь терапевтический эффект за счет ингибирования патологического гиперфосфорилирования тау-белка.[92]
Помимо фосфорилирования, О-GlcNAc влияет на другие посттрансляционные модификации, такие как ацетилирование лизина.[89] и моноубиквитинирование.[74]
Киназы
Протеинкиназы - это ферменты, ответственные за фосфорилирование остатков серина и треонина. О-GlcNAc был идентифицирован более чем у 100 (~ 20% человеческих киноме ) киназы, и эта модификация часто связана с изменениями активности киназы или объема субстрата киназы.[93]
Первое сообщение о том, что киназа напрямую регулируется О-GlcNAc был опубликован в 2009 году. CaMKIV гликозилирован по множеству сайтов, хотя было обнаружено, что S189 является основным сайтом. Мутант S189A более легко активируется фосфорилированием CaMKIV T200, что позволяет предположить, что О-GlcNAc в S189 ингибирует активность CaMKIV. Гомологическое моделирование показало, что S189 О-GlcNAc может мешать АТФ привязка.[88]
Известно, что AMPK и OGT модифицируют друг друга, т.е. AMPK фосфорилирует OGT и OGT. О-GlcNAcylates AMPK. Активация AMPK с помощью Рибонуклеотид AICA связан с ядерной локализацией OGT в дифференцированных мышечных трубках скелетных мышц C2C12, что приводит к увеличению ядерных О-GlcNAc. Этот эффект не наблюдался в пролиферирующих клетках и недифференцированных миобластических клетках.[94] Было обнаружено, что AMPK-фосфорилирование OGT T444 блокирует ассоциацию OGT с хроматином и снижает H2B S112. О-GlcNAc.[76] Было обнаружено, что сверхэкспрессия GFAT, фермента, который контролирует поток глюкозы в путь биосинтеза гексозамина, в жировой ткани мышей приводит к активации AMPK и последующему развитию. АКК торможение и повышенное окисление жирных кислот. Обработка глюкозамином культивированных адипоцитов 3T3L1 показала аналогичный эффект.[95] Точная связь между О-GlcNAc и AMPK не были полностью выяснены, поскольку в различных исследованиях сообщалось, что ингибирование OGA ингибирует активацию AMPK,[94] Ингибирование OGT также подавляет активацию AMPK,[76] усиление О-GlcNAc при обработке глюкозамином активирует AMPK,[95] и нокдаун OGT активирует AMPK;[96] эти результаты предполагают, что дополнительная косвенная связь между путями AMPK и О-GlcNAc или эффекты, специфичные для типов клеток.
Было показано, что распознавание субстрата CKIIα изменяется после S347. О-GlcNAcylation.[55]
Фосфатазы
Протеиновая фосфатаза 1 субъединицы PP1β и PP1γ, как было показано, образуют функциональные комплексы с OGT. Синтетический фосфопептид может дефосфорилироваться и О-GlcNAцилируется иммунопреципитатом OGT. Этот комплекс был назван «комплексом инь-ян», поскольку он заменяет фосфатную модификацию на О-GlcNAc модификация.[97]
MYPT1 - еще одна субъединица протеинфосфатазы, которая образует комплексы с OGT и сама является О-GlcNAcylated. MYPT1, по-видимому, играет роль в направлении OGT к определенным субстратам.[98]
Белковые взаимодействия
О-GlcNAцилирование белка может изменить его интерактом. В качестве О-GlcNAc очень гидрофильный, его присутствие может нарушить гидрофобные белок-белковые взаимодействия. Например, О-GlcNAc нарушает Sp1 взаимодействие с TAFII110,[99] и О-GlcNAc нарушает CREB взаимодействие с TAFII130 и CRTC.[100][101]
Некоторые исследования также выявили случаи, когда белок-белковые взаимодействия вызываются О-GlcNAc. Метаболическая маркировка диазиринсодержащим О-GlcNDAz был применен для идентификации белок-белковых взаимодействий, вызванных О-GlcNAc.[32] Использование гликопептида-приманки примерно на основе консенсусной последовательности для О-GlcNAc, α-енолаза, EBP1, и 14-3-3 были определены как потенциальные ОЧитатели -GlcNAc. Рентгеновская кристаллография показала, что 14-3-3 распознает О-GlcNAc через амфипатическую бороздку, которая также связывает фосфорилированные лиганды.[102] Также было предложено, чтобы Hsp70 действовал как лектин для распознавания О-GlcNAc.[103] Было высказано предположение, что О-GlcNAc играет роль во взаимодействии α-катенин и β-катенин.[90]
Стабильность и разложение белков
Совместный перевод О-GlcNAc был идентифицирован на Sp1 и Nup62. Эта модификация подавляет совместную трансляцию убиквитинирование и, таким образом, защищает возникающие полипептиды от протеасомной деградации. Подобные защитные эффекты О-GlcNAc на полноразмерном Sp1 не обнаружено. Неизвестно, универсален ли этот паттерн или применим только к конкретным белкам.[13]
Фосфорилирование белков часто используется в качестве метки для последующей деградации. Супрессор опухолей белок p53 нацелен на протеасомную деградацию через Сигналосома COP9 -опосредованное фосфорилирование Т155. О-GlcNAцилирование p53 S149 было связано со снижением фосфорилирования T155 и защитой p53 от деградации.[87] β-катенин О-GlcNAcylation конкурирует с фосфорилированием T41, которое сигнализирует β-катенину о деградации, стабилизируя белок.[90]
О-GlcNAцилирование Rpt2 Субъединица АТФазы 26S протеасома было показано, что ингибирует активность протеасом. Тестирование различных пептидных последовательностей показало, что эта модификация замедляет протеасомную деградацию гидрофобных пептидов, деградация гидрофильных пептидов, по-видимому, не затрагивается.[104] Было показано, что эта модификация подавляет другие пути, активирующие протеасомы, такие как Rpt6 фосфорилирование цАМФ-зависимая протеинкиназа.[105]
ОГА-С локализуется на липидные капли и было предложено локально активировать протеасомы, чтобы способствовать ремоделированию белков поверхности липидных капель.[106]
Реакция на стресс
Различные стимулы клеточного стресса были связаны с изменениями в О-GlcNAc. Лечение с пероксид водорода, хлорид кобальта (II), UVB свет, этиловый спирт, хлорид натрия, тепловой удар, и арсенит натрия, все приводит к повышенным О-GlcNAc. Нокаут OGT повышает чувствительность клеток к тепловому стрессу. Повышенный О-GlcNAc был связан с экспрессией Hsp40 и Hsp70.[107]
Терапевтическая значимость
Болезнь Альцгеймера
Многочисленные исследования показали, что аберрантное фосфорилирование тау является признаком болезни Альцгеймера.[108] О-GlcNA-цилирование бычьего тау было впервые охарактеризовано в 1996 году.[109] Последующий отчет в 2004 году продемонстрировал, что человеческий мозг tau также модифицирован О-GlcNAc. О-GlcNAцилирование тау-белка, как было продемонстрировано, регулирует фосфорилирование тау, которое было связано с образованием нейрофибриллярных клубков. Анализ образцов мозга показал, что белок О-GlcNAцилирование нарушено при болезни Альцгеймера, и парный спиральный фрагмент-тау не распознавался традиционными методами. О-Методы обнаружения GlcNAc, предполагающие, что патологический тау нарушен О-GlcNAцилирование относительно тау-белка, выделенного из контрольных образцов мозга. Подъемный тау О-GlcNAcylation было предложено в качестве терапевтической стратегии для снижения фосфорилирования тау.[86]
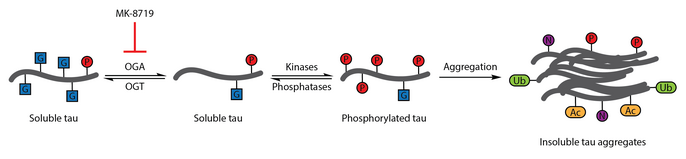
Чтобы проверить эту терапевтическую гипотезу, выборочно и гематоэнцефалический барьер -проницаемый ингибитор OGA тиамет-G. Лечение Thiamet-G позволило увеличить тау О-GlcNAcylation и подавление фосфорилирования тау в культуре клеток и in vivo у здоровых крыс Sprague-Dawley.[53] Последующее исследование показало, что лечение тиамет-G также увеличивает тау О-GlcNAcylation в модели трансгенных мышей JNPL3 tau. В этой модели на фосфорилирование тау-белка не оказывалось значительного влияния обработка тиамет-G, хотя наблюдалось уменьшение количества нейрофибриллярных клубков и более медленная потеря мотонейронов. Кроме того, О-GlcNAцилирование тау замедляет агрегацию тау in vitro.[83]
Ингибирование OGA с помощью МК -8719 изучается в клинических испытаниях как потенциальная стратегия лечения болезни Альцгеймера и других таупатии включая прогрессирующий надъядерный паралич.[92][110][111]
Рак
Нарушение регуляции О-GlcNAc связан с пролиферацией раковых клеток и ростом опухоли.
О-GlcNAцилирование гликолитический фермент PFK1 на S529 ингибирует ферментативную активность PFK1, уменьшая гликолитический поток и перенаправляя глюкозу в пентозофосфатный путь. Структурное моделирование и биохимические эксперименты показали, что О-GlcNAc at S529 would inhibit PFK1 allosteric activation by fructose 2,6-bisphosphate and oligomerization into active forms. In a mouse model, mice injected with cells expressing PFK1 S529A mutant showed lower tumor growth than mice injected with cells expressing PFK1 wild-type. Additionally, OGT overexpression enhanced tumor growth in the latter system but had no significant effect on the system with mutant PFK1. Гипоксия induces PFK1 S529 О-GlcNAc and increases flux through the pentose phosphate pathway to generate more NADPH, which maintains glutathione levels and detoxifies активные формы кислорода, imparting a growth advantage to cancer cells. PFK1 was found to be glycosylated in human breast and lung tumor tissues.[112] OGT has also been reported to positively regulate HIF-1α. HIF-1α is normally degraded under нормоксический conditions by prolyl hydroxylases that utilize α-ketoglutarate as a co-substrate. OGT suppresses α-ketoglutarate levels, protecting HIF-1α from proteasomal degradation by pVHL и продвижение аэробный гликолиз. In contrast with the previous study on PFK1, this study found that elevating OGT or О-GlcNAc upregulated PFK1, though the two studies are consistent in finding that О-GlcNAc levels are positively associated with flux through the pentose phosphate pathway. This study also found that decreasing О-GlcNAc selectively killed cancer cells via ER стресс -induced apoptosis.[65]
Человек pancreatic ductal adenocarcinoma (PDAC) cell lines have higher О-GlcNAc levels than human pancreatic duct эпителиальный (HPDE) cells. PDAC cells have some dependency upon О-GlcNAc for survival as OGT knockdown selectively inhibited PDAC cell proliferation (OGT knockdown did not significantly affect HPDE cell proliferation), and inhibition of OGT with 5S-GlcNAc showed the same result. Гипер-О-GlcNAcylation in PDAC cells appeared to be anti-apoptotic, inhibiting cleavage and activation of caspase-3 и каспаза-9. Numerous sites on the p65 subunit of NF-κB were found to be modified by О-GlcNAc in a dynamic manner; О-GlcNAc at p65 T305 and S319 in turn positively regulate other modifications associated with NF-κB activation such as p300 -mediated K310 acetylation and IKK -mediated S536 phosphorylation. These results suggested that NF-κB is constitutively activated by О-GlcNAc in pancreatic cancer.[66][89]
OGT stabilization of EZH2 in various breast cancer cell lines has been found to inhibit expression of tumor suppressor genes.[68] В гепатоцеллюлярная карцинома модели О-GlcNAc is associated with activating phosphorylation of HDAC1, which in turn regulates expression of the cell cycle regulator p21Waf1/Cip1 and cell motility regulator E-кадгерин.[72]
OGT has been found to stabilize SREBP-1 and activate lipogenesis in breast cancer cell lines. This stabilization was dependent on the proteasome and AMPK. OGT knockdown resulted in decreased nuclear SREBP-1, but proteasomal inhibition with MG132 blocked this effect. OGT knockdown also increased the interaction between SREBP-1 and the E3 ubiquitin ligase FBW7. AMPK is activated by T172 phosphorylation upon OGT knockdown, and AMPK phosphorylates SREBP-1 S372 to inhibit its cleavage and maturation. OGT knockdown had a diminished effect on SREBP-1 levels in AMPK-null cell lines. In a mouse model, OGT knockdown inhibited tumor growth but SREBP-1 overexpression partly rescued this effect.[96] These results contrast from those of a previous study which found that OGT knockdown/inhibition inhibited AMPK T172 phosphorylation and increased lipogenesis.[76]
In breast and prostate cancer cell lines, high levels of OGT and О-GlcNAc have been associated both in vitro и in vivo with processes associated with disease progression, e.g., ангиогенез, вторжение, и метастаз. OGT knockdown or inhibition was found to downregulate the transcription factor FoxM1 and upregulate the cell-cycle inhibitor стр. 27Kip1 (which is regulated by FoxM1-dependent expression of the E3 ubiquitin ligase component Skp2 ), causing G1 cell cycle arrest. This appeared to be dependent on proteasomal degradation of FoxM1, as expression of a FoxM1 mutant lacking a degron rescued the effects of OGT knockdown. FoxM1 was found not to be directly modified by О-GlcNAc, suggesting that hyper-О-GlcNAcylation of FoxM1 regulators impairs FoxM1 degradation. Targeting OGT also lowered levels of FoxM1-regulated proteins associated with cancer invasion and metastasis (MMP-2 & MMP-9 ), and angiogenesis (VEGF ).[113][114] О-GlcNAc modification of cofilin S108 has also been reported to be important for breast cancer cell invasion by regulating cofilin subcellular localization in invadopodia.[91]
Сахарный диабет
Повышенный О-GlcNAc has been associated with diabetes.
Pancreatic β cells synthesize and secrete инсулин to regulate blood glucose levels. One study found that inhibition of OGA with стрептозотоцин с последующим glucosamine treatment resulted in О-GlcNAc accumulation and apoptosis in β cells;[115] a subsequent study showed that a galactose-based analogue of streptozotocin was unable to inhibit OGA but still resulted in apoptosis, suggesting that the apoptotic effects of streptozotocin are not directly due to OGA inhibition.[116]
О-GlcNAc has been suggested to attenuate insulin signaling. In 3T3-L1 адипоциты, OGA inhibition with PUGNAc inhibited insulin-mediated glucose uptake. PUGNAc treatment also inhibited insulin-stimulated Акт T308 phosphorylation and downstream GSK3β S9 phosphorylation.[117] In a later study, insulin stimulation of COS-7 cells caused OGT to localize to the plasma membrane. Подавление PI3K с wortmannin reversed this effect, suggesting dependence on phosphatidylinositol(3,4,5)-triphosphate. Increasing О-GlcNAc levels by subjecting cells to high glucose conditions or PUGNAc treatment inhibited insulin-stimulated phosphorylation of Akt T308 and Akt activity. IRS1 phosphorylation at S307 and S632/S635, which is associated with attenuated insulin signaling, was enhanced. Subsequent experiments in mice with adenoviral delivery of OGT showed that OGT overexpression negatively regulated insulin signaling in vivo. Many components of the insulin signaling pathway, including β-катенин,[117] IR-β, IRS1, Akt, PDK1, and the p110α subunit of PI3K were found to be directly modified by О-GlcNAc.[118] Insulin signaling has also been reported to lead to OGT tyrosine phosphorylation and OGT activation, resulting in increased О-GlcNAc levels.[119]
As PUGNAc also inhibits лизосомный β-hexosaminidases, the OGA-selective inhibitor NButGT was developed to further probe the relationship between О-GlcNAc and insulin signaling in 3T3-L1 adipocytes. This study also found that PUGNAc resulted in impaired insulin signaling, but NButGT did not, as measured by changes in phosphorylation of Akt T308, suggesting that the effects observed with PUGNAc may be due to off-target effects besides OGA inhibition.[120]
болезнь Паркинсона
болезнь Паркинсона is associated with aggregation of α-synuclein.[121] В качестве О-GlcNAc modification of α-synuclein has been found to inhibit its aggregation, elevating α-synuclein О-GlcNAc is being explored as a therapeutic strategy to treat Parkinson's disease.[56][122]
Инфекционное заболевание
Бактериальный
Treatment of macrophages with lipopolysaccharide (LPS), a major component of the Грамотрицательные бактерии outer membrane, results in elevated О-GlcNAc in cellular and mouse models. During infection, cytosolic OGT was de-S-nitrosylated and activated. Подавление О-GlcNAc with DON inhibited the О-GlcNAcylation and nuclear translocation of NF-κB, as well as downstream induction of inducible nitric oxide synthase и ИЛ-1β производство. DON treatment also improved cell survival during LPS treatment.[123]
Популярный
О-GlcNAc has been implicated in influenza A virus (IAV) -индуцированный cytokine storm. Конкретно, О-GlcNAcylation of S430 on interferon regulatory factor-5 (IRF5) has been shown to promote its interaction with TNF receptor-associated factor 6 (TRAF6) in cellular and mouse models. TRAF6 mediates K63-linked ubiquitination of IRF5 which is necessary for IRF5 activity and subsequent cytokine production. Analysis of clinical samples showed that blood glucose levels were elevated in IAV-infected patients compared to healthy individuals. In IAV-infected patients, blood glucose levels positively correlated with Ил-6 и IL-8 уровни. О-GlcNAcylation of IRF5 was also relatively higher in мононуклеарные клетки периферической крови of IAV-infected patients.[124]
Другие приложения
Peptide therapeutics such as are attractive for their high specificity and potency, but they often have poor фармакокинетический profiles due to their degradation by serum протеазы.[125] Хотя О-GlcNAc is generally associated with intracellular proteins, it has been found that engineered peptide therapeutics modified by О-GlcNAc have enhanced serum stability in a mouse model and have similar structure and activity compared to the respective unmodified peptides. This method has been applied to engineer GLP-1 and PTH peptides.[126]
Смотрите также
Рекомендации
- ^ а б Zeidan, Quira; Hart, Gerald W. (2010-01-01). "The intersections between O-GlcNAcylation and phosphorylation: implications for multiple signaling pathways". Журнал клеточной науки. 123 (1): 13–22. Дои:10.1242/jcs.053678. ISSN 0021-9533. ЧВК 2794709. PMID 20016062.
- ^ Dias, Wagner B.; Cheung, Win D.; Hart, Gerald W. (2012-06-01). "O-GlcNAcylation of Kinases". Сообщения о биохимических и биофизических исследованиях. 422 (2): 224–228. Дои:10.1016/j.bbrc.2012.04.124. ISSN 0006-291X. ЧВК 3387735. PMID 22564745.
- ^ Haltiwanger, RS; Holt, GD; Hart, GW (1990-02-15). "Enzymatic Addition of O-GlcNAc to Nuclear and Cytoplasmic Proteins. Identification of a Uridine diphospho-N-acetylglucosamine:peptide beta-N-acetylglucosaminyltransferase". Журнал биологической химии. 265 (5): 2563–8. PMID 2137449.
- ^ Wulff-Fuentes, Eugenia; Olivier-Van Stichelen, Stephanie (2020). "The O-GlcNAc Database, Explore the O-GlcNAcome". Получено 20 ноября 2020.
- ^ Ma, Junfeng; Hart, Gerald W (2014-03-05). "O-GlcNAc profiling: from proteins to proteomes". Clinical Proteomics. 11 (1): 8. Дои:10.1186/1559-0275-11-8. ISSN 1542-6416. ЧВК 4015695. PMID 24593906.
- ^ Kelly, WG; Dahmus, ME; Hart, GW (1993-05-15). "RNA Polymerase II Is a Glycoprotein. Modification of the COOH-terminal Domain by O-GlcNAc". Журнал биологической химии. 268 (14): 10416–24. PMID 8486697.
- ^ а б c d е ж Sakabe, K; Ван, З; Hart, GW (2010-11-16). "Beta-N-acetylglucosamine (O-GlcNAc) Is Part of the Histone Code". Труды Национальной академии наук Соединенных Штатов Америки. 107 (46): 19915–20. Bibcode:2010PNAS..10719915S. Дои:10.1073/pnas.1009023107. ЧВК 2993388. PMID 21045127.
- ^ Levine, Z; Walker, S (2016-06-02). "The Biochemistry of O-GlcNAc Transferase: Which Functions Make It Essential in Mammalian Cells?". Ежегодный обзор биохимии. 85: 631–57. Дои:10.1146/annurev-biochem-060713-035344. PMID 27294441.
- ^ Ong, Qunxiang; Han, Weiping; Yang, Xiaoyong (2018-10-16). "O-GlcNAc as an Integrator of Signaling Pathways". Границы эндокринологии. 9: 599. Дои:10.3389/fendo.2018.00599. ISSN 1664-2392. ЧВК 6234912. PMID 30464755.
- ^ Харт, Джеральд У .; Slawson, Chad; Ramirez-Correa, Genaro; Lagerlof, Olof (2011-06-07). "Cross Talk Between O-GlcNAcylation and Phosphorylation: Roles in Signaling, Transcription, and Chronic Disease". Ежегодный обзор биохимии. 80: 825–858. Дои:10.1146/annurev-biochem-060608-102511. ISSN 0066-4154. ЧВК 3294376. PMID 21391816.
- ^ Torres, CR; Hart, GW (1984-03-10). "Topography and Polypeptide Distribution of Terminal N-acetylglucosamine Residues on the Surfaces of Intact Lymphocytes. Evidence for O-linked GlcNAc". Журнал биологической химии. 259 (5): 3308–17. PMID 6421821.
- ^ а б Shen, David L.; Gloster, Tracey M.; Yuzwa, Scott A.; Vocadlo, David J. (2012-05-04). "Insights into O-Linked N-Acetylglucosamine (O-GlcNAc) Processing and Dynamics through Kinetic Analysis of O-GlcNAc Transferase and O-GlcNAcase Activity on Protein Substrates". Журнал биологической химии. 287 (19): 15395–15408. Дои:10.1074/jbc.M111.310664. ISSN 0021-9258. ЧВК 3346082. PMID 22311971.
- ^ а б Чжу, Y; Liu, TW; Cecioni, S; Eskandari, R; Zandberg, WF; Vocadlo, DJ (May 2015). "O-GlcNAc Occurs Cotranslationally to Stabilize Nascent Polypeptide Chains". Природа Химическая Биология. 11 (5): 319–25. Дои:10.1038/nchembio.1774. PMID 25774941.
- ^ а б c Lazarus, MB; Nam, Y; Цзян, Дж; Sliz, P; Walker, S (2011-01-27). "Structure of Human O-GlcNAc Transferase and Its Complex With a Peptide Substrate". Природа. 469 (7331): 564–7. Bibcode:2011Natur.469..564L. Дои:10.1038/nature09638. ЧВК 3064491. PMID 21240259.
- ^ Macauley, MS; Whitworth, GE; Debowski, AW; Chin, D; Vocadlo, DJ (2005-07-08). "O-GlcNAcase Uses Substrate-Assisted Catalysis: Kinetic Analysis and Development of Highly Selective Mechanism-Inspired Inhibitors". Журнал биологической химии. 280 (27): 25313–22. Дои:10.1074/jbc.M413819200. PMID 15795231.
- ^ Roth, Christian; Chan, Sherry; Offen, Wendy A; Hemsworth, Glyn R; Willems, Lianne I; King, Dustin T; Varghese, Vimal; Britton, Robert; Vocadlo, David J; Davies, Gideon J (June 2017). "Structural and functional insight into human O-GlcNAcase". Природа Химическая Биология. 13 (6): 610–612. Дои:10.1038/nchembio.2358. ISSN 1552-4450. ЧВК 5438047. PMID 28346405.
- ^ Elsen, NL; Patel, SB; Ford, RE; Hall, DL; Hess, F; Kandula, H; Kornienko, M; Reid, J; Selnick, H (June 2017). "Insights Into Activity and Inhibition From the Crystal Structure of Human O-GlcNAcase". Природа Химическая Биология. 13 (6): 613–615. Дои:10.1038/nchembio.2357. PMID 28346407.
- ^ Joiner, CM; Levine, ZG; Aonbangkhen, C; Woo, CM; Walker, S (2019-08-21). "Aspartate Residues Far From the Active Site Drive O-GlcNAc Transferase Substrate Selection". Журнал Американского химического общества. 141 (33): 12974–12978. Дои:10.1021/jacs.9b06061. ЧВК 6849375. PMID 31373491.
- ^ Levine, ZG; Fan, C; Melicher, MS; Orman, M; Benjamin, T; Walker, S (2018-03-14). "O-GlcNAc Transferase Recognizes Protein Substrates Using an Asparagine Ladder in the Tetratricopeptide Repeat (TPR) Superhelix". Журнал Американского химического общества. 140 (10): 3510–3513. Дои:10.1021/jacs.7b13546. ЧВК 5937710. PMID 29485866.
- ^ а б S, Pathak; J, Alonso; M, Schimpl; K, Rafie; De, Blair; Vs, Borodkin; O, Albarbarawi; Dmf, van Aalten (Sep 2015). "The Active Site of O-GlcNAc Transferase Imposes Constraints on Substrate Sequence". Структурная и молекулярная биология природы. 22 (9): 744–750. Дои:10.1038/nsmb.3063. ЧВК 4979681. PMID 26237509.
- ^ Cheung, WD; Sakabe, K; Housley, MP; Dias, WB; Hart, GW (2008-12-05). "O-linked beta-N-acetylglucosaminyltransferase Substrate Specificity Is Regulated by Myosin Phosphatase Targeting and Other Interacting Proteins". Журнал биологической химии. 283 (49): 33935–41. Дои:10.1074/jbc.M806199200. ЧВК 2590692. PMID 18840611.
- ^ Zachara, Natasha E.; Vosseller, Keith; Hart, Gerald W. (November 2011). "Detection and Analysis of Proteins Modified by O-Linked N-Acetylglucosamine". Current Protocols in Protein Science. CHAPTER: Unit12.8. Дои:10.1002/0471140864.ps1208s66. ISSN 1934-3655. ЧВК 3349994. PMID 22045558.
- ^ Snow, C. M.; Senior, A.; Gerace, L. (1987-05-01). "Monoclonal antibodies identify a group of nuclear pore complex glycoproteins". Журнал клеточной биологии. 104 (5): 1143–1156. Дои:10.1083/jcb.104.5.1143. ISSN 0021-9525. ЧВК 2114474. PMID 2437126.
- ^ Comer, FI; Vosseller, K; Wells, L; Accavitti, MA; Hart, GW (2001-06-15). "Characterization of a Mouse Monoclonal Antibody Specific for O-linked N-acetylglucosamine". Аналитическая биохимия. 293 (2): 169–77. Дои:10.1006/abio.2001.5132. PMID 11399029.
- ^ Teo, CF; Ingale, S; Wolfert, MA; Elsayed, GA; Nöt, LG; Chatham, JC; Wells, L; Boons, GJ (May 2010). "Glycopeptide-specific Monoclonal Antibodies Suggest New Roles for O-GlcNAc". Природа Химическая Биология. 6 (5): 338–43. Дои:10.1038/nchembio.338. ЧВК 2857662. PMID 20305658.
- ^ а б DJ, Vocadlo; HC, Hang; Ej, Kim; Ja, Hanover; Cr, Bertozzi (2003-08-05). "A Chemical Approach for Identifying O-GlcNAc-modified Proteins in Cells". Труды Национальной академии наук Соединенных Штатов Америки. 100 (16): 9116–21. Bibcode:2003PNAS..100.9116V. Дои:10.1073/pnas.1632821100. ЧВК 171382. PMID 12874386.
- ^ а б c Clark, PM; Dweck, JF; Mason, DE; Hart, CR; Buck, SB; Peters, EC; Agnew, BJ; Hsieh-Wilson, LC (2008-09-03). "Direct In-Gel Fluorescence Detection and Cellular Imaging of O-GlcNAc-modified Proteins". Журнал Американского химического общества. 130 (35): 11576–7. Дои:10.1021/ja8030467. ЧВК 2649877. PMID 18683930.
- ^ а б c Rexach, JE; Rogers, CJ; Yu, SH; Tao, J; Sun, YE; Hsieh-Wilson, LC (September 2010). "Quantification of O-glycosylation Stoichiometry and Dynamics Using Resolvable Mass Tags". Природа Химическая Биология. 6 (9): 645–51. Дои:10.1038/nchembio.412. ЧВК 2924450. PMID 20657584.
- ^ а б Walter, LA; Batt, AR; Darabedian, N; Zaro, BW; Pratt, MR (2018-09-17). "Azide- And Alkyne-Bearing Metabolic Chemical Reporters of Glycosylation Show Structure-Dependent Feedback Inhibition of the Hexosamine Biosynthetic Pathway". ChemBioChem: Европейский журнал химической биологии. 19 (18): 1918–1921. Дои:10.1002/cbic.201800280. ЧВК 6261355. PMID 29979493.
- ^ Boyce, M; Carrico, IS; Ganguli, AS; Yu, SH; Hangauer, MJ; Hubbard, SC; Kohler, JJ; Bertozzi, CR (2011-02-22). "Metabolic Cross-Talk Allows Labeling of O-linked beta-N-acetylglucosamine-modified Proteins via the N-acetylgalactosamine Salvage Pathway". Труды Национальной академии наук Соединенных Штатов Америки. 108 (8): 3141–6. Bibcode:2011PNAS..108.3141B. Дои:10.1073/pnas.1010045108. ЧВК 3044403. PMID 21300897.
- ^ Tan, HY; Eskandari, R; Shen, D; Чжу, Y; Liu, TW; Willems, LI; Alteen, MG; Madden, Z; Vocadlo, DJ (2018-11-14). "Direct One-Step Fluorescent Labeling of O-GlcNAc-Modified Proteins in Live Cells Using Metabolic Intermediates". Журнал Американского химического общества. 140 (45): 15300–15308. Дои:10.1021/jacs.8b08260. PMID 30296064.
- ^ а б Yu, SH; Boyce, M; Wands, AM; Bond, MR; Bertozzi, CR; Kohler, JJ (2012-03-27). "Metabolic Labeling Enables Selective Photocrosslinking of O-GlcNAc-modified Proteins to Their Binding Partners". Труды Национальной академии наук Соединенных Штатов Америки. 109 (13): 4834–9. Bibcode:2012PNAS..109.4834Y. Дои:10.1073/pnas.1114356109. ЧВК 3323966. PMID 22411826.
- ^ Rodriguez, AC; Kohler, JJ (2014-08-01). "Recognition of Diazirine-Modified O-GlcNAc by Human O-GlcNAcase". MedChemComm. 5 (8): 1227–1234. Дои:10.1039/C4MD00164H. ЧВК 4109824. PMID 25068034.
- ^ Zaro, BW; Yang, YY; Hang, HC; Pratt, MR (2011-05-17). "Chemical Reporters for Fluorescent Detection and Identification of O-GlcNAc-modified Proteins Reveal Glycosylation of the Ubiquitin Ligase NEDD4-1". Труды Национальной академии наук Соединенных Штатов Америки. 108 (20): 8146–51. Bibcode:2011PNAS..108.8146Z. Дои:10.1073/pnas.1102458108. ЧВК 3100932. PMID 21540332.
- ^ Zaro, Balyn W.; Chuh, Kelly N.; Pratt, Matthew R. (2014-09-19). "Chemical Reporter for Visualizing Metabolic Cross-Talk between Carbohydrate Metabolism and Protein Modification". ACS Chemical Biology. 9 (9): 1991–1996. Дои:10.1021/cb5005564. ISSN 1554-8929. ЧВК 4168799. PMID 25062036.
- ^ а б "Click-IT™ O-GlcNAc Enzymatic Labeling System". www.thermofisher.com. Получено 2020-05-30.
- ^ Carrillo, LD; Krishnamoorthy, L; Mahal, LK (2006-11-22). "A Cellular FRET-based Sensor for beta-O-GlcNAc, a Dynamic Carbohydrate Modification Involved in Signaling". Журнал Американского химического общества. 128 (46): 14768–9. Дои:10.1021/ja065835+. PMID 17105262.
- ^ Carrillo, Luz D.; Froemming, Joshua A.; Mahal, Lara K. (2011-02-25). "Targeted in Vivo O-GlcNAc Sensors Reveal Discrete Compartment-specific Dynamics during Signal Transduction". Журнал биологической химии. 286 (8): 6650–6658. Дои:10.1074/jbc.M110.191627. ISSN 0021-9258. ЧВК 3057821. PMID 21138847.
- ^ Ma, Junfeng; Hart, Gerald W. (2017-02-02). "Analysis of Protein O-GlcNAcylation by Mass Spectrometry". Current Protocols in Protein Science. 87: 24.10.1–24.10.16. Дои:10.1002/cpps.24. ISSN 1934-3655. ЧВК 5300742. PMID 28150883.
- ^ Wells, L; Vosseller, K; Cole, RN; Cronshaw, JM; Matunis, MJ; Hart, GW (October 2002). "Mapping Sites of O-GlcNAc Modification Using Affinity Tags for Serine and Threonine Post-Translational Modifications". Molecular & Cellular Proteomics : MCP. 1 (10): 791–804. Дои:10.1074/mcp.m200048-mcp200. PMID 12438562.
- ^ Zhao, Peng; Винер, Роза; Teo, Chin Fen; Boons, Geert-Jan; Horn, David; Wells, Lance (2011-09-02). "Combining High-energy C-trap Dissociation and Electron Transfer Dissociation for Protein O-GlcNAc Modification Site Assignment". Журнал протеомных исследований. 10 (9): 4088–4104. Дои:10.1021/pr2002726. ISSN 1535-3893. ЧВК 3172619. PMID 21740066.
- ^ Palaniappan, Krishnan K.; Pitcher, Austin A.; Smart, Brian P.; Spiciarich, David R.; Iavarone, Anthony T .; Bertozzi, Carolyn R. (2011-08-19). "Isotopic Signature Transfer and Mass Pattern Prediction (IsoStamp): An Enabling Technique for Chemically-Directed Proteomics". ACS Chemical Biology. 6 (8): 829–836. Дои:10.1021/cb100338x. ISSN 1554-8929. ЧВК 3220624. PMID 21604797.
- ^ Woo, CM; Iavarone, AT; Spiciarich, DR; Palaniappan, KK; Bertozzi, CR (June 2015). "Isotope-targeted Glycoproteomics (IsoTaG): A Mass-Independent Platform for Intact N- And O-glycopeptide Discovery and Analysis". Nature Methods. 12 (6): 561–7. Дои:10.1038/nmeth.3366. ЧВК 4599779. PMID 25894945.
- ^ Woo, Christina M.; Felix, Alejandra; Byrd, William E.; Zuegel, Devon K.; Ishihara, Mayumi; Азади, Парастоо; Iavarone, Anthony T .; Pitteri, Sharon J.; Bertozzi, Carolyn R. (2017-04-07). "Development of IsoTaG, a Chemical Glycoproteomics Technique for Profiling Intact N- and O-Glycopeptides from Whole Cell Proteomes". Журнал протеомных исследований. 16 (4): 1706–1718. Дои:10.1021/acs.jproteome.6b01053. ISSN 1535-3893. ЧВК 5507588. PMID 28244757.
- ^ Woo, Christina M.; Felix, Alejandra; Zhang, Lichao; Elias, Joshua E.; Bertozzi, Carolyn R. (January 2017). "Isotope Targeted Glycoproteomics (IsoTaG) analysis of sialylated N- and O-glycopeptides on an Orbitrap Fusion Tribrid using azido and alkynyl sugars". Аналитическая и биоаналитическая химия. 409 (2): 579–588. Дои:10.1007/s00216-016-9934-9. ISSN 1618-2642. ЧВК 5342897. PMID 27695962.
- ^ а б Woo, CM; Lund, PJ; Huang, AC; Davis, MM; Bertozzi, CR; Pitteri, SJ (April 2018). "Mapping and Quantification of Over 2000 O-linked Glycopeptides in Activated Human T Cells With Isotope-Targeted Glycoproteomics (Isotag)". Molecular & Cellular Proteomics : MCP. 17 (4): 764–775. Дои:10.1074/mcp.RA117.000261. ЧВК 5880114. PMID 29351928.
- ^ Khidekel, N; Ficarro, SB; Clark, PM; Bryan, MC; Swaney, DL; Rexach, JE; Sun, YE; Coon, JJ; Peters, EC; Hsieh-Wilson, LC (June 2007). "Probing the Dynamics of O-GlcNAc Glycosylation in the Brain Using Quantitative Proteomics" (PDF). Природа Химическая Биология. 3 (6): 339–48. Дои:10.1038/nchembio881. PMID 17496889.
- ^ Qin, K; Чжу, Y; Qin, W; Gao, J; Shao, X; Wang, YL; Zhou, W; Wang, C; Chen, X (2018-08-17). "Quantitative Profiling of Protein O-GlcNAcylation Sites by an Isotope-Tagged Cleavable Linker". ACS Chemical Biology. 13 (8): 1983–1989. Дои:10.1021/acschembio.8b00414. PMID 30059200.
- ^ Ли, Дж; Li, Z; Duan, X; Qin, K; Dang, L; Солнце, S; Cai, L; Hsieh-Wilson, LC; Wu, L; Yi, W (2019-01-18). "An Isotope-Coded Photocleavable Probe for Quantitative Profiling of Protein O-GlcNAcylation" (PDF). ACS Chemical Biology. 14 (1): 4–10. Дои:10.1021/acschembio.8b01052. PMID 30620550.
- ^ Liu, Tai-Wei; Zandberg, Wesley F.; Gloster, Tracey M.; Deng, Lehua; Murray, Kelsey D.; Shan, Xiaoyang; Vocadlo, David J. (June 25, 2018). "Metabolic Inhibitors of O-GlcNAc Transferase That Act In Vivo Implicate Decreased O-GlcNAc Levels in Leptin-Mediated Nutrient Sensing". Angewandte Chemie International Edition. 57 (26): 7644–7648. Дои:10.1002/anie.201803254. ISSN 1521-3773. ЧВК 6055616. PMID 29756380.
- ^ Martin, Sara E. S.; Tan, Zhi-Wei; Itkonen, Harri M.; Duveau, Damien Y.; Paulo, Joao A.; Janetzko, John; Boutz, Paul L.; Törk, Lisa; Moss, Frederick A.; Thomas, Craig J.; Gygi, Steven P. (October 24, 2018). "Structure-Based Evolution of Low Nanomolar O-GlcNAc Transferase Inhibitors". Журнал Американского химического общества. 140 (42): 13542–13545. Дои:10.1021/jacs.8b07328. ISSN 1520-5126. ЧВК 6261342. PMID 30285435.
- ^ Dorfmueller, Helge C.; Borodkin, Vladimir S.; Schimpl, Marianne; Shepherd, Sharon M.; Shpiro, Natalia A.; van Aalten, Daan M. F. (2006-12-27). "GlcNAcstatin: a picomolar, selective O-GlcNAcase inhibitor that modulates intracellular O-glcNAcylation levels". Журнал Американского химического общества. 128 (51): 16484–16485. Дои:10.1021/ja066743n. ISSN 0002-7863. ЧВК 7116141. PMID 17177381.
- ^ а б Yuzwa, SA; Macauley, MS; Heinonen, JE; Shan, X; Dennis, RJ; He, Y; Whitworth, GE; Stubbs, KA; McEachern, EJ (August 2008). "A Potent Mechanism-Inspired O-GlcNAcase Inhibitor That Blocks Phosphorylation of Tau in Vivo". Природа Химическая Биология. 4 (8): 483–90. Дои:10.1038/nchembio.96. PMID 18587388.
- ^ Akella, Neha M.; Ciraku, Lorela; Reginato, Mauricio J. (2019-07-04). "Fueling the fire: emerging role of the hexosamine biosynthetic pathway in cancer". BMC Биология. 17 (1): 52. Дои:10.1186/s12915-019-0671-3. ISSN 1741-7007. ЧВК 6610925. PMID 31272438.
- ^ а б c d Tarrant, MK; Rho, HS; Xie, Z; Jiang, YL; Gross, C; Culhane, JC; Yan, G; Qian, J; Ichikawa, Y (2012-01-22). "Regulation of CK2 by Phosphorylation and O-GlcNAcylation Revealed by Semisynthesis". Природа Химическая Биология. 8 (3): 262–9. Дои:10.1038/nchembio.771. ЧВК 3288285. PMID 22267120.
- ^ а б c d Marotta, NP; Lin, YH; Lewis, YE; Ambroso, MR; Zaro, BW; Roth, MT; Arnold, DB; Langen, R; Pratt, MR (Nov 2015). "O-GlcNAc Modification Blocks the Aggregation and Toxicity of the Protein α-Synuclein Associated With Parkinson's Disease". Nature Chemistry. 7 (11): 913–20. Bibcode:2015NatCh...7..913M. Дои:10.1038/nchem.2361. ЧВК 4618406. PMID 26492012.
- ^ а б Gorelik, A; Bartual, SG; Borodkin, VS; Varghese, J; Ferenbach, AT; van Aalten, DMF (November 2019). "Genetic Recoding to Dissect the Roles of Site-Specific Protein O-GlcNAcylation". Структурная и молекулярная биология природы. 26 (11): 1071–1077. Дои:10.1038/s41594-019-0325-8. ЧВК 6858883. PMID 31695185.
- ^ Lewis, YE; Galesic, A; Levine, PM; De Leon, CA; Lamiri, N; Brennan, CK; Pratt, MR (2017-04-21). "O-GlcNAcylation of α-Synuclein at Serine 87 Reduces Aggregation Without Affecting Membrane Binding". ACS Chemical Biology. 12 (4): 1020–1027. Дои:10.1021/acschembio.7b00113. ЧВК 5607117. PMID 28195695.
- ^ а б Chuh, Kelly N.; Batt, Anna R.; Zaro, Balyn W.; Darabedian, Narek; Marotta, Nicholas P.; Brennan, Caroline K.; Amirhekmat, Arya; Pratt, Matthew R. (2017-06-14). "The New Chemical Reporter 6-Alkynyl-6-deoxy-GlcNAc Reveals O-GlcNAc Modification of the Apoptotic Caspases That Can Block the Cleavage/Activation of Caspase-8". Журнал Американского химического общества. 139 (23): 7872–7885. Дои:10.1021/jacs.7b02213. ISSN 0002-7863. ЧВК 6225779. PMID 28528544.
- ^ Maynard, JC; Burlingame, AL; Medzihradszky, KF (November 2016). "Cysteine S-linked N-acetylglucosamine (S-GlcNAcylation), A New Post-translational Modification in Mammals". Molecular & Cellular Proteomics : MCP. 15 (11): 3405–3411. Дои:10.1074/mcp.M116.061549. ЧВК 5098038. PMID 27558639.
- ^ Macauley, MS; Stubbs, KA; Vocadlo, DJ (2005-12-14). "O-GlcNAcase Catalyzes Cleavage of Thioglycosides Without General Acid Catalysis". Журнал Американского химического общества. 127 (49): 17202–3. Дои:10.1021/ja0567687. PMID 16332065.
- ^ Mehta, AY; Veeraiah, RKH; Датта, S; Goth, CK; Hanes, MS; Gao, C; Stavenhagen, K; Kardish, R; Matsumoto, Y; Heimburg-Molinaro, J; Boyce, M; Pohl, NLB; Cummings, RD (17 September 2020). "Parallel Glyco-SPOT Synthesis of Glycopeptide Libraries". Клеточная химическая биология. 27 (9): 1207–1219.e9. Дои:10.1016/j.chembiol.2020.06.007. ЧВК 7556346. PMID 32610041.
- ^ De Leon, CA; Levine, PM; Craven, TW; Pratt, MR (2017-07-11). "The Sulfur-Linked Analogue of O-GlcNAc (S-GlcNAc) Is an Enzymatically Stable and Reasonable Structural Surrogate for O-GlcNAc at the Peptide and Protein Levels". Биохимия. 56 (27): 3507–3517. Дои:10.1021/acs.biochem.7b00268. ЧВК 5598463. PMID 28627871.
- ^ Ramirez, DH; Aonbangkhen, C; Wu, HY; Naftaly, JA; Tang, S; O'Meara, TR; Woo, CM (2020-04-17). "Engineering a Proximity-Directed O-GlcNAc Transferase for Selective Protein O-GlcNAcylation in Cells". ACS Chemical Biology. 15 (4): 1059–1066. Дои:10.1021/acschembio.0c00074. ЧВК 7296736. PMID 32119511.
- ^ а б Ferrer, Christina M.; Lynch, Thomas P.; Sodi, Valerie L.; Falcone, John N.; Schwab, Luciana P.; Peacock, Danielle L.; Vocadlo, David J.; Seagroves, Tiffany N.; Reginato, Mauricio J. (2014-06-05). "O-GlcNAcylation regulates cancer metabolism and survival stress signaling via regulation of the HIF-1 pathway". Молекулярная клетка. 54 (5): 820–831. Дои:10.1016/j.molcel.2014.04.026. ISSN 1097-4164. ЧВК 4104413. PMID 24857547.
- ^ а б Ma, Z; Vocadlo, DJ; Vosseller, K (2013-05-24). "Hyper-O-GlcNAcylation Is Anti-Apoptotic and Maintains Constitutive NF-κB Activity in Pancreatic Cancer Cells". Журнал биологической химии. 288 (21): 15121–30. Дои:10.1074/jbc.M113.470047. ЧВК 3663532. PMID 23592772.
- ^ Torres, IO; Fujimori, DG (December 2015). "Functional Coupling Between Writers, Erasers and Readers of Histone and DNA Methylation". Текущее мнение в структурной биологии. 35: 68–75. Дои:10.1016/j.sbi.2015.09.007. ЧВК 4688207. PMID 26496625.
- ^ а б Chu, CS; Lo, PW; Yeh, YH; Hsu, PH; Peng, SH; Teng, YC; Kang, ML; Wong, CH; Juan, LJ (2014-01-28). "O-GlcNAcylation Regulates EZH2 Protein Stability and Function". Труды Национальной академии наук Соединенных Штатов Америки. 111 (4): 1355–60. Bibcode:2014PNAS..111.1355C. Дои:10.1073/pnas.1323226111. ЧВК 3910655. PMID 24474760.
- ^ Lo, PW; Shie, JJ; ChChen, CH; Wu, CY; Hsu, TL; Wong, CH (2018-07-10). "O-GlcNAcylation Regulates the Stability and Enzymatic Activity of the Histone Methyltransferase EZH2". Труды Национальной академии наук Соединенных Штатов Америки. 115 (28): 7302–7307. Дои:10.1073/pnas.1801850115. ЧВК 6048490. PMID 29941599.
- ^ Чжан, Q; Лю, X; Gao, W; Li, P; Hou, J; Ли, Дж; Wong, J (2014-02-28). "Differential Regulation of the Ten-Eleven Translocation (TET) Family of Dioxygenases by O-linked β-N-acetylglucosamine Transferase (OGT)". Журнал биологической химии. 289 (9): 5986–96. Дои:10.1074/jbc.M113.524140. ЧВК 3937666. PMID 24394411.
- ^ Zhang, Qiao; Лю, Сяогуан; Gao, Wenqi; Li, Pishun; Hou, Jingli; Li, Jiwen; Wong, Jiemin (2014-02-28). "Differential Regulation of the Ten-Eleven Translocation (TET) Family of Dioxygenases by O-Linked β-N-Acetylglucosamine Transferase (OGT)". Журнал биологической химии. 289 (9): 5986–5996. Дои:10.1074/jbc.M113.524140. ISSN 0021-9258. ЧВК 3937666. PMID 24394411.
- ^ а б c Zhu, Guizhou; Tao, Tao; Zhang, Dongmei; Liu, Xiaojuan; Qiu, Huiyuan; Han, LiJian; Xu, Zhiwei; Xiao, Ying; Cheng, Chun; Shen, Aiguo (Aug 2016). "O-GlcNAcylation of histone deacetylases 1 in hepatocellular carcinoma promotes cancer progression". Гликобиология. 26 (8): 820–833. Дои:10.1093/glycob/cww025. ISSN 1460-2423. PMID 27060025.
- ^ Fong, Jerry J.; Nguyen, Brenda L.; Bridger, Robert; Medrano, Estela E.; Wells, Lance; Pan, Shujuan; Sifers, Richard N. (2012-04-06). "β-N-Acetylglucosamine (O-GlcNAc) Is a Novel Regulator of Mitosis-specific Phosphorylations on Histone H3". Журнал биологической химии. 287 (15): 12195–12203. Дои:10.1074/jbc.M111.315804. ISSN 0021-9258. ЧВК 3320971. PMID 22371497.
- ^ а б c Fujiki, R; Hashiba, W; Sekine, H; Yokoyama, A; Chikanishi, T; Ito, S; Imai, Y; Kim, J; He, HH (2011-11-27). "GlcNAcylation of Histone H2B Facilitates Its Monoubiquitination". Природа. 480 (7378): 557–60. Bibcode:2011Natur.480..557F. Дои:10.1038/nature10656. ЧВК 7289526. PMID 22121020.
- ^ Chen, Q; Чен, Y; Bian, C; Fujiki, R; Yu, X (2013-01-24). "TET2 Promotes Histone O-GlcNAcylation During Gene Transcription". Природа. 493 (7433): 561–4. Bibcode:2013Natur.493..561C. Дои:10.1038/nature11742. ЧВК 3684361. PMID 23222540.
- ^ а б c d Xu, Qiuran; Yang, Caihong; Du, Yu; Chen, Yali; Liu, Hailong; Дэн, Мин; Zhang, Haoxing; Чжан, Лэй; Liu, Tongzheng; Liu, Qingguang; Wang, Liewei (2014-05-01). "AMPK regulates histone H2B O-GlcNAcylation". Исследования нуклеиновых кислот. 42 (9): 5594–5604. Дои:10.1093/nar/gku236. ISSN 0305-1048. ЧВК 4027166. PMID 24692660.
- ^ Kreppel, L. K.; Hart, G. W. (1999-11-05). "Regulation of a cytosolic and nuclear O-GlcNAc transferase. Role of the tetratricopeptide repeats". Журнал биологической химии. 274 (45): 32015–32022. Дои:10.1074/jbc.274.45.32015. ISSN 0021-9258. PMID 10542233.
- ^ а б Cheung, Win D.; Hart, Gerald W. (2008-05-09). "AMP-activated Protein Kinase and p38 MAPK Activate O-GlcNAcylation of Neuronal Proteins during Glucose Deprivation". Журнал биологической химии. 283 (19): 13009–13020. Дои:10.1074/jbc.M801222200. ISSN 0021-9258. ЧВК 2435304. PMID 18353774.
- ^ Zou, Luyun; Zhu-Mauldin, Xiaoyuan; Marchase, Richard B.; Paterson, Andrew J.; Лю, Цзянь; Yang, Qinglin; Chatham, John C. (2012-10-05). "Glucose deprivation-induced increase in protein O-GlcNAcylation in cardiomyocytes is calcium-dependent". Журнал биологической химии. 287 (41): 34419–34431. Дои:10.1074/jbc.M112.393207. ISSN 1083-351X. ЧВК 3464547. PMID 22908225.
- ^ Taylor, Rodrick P.; Parker, Glendon J.; Hazel, Mark W.; Soesanto, Yudi; Fuller, William; Yazzie, Marla J.; McClain, Donald A. (2008-03-07). "Glucose deprivation stimulates O-GlcNAc modification of proteins through up-regulation of O-linked N-acetylglucosaminyltransferase". Журнал биологической химии. 283 (10): 6050–6057. Дои:10.1074/jbc.M707328200. ISSN 0021-9258. PMID 18174169.
- ^ Chen, PH; Smith, TJ; Wu, J; Siesser, PJ; Bisnett, BJ; Khan, F; Hogue, M; Soderblom, E; Tang, F; Marks, JR; Major, MB; Swarts, BM; Boyce, M; Chi, Jen-Tsan (2017-08-01). "Glycosylation of KEAP1 Links Nutrient Sensing to Redox Stress Signaling". Журнал EMBO. 36 (15): 2233–2250. Дои:10.15252/embj.201696113. ЧВК 5538768. PMID 28663241.
- ^ McGreal, SR; Bhushan, B; Walesky, C; McGill, MR; Lebofsky, M; Kandel, SE; Winefield, RD; Jaeschke, H; Zachara, NE; Zhang, Z; Tan, EP; Slawson, C; Apte, U (2018-04-01). "Modulation of O-GlcNAc Levels in the Liver Impacts Acetaminophen-Induced Liver Injury by Affecting Protein Adduct Formation and Glutathione Synthesis". Токсикологические науки. 162 (2): 599–610. Дои:10.1093/toxsci/kfy002. ЧВК 6012490. PMID 29325178.
- ^ а б Yuzwa, SA; Shan, X; Macauley, MS; Clark, T; Skorobogatko, Y; Vosseller, K; Vocadlo, DJ (2012-02-26). "Increasing O-GlcNAc Slows Neurodegeneration and Stabilizes Tau Against Aggregation". Природа Химическая Биология. 8 (4): 393–9. Дои:10.1038/nchembio.797. PMID 22366723.
- ^ Cheng, X .; Cole, R. N.; Zaia, J.; Hart, G. W. (2000-09-26). "Alternative O-glycosylation/O-phosphorylation of the murine estrogen receptor beta". Биохимия. 39 (38): 11609–11620. Дои:10.1021/bi000755i. ISSN 0006-2960. PMID 10995228.
- ^ Comer, F. I.; Hart, G. W. (2001-07-03). "Reciprocity between O-GlcNAc and O-phosphate on the carboxyl terminal domain of RNA polymerase II". Биохимия. 40 (26): 7845–7852. Дои:10.1021/bi0027480. ISSN 0006-2960. PMID 11425311.
- ^ а б Liu, Fei; Iqbal, Khalid; Grundke-Iqbal, Inge; Харт, Джеральд У .; Gong, Cheng-Xin (2004-07-20). "O-GlcNAcylation regulates phosphorylation of tau: A mechanism involved in Alzheimer's disease". Труды Национальной академии наук Соединенных Штатов Америки. 101 (29): 10804–10809. Bibcode:2004PNAS..10110804L. Дои:10.1073/pnas.0400348101. ISSN 0027-8424. ЧВК 490015. PMID 15249677.
- ^ а б Yang, WH; Kim, JE; Nam, HW; Ju, JW; Ким, HS; Kim, YS; Cho, JW (Oct 2006). "Modification of p53 With O-linked N-acetylglucosamine Regulates p53 Activity and Stability". Природа клеточной биологии. 8 (10): 1074–83. Дои:10.1038/ncb1470. PMID 16964247. S2CID 12326082.
- ^ а б Dias, WB; Cheung, WD; Ван, З; Hart, GW (2009-08-07). "Regulation of Calcium/Calmodulin-Dependent Kinase IV by O-GlcNAc Modification". Журнал биологической химии. 284 (32): 21327–37. Дои:10.1074/jbc.M109.007310. ЧВК 2755857. PMID 19506079.
- ^ а б c Ma, Z; Chalkley, RJ; Vosseller, K (2017-06-02). "Hyper- O-GlcNAcylation Activates Nuclear Factor κ-Light-Chain-Enhancer of Activated B Cells (NF-κB) Signaling Through Interplay With Phosphorylation and Acetylation". Журнал биологической химии. 292 (22): 9150–9163. Дои:10.1074/jbc.M116.766568. ЧВК 5454098. PMID 28416608.
- ^ а б c Olivier-Van Stichelen, Stéphanie; Dehennaut, Vanessa; Buzy, Armelle; Zachayus, Jean-Luc; Guinez, Céline; Mir, Anne-Marie; El Yazidi-Belkoura, Ikram; Copin, Marie-Christine; Boureme, Didier; Loyaux, Denis; Ferrara, Pascual (Aug 2014). "O-GlcNAcylation stabilizes β-catenin through direct competition with phosphorylation at threonine 41". Журнал FASEB. 28 (8): 3325–3338. Дои:10.1096/fj.13-243535. ISSN 1530-6860. ЧВК 4101651. PMID 24744147.
- ^ а б Huang, Xun; Pan, Qiuming; Sun, Danni; Чен, Вэй; Shen, Aijun; Huang, Min; Ding, Jian; Geng, Meiyu (2013-12-20). "O-GlcNAcylation of Cofilin Promotes Breast Cancer Cell Invasion". Журнал биологической химии. 288 (51): 36418–36425. Дои:10.1074/jbc.M113.495713. ISSN 0021-9258. ЧВК 3868755. PMID 24214978.
- ^ а б c Selnick, Harold G.; Hess, J. Fred; Tang, Cuyue; Liu, Kun; Schachter, Joel B.; Ballard, Jeanine E.; Marcus, Jacob; Klein, Daniel J.; Wang, Xiaohai; Pearson, Michelle; Savage, Mary J.; Kaul, Ramesh; Li, Tong-Shuang; Vocadlo, David J.; Zhou, Yuanxi; Zhu, Yongbao; Mu, Changwei; Wang, Yaode; Wei, Zhongyong; Bai, Chang; Duffy, Joseph L.; McEachern, Ernest J. (Nov 2019). "Discovery of MK-8719, a Potent O-GlcNAcase Inhibitor as a Potential Treatment for Tauopathies". Журнал медицинской химии. 62 (22): 10062–10097. Дои:10.1021/acs.jmedchem.9b01090. ISSN 1520-4804. PMID 31487175.
- ^ Schwein, Paul A; Woo, Christina M (2020-03-20). "The O-GlcNAc Modification on Kinases". ACS Chemical Biology. 15 (3): 602–617. Дои:10.1021/acschembio.9b01015. ЧВК 7253032. PMID 32155042.
- ^ а б Bullen, JW; Balsbaugh, JL; Chanda, D; Shabanowitz, J; Хант, Д.Ф .; Neumann, D; Hart, GW (2014-04-11). "Cross-talk Between Two Essential Nutrient-Sensitive Enzymes: O-GlcNAc Transferase (OGT) and AMP-activated Protein Kinase (AMPK)". Журнал биологической химии. 289 (15): 10592–606. Дои:10.1074/jbc.M113.523068. ЧВК 4036179. PMID 24563466.
- ^ а б Луо, Бай; Паркер, Глендон Дж .; Кукси, Роберт С .; Соэсанто, Юди; Эванс, Марк; Джонс, Дебора; Макклейн, Дональд А. (2007-03-09). «Хронический поток гексозамина стимулирует окисление жирных кислот за счет активации AMP-активированной протеинкиназы в адипоцитах». Журнал биологической химии. 282 (10): 7172–7180. Дои:10.1074 / jbc.M607362200. ISSN 0021-9258. PMID 17227772.
- ^ а б Соди, ВЛ; Bacigalupa, ZA; Феррер, СМ; Ли, СП; Гокал, Вашингтон; Mukhopadhyay, D; Wellen, KE; Иван, М; Регинато, MJ (15 февраля 2018 г.). «Датчик питательных веществ O-GlcNAc трансфераза контролирует метаболизм раковых липидов посредством регуляции SREBP-1». Онкоген. 37 (7): 924–934. Дои:10.1038 / onc.2017.395. ЧВК 5814337. PMID 29059153.
- ^ Уэллс, Лэнс; Креппель, Лиза К .; Комер, Фрэнк I .; Wadzinski, Brian E .; Харт, Джеральд В. (2004-09-10). «O-GlcNAc трансфераза находится в функциональном комплексе с каталитическими субъединицами протеинфосфатазы 1». Журнал биологической химии. 279 (37): 38466–38470. Дои:10.1074 / jbc.M406481200. ISSN 0021-9258. PMID 15247246.
- ^ Cheung, Win D .; Сакабэ, Каору; Хаусли, Майкл П .; Диас, Вагнер Б .; Харт, Джеральд В. (2008-12-05). «Специфичность субстрата О-связанной бета-N-ацетилглюкозаминилтрансферазы регулируется нацеливанием миозинфосфатазы и других взаимодействующих белков». Журнал биологической химии. 283 (49): 33935–33941. Дои:10.1074 / jbc.M806199200. ISSN 0021-9258. ЧВК 2590692. PMID 18840611.
- ^ Ян, X .; Вс, К .; Roos, M.D .; Chang, Q .; Патерсон, А. Дж .; Кудлоу, Дж. Э. (05.06.2001). «О-связывание N-ацетилглюкозамина с доменом активации Sp1 ингибирует его транскрипционную способность». Труды Национальной академии наук Соединенных Штатов Америки. 98 (12): 6611–6616. Bibcode:2001PNAS ... 98.6611Y. Дои:10.1073 / pnas.111099998. ISSN 0027-8424. ЧВК 34401. PMID 11371615.
- ^ Ламар-Винсент, Натан; Хси-Уилсон, Линда К. (2004-06-04). «Динамическое гликозилирование фактора транскрипции CREB: потенциальная роль в регуляции генов» (PDF). Журнал Американского химического общества. 125 (22): 6612–6613. Дои:10.1021 / ja028200t. ISSN 0002-7863. PMID 12769553.
- ^ Rexach, Jessica E .; Кларк, Питер М .; Мейсон, Дэниел Э .; Neve, Rachael L .; Питерс, Эрик С .; Хси-Уилсон, Линда К. (22 января 2012 г.). «Динамическая модификация O-GlcNAc регулирует опосредованную CREB экспрессию генов и формирование памяти». Природа Химическая Биология. 8 (3): 253–261. Дои:10.1038 / nchembio.770. ISSN 1552-4469. ЧВК 3288555. PMID 22267118.
- ^ Toleman, Clifford A .; Шумахер, Мария А .; Ю, Сок-Хо; Цзэн, Вэньцзе; Кокс, Натан Дж .; Смит, Тимоти Дж .; Содерблом, Эрик Дж .; Wands, Amberlyn M .; Колер, Дженнифер Дж .; Бойс, Майкл (2018-06-05). «Структурные основы распознавания O-GlcNAc белками 14-3-3 млекопитающих». Труды Национальной академии наук Соединенных Штатов Америки. 115 (23): 5956–5961. Дои:10.1073 / pnas.1722437115. ISSN 0027-8424. ЧВК 6003352. PMID 29784830.
- ^ Гинес, Селин; Лемуан, Жером; Михальски, Жан-Клод; Лефевр, Тони (18.06.2004). «Белок теплового шока массой 70 кДа обладает регулируемой лектиновой активностью в отношении О-связанного N-ацетилглюкозамина». Сообщения о биохимических и биофизических исследованиях. 319 (1): 21–26. Дои:10.1016 / j.bbrc.2004.04.144. ISSN 0006-291X. PMID 15158436.
- ^ Чжан, Ф; Вс, К; Ян, Х; Боу, ДБ; Патерсон, AJ; Кудлоу, Дж. Э. (12 декабря 2003 г.). «Модификация O-GlcNAc является эндогенным ингибитором протеасомы». Клетка. 115 (6): 715–25. Дои:10.1016 / s0092-8674 (03) 00974-7. PMID 14675536. S2CID 8221476.
- ^ Чжан, Фэнсюэ; Ху, Юн; Хуанг, Пинг; Toleman, Clifford A .; Патерсон, Эндрю Дж .; Кадлоу, Джеффри Э. (2007-08-03). «Функция протеасомы регулируется циклической АМФ-зависимой протеинкиназой посредством фосфорилирования Rpt6». Журнал биологической химии. 282 (31): 22460–22471. Дои:10.1074 / jbc.M702439200. ISSN 0021-9258. PMID 17565987.
- ^ Keembiyehetty, Chithra N .; Кшеслак, Анна; С любовью, Дона С .; Ганновер, Джон А. (2011-08-15). «Изоформа O-GlcNAcase, нацеленная на липидные капли, является ключевым регулятором протеасомы». Журнал клеточной науки. 124 (Pt 16): 2851–2860. Дои:10.1242 / jcs.083287. ISSN 1477-9137. ЧВК 3148132. PMID 21807949.
- ^ Захара, Наташа Е .; О'Доннелл, Найл; Cheung, Win D .; Мерсер, Джессика Дж .; Март, Джейми Д.; Харт, Джеральд В. (2004-07-16). «Динамическая модификация O-GlcNAc ядерно-цитоплазматических белков в ответ на стресс. Ответ выживания клеток млекопитающих». Журнал биологической химии. 279 (29): 30133–30142. Дои:10.1074 / jbc.M403773200. ISSN 0021-9258. PMID 15138254.
- ^ Икбал, Халид; Лю, Фэй; Гун, Чэн-Синь; Грундке-Икбал, Инге (декабрь 2010 г.). "Тау при болезни Альцгеймера и связанных с ней таупатиях". Текущее исследование болезни Альцгеймера. 7 (8): 656–664. Дои:10.2174/156720510793611592. ISSN 1567-2050. ЧВК 3090074. PMID 20678074.
- ^ Арнольд, CS; Johnson, GV; Коул, Р.Н.; Донг, DL; Ли, М; Харт, GW (1996-11-15). «Тау-белок, связанный с микротрубочками, широко модифицирован O-связанным N-ацетилглюкозамином». Журнал биологической химии. 271 (46): 28741–4. Дои:10.1074 / jbc.271.46.28741. PMID 8910513.
- ^ Сандху, Пунам; Ли, Чонхун; Баллард, Жанин; Уокер, Бретань; Эллис, Джоан; Маркус, Джейкоб; Тулан, Рассвет; Дрейер, Дэниел; МакЭвой, Томас; Даффи, Джозеф; Миченер, Мария (июль 2016 г.). «P4-036: Фармакокинетика и фармакодинамика для поддержки клинических исследований MK-8719: ингибитор O-GlcNAcase для прогрессирующего надъядерного паралича». Болезнь Альцгеймера и деменция. 12: P1028. Дои:10.1016 / j.jalz.2016.06.2125. S2CID 54229492.
- ^ Медина, Мигель (2018-04-11). «Обзор клинической разработки препаратов на основе тау-белка». Международный журнал молекулярных наук. 19 (4): 1160. Дои:10.3390 / ijms19041160. ISSN 1422-0067. ЧВК 5979300. PMID 29641484.
- ^ Йи, Вэнь; Кларк, Питер М .; Мейсон, Дэниел Э .; Кинан, Мэри С .; Хилл, Коллин; Годдард, Уильям А .; Питерс, Эрик С .; Дриггерс, Эдвард М .; Хси-Уилсон, Линда К. (24 августа 2012 г.). «Гликозилирование PFK1 является ключевым регулятором роста раковых клеток и центральных метаболических путей». Наука. 337 (6097): 975–980. Дои:10.1126 / science.1222278. ISSN 0036-8075. ЧВК 3534962. PMID 22923583.
- ^ Caldwell, SA; Джексон, SR; Шахриари, Канзас; Линч, Т.П .; Сетхи, G; Уокер, S; Vosseller, K; Регинато, MJ (13 мая 2010 г.). «Датчик питательных веществ O-GlcNAc трансфераза регулирует онкогенез рака молочной железы посредством нацеливания на онкогенный фактор транскрипции FoxM1». Онкоген. 29 (19): 2831–42. Дои:10.1038 / onc.2010.41. PMID 20190804. S2CID 25957261.
- ^ Линч, Т.П .; Феррер, СМ; Джексон, SR; Шахриари, Канзас; Vosseller, K; Регинато, MJ (30 марта 2012 г.). «Критическая роль O-связанной β-N-ацетилглюкозаминтрансферазы в инвазии рака простаты, ангиогенезе и метастазировании». Журнал биологической химии. 287 (14): 11070–81. Дои:10.1074 / jbc.M111.302547. ЧВК 3322861. PMID 22275356.
- ^ Лю, К; Патерсон, AJ; Подбородок, E; Кудлоу, Дж. Э. (14 марта 2000 г.). «Глюкоза стимулирует модификацию белка с помощью O-связанного GlcNAc в бета-клетках поджелудочной железы: связь O-связанного GlcNAc с гибелью бета-клеток». Труды Национальной академии наук Соединенных Штатов Америки. 97 (6): 2820–5. Bibcode:2000PNAS ... 97.2820L. Дои:10.1073 / pnas.97.6.2820. ЧВК 16013. PMID 10717000.
- ^ Патхак, Шалини; Dorfmueller, Helge C .; Бородкин, Владимир С .; ван Аалтен, Даан М.Ф. (2008-08-25). «Химическое рассечение связи между стрептозотоцином, O-GlcNAc и гибелью клеток поджелудочной железы». Химия и биология. 15 (8): 799–807. Дои:10.1016 / j.chembiol.2008.06.010. ISSN 1074-5521. ЧВК 2568864. PMID 18721751.
- ^ а б Vosseller, K; Wells, L; Лейн, Мэриленд; Харт, GW (16 апреля 2002 г.). «Повышенное нуклеоцитоплазматическое гликозилирование с помощью O-GlcNAc приводит к резистентности к инсулину, связанной с дефектами активации Akt в адипоцитах 3T3-L1». Труды Национальной академии наук Соединенных Штатов Америки. 99 (8): 5313–8. Bibcode:2002PNAS ... 99,5313 В. Дои:10.1073 / pnas.072072399. ЧВК 122766. PMID 11959983.
- ^ Ян, Х; Онгусаха, ПП; Майлз, Полицейский; Havstad, JC; Чжан, Ф; Итак, WV; Kudlow, JE; Michell, RH; Олефский, HM; Филд, SJ; Эванс, RM дата = 21 февраля 2008 г. (2008 г.). «Сигнализация фосфоинозитидов связывает трансферазу O-GlcNAc с резистентностью к инсулину». Природа. 451 (7181): 964–9. Bibcode:2008Натура.451..964л. Дои:10.1038 / природа06668. PMID 18288188. S2CID 18459576.
- ^ Уилан, Стивен А .; Лейн, М. Дэниел; Харт, Джеральд В. (2008-08-01). «Регулирование O-связанной β-N-ацетилглюкозаминтрансферазы посредством передачи сигналов инсулина». Журнал биологической химии. 283 (31): 21411–21417. Дои:10.1074 / jbc.M800677200. ISSN 0021-9258. ЧВК 2490780. PMID 18519567.
- ^ Macauley, MS; Бабб, АК; Мартинес-Флейтес, К; Дэвис, GJ; Вокадло, диджей (12 декабря 2008 г.). «Повышение общих уровней O-GlcNAc в адипоцитах 3T3-L1 путем селективного ингибирования O-GlcNAcase не вызывает резистентности к инсулину». Журнал биологической химии. 283 (50): 34687–95. Дои:10.1074 / jbc.M804525200. ЧВК 3259902. PMID 18842583.
- ^ Стефанис, Леонид (февраль 2012 г.). «α-Синуклеин при болезни Паркинсона». Перспективы Колд-Спринг-Харбор в медицине. 2 (2): a009399. Дои:10.1101 / cshperspect.a009399. ISSN 2157-1422. ЧВК 3281589. PMID 22355802.
- ^ «Гликозилирование как ингибитор агрегации альфа-синуклеина». Фонд Майкла Дж. Фокса по исследованию болезни Паркинсона | Болезнь Паркинсона. Получено 2020-06-05.
- ^ Рю, Ин-Хён; До, Су-Иль (29.04.2011). «Денитрозилирование S-нитрозилированного OGT запускается при LPS-стимулированном врожденном иммунном ответе». Сообщения о биохимических и биофизических исследованиях. 408 (1): 52–57. Дои:10.1016 / j.bbrc.2011.03.115. ISSN 1090-2104. PMID 21453677.
- ^ Ван, Цимин; Фанг, Пейнинг; Он, Руи; Ли, Мэнци; Ю, Хайшэн; Чжоу, Ли; Йи, Ю; Ван, Фубинг; Ронг, юань; Чжан, И; Чен, Айдонг (2020-04-15). «O-GlcNAc трансфераза способствует цитокиновому шторму, вызванному вирусом гриппа А, воздействуя на регуляторный фактор 5 интерферона». Достижения науки. 6 (16): eaaz7086. Дои:10.1126 / sciadv.aaz7086. ISSN 2375-2548. ЧВК 7159909. PMID 32494619.
- ^ Каспар, AA; Райхерт, JM (сентябрь 2013 г.). «Будущие направления развития пептидной терапии». Открытие наркотиков сегодня. 18 (17–18): 807–17. Дои:10.1016 / j.drudis.2013.05.011. PMID 23726889.
- ^ Левин, PM; Балана, АТ; Sturchler, E; Куле, К; Нода, Н; Зажицкая, Б; Дейли, EJ; Чыонг, TT; Katritch, V; Гарделла, TJ; Wootten, D; Секстон, PM; Макдональд, П; Пратт, MR (2019-09-11). «Разработка O-GlcNAc пептидных агонистов GPCR улучшает их стабильность и активность in vivo». Журнал Американского химического общества. 141 (36): 14210–14219. Дои:10.1021 / jacs.9b05365. ЧВК 6860926. PMID 31418572.
дальнейшее чтение
- Захара, Наташа; Акимото, Ёсихиро; Харт, Джеральд В. (2015), Варки, Аджит; Каммингс, Ричард Д .; Эско, Джеффри Д.; Стэнли, Памела (ред.) "Модификация O-GlcNAc ", Основы гликобиологии (3-е изд.), Cold Spring Harbor Laboratory Press, PMID 28876858.
