CREB - CREB - Wikipedia
CREB-TF (CREB, белок, связывающий элемент ответа цАМФ)[1] это сотовый фактор транскрипции. Он привязан к определенным ДНК последовательности, называемые элементами ответа цАМФ (CRE), тем самым увеличивая или уменьшая транскрипция из гены.[2] CREB был впервые описан в 1987 году как лагерь -ответственный фактор транскрипции, регулирующий соматостатин ген.[3]
Гены, транскрипция которых регулируется CREB, включают: c-fos, BDNF, тирозингидроксилаза, многочисленные нейропептиды (Такие как соматостатин, энкефалин, VGF, кортикотропин-рилизинг гормон ),[2] и гены, участвующие в млекопитающих циркадные часы (PER1, PER2 ).[4]
CREB по структуре и функциям тесно связан с CREM (модулятор ответного элемента цАМФ ) и ATF-1 (активирующий фактор транскрипции-1 ) белки. Белки CREB экспрессируются у многих животных, включая человека.
CREB играет хорошо задокументированную роль в нейрональная пластичность и Долгосрочная память образование в головном мозге, и было показано, что он является неотъемлемой частью образования пространственная память.[5] Подавление CREB связано с патологией Болезнь Альцгеймера и повышение экспрессии CREB рассматривается как возможная терапевтическая мишень для болезни Альцгеймера.[6] CREB также играет роль в фотообучение у млекопитающих.
Подтипы
Следующие гены кодируют CREB или CREB-подобные белки:
- CREB1 (CREB1 )
- CREB2 переименован ATF4 (ATF4 )
- CREB3 (CREB3 )
- CREB5 (CREB5 )
- CREB3L1 (CREB3L1 )
- CREB3L2 (CREB3L2 )
- CREB3L3 (CREB3L3 )
- CREB3L4 (CREB3L4 )
Структура

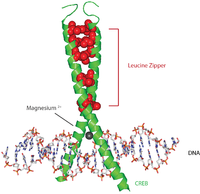
Белки CREB активируются фосфорилированием различных киназ, в том числе PKA, и Ca2+/ кальмодулин-зависимые протеинкиназы от остатка серина 133.[7] При активации белок CREB привлекает другие коактиваторы транскрипции для связывания с 5 ’вышележащей областью промотора CRE. Гидрофобные аминокислоты лейцина расположены вдоль внутреннего края альфа-спирали. Эти остатки лейцина прочно связываются с остатками лейцина другого белка CREB, образуя димер. Эта цепочка остатков лейцина образует мотив лейциновой молнии. Белок также имеет ион магния, который облегчает связывание с ДНК.
элемент ответа cAMP
В элемент ответа cAMP (CRE) - это элемент ответа для CREB, который содержит высококонсервативную нуклеотидную последовательность 5'-TGACGTCA-3 ’. Сайты CRE обычно находятся выше генов в пределах промоутер или же усилитель регионы.[8] В геноме человека насчитывается около 750 000 палиндромных и полусайтовых CRE. Однако большинство этих сайтов остаются несвязанными из-за цитозина. метилирование, который физически препятствует связыванию белков.[9]
Механизм действия
Типичная (хотя и несколько упрощенная) последовательность событий выглядит следующим образом: сигнал, поступающий на поверхность клетки, активирует соответствующий рецептор, что приводит к выработке второй посланник такие как цАМФ или Ca2+, что, в свою очередь, активирует протеинкиназа. Эта протеинкиназа перемещается в ядро клетки, где он активирует белок CREB. Активированный белок CREB затем связывается с областью CRE, а затем связывается с CBP (CREB-связывающий белок), который коактивирует его, позволяя включать или выключать определенные гены. Связывание ДНК CREB опосредуется его основным доменом лейциновой молнии (bZIP домен ), как показано на изображении.
Функция в мозге
CREB выполняет множество функций во многих различных органах, и некоторые из его функций были изучены применительно к мозгу.[10] CREB белки в нейроны считается, что они участвуют в формировании долговременных воспоминаний;[11] это было показано на примере морской улитки Аплизия плодовая муха Drosophila melanogaster, в крысы и у мышей (см. CREB в молекулярном и клеточном познании ).[1] CREB необходим на поздней стадии долгосрочное потенцирование. CREB также играет важную роль в развитии наркотическая зависимость и тем более в психологическая зависимость.[12][13][14] Различают активаторную и репрессорную формы CREB. Мухи, генетически модифицированные для сверхэкспрессии неактивной формы CREB, теряют способность сохранять долговременную память. CREB также важен для выживания нейронов, как показано на генно-инженерных мышах, у которых CREB и CREM были удалены в головном мозге. Если CREB теряется во всем развивающемся эмбрионе мыши, мыши умирают сразу после рождения, что еще раз подчеркивает критическую роль CREB в обеспечении выживания нейронов.
Связь с заболеванием
Нарушение функции CREB в головном мозге может способствовать развитию и прогрессированию болезнь Хантингтона.
Нарушения белка, который взаимодействует с доменом KID CREB, CREB-связывающий белок, (CBP) связан с Синдром Рубинштейна-Тайби.
Есть некоторые свидетельства того, что недостаточное функционирование CREB связано с сильное депрессивное расстройство.[15] Депрессивные крысы со сверхэкспрессией CREB в зубчатые извилины вели себя так же, как крысы, получавшие антидепрессанты.[16] Посмертные исследования также показали, что кора пациентов с нелеченым большим депрессивным расстройством содержит более низкие концентрации CREB по сравнению как со здоровыми людьми из контрольной группы, так и с пациентами, получавшими антидепрессанты.[16] Функция CREB может модулироваться сигнальным путем, возникающим в результате связывания серотонин и норадреналин к постсинаптическим рецепторам, связанным с G-белком. Дисфункция этих нейротрансмиттеров также связана с большим депрессивным расстройством.[15]
Считается также, что CREB участвует в развитии некоторых видов рака.
Участие в циркадных ритмах
Увлечение циркадных часов млекопитающих устанавливается с помощью световой индукции PER. Свет возбуждает меланопсин-содержащий светочувствительные ганглиозные клетки сетчатки которые сигнализируют супрахиазматическое ядро (SCN) через ретиногипоталамический тракт (RHT). Возбуждение RHT сигнализирует о высвобождении глутамата, который принимается Рецепторы NMDA на SCN, что приводит к притоку кальция в SCN. Кальций вызывает активность Са2+/кальмодулин-зависимые протеинкиназы, что приводит к активации PKA, PKC, и CK2.[17] Эти киназы затем фосфорилируют CREB циркадным образом, что дополнительно регулирует экспрессию нижележащих генов.[18] Фосфорилированный CREB распознает элемент ответа цАМФ и служит фактором транскрипции для Per1 и Per2, два гена, которые регулируют циркадные часы млекопитающих. Эта индукция белка PER может вовлекать циркадные часы в циклы свет / темнота, подавляя собственную транскрипцию через петлю обратной связи транскрипции-трансляции, которая может опережать или задерживать циркадные часы. Однако реакция индукции белков PER1 и PER2 значима только в течение субъективной ночи.[4]
Открытие участия CREB в циркадных ритмах
Майкл Гринберг впервые продемонстрировали роль CREB в циркадных часах млекопитающих в 1993 году с помощью серии экспериментов, которые коррелировали фазовые световые импульсы с фосфорилированием CREB. In vitro свет в течение субъективной ночи увеличивал фосфорилирование CREB, а не уровни белка CREB. In vivo, световые импульсы, вызывающие фазовый сдвиг в течение субъективной ночи, коррелировали с фосфорилированием CREB в SCN.[19] Эксперименты Гюнтера Шутца в 2002 году продемонстрировали, что мутантные мыши, лишенные сайта фосфорилирования Ser142, не могут индуцировать регуляторный ген часов mPer1 в ответ на световой импульс. Более того, у этих мутантных мышей были трудности с переходом на светлый-темный цикл.[20]
Смотрите также
Рекомендации
- ^ а б Бурчуладзе; и другие. (1994). «Недостаточная долговременная память у мышей с целевой мутацией цАМФ-зависимого белка, связывающего элемент». Клетка. 79 (1): 59–68. Дои:10.1016/0092-8674(94)90400-6. PMID 7923378. S2CID 17250247.
- ^ а б Первес, Дейл; Джордж Дж. Августин; Дэвид Фицпатрик; Уильям К. Холл; Энтони-Самуэль Ламантия; Джеймс О. Макнамара и Леонард Э. Уайт (2008). Неврология (4-е изд.). Sinauer Associates. С. 170–6. ISBN 978-0-87893-697-7.
- ^ Montminy, MR; Билезикджян, LM (1987). «Связывание ядерного белка с элементом ответа на циклический AMP гена соматостатина». Природа. 328 (6126): 175–178. Bibcode:1987Натура.328..175М. Дои:10.1038 / 328175a0. PMID 2885756. S2CID 4345292.
- ^ а б Дибнер, Чарна; Шиблер, Ули; Альбрехт, Урс (2010). «Циркадная система хронометража млекопитающих: организация и координация центральных и периферийных часов» (PDF). Ежегодный обзор физиологии. 72 (1): 517–549. Дои:10.1146 / annurev-physicol-021909-135821. PMID 20148687.
- ^ Сильва; и другие. (1998). «КРЕБ и Память» (PDF). Ежегодный обзор нейробиологии. 21: 127–148. Дои:10.1146 / annurev.neuro.21.1.127. PMID 9530494. Архивировано из оригинал (PDF) 28 августа 2008 г.. Получено 22 января 2010.
- ^ Подавление экспрессии CREB в мозге Альцгеймера и в нейронах гиппокампа крыс, обработанных антителами
- ^ Шайвиц, Адам Дж .; Гринберг, Майкл Э. (1999). «CREB: индуцированный стимулом фактор транскрипции, активируемый разнообразным массивом внеклеточных сигналов». Ежегодный обзор биохимии. 68 (1): 821–861. Дои:10.1146 / annurev.biochem.68.1.821. PMID 10872467.
- ^ Карлезон, Вашингтон; Думан, РС; Нестлер, EJ (август 2005 г.). «Многоликая CREB». Тенденции в неврологии. 28 (8): 436–445. Дои:10.1016 / j.tins.2005.06.005. PMID 15982754. S2CID 6480593.
- ^ Altarejos, Judith Y .; Монмини, Марк (март 2011). «Коактиваторы CREB и CRTC: датчики гормональных и метаболических сигналов». Обзоры природы Молекулярная клеточная биология. 12 (3): 141–151. Дои:10.1038 / nrm3072. ISSN 1471-0072. ЧВК 4324555. PMID 21346730.
- ^ Карлезон В.А., Думан Р.С., Нестлер Э.Дж. (август 2005 г.). «Многоликая CREB». Тенденции в неврологии. 28 (8): 436–45. Дои:10.1016 / j.tins.2005.06.005. PMID 15982754. S2CID 6480593.
- ^ Кандел, Эрик Р. (14 мая 2012 г.). «Молекулярная биология памяти: цАМФ, PKA, CRE, CREB-1, CREB-2 и CPEB». Молекулярный мозг. 5: 14. Дои:10.1186/1756-6606-5-14. ISSN 1756-6606. ЧВК 3514210. PMID 22583753.
- ^ Назарян А., Сун В.Л., Чжоу Л., Кемен Л.М., Дженаб С., Хинонес-Дженаб В. (апрель 2009 г.). «Половые различия в базальных и кокаин-индуцированных изменениях белков PKA и CREB в прилежащем ядре». Психофармакология. 203 (3): 641–50. Дои:10.1007 / s00213-008-1411-5. PMID 19052730. S2CID 24064950.
- ^ Ван И, Геззи А., Инь Дж. К., Аткинсон Н. С. (июнь 2009 г.). «CREB-регуляция экспрессии гена BK-канала лежит в основе быстрой устойчивости к лекарствам». Гены, мозг и поведение. 8 (4): 369–76. Дои:10.1111 / j.1601-183X.2009.00479.x. ЧВК 2796570. PMID 19243452.
- ^ ДиРокко Д.П., Шайнер З.С., Синдреу CB, Чан Г.С., Сторм DR (февраль 2009 г.). «Роль аденилатциклаз, стимулируемых кальмодулином, в сенсибилизации кокаина». Журнал неврологии. 29 (8): 2393–403. Дои:10.1523 / JNEUROSCI.4356-08.2009. ЧВК 2678191. PMID 19244515.
- ^ а б Belmaker, R.H .; Агам, Галила (2008). "Сильное депрессивное расстройство". Медицинский журнал Новой Англии. 358 (1): 55–68. Дои:10.1056 / nejmra073096. PMID 18172175.
- ^ а б Бленди, Дж. А. (2006). «Роль CREB в лечении депрессии и антидепрессантами». Биологическая психиатрия. 59 (12): 1144–50. Дои:10.1016 / j.biopsych.2005.11.003. PMID 16457782. S2CID 20918484.
- ^ Айер, Раджашекар; Ван, Тунфэй; Жилетт, Марта (19 сентября 2014 г.). «Циркадный стробирование нейронных функций: основа итеративной метапластичности». Границы системной нейробиологии. 8: 164. Дои:10.3389 / fnsys.2014.00164. ЧВК 4168688. PMID 25285070.
- ^ Обриетан, Карл; Импи, Сорен; Смит, Дэйв; Афон, Хайме; Сторм, Деррик Р. (11 апреля 2002 г.). «Циркадная регуляция экспрессии генов, опосредованной элементом ответа цАМФ, в супрахиазматических ядрах». Нейрон. 274 (25): 17748–17756. Дои:10.1074 / jbc.274.25.17748. PMID 10364217.
- ^ Ginty, D. D .; Корнхаузер, Дж. М .; Томпсон, М. А .; Bading, H .; Mayo, K. E .; Takahashi, J. S .; Гринберг, М. Э. (9 апреля 1993 г.). «Регулирование фосфорилирования CREB в супрахиазматическом ядре светом и циркадными часами». Наука. 260 (5105): 238–241. Bibcode:1993Наука ... 260..238Г. Дои:10.1126 / science.8097062. ISSN 0036-8075. PMID 8097062.
- ^ Гау, Даниэль; Лембергер, Томас; фон Галл, Шарлотта; Кретц, Оливер; Ле Мин, Нгует; Гасс, Питер; Шмид, Вольфганг; Шиблер, Ули; Корф, Хорст В. (11 апреля 2002 г.). «Фосфорилирование CREB Ser142 регулирует индуцированные светом фазовые сдвиги циркадных часов». Нейрон. 34 (2): 245–253. Дои:10.1016 / S0896-6273 (02) 00656-6. PMID 11970866. S2CID 14507897.
- Библиография
- Лорен Слейтер (2005). Открытие ящика Скиннера: великие психологические эксперименты двадцатого века. Нью-Йорк: W. W. Norton & Company. ISBN 978-0-393-32655-0.
- Барко А., Бейли С., Кандел Е. (2006). «Общие молекулярные механизмы в явной и неявной памяти». J. Neurochem. 97 (6): 1520–33. Дои:10.1111 / j.1471-4159.2006.03870.x. PMID 16805766.
- Конкрайт М., Монтмини М. (2005). "CREB: неустановленный сообщник рака". Тенденции Cell Biol. 15 (9): 457–9. Дои:10.1016 / j.tcb.2005.07.007. PMID 16084096.
- Mantamadiotis T, Lemberger T, Bleckmann S, Kern H, Kretz O, Martin Villalba A, Tronche F, Kellendonk C, Gau D, Kapfhammer J, Otto C, Schmid W., Schütz G (2002). «Нарушение функции CREB в головном мозге приводит к нейродегенерации». Nat. Genet. 31 (1): 47–54. Дои:10,1038 / ng882. PMID 11967539. S2CID 22014116.
- Майр Б., Монтмини М. (2001). «Регуляция транскрипции зависимым от фосфорилирования фактором CREB». Nat. Преподобный Мол. Cell Biol. 2 (8): 599–609. Дои:10.1038/35085068. PMID 11483993. S2CID 1056720.
- Инь Дж, Дель Веккио М, Чжоу Х, Талли Т. (1995). «CREB как модулятор памяти: индуцированная экспрессия изоформы активатора dCREB2 усиливает долговременную память у дрозофилы». Клетка. 81 (1): 107–15. Дои:10.1016/0092-8674(95)90375-5. PMID 7720066. S2CID 15863948.
- Инь Дж., Уоллах Дж., Дель Веккио М., Уайлдер Э., Чжоу Х., Куинн В., Талли Т. (1994). «Индукция доминантно-отрицательного трансгена CREB специфически блокирует долговременную память у дрозофилы». Клетка. 79 (1): 49–58. Дои:10.1016/0092-8674(94)90399-9. PMID 7923376. S2CID 33623585.
внешняя ссылка
- http://www.ebi.ac.uk/interpro/entry/IPR001630
- Йоханнесен, М., Педерсен Дельганди, М., Моэнс, У. (2004 г.) - Что включает CREB? - сотовый сигнал .; 10: 1211-1227. https://web.archive.org/web/20070928090058/http://www.sigtrans.org/publications/what-turns-creb-on/
- https://web.archive.org/web/20060902183214/http://focus.hms.harvard.edu//2001/Oct26_2001/neuroscience.html
- CREB + протеин в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Дрозофила Циклический AMP-ответный элемент связывающий белок A - Интерактивная муха
- Дрозофила Элемент ответа циклического АМФ, связывающий белок B в точке 17A - Интерактивная муха
