CBS домен - CBS domain
| CBS домен | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
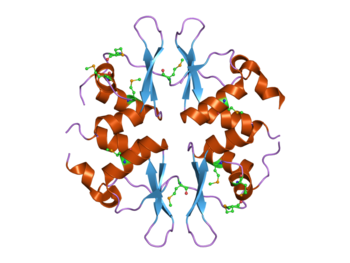 Структура дрожжевого белка SNF4, содержащего четыре домена CBS.[1] Этот белок является частью комплекса AMP-активируемой протеинкиназы (AMPK). | |||||||||||
| Идентификаторы | |||||||||||
| Символ | CBS | ||||||||||
| Pfam | PF00571 | ||||||||||
| ИнтерПро | IPR000644 | ||||||||||
| УМНАЯ | CBS | ||||||||||
| PROSITE | PS51371 | ||||||||||
| SCOP2 | 1zfj / Объем / СУПФАМ | ||||||||||
| CDD | cd02205 | ||||||||||
| |||||||||||
В молекулярной биологии CBS домен это белковый домен обнаружен в ряде белков у всех видов, от бактерий до человека. Впервые он был идентифицирован как консервативная последовательность области в 1997 году и назван в честь цистатионин бета-синтаза, один из белков, в котором он содержится.[2] Домены CBS также обнаруживаются в большом количестве других белков, таких как инозинмонофосфатдегидрогеназа,[3] управляемые по напряжению хлоридные каналы[4][5][6][7][8] и АМФ-активированная протеинкиназа (АМПК).[9][10] Домены CBS регулируют активность ассоциированных ферментативных доменов и доменов-транспортеров в ответ на связывание молекул с аденозильными группами, такими как AMP и АТФ, или же s-аденозилметионин.[11]
Структура
Домен CBS состоит из бета-альфа-бета-бета-альфа вторичная структура шаблон, который сложенный в шаровидный третичная структура который содержит трехцепочечный антипараллельный β-лист с двумя α-спирали с одной стороны. Домены CBS всегда находятся парами в белковых последовательностях, и каждая пара этих доменов тесно связана в псевдодимерном расположении через свои β-листы, образуя так называемую CBS-пару или Бейтман домен.[12][13] Эти пары доменов CBS могут связываться друг с другом (т.е. коды PDB 3KPC, 1ПВМ, 2OOX) Или по прямой (т.е. коды PDB 1O50, 1ПБЖ) Образуют дискообразную компактную структуру. Таким образом, они образуют щели, которые составляют канонические области связывания лиганда.[14][15][16][17][18] В принципе, количество канонических сайтов связывания соответствует количеству CBS-доменов в молекуле и традиционно нумеруются в соответствии с CBS-доменом, который содержит каждый из консервативных остатков аспартата, которые потенциально взаимодействуют с рибозой нуклеотидов.[19] Однако не все эти полости могут обязательно связывать нуклеотиды или быть функциональными. Недавно неканонический сайт для AMP был также описан в белке MJ1225 из М. jannaschii, хотя его функциональная роль пока неизвестна.[20]

Связывание лиганда
Было показано, что домены CBS связываются с аденозильными группами в таких молекулах, как AMP и АТФ,[11] или s-аденозилметионин,[21] но они также могут связывать ионы металлов, такие как Mg2+.[22][23] Связывая эти разные лиганды, домены CBS регулируют активность ассоциированных ферментативных доменов.[24] Молекулярные механизмы, лежащие в основе этой регуляции, только начинают выясняться.[16][17][21][22][25] На данный момент предложены два разных типа механизмов. Первый утверждает, что нуклеотидная часть лиганда практически не вызывает изменений в структуре белка, т.е. электростатический потенциал в сайте связывания является наиболее важным свойством связывания аденозиновых нуклеотидов.[17][26] Этот «статический» отклик будет задействован в процессах, в которых регулирование энергетическим зарядом было бы выгодным.[17][26] Напротив, второй тип механизма (обозначаемый как «динамический») включает драматические конформационные изменения в структуре белка при связывании лиганда, и сообщалось о цитозольном домене Mg2+ транспортер MgtE из Термус термофильный,[22] неизвестная функция белка MJ0100 из М. jannaschii [21][27] и регуляторный регион Clostridium perfringens пирофосфатаза.[28]
Связанные домены
Домены CBS часто встречаются в белках, содержащих другие домены. Эти домены обычно ферментативный, мембранные транспортеры или ДНК-связывающие домены. Однако также часто встречаются белки, содержащие только домены CBS, особенно у прокариот. Эти автономные белки домена CBS могут образовывать комплексы при связывании с другими белками, такими как киназы, с которыми они взаимодействуют и регулируют.

Мутации, ведущие к болезни
Мутации в некоторых белках, содержащих домен CBS человека, приводят к генетическим заболеваниям.[3] Например, мутации в цистатионин-бета-синтаза белок приводит к наследственному нарушению обмена веществ, которое называется гомоцистинурия (OMIM: 236200 ).[29] Было показано, что мутации в гамма-субъединице фермента AMPK приводят к семейной гипертрофическая кардиомиопатия с Синдром Вольфа-Паркинсона-Уайта (OMIM: 600858 ). Мутации в доменах CBS фермента IMPDH приводят к состоянию глаз пигментный ретинит (OMIM: 180105 ).
У людей есть несколько ограниченных напряжением хлоридный канал гены и мутации в доменах CBS некоторых из них были идентифицированы как причина генетических заболеваний. Мутации в CLCN1 привести к миотония (OMIM: 160800 ),[30] мутации в CLCN2 может привести к идиопатическая генерализованная эпилепсия (OMIM: 600699 ), мутации в CLCN5 может привести к Болезнь Дента (OMIM: 300009 ), мутации в CLCN7 может привести к остеопетроз (OMIM: 259700 ),[31] и мутации в CLCNKB может привести к Синдром Барттера (OMIM: 241200 ).
Рекомендации
- ^ PDB: 2-е; Рудольф М.Дж., Амодео Г.А., Ирам С.Х., Хонг С.П., Пирино Дж., Карлсон М., Тонг Л. (январь 2007 г.). «Структура домена Bateman2 дрожжевого Snf4: димерная ассоциация и актуальность для связывания AMP». Структура. 15 (1): 65–74. Дои:10.1016 / j.str.2006.11.014. PMID 17223533.
- ^ Бейтман А. (январь 1997 г.). «Структура домена, общего для архебактерий и белка болезни гомоцистинурии». Trends Biochem. Наука. 22 (1): 12–3. Дои:10.1016 / S0968-0004 (96) 30046-7. PMID 9020585.
- ^ а б Игноул С., Эггермонт Дж. (Декабрь 2005 г.). «Домены CBS: структура, функция и патология белков человека». Являюсь. J. Physiol., Cell Physiol.. 289 (6): C1369–78. Дои:10.1152 / ajpcell.00282.2005. PMID 16275737.
- ^ Ponting CP (март 1997 г.). «Домены CBS в хлоридных каналах CIC, вовлеченные в миотонию и нефролитиаз (камни в почках)». J. Mol. Med. 75 (3): 160–3. PMID 9106071.
- ^ Мейер С., Дутцлер Р. (февраль 2006 г.). «Кристаллическая структура цитоплазматического домена хлоридного канала ClC-0». Структура. 14 (2): 299–307. Дои:10.1016 / j.str.2005.10.008. PMID 16472749.
- ^ Юсеф Ю. Р., Суньига Л., Каталон М., Нимейер М. И., Сид LP, Сепульведа Ф. В. (апрель 2006 г.). «Удаление стробирования в потенциал-зависимом хлоридном канале ClC-2 посредством точечных мутаций, затрагивающих поры и C-концевой домен CBS-2». J. Physiol. 572 (Pt 1): 173–81. Дои:10.1113 / jphysiol.2005.102392. ЧВК 1779660. PMID 16469788.
- ^ Маркович С., Дутцлер Р. (июнь 2007 г.). «Структура цитоплазматического домена хлоридного канала ClC-Ka выявляет консервативный интерфейс взаимодействия». Структура. 15 (6): 715–25. Дои:10.1016 / j.str.2007.04.013. PMID 17562318.
- ^ Мейер С., Савареси С., Форстер И.К., Дутцлер Р. (январь 2007 г.). «Распознавание нуклеотидов цитоплазматическим доменом человеческого хлоридного переносчика ClC-5». Nat. Struct. Мол. Биол. 14 (1): 60–7. Дои:10.1038 / nsmb1188. PMID 17195847. S2CID 20733119.
- ^ День П, Шарфф А., Парра Л. и др. (Май 2007 г.). «Структура пары CBS-домен из регуляторной субъединицы гамма1 человеческого AMPK в комплексе с AMP и ZMP». Acta Crystallogr. D. 63 (Pt 5): 587–96. Дои:10.1107 / S0907444907009110. PMID 17452784.
- ^ Рудольф М.Дж., Амодео Г.А., Ирам С.Х. и др. (Январь 2007 г.). «Структура домена Bateman2 дрожжевого Snf4: димерная ассоциация и актуальность для связывания AMP». Структура. 15 (1): 65–74. Дои:10.1016 / j.str.2006.11.014. PMID 17223533.
- ^ а б Кемп Б.Е. (январь 2004 г.). «Домены Бейтмана и производные аденозина образуют обязывающий договор». J. Clin. Вкладывать деньги. 113 (2): 182–4. Дои:10.1172 / JCI20846. ЧВК 311445. PMID 14722609.
- ^ Кемп Б.Е. (январь 2004 г.). «Домены Бейтмана и производные аденозина образуют обязывающий договор». J. Clin. Вкладывать деньги. 113 (2): 182–4. Дои:10.1172 / JCI20846. ЧВК 311445. PMID 14722609.
- ^ Чжан Р., Эванс Дж., Ротелла Ф. Дж., Уэстбрук Е. М., Бено Д., Хуберман Е., Иоахимиак А., Колларт Ф. Р. (апрель 1999 г.). «Характеристики и кристаллическая структура бактериальной инозин-5'-монофосфатдегидрогеназы». Биохимия. 38 (15): 4691–700. CiteSeerX 10.1.1.488.2542. Дои:10.1021 / bi982858v. PMID 10200156.
- ^ Рудольф М.Дж., Амодео Г.А., Ирам С.Х., Хонг С.П., Пирино Дж., Карлсон М., Тонг Л. (январь 2007 г.). «Структура домена Bateman2 дрожжевого Snf4: димерная ассоциация и актуальность для связывания AMP». Структура. 15 (1): 65–74. Дои:10.1016 / j.str.2006.11.014. PMID 17223533.
- ^ Мейер С., Савареси С., Форстер И.К., Дутцлер Р. (январь 2007 г.). «Распознавание нуклеотидов цитоплазматическим доменом человеческого хлоридного транспортера ClC-5». Nat. Struct. Мол. Биол. 14 (1): 60–7. Дои:10.1038 / nsmb1188. PMID 17195847. S2CID 20733119.
- ^ а б Амодео Г.А., Рудольф М.Дж., Тонг Л. (сентябрь 2007 г.). «Кристаллическая структура гетеротримерного ядра Saccharomyces cerevisiae, гомолога AMPK SNF1». Природа. 449 (7161): 492–5. Дои:10.1038 / природа06127. PMID 17851534. S2CID 4342092.
- ^ а б c d Таунли Р., Шапиро Л. (март 2007 г.). «Кристаллические структуры аденилатного сенсора из AMP-активированной протеинкиназы делящихся дрожжей». Наука. 315 (5819): 1726–9. Дои:10.1126 / science.1137503. PMID 17289942. S2CID 38983201.
- ^ Джин Икс, Таунли Р., Шапиро Л. (октябрь 2007 г.). «Структурное понимание регулирования AMPK: в игру вступает ADP». Структура. 15 (10): 1285–95. Дои:10.1016 / j.str.2007.07.017. PMID 17937917.
- ^ Кемп Б. Е., Окхилл Дж. С., Скотт Дж. В. (октябрь 2007 г.). «Структура и регулировка АМПК с трех сторон». Структура. 15 (10): 1161–3. Дои:10.1016 / j.str.2007.09.006. PMID 17937905.
- ^ Гомес-Гарсия I, Ойенарте I, Мартинес-Крус, Лос-Анджелес (май 2010 г.). «Кристаллическая структура белка MJ1225 из Methanocaldococcus jannaschii демонстрирует сильную сохранность ключевых структурных особенностей, наблюдаемых в эукариальном гамма-AMPK». Дж Мол Биол. 399 (1): 53–70. Дои:10.1016 / j.jmb.2010.03.045. PMID 20382158.
- ^ а б c Лукас М., Энсинар Дж. А., Аррибас Е. А., Ойенарте И., Гарсия И. Г., Кортасар Д., Фернандес Дж. А., Мато Дж. М., Мартинес-Чантар М.Л., Мартинес-Крус, Лос-Анджелес (февраль 2010 г.). «Связывание S-метил-5'-тиоаденозина и S-аденозил-L-метионина с белком MJ0100 запускает конформационное изменение« открыто-закрыто »в его паре мотивов CBS». J. Mol. Биол. 396 (3): 800–20. Дои:10.1016 / j.jmb.2009.12.012. PMID 20026078.
- ^ а б c Иситани Р., Сугита Ю., Дохмае Н., Фуруя Н., Хаттори М., Нуреки О. (октябрь 2008 г.). «Mg2 + -чувствительный механизм транспортера Mg2 + MgtE исследован с помощью молекулярно-динамических исследований». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 105 (40): 15393–8. Дои:10.1073 / pnas.0802991105. ЧВК 2563093. PMID 18832160.
- ^ Хаттори М., Нуреки О. (март 2008 г.). «[Структурная основа механизма гомеостаза Mg2 транспортером MgtE]». Танпакушицу Какусан Косо (на японском языке). 53 (3): 242–8. PMID 18326297.
- ^ Скотт Дж. У., Хоули С. А., Грин К. А. и др. (Январь 2004 г.). «Домены CBS образуют энергочувствительные модули, связывание аденозиновых лигандов которых нарушается мутациями болезни». J. Clin. Вкладывать деньги. 113 (2): 274–84. Дои:10.1172 / JCI19874. ЧВК 311435. PMID 14722619.
- ^ Туоминен Х., Салминен А., Оксанен Э., Ямсен Дж., Хейккиля О, Лехтио Л., Магретова Н. Н., Гольдман А., Байков А. А., Лахти Р. (май 2010 г.). «Кристаллические структуры доменов CBS и DRTGG регуляторной области пирофосфатазы Clostridiumperfringens в комплексе с ингибитором АМФ и активатором диаденозинтетрафосфатом». J. Mol. Биол. 398 (3): 400–13. Дои:10.1016 / j.jmb.2010.03.019. PMID 20303981.
- ^ а б Сяо Б., Хит Р., Сайу П., Лейпер ФК, Леоне П., Цзин С., Уокер П.А., Хайр Л., Экклестон Дж. Ф., Дэвис К. Т., Мартин С. Р., Карлинг Д., Гамблин С. Дж. (Сентябрь 2007 г.). «Структурная основа связывания AMP с AMP-активированной протеинкиназой млекопитающих». Природа. 449 (7161): 496–500. Дои:10.1038 / природа06161. PMID 17851531. S2CID 4345919.
- ^ Лукас М., Кортазар Д., Астигаррага Э. и др. (Октябрь 2008 г.). «Очистка, кристаллизация и предварительный рентгеноструктурный анализ пары CBS-доменов из белка MJ0100 Methanococcus jannaschii». Acta Crystallographica Раздел F. 64 (Pt 10): 936–41. Дои:10.1107 / S1744309108027930. ЧВК 2564890. PMID 18931440.
- ^ Туоминен Х., Салминен А., Оксанен Э. и др. (Май 2010 г.). "Кристаллические структуры доменов CBS и DRTGG регуляторной области Clostridium perfringens пирофосфатазы в комплексе с ингибитором, AMP и активатором, диаденозинтетрафосфатом". Дж Мол Биол. 398 (3): 400–413. Дои:10.1016 / j.jmb.2010.03.019. PMID 20303981.
- ^ Шан X, Данбрак Р.Л., Кристофер С.А., Крюгер В.Д. (март 2001 г.). «Мутации в регуляторном домене цистатионин-бета-синтазы могут функционально подавлять мутации цистатионин-бета-синтазы, происходящие от пациентов». Гм. Мол. Genet. 10 (6): 635–43. Дои:10,1093 / чмг / 10,6,635. PMID 11230183.
- ^ Пущ М. (апрель 2002 г.). «Миотония, вызванная мутациями гена мышечного хлоридного канала CLCN1». Гм. Мутат. 19 (4): 423–34. Дои:10.1002 / humu.10063. PMID 11933197.
- ^ Cleiren E, Bénichou O, Van Hul E, et al. (Декабрь 2001 г.). «Болезнь Альберса-Шёнберга (аутосомно-доминантный остеопетроз, тип II) возникает в результате мутаций в гене хлоридного канала ClCN7». Гм. Мол. Genet. 10 (25): 2861–7. Дои:10.1093 / hmg / 10.25.2861. PMID 11741829.
