Домен эффектора смерти - Death effector domain
| Домен эффектора смерти | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
 структура FADD (Mort1) эффекторного домена смерти.[1] | |||||||||||
| Идентификаторы | |||||||||||
| Символ | DED | ||||||||||
| Pfam | PF01335 | ||||||||||
| ИнтерПро | IPR001875 | ||||||||||
| УМНАЯ | DED | ||||||||||
| PROSITE | PS50168 | ||||||||||
| SCOP2 | 1a1z / Объем / СУПФАМ | ||||||||||
| CDD | cd00045 | ||||||||||
| |||||||||||
В смертельный эффекторный домен (DED) представляет собой домен взаимодействия с белками, обнаруживаемый только у эукариот, который регулирует множество клеточных сигнальных путей.[2] Домен DED находится в неактивном состоянии. Procaspases (цистеиновые протеазы ) и белки, которые регулируют активацию каспаз в каскаде апоптоза, такие как FAS-ассоциированный белок, содержащий домен смерти (FADD ). FADD рекрутирует прокаспазу 8 и прокаспазу 10 в индуцированный смертью сигнальный комплекс (DISC). Этот набор опосредуется гомотипическим взаимодействием между прокаспазой DED и вторым DED, который является эффекторным доменом смерти в адаптерный белок который напрямую связан с активированными рецепторами TNF. Образование комплекса позволяет протеолитической активации прокаспазы в активную форму каспазы, что приводит к инициированию апоптоз (смерть клетки). Структурно домен DED является подклассом белковых мотивов, известных как загон смерти и содержит 6 альфа-спиралей, которые очень напоминают структуру Домен смерти (ДД).
Структура

DED является подсемейством суперсемейства DD (другие распознаваемые домены в этом суперсемействе: домен caspase-recruitment (CARD), пириновый домен (PYD) и домен смерти (DD)). Подсемейства структурно похожи друг на друга, все они (и DED в частности) состоят из пучка из 6 альфа-спиралей, но расходятся по поверхностным особенностям.
Полный первичная структура этого белкового домена не было определено согласованно. В некоторых исследованиях описаны остатки 2-184, но остатки С-конца и N-конца еще не идентифицированы. Присутствие аминокислот, определяющих растворимость и агрегацию DED, позволило идентифицировать DED в различных белках, таких как каспаза-8 и MC159. В вторичный структура Домена, как сказано, построено 6 альфа-спиралями.
В третичная структура домена был описан с кристаллизация из каспаза 8 в человеке. Для описания структуры использовалась дифракция рентгеновских лучей с полученным разрешением 2,2 Å.[3] DED в этом белке показывают асимметричную единицу димер, с его интерфейсом содержит две сети водородных связей, которые выглядят как нитевидная структура. Функция ED определяется его структурой. Насколько известно, гомотипические взаимодействия, которые активируют каспазу и запускают апоптоз, опосредуются асимметричными поверхностными контактами между партнерами (как DED1 и DED2 в случае каспазы-8).[4] Остатки, которые образуют поверхности, обычно представляют собой заряженные аминокислоты, но на интерактивной поверхности домена также можно наблюдать короткий гидрофобный участок.
Функция
Домен DED наиболее известен своей ролью в апоптозе. Однако белки, содержащие DED, также участвуют в других клеточных процессах, поэтому они контролируют решения как о жизни, так и о смерти клеток.
Внешний апоптоз
[5] Апоптоз - это контролируемая и запрограммированная смерть клеток, которая дает преимущества в течение жизненного цикла организма. Внешний путь управляется семейством протеаз, которые становятся активными в ответ на стимулы смерти. Чтобы узнать роль DED в этом процессе, важно наблюдать за формированием мультибелкового сигнального комплекса, включающего смерть (DISC).
DR4, TRAIL-R2 и CD95 рецепторы смерти (члены Суперсемейство рецепторов TNF ), которые взаимодействуют вместе, используя свои внутриклеточные домены смерти (DD). DD FADD, белка, содержащего DED, может затем взаимодействовать с этими описанными DD. Здесь функция FADD DED заключается в создании стабилизированной структуры путем самоассоциации FADD.

[6] Эти взаимодействия определяются спиралями α1 / α4 и α2 / α3: остатки Ser1, Val6, His9, Leu43, Asp44 и Glu51 из α1 / α4 находятся в контакте с Thr21, Phe25, Lys33, Arg34, Glu37 и Glu51 из α2 / α3 вторая молекула. Каждое взаимодействие занимает площадь 1062 Å.2 и вклады от гидрофобных боковых цепей, водородных связей и солевых мостиков. Конечный гомодимер имеет структуру, ориентированную так, что каждая субъединица имеет 2 сайта взаимодействия.
Прокаспаза-8, также белок, содержащий DED, имеет сродство к FADD DED. По этой причине они набираются в FADD в качестве мономеров через свои DED. Это взаимодействие определяется α1 / α4 прокапазы-8 DED-A и FADD DED α2 / α3 или α1 / α4 FADD DED и α2 / α5 прокапазы-8 DED-B. Прокаспаза-8 DED-B взаимодействует с FADD, а DED-A опосредует образование цепи капазы-8, или наоборот. Однако в обоих случаях взаимодействие приводит к созданию димера между прокаспазами, который вызывает конформационные изменения. Эта димеризация важна для создания активного сайта; субъединица p12 высвобождается и впоследствии преобразуется в малую субъединицу p10. Две молекулы прокапазы-8 связаны с этими субъединицами p10, вызывая активную гибель клеток протеазы-8.[7][8]
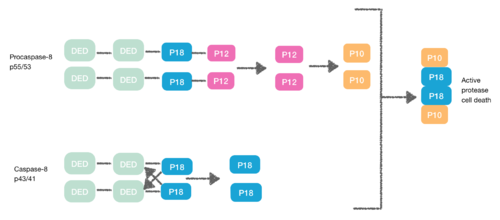
Некроптоз
[9] Во время создания DISC прокаспаза-8 может также гетеродимеризоваться с другим DED-содержащим белком, известным как FLIP.L. КУВЫРОКLПсевдокаспаза имеет два тандемных DED, которые очень похожи на N-конец капазы-8, но в которых есть важная мутация в активном сайте (цистеин в тирозин).
Эта гетеродимерация между их DED предотвращает нормальную гомодимерацию, так что псевдокаспаза не может активировать апоптотический каскад. КУВЫРОКL Псевдокаспаза более эффективна при индукции конформационных изменений. Однако FLIPL не обладает достаточной ферментативной активностью, поэтому расщепление между DED и p18 невозможно. В результате невозможно создать активную протеазную гибель клеток.[10]
Прокаспаза-8 также может гетеродимеризоваться с FLIPS, а также белок, содержащий DED. В этом случае гетеродимеризация напрямую не может активировать прокаспазу-8, поскольку начальное конформационное изменение не может происходить в каспазном домене прокаспазы-8.[10]

Таким образом DED может также ингибировать каскад апоптоза, и в результате некроптоз.
Семейство белков DED
DED-содержащие белки
Каспаза-8 и каспаза-10
[11] Каспазы цистеиновые протеазы отвечает за демонтаж ячейки во время апоптоз.
Эти белки являются зимогенами и становятся активными после расщепления на определенных участках внутри молекулы.
Структура:
- Домен Эффектора Смерти (DED) и Домен найма Caspase (CARD) которые включены в структуру, называемую про-доменом, которая расположена на N-конце
- Домен каталитической протеазы на С-конце.
Есть две группы протеазы:
- Эффекторные каспазы: вызывают большую часть морфологических изменений, происходящих при апоптозе.
- Инициаторные каспазы: ответственны за активацию эффекторных каспаз. Эти каспазы активируются через олигомеризация и расщепление, которое делает белок функциональным.
Два тандемных DED в продомене каспазы индуцируют белок-белковые взаимодействия с другими белками, такими как FADD.
Изучение каспаз важно, так как они не только контролируют апоптоз, но и подавляют его, в зависимости от потребностей клетки. Ученые обнаружили, что они представляют собой механизм, который может регулировать жизнь клеток и важен для лечения рака.
FLICE-подобные ингибирующие белки (FLIP)
FLICE-подобные ингибирующие белки (FLIP) представляют собой клеточные ингибиторы, способные останавливать сигнал рецепторов смерти, которые вызывают апоптоз клеток.
Первые идентифицированные FLIP были экспрессированы вирусами γ-герпеса, поэтому их назвали v-FLIP. Эти v-FLIP были способны связываться с рецептором в сигнальный комплекс, вызывающий смерть (DISC), таким образом блокируя CD95-опосредованный апоптоз.
[12]vFLIP преимущественно содержат два последовательных DED, которые очень гомологичны N-концу каспазы-8.
[10] В сотовый гомологи v-FLIP обычно выражаются в двух формах:
- c-FLIPS (кратко): он содержит только тандемные амино-концевые DED, за которыми следует короткий карбокси-концевой участок. Его структура похожа на вирусные FLIP.
- c-FLIPL (длинный): он состоит не только из тандемных DED, но также из протеазоподобного домена (гомологичного каспазе-8), в котором мутированы различные важные для протеазной активности аминокислоты, включая цистеин в активном центре.
[12] Обе формы c-FLIP попадают на CD95 DISC, где они гетеродимеризуются с каспазой-8. c-FLIP участвует в передаче сигналов по альтернативным путям, связывая рецептор CD95 с NF-κB, JNK и MAPK пути.
ПЭА-15 / ПЭД
PEA-15 (фосфопротеин, обогащенный астроцитами-15 кДа) также известен как PED (фосфопротеин, обогащенный при диабете) это DED-содержащий белок с плейотропные эффекты.
PED - это небольшой некаталитический белок, состоящий из N-концевого эффекторный домен смерти (DED) и С-концевой хвост с неправильной структурой.[13] PED / PEA-15 взаимодействует с различными типами белков с DED и без них, и его специфичность присоединения к этим белкам опосредуется фосфорилирование на два остатка серина на С-конце хвоста:
- Ser104: фосфорилируется протеинкиназа C (PKC).
- Ser116: субстрат для кальций / кальмодулин-зависимая протеинкиназа II (CamKII).
[13] ПЭА-15 работает как антиапоптотический белок DED в нескольких сигнальные каскады. В путях, опосредованных TNF α, CD95 и TRAIL, PEA-15 действует, связывая и нарушая взаимодействия FADD и каспазы-8.
[10] Помимо апоптоза, ПЭА-15 ингибирует опосредованный инсулином транспорт глюкозы в мышечных клетках, поэтому высокий уровень экспрессии мРНК ПЭА-15 был связан с сахарный диабет II типа.
DEDD / DEDD2
Эффекторный домен смерти, содержащий ДНК привязка (DEDD). Демонстрирует способность связывания ДНК, локализованную в ядрышках при сверхэкспрессии, где она связывается с молекулой, называемой DEDAF (DED-ассоциированный фактор), которая потенцирует апоптоз. Вдобавок он блокирует РНК-полимераза I транскрипция путем связывания с ДНК.
DEDD2 (FLAME-3) является гомологом DEDD, который имеет 48,5% аминокислотной последовательности. Отмечается, что он взаимодействует с c-FLIP и DEDD и играет важную роль в полимераза II -зависимая репрессия транскрипции.
HIP-1 и HIPPI
Гентингтин взаимодействующий белок-1 (HIP-1) белок, который взаимодействует с Хантингтин (Htt), другой белок, который при мутации (с расширенными повторами полиглутамина) образует белковые агрегаты в головном мозге пациентов с Болезнь Хантингтона (HD).
[14] HIP-1 содержит эффекторный домен псевдосмерти (pDED), вот почему сверхэкспрессия HIP-1 вызывает апоптоз в нескольких клетках, как это делают белки DED. Этот тип апоптоза зависит от pDED HIP-1 и заключается в активации каспазы-3, фермента, который снижается при экспрессии Htt дикого типа, что предполагает, что HIP-1 взаимодействует с Htt в патомеханизм болезни Гентингтона.
[10] Дрожжами двухгибридный скрининг, HIP-1 взаимодействует с белком из 419 аминокислот, называемым HIPPI (белок-взаимодействующий белок HIP-1). Последующие эксперименты показали, что наличие HIPPI определяет апоптоз, индуцированный HIP-1.
ВСПЫШКА
FLICE-ассоциированный огромный белок. Содержит домен, аналогичный DED, но гомология очень слабая, и его функция все еще неясна.
Терапевтическое использование DED
[7] Было показано, что комплексы DED функционируют на важнейших этапах управления процессами жизни и смерти клеток. Эти знания особенно полезны в терапии, потому что существует очень много патологий, связанных с ненормальным контролем жизни клеток.
Отсутствие апоптоза - признак рака. В некоторых случаях ген, кодирующий прокаспазу-8, заглушается метилированием, поэтому для получения активной протеазы необходимо активировать ген с помощью эпигенетических методов лечения. В других случаях наблюдается избыточная экспрессия FLIP, антиапоптотической молекулы, которая препятствует образованию активной каспазы. В этом случае есть некоторые противораковые агенты, которые подавляют экспрессию FLIP.
Однако аномальный апоптоз не является исключительным признаком рака, существуют и другие патологии, такие как воспаление и нейродегенеративные заболевания, которые также можно лечить с помощью таких терапевтических средств.
Рекомендации
- ^ Эберштадт М., Хуанг Б., Чен З. и др. (Апрель 1998 г.). «Структура ЯМР и мутагенез эффекторного домена смерти FADD (Mort1)». Природа. 392 (6679): 941–5. Дои:10.1038/31972. PMID 9582077. S2CID 4370202.
- ^ Валмики М.Г., Рамос Дж.В. (март 2009 г.). «Белки, содержащие эффекторный домен смерти». Клетка. Мол. Life Sci. 66 (5): 814–30. Дои:10.1007 / s00018-008-8489-0. PMID 18989622. S2CID 13117680.
- ^ Шен, Чен; Юэ, Хун; Пей, Цзяньвэнь; Го, Сяоминь; Ван, Дао; Цюань, Джун-Мин (2015). «Кристаллическая структура эффекторных доменов гибели каспазы-8». Сообщения о биохимических и биофизических исследованиях. 463 (3): 297–302. Дои:10.1016 / j.bbrc.2015.05.054. ISSN 0006-291X. PMID 26003730.
- ^ «Структуры, домены и функции в клеточной смерти».
- ^ Элмор, Сьюзан (2007). «Апоптоз: обзор запрограммированной гибели клеток». Токсикологическая патология. 35 (4): 495–516. Дои:10.1080/01926230701320337. ISSN 1533-1601. ЧВК 2117903. PMID 17562483.
- ^ Сингх, Ниту; Хасан, Али; Бозе, Каколи (2015). «Молекулярные основы сборки цепи эффекторного домена смерти и его роль в активации каспазы-8». Журнал FASEB. 30 (1): 186–200. Дои:10.1096 / fj.15-272997. ISSN 1530-6860. PMID 26370846.
- ^ а б Райли, JS; Малик, А; Holohan, C; Лонгли, ДБ (2015). «DED или живые: сборка и регуляция комплексов эффекторных доменов смерти». Смерть клеток и болезнь. 6 (8): e1866. Дои:10.1038 / cddis.2015.213. ISSN 2041-4889. ЧВК 4558505. PMID 26313917.
- ^ Яо, Чжань; Дуань, Шаньшань; Хоу, Дэжи; Хиз, Клаус; Ву, Миан (2007). «Эффекторный домен смерти DEDa, продукт саморасщепления каспазы-8 / Mch5, перемещается в ядро путем связывания с ERK1 / 2 и усиливает экспрессию прокаспазы-8 посредством p53-зависимого механизма». Журнал EMBO. 26 (4): 1068–1080. Дои:10.1038 / sj.emboj.7601571. ISSN 1460-2075. ЧВК 1852837. PMID 17290218.
- ^ Ли, Ын-Ву; Со, Джинхо; Чон, Манхён; Ли, Сангсик; Песня, Jaewhan (2012). «Роль FADD во внешнем апоптозе и некроптозе». BMB отчеты. 45 (9): 496–508. Дои:10.5483 / BMBRep.2012.45.9.186. ISSN 1976-670X. PMID 23010170.
- ^ а б c d е Barnhart, Bryan C; Ли, Жюстин С; Алаппат, Элизабет С; Питер, Маркус Э (2003). «Семейство белков эффекторного домена смерти». Онкоген. 22 (53): 8634–8644. Дои:10.1038 / sj.onc.1207103. ISSN 0950-9232. PMID 14634625.
- ^ Schleich, K .; Buchbinder, J. H .; Pietkiewicz, S .; Kähne, T .; Warnken, U .; Öztürk, S .; Schnölzer, M .; Naumann, M .; Краммер, П. Х. (2016-04-01). «Молекулярная архитектура цепей DED на DISC: регуляция активации прокаспазы-8 короткими белками DED c-FLIP и продоменом прокаспазы-8». Гибель клеток и дифференциация. 23 (4): 681–694. Дои:10.1038 / cdd.2015.137. ISSN 1350-9047. ЧВК 4986640. PMID 26494467.
- ^ а б Yu, JW; Ши, Y (2008). «FLIP и семейство эффекторных доменов смерти». Онкоген. 27 (48): 6216–6227. Дои:10.1038 / onc.2008.299. ISSN 0950-9232. PMID 18931689.
- ^ а б Туми, Эдвард С; Кордаско, Дана Ф; Вэй, Юйфэн (2012). «Глубокие конформационные изменения PED / PEA-15 в комплексе ERK2, выявленные с помощью динамики основной цепи ЯМР». Biochimica et Biophysica Acta (BBA) - Белки и протеомика. 1824 (12): 1382–1393. Дои:10.1016 / j.bbapap.2012.07.001. ISSN 1570-9639. PMID 22820249.
- ^ Бхаттачарья, Нитай П.; Банерджи, Маниша; Маджумдер, Прита (2008). «Болезнь Хантингтона: роль взаимодействующего с гентингтином белка 1 (HIP-1) и его молекулярного партнера HIPPI в регуляции апоптоза и транскрипции». Журнал FEBS. 275 (17): 4271–4279. Дои:10.1111 / j.1742-4658.2008.06563.x. ISSN 1742-464X. PMID 18637945.
