Рацемизация - Racemization
В химия, рацемизация представляет собой преобразование под действием тепла или химической реакции оптически активный соединение в рацемическую (оптически неактивную) форму. Половина оптически активного вещества становится его зеркальным отражением (энантиомером), называемым рацемическими смесями (т.е. содержат равное количество (+) и (-) форм). Если рацемизация приводит к смеси, в которой D и L энантиомеры присутствуют в равных количествах, полученный образец описывается как рацемическая смесь или рацемат.[1][2] Рацемизация может протекать через ряд различных механизмов, и это имеет особое значение в фармакологии, поскольку разные энантиомеры могут иметь разные фармацевтические эффекты.
Стереохимия
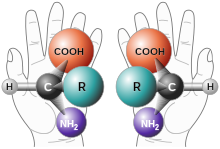
Хиральный молекулы имеют две формы (в каждой точке асимметрии), которые различаются своими оптическими характеристиками: левовращающая форма (в (-) - форма) будет вращать плоскость поляризации пучка света слева, тогда как правовращающий форма ( (+) - форма) повернет плоскость поляризации светового луча вправо. Две формы, которые не могут быть совмещены при вращении в трехмерном пространстве, называются энантиомеры. Обозначения не следует путать с D и L название молекул, которое указывает на сходство по структуре с D-глицеральдегид и L-глицеральдегид. Также, (р)- и (S) - относятся к химической структуре молекулы на основе Правила приоритета Кана – Ингольда – Прелога наименования, а не вращения света.
Рацемизация происходит, когда одна чистая форма энантиомера превращается в равную пропорцию обоих энантиомеров, образуя рацемат. Когда имеется равное количество правовращающих и левовращающих молекул, чистое оптическое вращение рацемата равно нулю.[1] Энантиомеры также следует отличать от диастереомеры которые представляют собой тип стереоизомеров, которые имеют различные молекулярные структуры вокруг стереоцентр и не являются зеркальным отображением.
Физические свойства
Рацемат может иметь физические свойства, отличные от любого из чистых энантиомеров из-за дифференциальных межмолекулярных взаимодействий (см. Раздел «Биологическое значение»). Переход от чистого энантиомера к рацемату может изменить его плотность, температуру плавления, растворимость, теплоту плавления, показатель преломления и его различные спектры. Кристаллизация рацемата может давать отдельные (+) и (-) формы или одно рацемическое соединение.
Биологическое значение
В целом большинство биохимические реакции являются стереоселективными, поэтому только один стереоизомер будет производить желаемый продукт, в то время как другой просто не участвует или может вызывать побочные эффекты. Следует отметить, что L форма аминокислот и D Форма сахаров (прежде всего глюкоза) обычно является биологически активной формой. Это связано с тем, что многие биологические молекулы являются хиральными, и поэтому реакции между конкретными энантиомерами производят чистые стереоизомеры.[3] Также примечателен тот факт, что все аминокислотные остатки существуют в L форма. Однако бактерии производят D-аминокислотные остатки, которые полимеризуются в короткие полипептиды, которые можно найти в стенках бактериальных клеток. Эти полипептиды хуже усваиваются пептидазами и синтезируются бактериальными ферментами вместо трансляции мРНК, которая обычно дает L-аминокислоты.[3]
Стереоселективный характер большинства биохимических реакций означал, что разные энантиомеры химического вещества могут иметь разные свойства и эффекты на человека. Многие психотропные препараты проявляют разную активность или эффективность между изомерами, например амфетамин часто выпускается в виде рацемических солей, в то время как более активные декстроамфетамин зарезервирован для рефрактерных случаев или более серьезных показаний; другой пример метадон, из которых один изомер обладает активностью как опиоидный агонист, а другой - как Антагонист NMDA.[4]
Рацемизация фармацевтические препараты может случиться in vivo. Талидомид как (р) энантиомер эффективен против утреннее недомогание, в то время как (S) энантиомер тератогенный, вызывающие врожденные дефекты при приеме в первом триместре беременности. Если человеку вводят только один энантиомер, обе формы могут быть позже обнаружены в сыворотке крови.[5] Таким образом, препарат не считается безопасным для женщин детородного возраста, и, хотя он имеет и другие применения, его использование строго контролируется.[6][7] Талидомид можно использовать для лечения множественная миелома.[8]Другой широко используемый препарат - это ибупрофен который обладает противовоспалительным действием только как один энантиомер, тогда как другой является биологически инертным. Точно так же (S) стереоизомер гораздо более реакционноспособен, чем (р) энантиомер в циталопрам (Celexa), антидепрессант, подавляющий обратный захват серотонина, является активным.[2][3][9] Таким образом, конфигурационная стабильность лекарственного средства представляет собой область интересов фармацевтических исследований.[10] Производство и анализ энантиомеров в фармацевтической промышленности изучается в области хирального органического синтеза.
Образование рацемических смесей
Рацемизация может быть достигнута простым смешиванием равных количеств двух чистых энантиомеров. Рацемизация также может происходить при химическом взаимопревращении. Например, когда (р) -3-фенил-2-бутанон растворяют в водном этаноле, который содержит NaOH или же HCl образуется рацемат. Рацемизация происходит посредством промежуточного энол форма, в которой бывший стереоцентр становится плоским и, следовательно, ахиральным.[11] Прибывающая группа может приближаться с любой стороны самолета, поэтому существует равная вероятность того, что протонирование обратно к хиральному кетону произведет либо р или S форма, приводящая к рацемату.
Рацемизация может происходить посредством некоторых из следующих процессов:
- Реакции замещения, которые проходят через карбокатион промежуточный, такой как реакции мономолекулярного замещения, приводят к нестереоспецифическому добавлению заместителей, что приводит к рацемизации.
- Несмотря на то что реакции мономолекулярного элиминирования также проходят через карбокатион, они не образуют хирального центра. Вместо этого они приводят к набору геометрические изомеры в котором транс/СНГ (E/Z) образуются формы, а не рацематы.
- В мономолекулярном алифатическом электрофильное замещение реакция, если карбанион плоский или если он не может поддерживать пирамидальную структуру, то должна происходить рацемизация, хотя и не всегда.[12]
- В замещение свободных радикалов реакция, если образование свободного радикала происходит у хирального углерода, то почти всегда наблюдается рацемизация.[13]
Скорость рацемизации (от L-формируется в смесь L-формы и D-forms) использовался как способ датирования биологических образцов в тканях с низкой скоростью оборота, судебно-медицинских образцов и окаменелостей в геологических отложениях. Этот метод известен как аминокислотное датирование.
Открытие оптической активности
В 1843 году Луи Пастер обнаружил оптическую активность пара винной или рацемической кислоты, обнаруженной в виноградном вине. Он смог разделить два кристалла энантиомера, которые вращали поляризованный свет в противоположных направлениях.[2]
Смотрите также
Рекомендации
- ^ а б Streitwieser & Heathcock (1985), стр. 122–124.
- ^ а б c Nelson, D. L .; Кокс, М. М. (2013). Принципы биохимии Ленингера (6-е изд.). Нью-Йорк: В. Х. Фриман. ISBN 1429234148.
- ^ а б c Воет, Д.; Воет, Дж. Г.; Пратт, К. В. (2013). Основы биохимии: жизнь на молекулярном уровне (4-е изд.). Хобокен, штат Нью-Джерси: Джон Уайли и сыновья. ISBN 0470547847.
- ^ Арнольд, Л. Э .; Wender, P.H .; McCloskey, K .; Снайдер, С. Х. (1972). «Левоамфетамин и декстроамфетамин: сравнительная эффективность при гиперкинетическом синдроме: оценка по целевым симптомам». Arch. Генеральная психиатрия. 27 (6): 816–822. Дои:10.1001 / archpsyc.1972.01750300078015. PMID 4564954.
- ^ Teo, S.K .; Colburn, W. A .; Tracewell, W. G .; Kook, K. A .; Стирлинг, Д. И .; Jaworsky, M. S .; Шеффлер, М. А .; Thomas S.D .; Ласкин, О. Л. (2004). «Клиническая фармакокинетика талидомида». Clin. Фармакокинет. 43 (5): 311–327. Дои:10.2165/00003088-200443050-00004. PMID 15080764.
- ^ Стольберг, С. Г. (17 июля 1998 г.). «Талидомид, одобренный для лечения проказы, с другими замеченными применениями». Нью-Йорк Таймс. Получено 8 января 2012.
- ^ «Использование талидомида при проказе». ВОЗ: устранение проказы. Всемирная организация здоровья. Получено 22 апреля 2010.
- ^ Редди, К. С. С .; Касивисванат, И. В. (2013). "Расимизация (р) –Альфа-Этил-2-оксо-1-пирролидинуксусная кислота с тионилхлоридом ». Международный журнал для ученых-фармацевтов. 2 (1): 45–48.
- ^ Жако, С .; Дэвид, Д. Дж .; Gardier, A.M .; Санчес, К. (2007). «Эсциталопрам и циталопрам: неожиданная роль р-энантиомер ». Энсефаль. 33 (2): 179–187. PMID 17675913.
- ^ Reist, M .; Testa, B .; Каррапт, П.-А. «Рацемизация лекарств и ее значение в фармацевтических исследованиях». В Eichelbaum, Michel F .; Теста, Бернард; Somogyi, Эндрю (ред.). Стереохимические аспекты действия и распределения лекарств. Справочник по экспериментальной фармакологии. 153. С. 91–112. Дои:10.1007/978-3-642-55842-9_4.
- ^ Streitwieser & Heathcock (1985) стр. 373
- ^ Март (1985), стр. 517–518
- ^ March (1985) стр. 610
Библиография
- Марч, Дж. (1985). Высшая органическая химия: реакции, механизмы и структура (3-е изд.). Джон Уайли и сыновья. ISBN 0471854727.
- Штрайтвизер, А.; Хиткок, К. Х. (1985). Введение в органическую химию (3-е изд.). Максвелл Макмиллан. ISBN 0029467209.
