Химия - Chemistry
 |
| Химия |
|---|

Химия это научная дисциплина связан с элементы и соединения состоит из атомы, молекулы и ионы: их состав, структура, свойства, поведение и изменения, которые они претерпевают во время реакция с другим вещества.[1][2][3]
По своему предмету химия занимает промежуточное положение между физика и биология.[4] Иногда его называют центральная наука потому что он дает основу для понимания как базовый и применяемый научные дисциплины на фундаментальном уровне.[5] Например, химия объясняет аспекты химии растений (ботаника ), образование магматических пород (геология ), как образуется атмосферный озон и как разлагаются загрязнители окружающей среды (экология ) свойства грунта на Луне (космохимия ), как действуют лекарства (фармакология ), а как собирать ДНК доказательства на месте преступления (криминалистика ).
В химии рассматриваются такие темы, как взаимодействие атомов и молекул через химические связи формировать новые химические соединения. Существует два типа химических связей: 1. Первичные химические связи, например ковалентный связи, в которых атомы разделяют один или несколько электронов; ионные связи, в котором атом отдает один или несколько электроны к другому атому произвести ионы (катионы и анионы ); Металлические связи и 2. Вторичные химические связи, например водородные связи;Сила Ван-дер-Ваальса связи, ион-ионное взаимодействие, ион-дипольное взаимодействие и т. д.
Этимология
Слово химия происходит от модификации слова алхимия, которые относились к более раннему набору практик, которые включали элементы химии, металлургия, философия, астрология, астрономия, мистика и лекарство. Алхимию часто считают связанной со стремлением превратить свинец или другие неблагородные металлы в золото, хотя алхимики также интересовались многими вопросами современной химии.[6]
Современное слово алхимия в свою очередь происходит от арабский слово аль-кимия (الكیمیاء). По происхождению термин заимствован из Греческий χημία или χημεία.[7][8] Это может иметь Египтянин происхождение с аль-кимия происходит от греческого χημία, которое, в свою очередь, происходит от слова Кемет, древнее название Египта на египетском языке.[7] Альтернативно, аль-кимия может происходить от χημεία, что означает «склеить».[9]
Современные принципы

Текущая модель атомной структуры - это квантово-механическая модель.[10] Традиционная химия начинается с изучения элементарные частицы, атомы, молекулы,[11] вещества, металлы, кристаллы и другие совокупности иметь значение. Вещество можно изучать в твердом, жидком, газовом и плазменном состоянии. состояния, по отдельности или в комбинации. В взаимодействия, реакции а превращения, которые изучаются в химии, обычно являются результатом взаимодействий между атомами, приводящего к перестройке химических связей, удерживающих атомы вместе. Такое поведение изучается в химии. лаборатория.
Химическая лаборатория стереотипно использует различные формы лабораторная посуда. Однако посуда не занимает центральное место в химии, и большая часть экспериментальной (а также прикладной / промышленной) химии обходится без нее.

А химическая реакция представляет собой преобразование некоторых веществ в одно или несколько различных веществ.[12] В основе такого химического превращения лежит перегруппировка электронов в химических связях между атомами. Его можно символически изобразить через химическое уравнение, который обычно включает атомы как субъекты. Число атомов слева и справа в уравнении химического превращения равно. (Когда количество атомов с обеих сторон неодинаково, преобразование называется ядерная реакция или же радиоактивный распад.) Тип химических реакций, в которых может происходить вещество, и изменения энергии, которые могут сопровождать его, ограничиваются некоторыми основными правилами, известными как химические законы.
Энергия и энтропия соображения неизменно важны почти во всех химических исследованиях. Химические вещества классифицируются по их структура, фаза, а также их химический состав. Их можно проанализировать с помощью инструментов химический анализ, например спектроскопия и хроматография. Ученые, занимающиеся химическими исследованиями, известны как химики.[13] Большинство химиков специализируются на одной или нескольких дисциплинах. Несколько концепции необходимы для изучения химии; некоторые из них:[14]
Иметь значение
В химии материя определяется как все, что имеет масса покоя и объем (занимает место) и состоит из частицы. Частицы, из которых состоит материя, также имеют массу покоя - не все частицы имеют массу покоя, например фотон. Материя может быть чистой химическая субстанция или смесь веществ.[15]
Атом

Атом - основная единица химии. Он состоит из плотного ядра, называемого атомное ядро окруженный пространством, занимаемым электронное облако. Ядро состоит из положительно заряженных протоны и незаряженный нейтроны (вместе называли нуклоны ), а электронное облако состоит из отрицательно заряженных электроны которые вращаются вокруг ядра. В нейтральном атоме отрицательно заряженные электроны уравновешивают положительный заряд протонов. Ядро плотное; масса нуклона примерно в 1836 раз больше, чем у электрона, а радиус атома примерно в 10 000 раз больше его ядра.[16][17]
Атом также является самым маленьким объектом, который может сохранять химические свойства элемента, например электроотрицательность, потенциал ионизации, предпочтительно степень окисления (s), координационный номер и предпочтительные типы облигаций для образования (например, металлический, ионный, ковалентный ).
Элемент
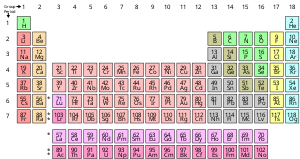
Химический элемент - это чистое вещество, состоящее из одного типа атомов, характеризующегося определенным числом протоны в ядрах его атомов, известных как атомный номер и представлен символом Z. В массовое число представляет собой сумму количества протонов и нейтронов в ядре. Хотя все ядра всех атомов, принадлежащих к одному элементу, будут иметь один и тот же атомный номер, они не обязательно могут иметь одинаковое массовое число; атомы элемента, которые имеют разные массовые числа, известны как изотопы. Например, все атомы с шестью протонами в ядрах являются атомами химического элемента. углерод, но атомы углерода могут иметь массовые числа 12 или 13.[17]
Стандартное представление химических элементов находится в периодическая таблица, который упорядочивает элементы по атомному номеру. Таблица Менделеева построена в группы, или столбцы, и периоды, или строк. Таблица Менделеева полезна для определения периодические тенденции.[18]
Сложный
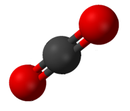
А сложный представляет собой чистое химическое вещество, состоящее более чем из одного элемента. Свойства соединения мало похожи на свойства его элементов.[19] Стандартная номенклатура соединений устанавливается Международный союз теоретической и прикладной химии (ИЮПАК). Органические соединения названы в соответствии с органическая номенклатура система.[20] Имена для неорганические соединения созданы в соответствии с неорганическая номенклатура система. Когда соединение имеет более одного компонента, они делятся на два класса: электроположительные и электроотрицательные компоненты.[21] В дополнение Химическая служба рефератов разработал метод индексации химических веществ. На этой схеме каждое химическое вещество идентифицируется по номеру, известному как его Регистрационный номер CAS.
Молекула

А молекула наименьшая неделимая порция чистого химическая субстанция который имеет уникальный набор химических свойств, то есть способность вступать в определенный набор химических реакций с другими веществами. Однако это определение хорошо работает только для веществ, которые состоят из молекул, что неверно для многих веществ (см. Ниже). Молекулы обычно представляют собой набор атомов, связанных вместе ковалентные связи, так что структура электрически нейтральна, и все валентные электроны спарены с другими электронами либо в связях, либо в одинокие пары.
Таким образом, молекулы существуют как электрически нейтральные единицы, в отличие от ионов. Когда это правило нарушается и «молекула» получает заряд, результат иногда называют молекулярный ион или многоатомный ион. Однако дискретный и раздельный характер молекулярной концепции обычно требует, чтобы молекулярные ионы присутствовали только в хорошо разделенной форме, такой как направленный пучок в вакууме в масс-спектрометр. Заряженные многоатомные скопления, находящиеся в твердых телах (например, обычных сульфатных или нитрат-ионах), обычно не считаются «молекулами» в химии. Некоторые молекулы содержат один или несколько неспаренных электронов, создающих радикалы. Большинство радикалов относительно реакционны, но некоторые, например оксид азота (NO), могут быть стабильными.
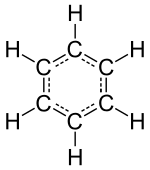
«Инертный» или элементы благородных газов (гелий, неон, аргон, криптон, ксенон и радон ) состоят из одиночных атомов как их наименьшей дискретной единицы, но другие изолированные химические элементы состоят либо из молекул, либо из сетей атомов, связанных друг с другом тем или иным образом. Опознаваемые молекулы состоят из знакомых веществ, таких как вода, воздух и многие органические соединения, такие как спирт, сахар, бензин и другие вещества. фармацевтические препараты.
Однако не все вещества или химические соединения состоят из дискретных молекул, и действительно, большинство твердых веществ, составляющих твердую кору, мантию и ядро Земли, являются химическими соединениями без молекул. Эти другие типы веществ, такие как ионные соединения и твердые тела сети, организованы таким образом, что не существует идентифицируемых молекул как таковой. Вместо этого эти вещества обсуждаются с точки зрения формульные единицы или же элементарные ячейки как мельчайшая повторяющаяся структура в веществе. Примерами таких веществ являются минеральные соли (такие как столовая соль ), твердых тел, таких как углерод и алмаз, металлы и знакомые кремнезем и силикатные минералы такие как кварц и гранит.
Одной из основных характеристик молекулы является ее геометрия, которую часто называют ее структура. Хотя структура двухатомных, трехатомных или четырехатомных молекул может быть тривиальной (линейной, угловой пирамидальной и т. Д.), Структура многоатомных молекул, состоящих из более чем шести атомов (нескольких элементов), может иметь решающее значение для ее химической природы. .
Вещество и смесь
  | |
  | |
  | |
| Примеры чистых химических веществ. Слева направо: элементы банка (Sn) и сера (S), алмаз (ан аллотроп из углерод ), сахароза (чистый сахар) и хлорид натрия (соль) и бикарбонат натрия (пищевая сода), которые являются ионными соединениями. |
Химическое вещество - это вещество с определенным сочинение и набор характеристики.[22] Набор веществ называется смесью. Примеры смесей: воздуха и сплавы.[23]
Моль и количество вещества
Моль - это единица измерения, обозначающая количество вещества (также называется химическим количеством). Один моль определяется как содержащий ровно 6.02214076×1023 частицы (атомы, молекулы, ионы, или же электроны ), где количество частиц на моль известен как Константа Авогадро.[24] Молярная концентрация количество определенного вещества на объем решение, и обычно указывается в моль /дм3.[25]
Фаза
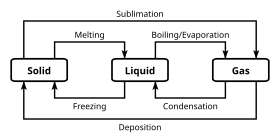
Помимо определенных химических свойств, которые различают различные химические классификации, химические вещества могут существовать в нескольких фазах. По большей части химические классификации не зависят от этих классификаций объемных фаз; однако некоторые более экзотические фазы несовместимы с определенными химическими свойствами. А фаза представляет собой набор состояний химической системы, которые имеют аналогичные объемные структурные свойства, в диапазоне условий, таких как давление или же температура.
Физические свойства, такие как плотность и показатель преломления имеют тенденцию укладываться в значения, характерные для данной фазы. Фаза материи определяется фаза перехода, то есть когда энергия, вложенная в систему или забранная из нее, идет на перестройку структуры системы, а не на изменение объемных условий.
Иногда различие между фазами может быть непрерывным, а не иметь дискретную границу », в этом случае считается, что материя находится в сверхкритический государственный. Когда три государства встречаются в зависимости от условий, это называется тройная точка и поскольку это инвариантно, это удобный способ определить набор условий.
Наиболее известные примеры фаз: твердые вещества, жидкости, и газы. Многие вещества имеют несколько твердых фаз. Например, есть три фазы твердого утюг (альфа, гамма и дельта), которые меняются в зависимости от температуры и давления. Принципиальным отличием твердых фаз является Кристальная структура, или расположение атомов. Другой этап, обычно встречающийся в изучении химии, - это водный фаза, которая представляет собой состояние веществ, растворенных в водный раствор (то есть в воде).
Менее знакомые фазы включают плазма, Конденсаты Бозе – Эйнштейна и фермионные конденсаты и парамагнитный и ферромагнитный фазы магнитный материалы. В то время как наиболее знакомые этапы относятся к трехмерным системам, также можно определить аналоги в двумерных системах, что привлекло внимание из-за его значимости для систем в биология.
Склеивание
Говорят, что атомы, слипшиеся в молекулы или кристаллы, связаны друг с другом. Химическая связь может быть представлена как многополюсный баланс между положительными зарядами в ядрах и отрицательными зарядами, колеблющимися вокруг них.[26] Это больше, чем просто притяжение и отталкивание, энергии и распределения характеризуют доступность электрона для связи с другим атомом.
Химическая связь может быть Ковалентная связь, ионная связь, а водородная связь или просто из-за Сила Ван-дер-Ваальса. Каждому из этих видов связей приписывается определенный потенциал. Эти потенциалы создают взаимодействия которые удерживают атомы вместе в молекулы или же кристаллы. Во многих простых соединениях теория валентной связи, модель отталкивания электронных пар валентных оболочек (VSEPR ), а концепция степень окисления может использоваться для объяснения молекулярной структуры и состава.
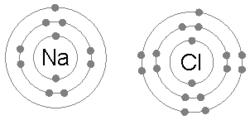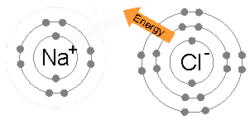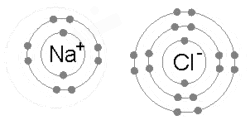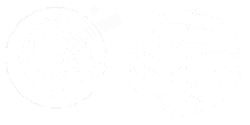
Ионная связь образуется, когда металл теряет один или несколько своих электронов, становясь положительно заряженным катионом, а затем электроны приобретаются атомом неметалла, становясь отрицательно заряженным анионом. Два противоположно заряженных иона притягиваются друг к другу, и ионная связь представляет собой электростатическую силу притяжения между ними. Например, натрий (Na), металл, теряет один электрон, чтобы стать Na+ катион, пока хлор (Cl), неметалл, получает этот электрон, чтобы стать Cl−. Ионы удерживаются вместе за счет электростатического притяжения, и это соединение хлорид натрия (NaCl) или обычная поваренная соль.

В ковалентной связи одна или несколько пар валентные электроны разделяются двумя атомами: образовавшаяся электрически нейтральная группа связанных атомов называется молекула. Атомы будут разделять валентные электроны таким образом, чтобы создать благородный газ электронная конфигурация (восемь электронов на внешней оболочке) для каждого атома. Говорят, что атомы, которые имеют тенденцию объединяться таким образом, что каждый из них имеет восемь электронов на валентной оболочке, следуют Правило октета. Однако некоторые элементы, такие как водород и литий нужно всего два электрона в их внешней оболочке, чтобы достичь этой стабильной конфигурации; говорят, что эти атомы следуют правило дуэта, и таким образом они достигают электронной конфигурации благородного газа гелий, имеющий на внешней оболочке два электрона.
Точно так же теории из классическая физика может использоваться для предсказания многих ионных структур. С более сложными соединениями, такими как металлические комплексы теория валентных связей менее применима, и альтернативные подходы, такие как молекулярная орбиталь теория, обычно используются. См. Схему электронных орбиталей.
Энергия
В контексте химии энергия - это атрибут вещества как следствие его атомный, молекулярный или совокупный структура. Поскольку химическое превращение сопровождается изменением одного или нескольких таких типов структур, оно неизменно сопровождается изменением увеличивать или же снижаться из энергия вовлеченных веществ. Некоторая энергия передается между окружающей средой и реагентами реакции в виде тепла или свет; таким образом, продукты реакции могут иметь больше или меньше энергии, чем реагенты.
Говорят, что реакция экзергонический если конечное состояние ниже по энергетической шкале, чем начальное состояние; в случае эндергонические реакции ситуация обратная. Реакция называется экзотермический если реакция выделяет тепло в окружающую среду; в случае эндотермические реакции, реакция поглощает тепло из окружающей среды.
Химические реакции неизменно невозможны, если реагенты не преодолевают энергетический барьер, известный как энергия активации. В скорость химической реакции (при данной температуре T) связана с энергией активации E коэффициентом заселенности Больцмана - это вероятность того, что молекула будет иметь энергию больше или равную E при данной температуре T. Эта экспоненциальная зависимость скорости реакции от температуры известна как Уравнение Аррениуса Энергия активации, необходимая для протекания химической реакции, может быть в виде тепла, света, электричество или механический сила в виде УЗИ.[27]
Родственная концепция свободная энергия, который также включает соображения энтропии, является очень полезным средством для предсказания осуществимости реакции и определения состояния равновесия химической реакции в химическая термодинамика. Реакция возможна только в том случае, если полное изменение Свободная энергия Гиббса отрицательный, ; если он равен нулю, говорят, что химическая реакция протекает при равновесие.
Существуют только ограниченные возможные состояния энергии для электронов, атомов и молекул. Они определяются правилами квантовая механика, которые требуют квантование энергии связанной системы. Считается, что атомы / молекулы в более высоком энергетическом состоянии возбуждены. Молекулы / атомы вещества в возбужденном энергетическом состоянии часто гораздо более реактивны; то есть более подвержен химическим реакциям.
Фаза вещества неизменно определяется его энергией и энергией окружающей среды. Когда межмолекулярные силы вещества таковы, что энергии окружающей среды недостаточно для их преодоления, оно находится в более упорядоченной фазе, такой как жидкость или твердое тело, как в случае с водой (H2О); жидкость при комнатной температуре, потому что ее молекулы связаны водородные связи.[28] В то время как сероводород (ЧАС2S) представляет собой газ при комнатной температуре и стандартном давлении, так как его молекулы связаны более слабыми диполь-дипольные взаимодействия.
Передача энергии от одного химического вещества к другому зависит от размер энергии кванты выделяется из одного вещества. Однако тепловая энергия часто легче передается практически от любого вещества к другому, потому что фононы ответственные за колебательные и вращательные уровни энергии в веществе имеют гораздо меньше энергии, чем фотоны вызывается для передачи электронной энергии. Таким образом, поскольку уровни колебательной и вращательной энергии расположены ближе друг к другу, чем уровни электронной энергии, тепло легче переносится между веществами по сравнению со светом или другими формами электронной энергии. Например, ультрафиолетовое электромагнитное излучение не передается от одного вещества к другому с такой же эффективностью, как тепловая или электрическая энергия.
Наличие характерных уровней энергии для разных химические субстанции полезно для их идентификации путем анализа спектральные линии. В химической промышленности часто используются разные виды спектров. спектроскопия, например ИК, микроволновая печь, ЯМР, СОЭ и т. д. Спектроскопия также используется для определения состава удаленных объектов, таких как звезды и далекие галактики, путем анализа их спектров излучения.

Период, термин химическая энергия часто используется для обозначения способности химического вещества претерпевать преобразование через химическая реакция или преобразовывать другие химические вещества.
Реакция

Когда химическое вещество трансформируется в результате взаимодействия с другим веществом или с энергией, считается, что произошла химическая реакция. А химическая реакция таким образом, понятие связано с «реакцией» вещества, когда оно вступает в тесный контакт с другим, будь то смесь или решение; воздействие какой-либо формы энергии или того и другого. Это приводит к некоторому обмену энергией между составляющими реакции, а также с системной средой, которая может быть сконструирована как сосуды - часто лабораторная посуда.
Химические реакции могут привести к образованию или диссоциация молекул, то есть молекулы, распадающиеся на части с образованием двух или более молекул или перегруппировку атомов внутри или между молекулами. Химические реакции обычно включают образование или разрыв химических связей. Снижение окисления, диссоциация, кислотно-щелочной нейтрализация и молекулярный перестановка являются одними из наиболее часто используемых видов химических реакций.
Химическую реакцию можно символически изобразить через химическое уравнение. В то время как в неядерной химической реакции количество и вид атомов в обеих частях уравнения равны, для ядерной реакции это справедливо только для ядерных частиц, а именно. протоны и нейтроны.[29]
Последовательность шагов, на которых может происходить реорганизация химических связей в ходе химической реакции, называется ее последовательностью. механизм. Можно представить себе, что химическая реакция протекает в несколько стадий, каждая из которых может иметь разную скорость. Много промежуточные продукты реакции таким образом, можно предусмотреть переменную стабильность в ходе реакции. Предложены механизмы реакции для объяснения кинетика и относительная смесь продуктов реакции. Много физико-химики специализируемся на изучении и предложении механизмов различных химических реакций. Несколько эмпирических правил, таких как Правила Вудворда – Хоффмана часто бывает полезным при предложении механизма химической реакции.
Согласно ИЮПАК Золотая книга, химическая реакция - это «процесс, который приводит к взаимному превращению химических веществ».[30] Соответственно, химическая реакция может быть элементарная реакция или ступенчатая реакция. Сделано дополнительное предостережение, поскольку это определение включает случаи, когда взаимопревращение конформеров экспериментально наблюдаем. Такие поддающиеся обнаружению химические реакции обычно включают в себя наборы молекулярных объектов, как указано в этом определении, но часто концептуально удобно использовать этот термин также для изменений, затрагивающих отдельные молекулярные объекты (то есть «микроскопические химические явления»).
Ионы и соли

An ион представляет собой заряженную разновидность, атом или молекулу, которая потеряла или приобрела один или несколько электронов. Когда атом теряет электрон и, таким образом, имеет больше протонов, чем электронов, атом представляет собой положительно заряженный ион или катион. Когда атом получает электрон и, таким образом, имеет больше электронов, чем протонов, атом является отрицательно заряженным ионом или анион. Катионы и анионы могут образовывать кристаллическую решетку нейтральных соли, например Na+ и Cl− формирование ионов хлорид натрия, или NaCl. Примеры многоатомные ионы которые не распадаются во время кислотно-основные реакции находятся гидроксид (ОЙ−) и фосфат (PO43−).
Плазма состоит из газообразного вещества, которое было полностью ионизировано, обычно при высокой температуре.
Кислотность и основность
Вещество часто можно классифицировать как кислоту или основание. Есть несколько различных теорий, объясняющих кислотно-щелочное поведение. Самый простой - это Теория Аррениуса, в котором говорится, что кислота - это вещество, которое производит ионы гидроксония когда он растворен в воде, а основа - это та, которая производит гидроксид-ионы при растворении в воде. В соответствии с Кислотно-основная теория Бренстеда – Лоури, кислоты - это вещества, дающие положительный водород ион с другим веществом в химической реакции; в более широком смысле, основание - это вещество, которое принимает этот ион водорода.
Третья распространенная теория: Кислотно-основная теория Льюиса, основанный на образовании новых химических связей. Теория Льюиса объясняет, что кислота - это вещество, которое способно принимать пару электронов от другого вещества в процессе образования связи, в то время как основание - это вещество, которое может предоставить пару электронов для образования новой связи. Согласно этой теории, ключевыми предметами обмена являются обвинения.[31] Есть несколько других способов, которыми вещество может быть классифицировано как кислота или основание, как видно из истории этой концепции.[32]
Сила кислоты обычно измеряется двумя методами. Одно измерение, основанное на определении кислотности Аррениуса, - pH, который является мерой концентрации ионов гидроксония в растворе, выраженной на отрицательном логарифмический шкала. Таким образом, растворы с низким pH имеют высокую концентрацию ионов гидроксония и могут быть названы более кислыми. Другое измерение, основанное на определении Бронстеда – Лоури, - это константа диссоциации кислоты (Kа), который измеряет относительную способность вещества действовать как кислота согласно определению кислоты Бренстеда – Лоури. То есть вещества с более высоким Kа с большей вероятностью отдают ионы водорода в химических реакциях, чем те, у которых более низкий Kа значения.
Редокс
Редокс (красныйдействие-быкidation) реакции включают все химические реакции в котором атомы имеют свои степень окисления изменяется либо приобретением электронов (восстановление), либо потерей электронов (окисление). Вещества, которые обладают способностью окислять другие вещества, считаются окислительными и известны как окислители, окислители или окислители. Окислитель удаляет электроны из другого вещества. Точно так же вещества, которые обладают способностью восстанавливать другие вещества, считаются восстанавливающими и известны как восстановители, восстановители или восстановители.
Восстановитель переносит электроны на другое вещество и, таким образом, окисляется. А поскольку он «отдает» электроны, его также называют донором электронов. Окисление и восстановление правильно относятся к изменению степени окисления - фактический перенос электронов может никогда не произойти. Таким образом, окисление лучше определить как увеличение степень окисления, и восстановление как уменьшение степени окисления.
Равновесие
Хотя концепция равновесие широко используется в науках, в контексте химии, он возникает всякий раз, когда возможен ряд различных состояний химического состава, например, в смеси нескольких химических соединений, которые могут реагировать друг с другом, или когда вещество может присутствовать более чем на одной фазе.
Система химических веществ, находящихся в равновесии, хотя и имеет неизменный состав, чаще всего не является статический; молекулы веществ продолжают реагировать друг с другом, вызывая динамическое равновесие. Таким образом, концепция описывает состояние, в котором такие параметры, как химический состав, остаются неизменными с течением времени.
Химические законы
Химические реакции регулируются определенными законами, которые стали фундаментальными понятиями в химии. Некоторые из них:
- Закон Авогадро
- Закон Бера – Ламберта
- Закон Бойля (1662, относительно давления и объема)
- Закон Чарльза (1787 г., относительно объема и температуры)
- Законы диффузии Фика
- Закон Гей-Люссака (1809, относительно давления и температуры)
- Принцип Ле Шателье
- Закон Генри
- Закон Гесса
- Закон сохранения энергии приводит к важным концепциям равновесие, термодинамика, и кинетика.
- Закон сохранения массы продолжает сохраняться в изолированные системы, даже в современной физике. Тем не мение, специальная теория относительности показывает, что из-за эквивалентность массы и энергии всякий раз, когда нематериальная «энергия» (тепло, свет, кинетическая энергия) удаляется из неизолированной системы, некоторая масса будет потеряна вместе с ней. Высокие потери энергии приводят к потере взвешиваемых количеств массы, что является важной темой в ядерная химия.
- Закон определенного состава, хотя во многих системах (особенно в биомакромолекулах и минералах) соотношения, как правило, требуют больших чисел и часто представлены в виде дробей.
- Закон кратных пропорций
- Закон Рауля
История
В история химии охватывает период от очень старых времен до наших дней. С нескольких тысячелетий до нашей эры цивилизации использовали технологии, которые в конечном итоге легли в основу различных отраслей химии. Примеры включают извлечение металлы из руды, изготовление глиняной посуды и глазури, ферментация пива и вина, извлечение химикатов из растений для медицины и парфюмерии, превращение жира в мыло, изготовление стекло, и делая сплавы подобно бронза. Химии предшествовала ее первонаука, алхимия, который представляет собой интуитивный, но ненаучный подход к пониманию составных частей материи и их взаимодействий. Ему не удалось объяснить природу материи и ее превращения, но, проводя эксперименты и записывая результаты, алхимики заложили основу для современной химии. Химия как совокупность знаний, отличная от алхимии, начала появляться, когда между ними было проведено четкое различие. Роберт Бойл в его работе Скептический химик (1661). Хотя и алхимия, и химия связаны с материей и ее преобразованиями, решающее различие было дано научный метод который химики заняты в своей работе. Считается, что химия стала признанной наукой благодаря работе Антуан Лавуазье, который разработал закон сохранение массы это требовало тщательных измерений и количественных наблюдений за химическими явлениями. История химии переплетается с история термодинамики, особенно благодаря работе Уиллард Гиббс.[33]
Определения
Определение химии со временем изменилось, поскольку новые открытия и теории увеличивают функциональность науки. Термин «химия» по мнению известного ученого Роберт Бойл в 1661 г. имел в виду материальные принципы смешанных тел.[34] В 1663 г. химик Кристофер Глейзер описал «химию» как научное искусство, с помощью которого человек учится растворять тела и извлекать из них различные вещества, входящие в их состав, а также как снова объединять их и возносить их к более высокому совершенству.[35]
Определение слова «химия» 1730 г. Георг Эрнст Шталь, означало искусство разделения смешанных, составных или агрегированных тел на их принципы; и составления таких органов на основе этих принципов.[36] В 1837 г. Жан-Батист Дюма считал, что слово «химия» относится к науке, изучающей законы и эффекты молекулярных сил.[37] Это определение продолжало развиваться, пока в 1947 году оно не стало означать науку о веществах: их структуру, их свойства и реакции, которые превращают их в другие вещества - характеристика, принятая Линус Полинг.[38] Совсем недавно, в 1998 г., профессор Раймонд Чанг расширил определение «химии» до обозначения изучения материи и изменений, которым она претерпевает.[39]
Дисциплины
Ранние цивилизации, такие как Египтяне[40] Вавилоняне, Индейцы[41] накопил практические знания в области металлургии, гончарного дела и красок, но не разработал систематическую теорию.
Основная химическая гипотеза впервые возникла в Классическая Греция с теорией четыре элемента как окончательно предложено Аристотель заявив, что Огонь, воздуха, земной шар и воды были основными элементами, из которых все складывается как комбинация. Греческий атомизм восходит к 440 году до нашей эры, возник в трудах философов, таких как Демокрит и Эпикур. В 50 г. до н. Э. Римский философ Лукреций расширил теорию в своей книге De rerum natura (О природе вещей).[42][43] В отличие от современных концепций науки, греческий атомизм был чисто философским по своей природе, мало заботясь об эмпирических наблюдениях и не заботясь о химических экспериментах.[44]
Ранняя форма идеи сохранение массы это понятие "Ничего не происходит из ничего " в Древнегреческая философия, который можно найти в Эмпедокл (прибл. 4 век до н.э.): «Ибо невозможно, чтобы что-либо могло произойти из того, чего не было, и нельзя было вызвать или услышать о том, что то, что есть, должно быть полностью уничтожено».[45] и Эпикур (3 век до н.э.), который, описывая природу Вселенной, писал, что «совокупность вещей всегда была такой, как сейчас, и всегда будет».[46]
в Эллинистический мир искусство алхимии сначала распространилось, смешивая магию и оккультизм в изучении природных веществ с конечной целью превращения элементов в золото и открытие эликсира вечной жизни.[47] Работа, в частности разработка дистилляция, продолжение в начале византийский период, когда самым известным практикующим был греко-египтянин 4-го века Зосим Панополисский.[48] Алхимия продолжала развиваться и практиковаться в Арабский мир после Мусульманские завоевания,[49] и оттуда, и от византийских остатков,[50] распространился в средневековье и эпоха Возрождения Европа в латинских переводах.

Развитие современного научный метод был медленным и трудным, но ранний научный метод химии начал появляться среди ранних мусульманских химиков, начиная с персо-арабского химика 9 века. Джабир ибн Хайян (известный в Европе как «Гебер»), которого иногда называют «отцом химии».[51][52][53][54] Он ввел систематический и экспериментальный подход к научным исследованиям, основанный на лаборатория, в отличие от древнегреческих и египетских алхимиков, чьи работы были в основном аллегорическими и часто непонятными.[55] Он также представил перегонный куб (аль-анбик) персидского энциклопедиста Ибн аль-Аввам в Европу, химически проанализированы многие химические субстанции, в составе гранильные, различать между щелочи и кислоты, и произвел сотни наркотики.[56] Его книги оказали сильное влияние на средневековых европейских алхимиков и оправдали их поиски философский камень.[57][58]в Средний возраст, Трактаты Джабира по алхимии были переведен на латынь и стали стандартными текстами для Европейский алхимики. К ним относятся Китаб аль-Кимья (названный Книга составления алхимии в Европе), переведенный Роберт Честерский (1144); и Китаб ас-Саб'ин (Книга Семидесяти) к Жерар Кремоны (до 1187 г.). Позже влиятельные мусульманские философы, такие как Абу аль-Райхан аль-Бируни,[59] Авиценна[60] и Аль-Кинди оспаривал теории алхимии, особенно теорию трансмутация металлов.
Под влиянием новые эмпирические методы выдвинутый Сэр Фрэнсис Бэкон и др., группа химиков на Оксфорд, Роберт Бойл, Роберт Гук и Джон Мэйоу начал преобразовывать старые алхимические традиции в научную дисциплину. В частности, Бойль считается отцом-основателем химии из-за его самой важной работы - классического текста по химии. Скептический химик где проводится различие между утверждениями алхимии и эмпирическими научными открытиями новой химии.[61] Он сформулировал Закон Бойля, отверг классические «четыре элемента» и предложил механистическую альтернативу атомов и химические реакции это можно было бы подвергнуть строгому эксперименту.[62]

Теория флогистон (вещество, лежащее в основе всего горения) было предложено немецкими Георг Эрнст Шталь в начале 18 века и только к концу века был отменен французским химиком Антуан Лавуазье, химический аналог Ньютона в физике; кто сделал больше, чем кто-либо другой, чтобы поставить новую науку на должную теоретическую основу, разъяснив принцип сохранение массы и разработка новой системы химической номенклатуры, используемой по сей день.[64]
Однако до его работы было сделано много важных открытий, в частности, касающихся природы «воздуха», который, как было обнаружено, состоит из множества различных газов. Шотландский химик Джозеф Блэк (первый химик-экспериментатор) и голландец Дж. Б. ван Гельмонт обнаруженный углекислый газ, или то, что Блэк называл «неподвижным воздухом» в 1754 году; Генри Кавендиш обнаруженный водород и выяснил его свойства и Джозеф Пристли и, независимо, Карл Вильгельм Шееле изолированный чистый кислород.
Английский ученый Джон Далтон предложил современный теория атомов; что все вещества состоят из неделимых «атомов» материи и что разные атомы имеют разный атомный вес.
Развитие электрохимической теории химических комбинаций произошло в начале 19 века в результате работы двух ученых, в частности, Йенс Якоб Берцелиус и Хэмфри Дэви, что стало возможным благодаря предшествующему изобретению гальваническая свая к Алессандро Вольта. Дэви открыл девять новых элементов, включая щелочных металлов извлекая их из оксиды с электрическим током.[65]

Британский Уильям Праут сначала предложил упорядочить все элементы по их атомному весу, так как все атомы имели вес, который был точным кратным атомному весу водорода. БАНКА. Newlands разработал раннюю таблицу элементов, которая затем превратилась в современную периодическая таблица элементов[68] в 1860-х годах Дмитрий Менделеев и независимо несколькими другими учеными, включая Юлиус Лотар Мейер.[69][70] Инертные газы, позже названные благородные газы были обнаружены Уильям Рамзи в сотрудничестве с Лорд Рэйли в конце века, заполнив тем самым основную структуру таблицы.

Нижний: Наблюдаемые результаты: небольшая часть частиц отклонилась, что указывает на небольшой концентрированный заряд.
На рубеже двадцатого века теоретические основы химии были окончательно поняты благодаря серии замечательных открытий, которые позволили исследовать и раскрыть саму природу внутренней структуры атомов. В 1897 г. J.J. Томсон из Кембриджский университет обнаружил электрон и вскоре после того, как французский ученый Беккерель а также пара Пьер и Мари Кюри исследовал феномен радиоактивность. В серии новаторских экспериментов по рассеянию Эрнест Резерфорд на Манчестерский университет открыл внутреннюю структуру атома и существование протона, классифицировал и объяснил различные типы радиоактивности и успешно преобразованный первый элемент бомбардировкой азот с альфа-частицы.
Его работу по атомной структуре улучшили его ученики, датский физик. Нильс Бор и Генри Мозли. Электронная теория химические связи и молекулярные орбитали разработан американскими учеными Линус Полинг и Гилберт Н. Льюис.
2011 год был объявлен Организацией Объединенных Наций Международным годом химии.[71] Это была инициатива Международного союза чистой и прикладной химии и Организации Объединенных Наций по вопросам образования, науки и культуры, в ней участвовали химические общества, ученые и учреждения во всем мире, и она опиралась на отдельные инициативы по организации местных и региональных мероприятий.
Органическая химия была разработана Юстус фон Либих и другие, следующие Фридрих Вёлер синтез мочевина что доказало, что живые организмы теоретически можно свести к химии.[72] Другими важными достижениями 19-го века были; понимание валентных связей (Эдвард Франкленд в 1852 г.) и применение термодинамики к химии (Дж. У. Гиббс и Сванте Аррениус в 1870-е годы).
Упражняться
Субдисциплины
Химия обычно делится на несколько основных дисциплин. Есть также несколько основных междисциплинарных и более специализированных областей химии.[73]
- Аналитическая химия анализ образцов материалов для понимания их химический состав и структура. Аналитическая химия включает стандартизированные экспериментальные методы в химии. Эти методы могут использоваться во всех разделах химии, за исключением чисто теоретической химии.
- Биохимия это исследование химикаты, химические реакции и химические взаимодействия что происходит в жизни организмы. Биохимия и органическая химия тесно связаны, так как в медицинская химия или же нейрохимия. Биохимия также связана с молекулярная биология и генетика.
- Неорганическая химия это изучение свойств и реакций неорганических соединений. Различие между органическими и неорганическими дисциплинами не является абсолютным, и есть много совпадений, что наиболее важно в суб-дисциплинах металлоорганическая химия.
- Химия материалов это приготовление, характеристика и понимание веществ с полезной функцией. Эта область представляет собой новую широту обучения в программах магистратуры, и она объединяет элементы из всех классических областей химии с акцентом на фундаментальные вопросы, которые уникальны для материалов. Основные системы изучения включают химию конденсированных фаз (твердых тел, жидкостей, полимеры ) и интерфейсы между разными фазами.
- Нейрохимия это изучение нейрохимические вещества; включая трансмиттеры, пептиды, белки, липиды, сахара и нуклеиновые кислоты; их взаимодействия и роли, которые они играют в формировании, поддержании и изменении нервной системы.
- Ядерная химия это исследование того, как субатомные частицы объединяются и образуют ядра. Современное Трансмутация является важным компонентом ядерной химии, а таблица нуклидов важный результат и инструмент для этой области.
- Органическая химия это исследование структуры, свойств, состава, механизмов и реакции из органические соединения. Органическое соединение определяется как любое соединение на основе углеродного скелета.
- Физическая химия это изучение физических и фундаментальных основ химических систем и процессов. В частности, для физико-химиков интересны энергетика и динамика таких систем и процессов. Важные области исследования включают: химическая термодинамика, химическая кинетика, электрохимия, статистическая механика, спектроскопия, а совсем недавно астрохимия.[74] Физическая химия во многом пересекается с молекулярная физика. Физическая химия предполагает использование исчисление бесконечно малых при выводе уравнений. Обычно это связано с квантовая химия и теоретическая химия. Физическая химия - это отдельная дисциплина от химическая физика, но опять же, здесь очень сильное перекрытие.
- Теоретическая химия изучение химии посредством фундаментальных теоретических рассуждений (обычно в рамках математика или же физика ). В частности, применение квантовая механика химии называется квантовая химия. С конца Вторая мировая война, развитие компьютеров позволило систематически развивать вычислительная химия, это искусство разработки и применения компьютерные программы для решения химических проблем. Теоретическая химия во многом пересекается с (теоретической и экспериментальной) физика конденсированного состояния и молекулярная физика.
Другие дисциплины в химии традиционно сгруппированы по типу изучаемого материала или виду исследования. К ним относятся неорганическая химия, изучение неорганический иметь значение; органическая химия, изучение органический (углеродные) вещества; биохимия, изучение вещества нашел в биологические организмы; физическая химия, изучение химических процессов с использованием физических понятий, таких как термодинамика и квантовая механика; и аналитическая химия, анализ образцов материалов, чтобы понять их химический состав и структура. В последние годы появилось гораздо больше специализированных дисциплин, например нейрохимия химическое исследование нервная система (видеть субдисциплины ).
Другие поля включают агрохимия, астрохимия (и космохимия ), химия атмосферы, химическая инженерия, химическая биология, химио-информатика, электрохимия, химия окружающей среды, фемтохимия, ароматическая химия, химия потока, геохимия, зеленая химия, гистохимия, история химии, химия гидрирования, иммунохимия, морская химия, материаловедение, математическая химия, механохимия, медицинская химия, молекулярная биология, молекулярная механика, нанотехнологии, химия натуральных продуктов, энология, металлоорганическая химия, нефтехимия, фармакология, фотохимия, физическая органическая химия, фитохимия, химия полимеров, радиохимия, химия твердого тела, сонохимия, супрамолекулярная химия, химия поверхности, синтетическая химия, термохимия, и много других.
Промышленность
В химическая индустрия представляет собой важную экономическую деятельность во всем мире. В 50 ведущих мировых производителей химической продукции в 2013 году было продано АМЕРИКАНСКИЙ ДОЛЛАР$ 980,5 млрд при рентабельности 10,3%.[75]
Профессиональные общества
- Американское химическое общество
- Американское общество нейрохимии
- Химический институт Канады
- Химическое общество Перу
- Международный союз теоретической и прикладной химии
- Королевский австралийский химический институт
- Королевское химическое общество Нидерландов
- Королевское химическое общество
- Общество химической промышленности
- Всемирная ассоциация теоретиков и вычислительных химиков
- Список обществ химии
Смотрите также
Рекомендации
- ^ "Что такое химия?". Chemweb.ucc.ie. Получено 12 июн 2011.
- ^ «Определение ХИМИИ». www.merriam-webster.com. Получено 24 августа 2020.
- ^ "Определение химии | Dictionary.com". www.dictionary.com. Получено 24 августа 2020.
- ^ Карстен Райнхардт. Химические науки в ХХ веке: преодолевая границы. Вайли-ВЧ, 2001. ISBN 3-527-30271-9. С. 1–2.
- ^ Теодор Л. Браун, Х. Юджин Лемей, Брюс Эдвард Бурстен, Х. Лемей. Химия: центральная наука. Прентис Холл; 8 издание (1999 г.). ISBN 0-13-010310-1. С. 3–4.
- ^ «История алхимии». Алхимическая лаборатория. Получено 12 июн 2011.
- ^ а б "алхимия", вход в Оксфордский словарь английского языка, J.A. Симпсон и E.S.C. Вайнер, т. 1, 2-е изд., 1989 г., ISBN 0-19-861213-3.
- ^ п. 854, «Арабская алхимия», Жорж К. Анавати, стр. 853–885 в Энциклопедия истории арабской науки, ред. Рошди Рашед и Регис Морелон, Лондон: Рутледж, 1996, т. 3, ISBN 0-415-12412-3.
- ^ Уикли, Эрнест (1967). Этимологический словарь современного английского языка. Нью-Йорк: Dover Publications. ISBN 0-486-21873-2
- ^ "химическая связь". Британика. Британская энциклопедия. Получено 1 ноября 2012.
- ^ Материя: атомы от Демокрита до Дальтона Энтони Карпи, доктор философии
- ^ ИЮПАК Золотая книга Определение
- ^ "Калифорнийский профессиональный справочник № 22: Химики". Calmis.ca.gov. 29 октября 1999 г. Архивировано с оригинал 10 июня 2011 г.. Получено 12 июн 2011.
- ^ «Общая химия в Интернете - дополнительные заметки: материя». Antoine.frostburg.edu. Получено 12 июн 2011.
- ^ Армстронг, Джеймс (2012). Общая, органическая и биохимия: прикладной подход. Брукс / Коул. п. 48. ISBN 978-0-534-49349-3.
- ^ Берроуз и др. 2008 г., п. 13.
- ^ а б Housecroft & Sharpe 2008, п. 2.
- ^ Берроуз и др. 2009 г., п. 110.
- ^ Берроуз и др. 2008 г., п. 12.
- ^ «Номенклатура органической химии ИЮПАК». Acdlabs.com. Получено 12 июн 2011.
- ^ Коннелли, Нил Г.; Дамхус, Туре; Хартсхорн, Ричард М.; Хаттон, Алан Т. (2005). Номенклатура неорганической химии Рекомендации ИЮПАК 2005 г.. RSCPublishing. стр.5 –12. ISBN 978-0-85404-438-2.
- ^ Hill, J.W .; Petrucci, R.H .; McCreary, T.W .; Перри, С.С. (2005). Общая химия (4-е изд.). Река Аппер Сэдл, Нью-Джерси: Пирсон Прентис Холл. п. 37.
- ^ М.М. Аведезийский; Хью Бейкер. Магний и магниевые сплавы. ASM International. п. 59.
- ^ Берроуз и др. 2008 г., п. 16.
- ^ Аткинс и де Паула 2009, п. 9.
- ^ Visionlearning. "Химическая связь Энтони Карпи, доктор философии". видениеобучение. Получено 12 июн 2011.
- ^ Рейли, Майкл. (2007). Механическая сила вызывает химическую реакцию, Служба новостей NewScientist.com, Рейли
- ^ Изменение состояний материи - Chemforkids.com
- ^ Уравнение химической реакции - Золотая книга ИЮПАК
- ^ Золотая книга Химическая реакция Золотая книга ИЮПАК
- ^ «Кислотно-основная концепция Льюиса». Апсидиум. 19 мая 2003. Архивировано с оригинал 27 мая 2008 г.. Получено 31 июля 2010.[ненадежный источник? ]
- ^ «История кислотности». Bbc.co.uk. 27 мая 2004 г.. Получено 12 июн 2011.
- ^ Избранные классические труды по истории химии
- ^ Бойль, Роберт (1661). Скептический химик. Нью-Йорк: Dover Publications, Inc. (перепечатка). ISBN 978-0-486-42825-3.
- ^ Глейзер, Кристофер (1663). Traite de la chymie. Париж. как найдено в: Ким, Ми Гён (2003). Близость, та неуловимая мечта - генеалогия химической революции. MIT Press. ISBN 978-0-262-11273-4.
- ^ Шталь, Джордж, Э. (1730). Философские принципы универсальной химии. Лондон.
- ^ Дюма, Ж. Б. (1837). «Affinite» (конспект лекций), vii, стр. 4. «Statique chimique», Париж: Académie des Sciences
- ^ Полинг, Линус (1947). Общая химия. Dover Publications, Inc. ISBN 978-0-486-65622-9.
- ^ Чанг, Раймонд (1998). Химия, 6-е изд.. Нью-Йорк: Макгроу Хилл. ISBN 978-0-07-115221-1.
- ^ Первые химики, 13 февраля 1999 г., New Scientist
- ^ Барнс, Рут (2004). Текстиль в обществах Индийского океана. Рутледж. п.1.
- ^ Лукреций. "de Rerum Natura (О природе вещей)". Архив интернет-классики. Массачусетский Институт Технологий. Получено 9 января 2007.
- ^ Симпсон, Дэвид (29 июня 2005 г.). "Лукреций (ок. 99–55 до н. Э.)". История философии в Интернете. Получено 10 ноября 2020.
- ^ Стродач, Джордж К. (2012). Искусство счастья. Нью-Йорк: Классика пингвинов. С. 7–8. ISBN 978-0-14-310721-7.
- ^ Пт. 12; см. стр. 291–2 из Кирк, Г. С .; Дж. Э. Рэйвен; Малкольм Шофилд (1983). Досократические философы (2-е изд.). Кембридж: Издательство Кембриджского университета. ISBN 978-0-521-27455-5.
- ^ Лонг, А. А .; Д. Н. Седли (1987). «Эпикуреизм: принципы сохранения». Философы эллинизма. Том 1: Переводы основных источников с философскими комментариями. Кембридж: Издательство Кембриджского университета. С. 25–26. ISBN 978-0-521-27556-9.
- ^ «Международный год химии - история химии». G.I.T. Лаборатория журнала Европа. 25 февраля 2011. Архивировано с оригинал 15 июня 2013 г.. Получено 12 марта 2013.
- ^ Брайан Х. Банч и Александр Хеллеманс (2004). История науки и техники. Houghton Mifflin Harcourt. п.88. ISBN 978-0-618-22123-3.
- ^ Моррис Клайн (1985) Математика для нематематика. Courier Dover Publications. п. 284. ISBN 0-486-24823-2
- ^ Марселин Бертело, Коллекция des anciens alchimistes grecs (3 т., Париж, 1887–1888, с. 161); Ф. Шервуд Тейлор, «Истоки греческой алхимии». Ambix 1 (1937), 40.
- ^ Derewenda, Zygmunt S .; Derewenda, ZS (2007). «О вине, хиральности и кристаллографии». Acta Crystallographica Раздел A. 64 (Pt 1): 246–258 [247]. Bibcode:2008AcCrA..64..246D. Дои:10.1107 / S0108767307054293. PMID 18156689.
- ^ Джон Уоррен (2005). «Война и культурное наследие Ирака: дело, к сожалению, плохо организованное», Третий мир ежеквартально, Том 26, выпуск 4 и 5, стр. 815–830.
- ^ Д-р А. Захур (1997), Джабир ибн Хайян (Гебер)
- ^ Пол Валлели, Как исламские изобретатели изменили мир, Независимый, 10 марта 2006 г.
- ^ Краус, Пауль, Джабир ибн Хайян, Contribution à l'histoire des idées scientifiques dans l'Islam. I. Le corpus des écrits jâbiriens. II. Jâbir et la science grecque,. Каир (1942–1943). Repr. Фуат Сезгин, (Естественные науки в исламе. 67–68), Франкфурт. 2002:
«Чтобы составить представление об историческом месте алхимии Джабира и решить проблему ее источников, рекомендуется сравнить его с тем, что осталось от алхимической литературы на греческом языке. Известно, в каком жалком состоянии эта литература достигла нас. Собран Византийские ученые с десятого века корпус греческих алхимиков представляет собой скопление бессвязных фрагментов, восходящих ко всем временам, начиная с третьего века до конца средневековья ».
"Попытки Бертло и Рюэля навести порядок в этой массе литературы привели только к плохим результатам, и более поздние исследователи, среди которых, в частности, г-жа Хаммер-Йенсен, Кожевник, Лагеркранц, фон Липпманн, Райценштейн, Руска, Бидез , Festugiere и другие смогли прояснить лишь некоторые детали ...
Изучение греческих алхимиков не очень обнадеживает. Даже поверхностное изучение греческих текстов показывает, что лишь очень небольшая часть была организована в соответствии с настоящими лабораторными экспериментами: даже предположительно технические сочинения в том состоянии, в котором мы находим их сегодня, представляют собой непонятную чепуху, которая отвергает любую интерпретацию.
С алхимией Джабира дело обстоит иначе. Относительно четкое описание процессов и алхимических аппаратов, методическая классификация веществ, отмечают экспериментальный дух, который чрезвычайно далек от странного и странного эзотеризма греческих текстов. Теория, на основе которой Джабир поддерживает свои операции, отличается ясностью и впечатляющим единством. У него больше, чем у других арабских авторов, отмечается баланс между теоретическим обучением и практическим обучением, между `ilm и Амаль. Напрасно можно было бы искать в греческих текстах такую систематическую работу, как та, которая представлена, например, в Книга Семидесяти."
(ср. Ахмад и Хасан. «Критическая переоценка проблемы Гебера: Часть третья». В архиве из оригинала 20 ноября 2008 г.. Получено 9 августа 2008.)
- ^ Уилл Дюрант (1980). Эпоха веры (История цивилизации, Том 4), п. 162-186. Саймон и Шустер. ISBN 0-671-01200-2.
- ^ Рагаи, Джехан (1992). «Философский камень: алхимия и химия». Журнал сравнительной поэтики. 12 (Метафора и аллегория в средние века): 58–77. Дои:10.2307/521636. JSTOR 521636.
- ^ Холмярд, Э. Дж. (1924). «Маслама аль-Маджрити и Рутбатул-Хаким». Исида. 6 (3): 293–305. Дои:10.1086/358238.
- ^ Мармура, Майкл Э .; Наср, Сейед Хоссейн (1965). "Введение в исламские космологические доктрины. Представления о природе и методы ее изучения Ихваном ас-Сафааном, аль-Бируни и Ибн Синой Сейеда Хоссейна Насра ". Зеркало. 40 (4): 744–746. Дои:10.2307/2851429. JSTOR 2851429.
- ^ Роберт Бриффо (1938). Создание человечестваС. 196–197.
- ^ «Роберт Бойл, основатель современной химии» Гарри Соотин (2011)
- ^ "История - Роберт Бойль (1627–1691)". BBC. Получено 12 июн 2011.
- ^ Eagle, Cassandra T .; Дженнифер Слоун (1998). "Мари-Анн Польз Лавуазье: мать современной химии". Химический педагог. 3 (5): 1–18. Дои:10.1007 / s00897980249a.
- ^ Ми Гюн Ким (2003). Близость, та неуловимая мечта: генеалогия химической революции. MIT Press. п.440. ISBN 978-0-262-11273-4.
- ^ Дэви, Хамфри (1808). «О некоторых новых явлениях химических изменений, производимых электричеством, в частности о разложении фиксированных щелочей и демонстрации новых веществ, составляющих их основы». Философские труды Королевского общества. 98: 1–45. Дои:10.1098 / рстл.1808.0001.
- ^ Химия 412 конспектов курса. «Краткая история развития Периодической таблицы». Университет Западного Орегона. Получено 20 июля 2015.
- ^ Примечание: «... это действительно правда, что если бы Менделеев никогда не жил, современные химики использовали бы Периодическую таблицу» и "Дмитрий Менделеев". Королевское химическое общество. Получено 18 июля 2015.
- ^ Зима, Марк. "WebElements: периодическая таблица в сети". В Университет Шеффилда. В архиве из оригинала 4 января 2014 г.. Получено 27 января 2014.
- ^ "Юлий Лотар Мейер и Дмитрий Иванович Менделеев". Институт истории науки. Июнь 2016. Получено 20 марта 2018.
- ^ «Что делает эти семейные сходства среди стихий? В 1860-е годы все ломали голову над этим, и некоторые ученые пришли к довольно схожим ответам. Наиболее триумфально решивший проблему человек был молодой россиянин по имени Дмитрий Иванович Менделеев, который посетил соляная шахта в Величке в 1859 году ». Броновски, Якоб (1973). Восхождение человека. Литтл, Браун и компания. п.322. ISBN 978-0-316-10930-7.
- ^ "Химия". Chemistry2011.org. Архивировано из оригинал 8 октября 2011 г.. Получено 10 марта 2012.
- ^ Ihde, Аарон Джон (1984). Развитие современной химии. Courier Dover Publications. п. 164. ISBN 978-0-486-64235-2.
- ^ W.G. Laidlaw; D.E. Райан; Гэри Хорлик; H.C. Кларк; Йозеф Такац; Мартин Коуи; RU. Лемье (10 декабря 1986 г.). «Химические дисциплины». Канадская энциклопедия. Архивировано из оригинал 12 марта 2012 г.. Получено 12 июн 2011.
- ^ Хербст, Эрик (12 мая 2005 г.). «Химия звездообразующих областей». Журнал физической химии А. 109 (18): 4017–4029. Bibcode:2005JPCA..109.4017H. Дои:10.1021 / jp050461c. PMID 16833724.
- ^ Талло, Александр Х. (28 июля 2014 г.). «50 лучших химических компаний мира по версии C&EN за 2014 год». Новости химии и машиностроения. Американское химическое общество. Получено 22 августа 2014.
Библиография
- Аткинс, Питер; де Паула, Хулио (2009) [1992]. Элементы физической химии (5-е изд.). Нью-Йорк: Oxford University Press. ISBN 978-0-19-922672-6.
- Берроуз, Эндрю; Холман, Джон; Парсонс, Эндрю; Пиллинг, Гвен; Цена, Гарет (2009). Химия3. Италия: Oxford University Press. ISBN 978-0-19-927789-6.
- Housecroft, Catherine E .; Шарп, Алан Г. (2008) [2001]. Неорганическая химия (3-е изд.). Харлоу, Эссекс: Pearson Education. ISBN 978-0-13-175553-6.
дальнейшее чтение
- Популярное чтение
- Аткинс, П. Палец Галилея (Oxford University Press ) ISBN 0-19-860941-8
- Аткинс, П. Молекулы Аткинса (Издательство Кембриджского университета) ISBN 0-521-82397-8
- Кин, Сэм. Исчезающая ложка - и другие правдивые сказки из периодической таблицы (Черный лебедь) Лондон, 2010 ISBN 978-0-552-77750-6
- Леви, Примо Периодическая таблица (Penguin Books) [1975], перевод с итальянского Раймонда Розенталя (1984) ISBN 978-0-14-139944-7
- Штвертка, А. Путеводитель по элементам (Издательство Оксфордского университета) ISBN 0-19-515027-9
- «Словарь истории идей». Архивировано из оригинал 10 марта 2008 г.
- . Британская энциклопедия. 6 (11-е изд.). 1911. С. 33–76.
- Учебники для вводного курса бакалавриата
- Аткинс, П.У., Овертон, Т., Рурк, Дж., Веллер, М. и Армстронг, Ф. Неорганическая химия Шрайвера и Аткинса (4-е издание) 2006 г. (Oxford University Press) ISBN 0-19-926463-5
- Чанг, Раймонд. Химия 6-е изд. Бостон: Джеймс М. Смит, 1998. ISBN 0-07-115221-0.
- Клейден, Джонатан; Гривс, Ник; Уоррен, Стюарт; Уотерс, Питер (2001). Органическая химия (1-е изд.). Издательство Оксфордского университета. ISBN 978-0-19-850346-0.
- Воет и Воет Биохимия (Вайли) ISBN 0-471-58651-X
- Продвинутые учебники для бакалавриата или магистратуры
- Аткинс, П. Физическая химия (Издательство Оксфордского университета) ISBN 0-19-879285-9
- Аткинс, П. и другие. Молекулярная квантовая механика (Издательство Оксфордского университета)
- Маквини, Р. Валентность Коулсона (Публикации Oxford Science) ISBN 0-19-855144-4
- Полинг, Л. Природа химической связи (Издательство Корнельского университета) ISBN 0-8014-0333-2
- Полинг, Л., Уилсон, Э. Введение в квантовую механику с приложениями к химии (Dover Publications) ISBN 0-486-64871-0
- Смарт и Мур Химия твердого тела: введение (Чепмен и Холл) ISBN 0-412-40040-5
- Стивенсон, Г. Математические методы для студентов естественных наук (Лонгман) ISBN 0-582-44416-0



