Периодическая таблица - Periodic table

В периодическая таблица, также известный как периодическая таблица элементов, организует химические элементы Такие как водород, кремний, утюг, и уран в соответствии с их повторяющимися свойствами. Номер каждого элемента соответствует количеству протонов в его ядре (которое совпадает с количеством электронов, вращающихся вокруг этого ядра). Современная таблица Менделеева представляет собой полезную основу для анализа химические реакции, и широко используется в химия, физика и другие науки.
Семь строк таблицы, называемой периоды, как правило, есть металлы слева и неметаллы справа. Колонны, называемые группы, содержат элементы со схожим химическим поведением. Шесть групп имеют принятые имена, а также присвоенные номера: например, элементы группы 17 являются галогены; и группа 18 - это благородные газы. Также отображаются четыре простых прямоугольных области или блоки связанных с наполнением разных атомные орбитали. Организация периодической таблицы может быть использована для установления взаимосвязей между различными свойствами элементов, а также для прогнозирования химических свойств и поведения неоткрытых или вновь синтезированных элементов.
Русский химик Дмитрий Менделеев опубликовал первую узнаваемую периодическую таблицу в 1869 году, разработанную в основном для иллюстрации периодических тенденций известных тогда элементов. Он также предсказал некоторые свойства неопознанные элементы которые должны были заполнить пробелы в таблице. Большинство его прогнозов вскоре подтвердились, кульминацией чего стало открытие галлий и германий в 1875 и 1886 годах соответственно, что подтвердило его прогнозы.[1] Идея Менделеева постепенно расширялась и уточнялась. открытие или синтез дополнительных новых элементов и разработка новых теоретических моделей для объяснения химического поведения.
В таблице представлен широко используемый макет. Другие формы (обсуждаются ниже ) подробно показывают различные конструкции. Продолжаются некоторые обсуждения относительно размещения и категоризации конкретных элементов, будущего расширения и ограничений таблицы, а также того, существует ли оптимальная форма таблицы.
| Часть серия на |
| Периодическая таблица |
|---|
Формы периодической таблицы |
По структуре таблицы Менделеева |
Страницы данных для элементов
|
|
Подробная таблица
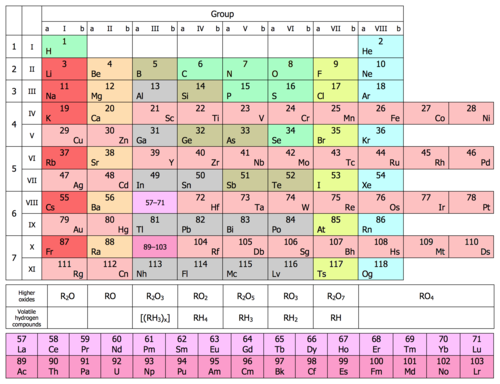
| Группа | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Водород и щелочных металлов | Щелочноземельные металлы | Пниктогены | Халькогены | Галогены | благородные газы | ||||||||||||||
| Период | |||||||||||||||||||
| 2 | |||||||||||||||||||
| 3 | |||||||||||||||||||
| 4 | |||||||||||||||||||
| 5 | |||||||||||||||||||
| 6 | |||||||||||||||||||
| 7 | |||||||||||||||||||
1 (красный) =Газ 3 (черный) =Твердый 80 (зеленый) =Жидкость 109 (серый) = Неизвестно Цвет атомного номера показывает состояние дела (в 0 ° C и 1 атм )
- Ca:40.078 - Формальное краткое значение, округленное (без неопределенности)[3]
- По: [209] - массовое число самого стабильного изотопа
Фоновый цвет показывает подкатегорию в тренде металл – металлоид – неметалл:
| Металл | Металлоид | Неметалл | Неизвестный химический характеристики | |||||||
| Щелочной металл | Щелочноземельный металл | Лантаноид | Актинид | Переходный металл | Пост переходный металл | Реактивный неметалл | благородный газ | |||
Номер каждого элемента - его атомный номер - соответствует количеству протонов в его ядре и количеству электронов, вращающихся вокруг этого ядра.
Наборы элементов
- В этом разделе описаны металлы и неметаллы (и металлоиды); категории элементов; группы и периоды; и блоки периодической таблицы.
Хотя признание металлов твердыми, легкоплавкими и в целом пластичными веществами восходит к древности,[4][5] Антуан Лавуазье может быть первым, кто официально различит металлы и неметаллы ("неметаллики") в 1789 г. с публикацией его «революционной»[6] Элементарный трактат по химии.[7] В 1811 г. Берцелиус называют неметаллические элементы металлоидами,[8][9] в отношении их способности образовывать оксианионы.[10][11] В 1825 г. в исправленном немецком издании его Учебник химии,[12][13] он разделил металлоиды на три класса. Это были: постоянно газообразные «газолиты» (водород, азот, кислород); настоящие металлоиды (сера, фосфор, углерод, бор, кремний); и солеобразующие «галогены» (фтор, хлор, бром, йод).[14] Лишь недавно, с середины 20 века, термин «металлоид» стал широко использоваться для обозначения элементов с промежуточными или пограничными свойствами между металлами и неметаллами. Менделеев опубликовал свою периодическую таблицу в 1869 году вместе со ссылками на группы семейств элементов и строк или периодов своей периодической таблицы. В то же время, Hinrichs писали, что на периодической таблице можно провести простые линии, чтобы обозначить интересующие свойства, например, элементы, имеющие металлический блеск (в отличие от тех, которые не имеют такого блеска).[15] Чарльз Джанет в 1928 году, похоже, первым обратился к блокам периодической таблицы.[16]
Металлы, металлоиды и неметаллы

Классификация может отличаться в зависимости от авторской направленности.
В соответствии с их общими физическими и химическими свойствами элементы можно разделить на основные категории металлы, металлоиды и неметаллы. Металлы, как правило, представляют собой блестящие твердые тела с высокой проводимостью, которые образуют сплавы друг с другом и солевые ионные соединения с неметаллами (кроме благородные газы ). Большинство неметаллов представляют собой цветные или бесцветные изоляционные газы; неметаллы, образующие соединения с другими неметаллами ковалентная связь. Между металлами и неметаллами находятся металлоиды, которые имеют промежуточные или смешанные свойства.[17]
Металлы и неметаллы можно дополнительно разделить на подкатегории, которые демонстрируют градацию от металлических до неметаллических свойств при перемещении слева направо в строках. Металлы можно подразделить на щелочные металлы с высокой реакционной способностью, на менее реакционные щелочноземельные металлы, лантаноиды и актиниды, на типичные переходные металлы и заканчивая физически и химически слабыми постпереходными металлами. Неметаллы можно просто разделить на многоатомные неметаллы, находясь ближе к металлоидам и проявляя некоторый зарождающийся металлический характер; по существу неметаллический двухатомные неметаллы, неметаллические и почти полностью инертные одноатомные благородные газы. Специализированные группы, такие как тугоплавкие металлы и благородные металлы, являются примерами подмножеств переходных металлов, также известных[18] и иногда обозначается.[19]
Размещение элементов в категориях и подкатегориях только на основе общих свойств несовершенно. Внутри каждой категории наблюдается большое несоответствие свойств с заметным перекрытием границ, как в случае с большинством схем классификации.[20] Бериллий, например, классифицируется как щелочноземельный металл, хотя его амфотерный химический состав и склонность к образованию в основном ковалентных соединений являются атрибутами химически слабого или пост-переходного металла. Радон классифицируется как неметаллический благородный газ, но имеет некоторую катионную химию, характерную для металлов. Возможны другие схемы классификации, такие как разделение элементов на категории минералогических проявлений, или же кристаллические структуры. Такая классификация элементов восходит к 1869 году, когда Hinrichs[21] писал, что простые граничные линии могут быть нанесены на периодическую таблицу, чтобы показать элементы, имеющие общие свойства, такие как металлы, неметаллы или газообразные элементы.
Категории
Набор элементов, обладающих некоторыми общими свойствами, обычно объединяется в химические категории. Некоторые из этих категорий известны лучше, чем другие; среди самых известных переходные металлы, благородные газы, и галогены. Пниктогены сделать одну категорию признанной наиболее авторитетным органом химической номенклатуры, Международный союз теоретической и прикладной химии (ИЮПАК), но это название не очень часто встречается в литературе; напротив, он избегает использования термина металлоид, что довольно хорошо известно в литературе. Обычно используется подмножество диапазона категорий для цветового обозначения элементов периодической таблицы.
Основное обоснование общего поведения в рамках категории обычно можно объяснить положением этих элементов в периодической таблице: например, благородные газы, хорошо известные своей химической инертностью, находятся в крайнем правом столбце, что означает, что они имеют полные электронные оболочки. и, таким образом, очень не желают участвовать в химических реакциях, тогда как галогены, которые известны как очень реактивные элементы и расположены слева от благородных газов, не имеют одного электрона для достижения такой конфигурации и, следовательно, с большой вероятностью будут притягивать один электрон. По этой причине многие категории соответствуют группам в периодической таблице, хотя бывают и исключения. Категории могут перекрываться, и их имена не обязательно должны отражать их общие свойства; например, редкие земли не особо редки.
Разные авторы могут использовать разные категории в зависимости от интересующих свойств. Кроме того, разные авторы могут расходиться во мнениях относительно того, какие элементы к каким категориям относятся, особенно в отношении границ. Приблизительное соответствие между группами и подобными химическими свойствами может нарушиться для некоторых из самых тяжелых элементов из-за сильных релятивистских эффектов,[22] и хотя распространено распространение категорий на всю группу, несмотря на это, некоторые вопросы были подняты по поводу этой практики.
Группы
А группа или же семья представляет собой вертикальный столбец в периодической таблице. Группы обычно имеют более значительные периодические тренды, чем периоды и блоки, как описано ниже. Современные квантово-механические теории атомной структуры объясняют групповые тенденции, предполагая, что элементы в одной и той же группе обычно имеют одинаковые электронные конфигурации. валентной оболочки.[23] Следовательно, элементы в одной группе, как правило, имеют общий химический состав и демонстрируют четкую тенденцию в свойствах с увеличением атомного номера.[24] В некоторых частях таблицы Менделеева, таких как d-блок и f-блок, горизонтальное сходство может быть столь же важным, как вертикальное, или более выраженным.[25][26][27]
Согласно международному соглашению об именах, группы нумеруются от 1 до 18 от крайнего левого столбца (щелочные металлы) до крайнего правого столбца (благородные газы).[28] Ранее они были известны римские цифры. В Америке за римскими цифрами следовала буква «А», если группа входила в s- или же p-блок, или "B", если группа была в d-блок. Используемые римские цифры соответствуют последней цифре сегодняшнего соглашения об именах (например, группа 4 элемента были группы IVB, а группа 14 элементов были группы IVA). В Европе буквы были аналогичными, за исключением того, что использовалась буква «А», если группа была раньше. группа 10, и "B" использовалось для групп, включая и после группы 10. Кроме того, группы 8, 9 и 10 обычно рассматривались как одна группа тройного размера, известная вместе в обоих обозначениях как группа VIII. В 1988 году была введена в действие новая система именования ИЮПАК, и старые имена групп были объявлены устаревшими.[29]
Некоторым из этих групп было присвоено банальные (бессистемные) имена, как показано в таблице ниже, хотя некоторые из них используются редко. Группы 3–10 не имеют тривиальных имен и упоминаются просто по их номерам группы или по имени первого члена своей группы (например, «группа скандия» для группа 3 ),[28] поскольку они демонстрируют меньше сходства и / или вертикальных тенденций.
Элементы в одной группе имеют тенденцию проявлять закономерности в радиус атома, энергия ионизации, и электроотрицательность. Сверху вниз в группе атомные радиусы элементов увеличиваются. Так как заполненных уровней энергии больше, валентные электроны находятся дальше от ядра. Сверху каждый последующий элемент имеет более низкую энергию ионизации, потому что легче удалить электрон, поскольку атомы менее прочно связаны. Точно так же в группе наблюдается снижение электроотрицательности сверху вниз из-за увеличения расстояния между валентными электронами и ядром.[30] Есть исключения из этих тенденций: например, в группа 11, электроотрицательность возрастает дальше по группе.[31]
| Группа ИЮПАК | 1а | 2 | 3б | н / д б | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Менделеев (I – VIII) | я | II | III | IV | V | VI | VII | VIII | я | II | III | IV | V | VI | VII | c | |||
| CAS (США, A-B-A) | Я | IIA | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | МИБ | IIIA | IVA | VA | ЧЕРЕЗ | VIIA | VIIIA | |||
| старый ИЮПАК (Европа, A-B) | Я | IIA | IIIA | IVA | VA | ЧЕРЕЗ | VIIA | VIII | IB | МИБ | IIIB | IVB | VB | VIB | VIIB | 0 | |||
| Банальное имя | ЧАС и Щелочных металловр | Щелочноземельные металлыр | Чеканка металлов | Triels | Тетрели | Пниктогеныр | Халькогеныр | Галогеныр | благородные газыр | ||||||||||
| Имя по элементур | Литиевая группа | Группа бериллия | Скандиевая группа | Группа титана | Группа ванадия | Группа хрома | Группа марганца | Группа железа | Кобальтовая группа | Никель группа | Медная группа | Группа цинка | Группа бора | Группа углерода | Группа азота | Кислородная группа | Группа фтора | Гелий или же Неоновая группа | |
| Период 1 | ЧАС | Он | |||||||||||||||||
| Период 2 | Ли | Быть | B | C | N | О | F | Ne | |||||||||||
| Период 3 | Na | Mg | Al | Si | п | S | Cl | Ar | |||||||||||
| Период 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | В качестве | Se | Br | Kr | |
| Период 5 | Руб. | Sr | Y | Zr | Nb | Пн | Tc | RU | Rh | Pd | Ag | CD | В | Sn | Sb | Te | я | Xe | |
| Период 6 | CS | Ба | Ла | Ce – Lu | Hf | Та | W | Re | Операционные системы | Ir | Pt | Au | Hg | Tl | Pb | Би | По | В | Rn |
| Период 7 | Пт | Ра | Ac | Чт – Пт | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og |
н / д Нет номера группы
б Группа 3 включает скандий (Sc) и иттрий (Y). Для остальной части группы источники различаются как (1) лютеций (Lu) и лоуренсий (Lr), или же (2) лантан (La) и актиний (Ac), или же (3) весь набор 15 + 15 лантаноиды и актиниды. ИЮПАК инициировал проект по стандартизации определения как (1) Sc, Y, Lu и Lr, или же (2) Sc, Y, La и Ac.[32]
c Группа 18, благородные газы, не была открыта во время первоначальной таблицы Менделеева. Позже (1902 г.) Менделеев принял доказательства их существования, и их можно было поместить в новую «группу 0», последовательно и без нарушения принципа таблицы Менделеева.
р Название группы в соответствии с рекомендациями IUPAC.
Периоды
А период представляет собой горизонтальную строку в периодической таблице. Хотя группы обычно имеют более значительные периодические тренды, есть регионы, где горизонтальные тренды более значимы, чем вертикальные групповые тренды, например, f-блок, где лантаноиды и актиниды образуют два существенных горизонтальных ряда элементов.[33]
Элементы в тот же период показывают тенденции в атомном радиусе, энергии ионизации, электронное сродство, и электроотрицательность. Двигаясь слева направо через период, атомный радиус обычно уменьшается. Это происходит потому, что к каждому последующему элементу добавляются протон и электрон, что приводит к тому, что электрон притягивается ближе к ядру.[34] Это уменьшение атомного радиуса также вызывает увеличение энергии ионизации при перемещении слева направо по периоду. Чем прочнее связан элемент, тем больше энергии требуется для удаления электрона. Электроотрицательность увеличивается таким же образом, как и энергия ионизации, из-за притяжения, оказываемого ядром на электроны.[30] Сродство к электрону также показывает небольшую тенденцию в течение периода. Металлы (левая часть периода) обычно имеют более низкое сродство к электрону, чем неметаллы (правая часть периода), за исключением благородных газов.[35]
Блоки

Конкретные регионы периодической таблицы могут быть названы блоки с учетом последовательности заполнения электронных оболочек элементов. Элементы назначаются блокам по орбиталям, на которых находятся их валентные электроны или вакансии.[36] В s-блок включает первые две группы (щелочные металлы и щелочноземельные металлы), а также водород и гелий. В p-блок включает последние шесть групп, которые являются группами с 13 по 18 в групповой нумерации IUPAC (от 3A до 8A в американской групповой нумерации) и содержит, среди других элементов, все металлоиды. В d-блок включает группы с 3 по 12 (или с 3B по 2B в американской нумерации групп) и содержит все переходные металлы. В f-блок, часто смещенный ниже остальной части таблицы Менделеева, не имеет номеров групп и включает большинство лантаноидов и актиноидов. Гипотетический g-блок ожидается, что он начнется около элемента 121, что на несколько элементов ниже того, что известно в настоящее время.[37]
Периодические тенденции и закономерности
Электронная конфигурация

Электронная конфигурация или организация электронов, вращающихся вокруг нейтральных атомов, демонстрирует повторяющуюся структуру или периодичность. Электроны занимают ряд электронные оболочки (пронумерованные 1, 2 и т. д.). Каждая оболочка состоит из одного или нескольких подоболочки (названы s, p, d, f и g). В качестве атомный номер увеличивается, электроны постепенно заполняют эти оболочки и подоболочки более или менее в соответствии с Правило Маделунга или правило упорядочивания энергии, как показано на диаграмме. Электронная конфигурация для неон, например, 1 с2 2 с2 2p6. С атомным номером десять, неон имеет два электрона в первой оболочке и восемь электронов во второй оболочке; в подоболочке s два электрона, а в подоболочке p - шесть. С точки зрения периодической таблицы, первый раз, когда электрон занимает новую оболочку, соответствует началу каждого нового периода, эти позиции занимают водород и щелочных металлов.[38][39]

Поскольку свойства элемента в основном определяются его электронной конфигурацией, свойства элементов также демонстрируют повторяющиеся закономерности или периодическое поведение, некоторые примеры которых показаны на диаграммах ниже для атомных радиусов, энергии ионизации и сродства к электрону. Именно эта периодичность свойств, проявления которых были замечены задолго до то основная теория была разработана, что привело к установлению периодического закона (свойства элементов повторяются с различными интервалами) и формулировке первых периодических таблиц.[38][39] Тогда периодический закон может быть последовательно уточнен как: в зависимости от атомного веса; в зависимости от атомного номера; и в зависимости от общего количества s, p, d и f электронов в каждом атоме. Циклы длятся 2, 6, 10 и 14 элементов соответственно.[40]
Кроме того, существует внутренняя «двойная периодичность», разделяющая оболочки пополам; это происходит потому, что первая половина электронов, попадающих в подоболочки определенного типа, заполняет незанятые орбитали, а вторая половина должна заполнять уже занятые орбитали, следуя Правило максимальной множественности Хунда. Таким образом, вторая половина подвергается дополнительному отталкиванию, что приводит к разделению тренда между элементами первой и второй половины; это, например, очевидно при наблюдении за энергиями ионизации элементов 2p, в которых триады BCN и OF-Ne показывают увеличение, но на самом деле кислород имеет первую ионизацию немного ниже, чем у азота, поскольку легче удалить лишние, парные электрон.[40]
Атомные радиусы

Радиусы атомов в периодической таблице изменяются предсказуемым и объяснимым образом.Например, радиусы обычно уменьшаются вдоль каждого периода таблицы, начиная с щелочных металлов к благородные газы; и увеличивайте каждую группу вниз. Радиус резко увеличивается между благородным газом в конце каждого периода и щелочным металлом в начале следующего периода. Эти тенденции изменения атомных радиусов (и различных других химических и физических свойств элементов) могут быть объяснены теория электронной оболочки атома; они предоставили важные доказательства для развития и подтверждения квантовая теория.[41]
Электроны в 4f-подоболочке, которая постепенно заполняется от лантан (элемент 57) на иттербий (элемент 70),[n 2] не особенно эффективны при защите увеличивающегося ядерного заряда от более удаленных суб-оболочек. Элементы, следующие сразу за лантаноидами, имеют атомные радиусы, которые меньше, чем можно было бы ожидать, и которые почти идентичны атомным радиусам элементов непосредственно над ними.[43] Следовательно лютеций имеет практически такой же атомный радиус (и химический состав), что и иттрий, гафний имеет практически такой же атомный радиус (и химический состав), что и цирконий, и тантал имеет атомный радиус, подобный ниобий, и так далее. Это эффект сокращение лантаноидов: аналогичное сокращение актинидов также существует. Эффект сокращения лантаноидов заметен до платина (элемент 78), после чего маскируется релятивистский эффект известный как эффект инертной пары.[44] В сокращение d-блока, что является аналогичным эффектом между d-блок и p-блок, менее выражено, чем сокращение лантаноидов, но возникает по той же причине.[43]
Такие сокращения существуют по всей таблице, но химически они наиболее актуальны для лантаноидов с их почти постоянной степенью окисления +3.[45]
Энергия ионизации

Первая энергия ионизации - это энергия, необходимая для удаления одного электрона из атома, вторая энергия ионизации - это энергия, необходимая для удаления второго электрона из атома, и так далее. Для данного атома последовательные энергии ионизации увеличиваются со степенью ионизации. Например, для магния первая энергия ионизации составляет 738 кДж / моль, а вторая - 1450 кДж / моль. Электроны на более близких орбиталях испытывают большие силы электростатического притяжения; таким образом, их удаление требует все больше энергии. Энергия ионизации увеличивается вверх и вправо от таблицы Менделеева.[44]
Большие скачки последовательных молярных энергий ионизации происходят при удалении электрона из конфигурации благородного газа (полная электронная оболочка). И снова для магния первые две приведенные выше молярные энергии ионизации магния соответствуют удалению двух 3s-электронов, а третья энергия ионизации намного больше 7730 кДж / моль для удаления 2p-электрона из очень стабильного неон -подобная конфигурация Mg2+. Подобные скачки происходят и в энергиях ионизации других атомов третьего ряда.[44]
Электроотрицательность

Электроотрицательность - это тенденция атом привлечь общую пару электроны.[46] На электроотрицательность атома влияют как его атомный номер и расстояние между валентные электроны и ядро. Чем выше его электроотрицательность, тем больше элемент притягивает электроны. Впервые это было предложено Линус Полинг в 1932 г.[47] В общем, электроотрицательность увеличивается при переходе слева направо по периоду и уменьшается при спуске по группе. Следовательно, фтор является наиболее электроотрицательным из элементов,[n 3] пока цезий является наименьшим, по крайней мере, из тех элементов, по которым имеются существенные данные.[31]
Из этого общего правила есть некоторые исключения. Галлий и германий имеют более высокую электроотрицательность, чем алюминий и кремний соответственно из-за сжатия d-блока. Элементы четвертого периода сразу после первого ряда переходных металлов имеют необычно малые атомные радиусы, потому что 3d-электроны неэффективны при экранировании увеличенного заряда ядра, а меньший размер атома коррелирует с более высокой электроотрицательностью.[31] Аномально высокая электроотрицательность свинца, особенно по сравнению с таллий и висмут, является артефактом электроотрицательности, меняющейся в зависимости от степени окисления: ее электроотрицательность лучше соответствует тенденциям, если она указывается для состояния +2 вместо состояния +4.[48]
Электронное сродство

Сродство атома к электрону - это количество энергии, высвобождаемой, когда электрон присоединяется к нейтральному атому с образованием отрицательного иона. Хотя сродство к электрону сильно различается, проявляются некоторые закономерности. В общем, неметаллы имеют более положительные значения сродства к электрону, чем металлы. Хлор наиболее сильно притягивает лишний электрон. Электронное сродство благородных газов не было окончательно измерено, поэтому они могут иметь или не иметь слегка отрицательные значения.[51]
Сродство к электрону обычно увеличивается с течением времени. Это вызвано заполнением валентной оболочки атома; атом группы 17 выделяет больше энергии, чем атом группы 1 при получении электрона, потому что он получает заполненную валентную оболочку и, следовательно, более стабилен.[51]
Можно было бы ожидать тенденции уменьшения сродства к электрону понижающих групп. Дополнительный электрон войдет на орбиталь дальше от ядра. Таким образом, этот электрон будет меньше притягиваться к ядру и выделять меньше энергии при добавлении. При спуске по группе около одной трети элементов являются аномальными, причем более тяжелые элементы имеют более высокое сродство к электрону, чем их следующие более легкие сродники. Во многом это связано с плохой защитой d- и f-электронами. Равномерное уменьшение сродства к электрону относится только к атомам группы 1.[52]
Металлический характер
Чем ниже значения энергии ионизации, электроотрицательности и сродства к электрону, тем больше металлический характер элемента. И наоборот, неметаллический характер увеличивается с увеличением значений этих свойств.[53] Учитывая периодические тенденции этих трех свойств, металлический характер имеет тенденцию к уменьшению на протяжении периода (или ряда) и с некоторыми неоднородностями (в основном) из-за плохой экранировки ядра d- и f-электронами, и релятивистские эффекты,[54] имеет тенденцию увеличиваться при спуске группы (или столбца, или семьи). Таким образом, большинство металлических элементов (например, цезий ) находятся в нижнем левом углу традиционных периодических таблиц и самых неметаллических элементов (таких как неон ) вверху справа. Сочетание горизонтальных и вертикальных тенденций с металлическим характером объясняет форму лестницы. разделительная линия между металлами и неметаллами найденные в некоторых периодических таблицах, и практика иногда категоризации нескольких элементов, смежных с этой строкой, или элементов, смежных с этими элементами, как металлоиды.[55][56]
Число окисления
За некоторыми незначительными исключениями, числа окисления среди элементов показаны четыре основные тенденции в соответствии с их географическим положением в периодической таблице: слева; середина; верно; и юг. Слева (группы с 1 по 4, не включая элементы f-блока, а также ниобий, тантал и, вероятно, дубний в группе 5), самая высокая наиболее стабильная степень окисления - это номер группы, при этом более низкие степени окисления менее стабильны. В середине (группы с 3 по 11) более высокие степени окисления становятся более стабильными в каждой группе. Группа 12 - исключение из этой тенденции; они ведут себя так, как если бы они были расположены слева от стола. Справа более высокие степени окисления имеют тенденцию становиться менее стабильными при снижении группы.[57] Сдвиг между этими тенденциями является непрерывным: например, группа 3 также имеет более низкие степени окисления, наиболее стабильные в своем самом легком члене (скандий с CsScCl3 например известен в состоянии +2),[58] и группа 12, по прогнозам, будет иметь Copernicium более легко показывает степень окисления выше +2.
Лантаноиды, расположенные вдоль южной части таблицы, отличаются общей степенью окисления +3; это их наиболее стабильное состояние. Ранние актиниды демонстрируют структуру степеней окисления, отчасти аналогичную таковой у их родственников переходных металлов периодов 6 и 7; более поздние актиниды более похожи на лантаноиды, хотя последние (за исключением лоуренсия) имеют все более важную степень окисления +2, которая становится наиболее стабильным состоянием для нобелия.[59]
Связывание или соединение групп
Слева направо через четыре блока длинной или 32-столбцовой формы периодической таблицы представляет собой серию связывающих или соединяющих друг друга групп элементов, расположенных примерно между каждым блоком. Как правило, группы на периферии блоков демонстрируют сходство с группами соседних блоков, а также с другими группами в своих собственных блоках, как и ожидалось, поскольку большинство периодических тенденций являются непрерывными.[60] Эти группы, как и металлоиды, проявляют свойства между группами или представляют собой смесь групп с обеих сторон. Химически элементы 3-й группы, лантаноиды и тяжелые элементы 4-й и 5-й групп проявляют некоторое поведение, подобное щелочноземельным металлам.[61] или, в более общем смысле, s блочные металлы[62][63][64] но обладают некоторыми физическими свойствами d блок переходных металлов.[65] Фактически, металлы вплоть до группы 6 объединены катионами класса А («жесткие» кислоты ), образующие более стабильные комплексы с лигандами, донорными атомами которых являются наиболее электроотрицательные неметаллы - азот, кислород и фтор; металлы, расположенные ниже в таблице, образуют переход к катионам класса B («мягкие» кислоты), которые образуют более стабильные комплексы с лигандами, донорные атомы которых являются менее электроотрицательными более тяжелыми элементами групп с 15 по 17.[66]
Между тем, лютеций химически ведет себя как лантаноид (с которым его часто классифицируют), но проявляет смесь физических свойств лантаноидов и переходных металлов (как иттрий).[67][68] Лоуренсий, как аналог лютеция, предположительно имел бы подобные характеристики.[n 4] Металлы для чеканки в группе 11 (медь, серебро и золото) химически способны действовать как переходные металлы или металлы основной группы.[71] Летучие металлы группы 12, цинк, кадмий и ртуть иногда рассматриваются как связывающие d блокировать п блокировать. Условно они d блочные элементы, но они имеют мало свойств переходных металлов и больше похожи на п заблокировать соседей в группе 13.[72][73] Относительно инертные благородные газы в группе 18 соединяют наиболее реактивные группы элементов в периодической таблице - галогены в группе 17 и щелочные металлы в группе 1.[60]
Каиносимметрия
Оболочки 1s, 2p, 3d, 4f и 5g первыми имеют значение ℓ, азимутальное квантовое число который определяет орбитальный угловой момент подоболочки. Это придает им особые свойства,[74] это было названо каиносимметрией (от греческого καινός «новый»).[40][75] Элементы, заполняющие эти орбитали, обычно менее металлические, чем их более тяжелые гомологи, предпочитают более низкие степени окисления и имеют меньшие атомные и ионные радиусы. Поскольку каиносимметричные орбитали появляются в четных рядах (за исключением единиц), это создает четную-нечетную разницу между периодами, начиная с периода 2 и далее: элементы в четных периодах меньше и имеют более высокие степени окисления (если они существуют), тогда как элементы в нечетные периоды отличаются в противоположном направлении.[75]
История
Первые попытки систематизации

В 1789 г. Антуан Лавуазье опубликовал список из 33 химические элементы, сгруппировав их в газы, металлы, неметаллы, и земли.[76] Следующее столетие химики потратили на поиски более точной схемы классификации. В 1829 г. Иоганн Вольфганг Дёберейнер заметил, что многие элементы могут быть сгруппированы в триады на основе их химических свойств. Литий, натрий, и калий, например, были сгруппированы в триады как мягкие, реактивный металлы. Доберейнер также заметил, что при распределении по атомному весу второй член каждой триады примерно равен среднему значению первого и третьего.[77] Это стало известно как Закон триад.[78] Немецкий химик Леопольд Гмелин работал с этой системой, и к 1843 году он определил десять триад, три группы по четыре и одну группу из пяти. Жан-Батист Дюма опубликовал работу в 1857 году, описывающую отношения между различными группами металлов. Хотя разные химики смогли определить отношения между небольшими группами элементов, им еще предстояло построить единую схему, охватывающую их все.[77] В 1857 г. немецкий химик Август Кекуле заметил, что углерод часто имеет четыре других связанных атома. Метан, например, имеет один атом углерода и четыре атома водорода.[79] Эта концепция со временем стала известна как валентность, где разные элементы связываются с разным числом атомов.[80]
В 1862 году французский геолог Александр-Эмиль Бегайе де Шанкуртуа опубликовал раннюю форму таблицы Менделеева, которую он назвал теллурической спиралью или винтом. Он был первым, кто заметил периодичность элементов. С помощью элементов, расположенных по спирали на цилиндре в порядке возрастания атомного веса, де Шанкуртуа показал, что элементы с подобными свойствами, кажется, встречаются через регулярные промежутки времени. В его диаграмму помимо элементов входили ионы и соединения. В его статье также использовались геологические, а не химические термины и не было диаграммы. В результате ему уделялось мало внимания, пока работа Дмитрий Менделеев.[81]

В 1864 г. Юлиус Лотар Мейер немецкий химик опубликовал таблицу с 28 элементами. Понимая, что расположение в соответствии с атомным весом не совсем соответствует наблюдаемой периодичности в химических свойствах, он отдал приоритет валентности над незначительными различиями в атомном весе. Был предсказан недостающий элемент между Si и Sn с атомным весом 73 и валентностью 4.[82] По совместительству английский химик Уильям Одлинг опубликовал расположение 57 элементов, упорядоченных на основе их атомного веса. С некоторыми неровностями и пробелами он заметил, что, казалось, была периодичность атомных весов между элементами, и это соответствовало «их обычно полученным группировкам».[83] Одлинг ссылался на идею периодического закона, но не развивал ее.[84] Впоследствии он предложил (в 1870 г.) классификацию элементов на основе валентности.[85]

Английский химик Джон Ньюлендс выпустил серию работ с 1863 по 1866 год, в которых отмечалось, что, когда элементы были перечислены в порядке возрастания атомного веса, аналогичные физические и химические свойства повторялись с интервалом в восемь раз. Он сравнил такую периодичность с октавы музыки.[86][87] Это так называется Закон октав современники Ньюлендса высмеивали, а Химическое общество отказался публиковать его работу.[88] Тем не менее Ньюлендс смог составить таблицу элементов и использовать ее для прогнозирования наличия недостающих элементов, таких как германий.[89] Химическое общество признало важность его открытий только через пять лет после того, как они приписали Менделееву.[90]
В 1867 г. Густав Хинрихс, датский ученый-химик из Америки, опубликовал спиральную периодическую систему, основанную на атомных спектрах, весах и химическом сходстве. Его работа считалась своеобразной, показной и запутанной, и это могло препятствовать ее признанию и принятию.[91][92]
Таблица менделеева




Профессор химии России Дмитрий Менделеев и немецкий химик Юлиус Лотар Мейер независимо опубликовали свои периодические таблицы в 1869 и 1870 годах соответственно.[93] Таблица Менделеева от 1 марта [ОПЕРАЦИОННЫЕ СИСТЕМЫ. 17 февраля] 1869 г.,[94] была его первой опубликованной версией. Таблица Мейера была расширенной версией его (Мейера) таблицы 1864 года.[95] Они оба построили свои таблицы, перечисляя элементы в строках или столбцах в порядке атомного веса и начиная новую строку или столбец, когда характеристики элементов начали повторяться.[96]
Признание и признание таблицы Менделеева явились результатом двух принятых им решений. Первый заключался в том, чтобы оставить в таблице пробелы, когда казалось, что соответствующий элемент еще не обнаружен.[97] Менделеев был не первым химиком, сделавшим это, но он был первым, кто был признан в использовании тенденций в своей периодической таблице для предсказания свойств этих недостающие элементы, Такие как галлий и германий.[98] Второе решение заключалось в том, чтобы иногда игнорировать порядок, предложенный атомные веса и переключать соседние элементы, такие как теллур и йод, чтобы лучше классифицировать их химические семейства.
Менделеев опубликовал в 1869 году, используя атомный вес для организации элементов, информацию, определяемую с достаточной точностью в его время. Атомный вес работал достаточно хорошо, чтобы Менделеев мог точно предсказать свойства недостающих элементов.
Менделеев предпринял необычный шаг, назвав недостающие элементы с помощью санскрит цифры эка (1), dvi (2), и три (3) для обозначения того, что рассматриваемый элемент был удален на один, два или три ряда от более легкого конгенера. Было высказано предположение, что Менделеев, делая это, отдавал дань уважения древним Грамматики санскрита, особенно Панини, который разработал периодический алфавит для языка.[99]

После открытия атомного ядра Эрнест Резерфорд в 1911 г. было предложено, чтобы целое число заряда ядра было идентично порядковому месту каждого элемента в периодической таблице. В 1913 г. английский физик Генри Мозли с помощью Рентгеновская спектроскопия подтвердили это предложение экспериментально. Мозли определил значение ядерного заряда каждого элемента и показал, что порядок Менделеева фактически размещает элементы в последовательном порядке по ядерному заряду.[100] Ядерный заряд идентичен протон подсчитать и определить значение атомный номер (Z) каждого элемента. Использование атомного номера дает определенную последовательность элементов, основанную на целых числах. В 1913 году Мозли предсказал, что единственные элементы, которые все еще отсутствуют между алюминием (Z = 13) и золото (Z = 79) были Z = 43, 61, 72 и 75, все из которых были позже обнаружены. Атомный номер - это абсолютное определение элемент и дает фактическую основу для упорядочивания таблицы Менделеева.[101]
Вторая версия и дальнейшее развитие
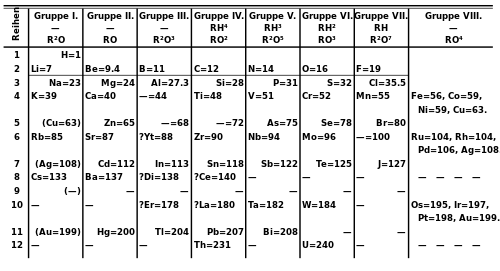
В 1871 году Менделеев опубликовал свою периодическую таблицу в новой форме, в которой группы похожих элементов располагались в столбцах, а не в строках, и эти столбцы пронумерованы от I до VIII, что соответствует степени окисления элемента. Он также дал подробные прогнозы свойств элементов, которые, как он ранее отмечал, отсутствуют, но должны существовать.[102] Эти пробелы впоследствии были заполнены, когда химики обнаружили дополнительные природные элементы.[103] Часто утверждается, что последним обнаруженным естественным элементом был франций (именуемые Менделеевым как эка-цезий) в 1939 году, но технически это был только последний элемент, обнаруженный в природе, а не путем синтеза.[104] Плутоний, произведенный синтетическим путем в 1940 году, был идентифицирован в следовых количествах как естественный элемент в 1971 году.[105]
Популярные[106] Макет периодической таблицы, также известный как обычная или стандартная форма (как показано в других местах этой статьи), принадлежит Горацию Гроувсу Демингу. В 1923 году американский химик Деминг опубликовал короткую (Менделеевский стиль ) и средний (18-колонка ) образуют периодические таблицы.[107][n 5] В 1928 году компания «Мерк и компания» подготовила раздаточный бланк 18-колоночной таблицы среднего размера Деминга, которая была широко распространена в американских школах. К 1930-м годам таблица Деминга появилась в справочниках и энциклопедиях по химии. Его также много лет распространяла научная компания Sargent-Welch.[108][109][110]
С развитием современных квантово-механический теории электрон конфигураций внутри атомов, стало очевидно, что каждый период (строка) в таблице соответствует заполнению квантовая оболочка электронов. У более крупных атомов больше электронных подоболочек, поэтому для более поздних таблиц требуются все более длинные периоды.[111]

В 1945 г. Гленн Сиборг, американский ученый, сделал предложение что актинидные элементы, словно лантаноиды, заполняли подуровень f. До этого считалось, что актиниды образуют четвертый ряд d-блоков. Коллеги Сиборга посоветовали ему не публиковать столь радикальное предложение, поскольку это, скорее всего, разрушит его карьеру. Поскольку Сиборг считал, что у него тогда не было карьеры, которая могла бы навредить репутации, он все равно опубликовал. Предложение Сиборга оказалось правильным, и впоследствии он выиграл гонку 1951 года. Нобелевская премия по химии за его работу по синтезу актинидных элементов.[112][113][n 6]
Хотя незначительные количества некоторых трансурановые элементы происходят естественно,[114] все они были впервые обнаружены в лабораториях. Их производство значительно расширило периодическую таблицу Менделеева, первая из которых нептуний, синтезирован в 1939 г.[115] Поскольку многие трансурановые элементы очень нестабильны и разлагаться быстро, их сложно обнаружить и охарактеризовать при производстве. Там были споры в отношении принятия конкурирующих заявок на обнаружение некоторых элементов, требующих независимой проверки для определения того, какая сторона имеет приоритет, и, следовательно, прав на имя.[116] В 2010 году совместное российско-американское сотрудничество на Дубна, Московская область, Россия, утверждали, что синтезировали шесть атомов Tennessine (элемент 117), что делает его самым последним заявленным открытием. Это вместе с нихоний (элемент 113), москва (элемент 115), и Оганессон (элемент 118) - это четыре последних названных элемента, названия которых стали официальными 28 ноября 2016 года.[117]
В честь 150-летия периодической таблицы Менделеева Объединенные Нации объявил 2019 год Международным годом Периодической таблицы Менделеева, отметив «одно из самых значительных достижений в науке».[118]
Различные периодические таблицы
Таблица из длинных или 32 столбцов

Современная таблица Менделеева иногда расширяется до ее длинной или 32-колоночной формы, восстанавливая указанные в сносках элементы f-блока в их естественное положение между s- и d-блоками, как предлагается Альфред Вернер в 1905 г.[119] В отличие от формы из 18 столбцов, такое расположение не приводит к «прерыванию последовательности возрастающих атомных номеров».[120] Также становится легче увидеть взаимосвязь f-блока с другими блоками периодической таблицы.[121] Уильям Б. Дженсен выступает за форму таблицы с 32 столбцами на том основании, что лантаноиды и актиниды в остальном рассматриваются в умах студентов как скучные, неважные элементы, которые можно изолировать и игнорировать.[122] Несмотря на эти преимущества, редакторы обычно избегают формы с 32 колонками из-за ее чрезмерного прямоугольного соотношения по сравнению с соотношением страниц книги.[123] и знакомство химиков с современной формой, представленной Сиборгом.[124]
| Группа → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Щелочной металл | Щелочноземельный металл | Группа бора | Группа углерода | Пниктоген | Халькоген | Галоген | благородный газ | |||||||||||||||||||||||||
| CAS: | Я | IIA | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | МИБ | IIIA | IVA | VA | ЧЕРЕЗ | VIIA | VIIIA | ||||||||||||||||
| старый ИЮПАК: | Я | IIA | IIIA | IVA | VA | ЧЕРЕЗ | VIIA | VIII | IB | МИБ | IIIB | IVB | VB | VIB | VIIB | 0 | ||||||||||||||||
| ↓ Период | ||||||||||||||||||||||||||||||||
| 1 | Водород
| →имя элемента атомный номер химический символ | Гелий
| |||||||||||||||||||||||||||||
| 2 | Литий
| Бериллий
| Бор
| Углерод
| Азот
| Кислород
| Фтор
| Неон
| ||||||||||||||||||||||||
| 3 | Натрий
| Магний
| Алюминий
| Кремний
| Фосфор
| Сера
| Хлор
| Аргон
| ||||||||||||||||||||||||
| 4 | Калий
| Кальций
| Скандий
| Титана
| Ванадий
| Хром
| Марганец
| Утюг
| Кобальт
| Никель
| Медь
| Цинк
| Галлий
| Германий
| Мышьяк
| Селен
| Бром
| Криптон
| ||||||||||||||
| 5 | Рубидий
| Стронций
| Иттрий
| Цирконий
| Ниобий
| Молибден
| Технеций [97] | Рутений
| Родий
| Палладий
| Серебро
| Кадмий
| Индий
| Банка
| Сурьма
| Теллур
| Йод
| Ксенон
| ||||||||||||||
| 6 | Цезий
| Барий
| Лантан
| Церий
| Празеодим
| Неодим
| Прометий [145] | Самарий
| Европий
| Гадолиний
| Тербий
| Диспрозий
| Гольмий
| Эрбий
| Тулий
| Иттербий
| Лютеций
| Гафний
| Тантал
| Вольфрам
| Рений
| Осмий
| Иридий
| Платина
| Золото
| Меркурий
| Таллий
| Свинец
| Висмут
| Полоний [209] | Астатин [210] | Радон [222] |
| 7 | Франций [223] | Радий [226] | Актиний [227] | Торий
| Протактиний
| Уран
| Нептуний [237] | Плутоний [244] | Америций [243] | Кюрий [247] | Берклиум [247] | Калифорний [251] | Эйнштейний [252] | Фермий [257] | Менделевий [258] | Нобелий [259] | Лоуренсий [266] | Резерфордий [267] | Дубний [268] | Сиборгий [269] | Бориум [270] | Калий [269] | Мейтнерий [278] | Дармштадтиум [281] | Рентгений [282] | Копернициум [285] | Nihonium [286] | Флеровий [289] | Московиум [290] | Ливерморий [293] | Tennessine [294] | Оганессон [294] |
1 (красный) =Газ 3 (черный) =Твердый 80 (зеленый) =Жидкость 109 (серый) = Неизвестно Цвет атомного номера показывает состояние дела (в 0 ° C и 1 атм )
- F:18.998403163(6) - Стандартный атомный вес[125]
- C: [12.0096, 12.0116] - Стандартный атомный вес - это интервал[125]
- F:18.998, C:12.011 - Сокращенное и условное значение (формальное сокращение)[3]
- По: [209] - массовое число самого стабильного изотопа
Фоновый цвет показывает подкатегорию в тренде металл – металлоид – неметалл:
| Металл | Металлоид | Неметалл | Неизвестный химический характеристики | |||||||
| Щелочной металл | Щелочноземельный металл | Лантаноид | Актинид | Переходный металл | Пост переходный металл | Реактивный неметалл | благородный газ | |||
Размещение водорода и гелия
Просто следуя электронным конфигурациям, водород (электронная конфигурация 1 с1) и гелий (1с2) следует поместить в группы 1 и 2, над литием (1s22 с1) и бериллий (1с22 с2).[126] Такое расположение является обычным для водорода, поскольку его химический состав имеет некоторое сходство с другими элементами группы 1: как и они, водород является одновалентным.[127][128][129] Но есть и некоторые существенные различия: например, водород является неметаллом, в отличие от других элементов группы 1, которые все являются металлами. По этой причине водород иногда помещают в группу 17,[130] учитывая строго одновалентный и в основном неметаллический химический состав водорода, а также строго одновалентный и неметаллический химический состав фтора (элемент, в остальном находящийся на вершине группы 17). Иногда, чтобы показать, что водород обладает свойствами, соответствующими свойствам щелочных металлов и галогенов, его показывают одновременно в верхней части двух столбцов.[131] Наконец, водород иногда помещают отдельно от какой-либо группы; это основано на том, что его общие свойства рассматриваются как достаточно отличающиеся от свойств элементов любой другой группы.
Необычайная инертность гелия чрезвычайно близка к инертности других легких благородных газов, неона и аргона в группе 18, и совсем не близка к поведению металлических и все более реакционноспособных элементов группы 2, и поэтому его почти всегда помещают в группу 18.[132][133] Тем не менее, гелий иногда помещают отдельно от какой-либо группы,[134] и есть даже несколько химиков, которые выступали за гелий в группе 2 на основании различных свойств, таких как энергия ионизации и реакционная способность, где гелий лучше вписывается в тенденцию группы 2, чем тенденцию группы 18.[135][136][137]
Группа 3 и ее элементы в периоды 6 и 7
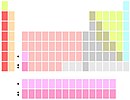
 La и Ac ниже Y |
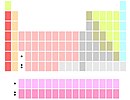
 Lu и Lr ниже Y |
 Маркеры под Y |
Хотя скандий и иттрий всегда являются первыми двумя элементами в группе 3, идентичность следующих двух элементов полностью не установлена. Они обычно лантан и актиний, и реже лютеций и лоуренсий. Два варианта проистекают из исторических трудностей с включением лантаноидов в периодическую таблицу Менделеева и аргументов относительно того, где именно ж начало и конец элементов блока.[138][n 7] Третий (компромиссный) вариант показывает две позиции ниже иттрий как занятые всеми лантаноидами и всеми актинидами.[139]
Вариант лантан-актиний[n 8] самый распространенный. В результате образуется группа 3, в которой все элементы ионизируются до электронной конфигурации благородного газа и имеют плавные вертикальные периодические тенденции.[140][141] Вариант лютеций-лоуренсий[n 9] приводит к непрерывному d-блоку, а излом вертикальных периодических трендов у лютеция совпадает с изломом других ранних групп d-блоков.[142] Вариант лантаноидов-актиноидов[n 10] подчеркивает химическое сходство между лантаноидами (хотя актиниды не так похожи).[143]
Большинство работающих химиков не подозревают о существовании каких-либо противоречий,[144] хотя этот вопрос периодически обсуждается на протяжении десятилетий[145] без видимого разрешения. ИЮПАК еще не дал рекомендаций по этому поводу; в 2015 году была создана целевая группа IUPAC для его предоставления.[146]
Дальнейшие расширения периодической таблицы
В настоящее время периодическая таблица состоит из семи полных строк, все поля которых заполнены обнаруженными элементами. Будущие элементы должны были бы начать восьмой ряд. По мере того, как атомные ядра становятся сильно заряженными, возникает необходимость в специальной теории относительности, чтобы оценить влияние ядра на электронное облако. Это приводит к тому, что тяжелые элементы имеют все более разные свойства по сравнению с их более легкими гомологами в периодической таблице, что уже заметно в конце шестого и начале седьмого периодов и, как ожидается, станет очень сильным в конце седьмого и восьмого периодов. Поэтому ведутся некоторые дискуссии о том, должен ли этот будущий восьмой период следовать модели, заданной более ранними периодами, или нет.[147][148][149] Более тяжелые элементы также становятся все более нестабильными, поскольку сильная сила, связывающая ядро, становится менее способным противодействовать отталкиванию между положительно заряженными протонами в нем, поэтому также остается открытым вопрос, сколько элементов восьмого периода смогут существовать. .[150][151] [114][152]
Столы с разной структурой
Через 100 лет после появления таблицы Менделеева в 1869 г. Эдвард Г. Мазурс собрал около 700 различных опубликованных версий таблицы Менделеева.[122][153][154] Помимо множества прямоугольных вариаций, были сформированы другие форматы таблицы Менделеева, например,[n 11] как круг, куб, цилиндр, здание, спираль, лемниската,[155] восьмиугольная призма, пирамида, сфера или треугольник. Такие альтернативы часто разрабатываются, чтобы выделить или подчеркнуть химические или физические свойства элементов, которые не так очевидны в традиционных периодических таблицах.[154]

Популярный[156] альтернативная структура - это структура Отто Теодор Бенфей (1960). Элементы расположены по непрерывной спирали с водородом в центре, а переходные металлы, лантаноиды и актиниды занимают полуострова.[157]
Большинство периодических таблиц двумерны;[114] трехмерные таблицы известны как минимум с 1862 года (до создания двумерной таблицы Менделеева 1869 года). Более свежие примеры включают периодическую классификацию Куртинса (1925 г.),[158] Система пластинок Рингли (1949),[159]Giguère Периодическая спираль (1965)[160] и Периодическое дерево Дюфура (1996).[161] Идя еще дальше, Периодическая таблица физика Стоу (1989)[162] был описан как четырехмерный (имеющий три пространственных измерения и одно цветовое измерение).[163]
Различные формы периодических таблиц можно рассматривать как лежащие в континууме химии и физики.[164] Ближе к химическому концу континуума можно найти, например, «непокорность» Райнера-Кэнхема.[165] Таблица Менделеева неорганического химика (2002),[166] который подчеркивает тенденции и закономерности, а также необычные химические отношения и свойства. Рядом с физическим концом континуума Джанет Периодическая таблица Левого Шага (1928). Это имеет структуру, которая показывает более тесную связь с порядком заполнения электронной оболочки и, по ассоциации, квантовая механика.[167] В чем-то похожий подход был использован Альпером,[168] хотя и критикуется Эрик Шерри как игнорирование необходимости отображения химической и физической периодичности.[130] Где-то в середине континуума находится повсеместно распространенная или стандартная форма периодической таблицы. Считается, что это лучше отражает эмпирические тенденции физического состояния, электрической и теплопроводности, степени окисления и других свойств, которые легко выводятся из традиционных методов химической лаборатории.[169] Считается, что его популярность является результатом того, что этот макет имеет хороший баланс функций с точки зрения простоты конструкции и размера, а также отображает атомарный порядок и периодические тенденции.[84][170]
| ж1 | ж2 | ж3 | ж4 | ж5 | ж6 | ж7 | ж8 | ж9 | ж10 | ж11 | ж12 | ж13 | ж14 | d1 | d2 | d3 | d4 | d5 | d6 | d7 | d8 | d9 | d10 | п1 | п2 | п3 | п4 | п5 | п6 | s1 | s2 | |
| 1 с | ЧАС | Он | ||||||||||||||||||||||||||||||
| 2 с | Ли | Быть | ||||||||||||||||||||||||||||||
| 2p 3 с | B | C | N | О | F | Ne | Na | Mg | ||||||||||||||||||||||||
| 3p 4 с | Al | Si | п | S | Cl | Ar | K | Ca | ||||||||||||||||||||||||
| 3D 4p 5 с | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | В качестве | Se | Br | Kr | Руб. | Sr | ||||||||||||||
| 4d 5p 6 с | Y | Zr | Nb | Пн | Tc | RU | Rh | Pd | Ag | CD | В | Sn | Sb | Te | я | Xe | CS | Ба | ||||||||||||||
| 4f 5d 6p 7 с | Ла | Ce | Pr | Nd | Вечера | См | Европа | Б-г | Tb | Dy | Хо | Э | Тм | Yb | Лу | Hf | Та | W | Re | Операционные системы | Ir | Pt | Au | Hg | Tl | Pb | Би | По | В | Rn | Пт | Ра |
| 5f 6d 7p 8 с | Ac | Чт | Па | U | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | 119 | 120 |
| f-блок | d-блок | p-блок | s-блок | |||||||||||||||||||||||||||||
Множество различных форм таблицы Менделеева вызвало вопрос о том, существует ли оптимальная или окончательная форма таблицы Менделеева, на который в настоящее время нет единого мнения.[171][172]
Смотрите также
- Список химических элементов
- Список статей, связанных с периодической таблицей
- Названия наборов химических элементов
- Стандартная модель
- Изобилие химических элементов
- Таблица конфигурации атомных электронов
- Сбор элементов
- Таблица нуклидов
- Тайна материи: поиск элементов (Фильм PBS)
- Хронология открытий химических элементов
Примечания
- ^ Нет данных по благородным газам, астату, францию и элементам тяжелее америций.
- ^ Хотя лантан не имеет 4f-электрона в основном состоянии, металлический лантан показывает 4f-электронное присутствие.[42] и он может отображать в своих соединениях символ 4f.
- ^ В то время как фтор является наиболее электроотрицательным из элементов, находящихся под Шкала Полинга, неон является наиболее электроотрицательным элементом по другим шкалам, таким как Шкала Аллена.
- ^ Хотя считается, что Lr имеет p-электрон, а не d-электрон в своей электронной конфигурации в основном состоянии, и поэтому можно было бы ожидать, что он будет летучим металлом, способным образовывать катион +1 в растворе, как таллий, никаких доказательств ни одного из этих свойств не было. могут быть получены, несмотря на экспериментальные попытки сделать это.[69] Первоначально предполагалось, что в его электронной конфигурации будет d-электрон.[69] и это все еще может иметь место для металлического лоуренсия, тогда как атомный лоуренсий в газовой фазе, скорее всего, имеет p-электрон.[70]
- ^ Антецедент 18-столбцовой таблицы Деминга можно увидеть в Периодическая таблица Адамса с 16 столбцами 1911 г.. Адамс опускает редкие земли и «радиоактивные элементы» (то есть актиниды) из основной части своей таблицы и вместо этого показывает их как «под присмотром только для экономии места »(редкоземельные элементы между Ba и eka-Yt; радиоактивные элементы между eka-Te и eka-I). См .: Elliot Q.A. (1911).« Модификация периодической таблицы ». Журнал Американского химического общества. 33(5): 684–88 [687].
- ^ Второй сверхдлинный ряд периодической таблицы для размещения известных и неоткрытых элементов с атомным весом больше висмута (торий, протактиний и уран, например) был постулирован еще в 1892 году. Большинство исследователей считали эти элементы аналогами переходных элементов третьей серии, гафния, тантала и вольфрама. Существование второй серии внутренних переходов в форме актинидов не принималось до тех пор, пока не было установлено сходство с электронными структурами лантаноидов. См .: van Spronsen, J. W. (1969). Периодическая система химических элементов. Амстердам: Эльзевир. стр. 315–16, ISBN 0-444-40776-6.
- ^ Отделение лантаноидов от основной части таблицы Менделеева приписывают чешскому химику. Богуслав Браунер который в 1902 г. отнес все их («Ce и т. д.) к одной позиции в группе 4, ниже циркония. Такое расположение было названо «гипотезой астероидов» по аналогии с астероидами, занимающими одну орбиту в Солнечной системе. До этого времени лантаноиды обычно (и безуспешно) размещались в группах с I по VIII более старой формы с 8 столбцами периодической таблицы. Хотя предшественники устройства Браунера 1902 года были записаны еще в 1895 году, известно, что он упоминал «химию астероидов» в письме Менделееву 1881 года. Другие авторы отнесли все лантаноиды либо к группе 3, либо к группам 3 и 4, либо к группам 2, 3 и 4. В 1922 г. Нильс Бор продолжил процесс отделения, разместив лантаноиды между s- и d-блоками. В 1949 г. Гленн Т. Сиборг (повторно) ввела популярную сегодня форму Менделеева, в которой лантаноиды и актиниды указаны в сносках. Сиборг впервые опубликовал свою таблицу в секретном отчете за 1944 год. Он был снова опубликован им в 1945 году в Новости химии и техники, и до 1949 года несколько авторов комментировали предложение Сиборга и в целом соглашались с ним. В том же году он отметил, что лучшим методом представления актинидов, по-видимому, было размещение их ниже лантаноидов и в качестве аналогов. См .: Thyssen P., Binnemans K. (2011). «Размещение редких земель в Периодической таблице: исторический анализ». В К. А. Гшнейдере младший (ред.). Справочник по физике и химии редких земель. 41. Амстердам: Elsevier, стр. 1–94; Сиборг Г. Т. (1994). Происхождение концепции актинидов ». В К. А. Гшнейдере младший (ред.). Справочник по физике и химии редких земель. 18. Амстердам: Elsevier, стр. 1-27.
- ^ Примеры этой таблицы см. Аткинс и другие. (2006). Неорганическая химия Шрайвера и Аткинса (4-е изд.). Оксфорд: Издательство Оксфордского университета • Myers et al. (2004). Holt Chemistry. Орландо: Холт, Райнхарт и Уинстон • Чанг Р. (2000). Основная химия (2-е изд.). Бостон: Макгроу-Хилл
- ^ Примеры таблицы группы 3 = Sc-Y-Lu-Lr см. В Rayner-Canham G. & Overton T. (2013). Описательная неорганическая химия (6-е изд.). Нью-Йорк: W. H. Freeman and Company • Brown et al. (2009). Химия: центральная наука (11-е изд.). Река Аппер Сэдл, Нью-Джерси: Pearson Education • Moore et al. (1978). Химия. Токио: Макгроу-Хилл Когакуша
- ^ Примеры группы 3 = Ln и An таблицы см. В Housecroft C.E. & Sharpe A.G. (2008). Неорганическая химия (3-е изд.). Харлоу: образование Пирсона • Халлидей и др. (2005). Основы физики (7-е изд.). Хобокен, Нью-Джерси: John Wiley & Sons • Nebergall et al. (1980). Общая химия (6-е изд.). Лексингтон: Д. К. Хит и компания
- ^ Видеть Интернет-база данных периодических таблиц для изображения такого рода вариантов.
Рекомендации
- ^ Эмсли, Джон (2001). Строительные блоки природы ((Твердый переплет, первое издание) изд.). Издательство Оксфордского университета. стр.521–22. ISBN 978-0-19-850340-8.
- ^ а б Мейя, Юрис; и другие. (2016). «Атомный вес элементов 2013 (Технический отчет IUPAC)». Чистая и прикладная химия. 88 (3): 265–91. Дои:10.1515 / pac-2015-0305.
- ^ а б Мейя, Юрис; и другие. (2016). «Атомный вес элементов 2013 (Технический отчет IUPAC)». Чистая и прикладная химия. 88 (3). Стол 2, 3 вместе; неуверенность устранена. Дои:10.1515 / pac-2015-0305.
- ^ Корнфорд, FM (1937). Космология Платона: Тимей Платона, переведенный с текущими комментариями Фрэнсиса Макдональда Корнфорда. Лондон: Рутледж и Кеган Пол. С. 249–50.
- ^ Обрист, Б. (1990). Константин Пизанский. Книга тайн алхимии: обзор естествознания середины 13 века,. Лейден: Э. Дж. Брилл. С. 163–64.
- ^ Strathern, P (2000). Мечта Менделеева: поиски стихии. Хэмиш Гамильтон ,. п. 239. ISBN 0-241-14065-X.CS1 maint: лишняя пунктуация (связь)
- ^ Роско, HE; Шорлеммер, FRS (1894). Трактат по химии: Том II: Металлы. Нью-Йорк: D Appleton. п. 4.
- ^ Голдсмит, Р.Х. (1982). «Металлоиды». Журнал химического образования. 59 (6): 526–527. Дои:10.1021 / ed059p526.
- ^ Берцелиус, JJ (1811). "Essai sur la nomenclature chimique". Journal de Physique, de Chimie, d'Histoire Naturelle. LXXIII: 253‒286 (258).
- ^ Партингтон, младший (1964). История химии. Лондон: Макмиллан. п. 168.
- ^ Баш, AD (1832 г.). «Очерк химической номенклатуры, приставленный к трактату по химии; Дж. Дж. Берцелиус». Американский журнал науки. 22: 248–277 (250).
- ^ Партингтон, младший (1964). История химии. Лондон: Макмиллан. С. 145, 168.
- ^ Йорпес, Дж. Э. (1970). Берцелиус: его жизнь и работа, пер. Б. Стил,. Беркли: Калифорнийский университет. п. 95.
- ^ Берцелиус, JJ (1825). Lehrbuch der Chemie (Учебник химии), т. 1, пт. 1, пер. Ф Вёле. Дрезден: Арнольд. п. 168.
- ^ Hinrichs, GD (1869). «О классификации и атомных весах так называемых химических элементов, с особым упором на определения Стаса». Труды Американской ассоциации развития науки. 18: 112–124.
- ^ Чарльз Джанет, Классификация hélicoïdale des éléments chimiques, Бове, 1928 г.
- ^ Зильберберг, М. С. (2006). Химия: молекулярная природа материи и изменений (4-е изд.). Нью-Йорк: Макгроу-Хилл. п. 536. ISBN 978-0-07-111658-9.
- ^ Manson, S. S .; Халфорд, Г. Р. (2006). Усталость и долговечность конструкционных материалов. Парк материалов, Огайо: ASM International. п.376. ISBN 978-0-87170-825-0.
- ^ Буллингер, HJ. (2009). Технологический гид: принципы, приложения, тенденции. Берлин: Springer-Verlag. п. 8. ISBN 978-3-540-88545-0.
- ^ Джонс, Б. В. (2010). Плутон: страж внешней солнечной системы.. Кембридж: Издательство Кембриджского университета. стр.169–71. ISBN 978-0-521-19436-5.
- ^ Хинрикс, Г. Д. (1869). «О классификации и атомных весах так называемых химических элементов, с особым упором на определения Стаса». Труды Американской ассоциации развития науки. 18 (5): 112–24. В архиве из оригинала от 2 августа 2016 г.
- ^ Мьюз, Ян-Майкл; Смитс, Одиллия Розетта; Джерабек, Пол; Швердтфегер, Питер (25 июля 2019 г.). "Оганессон - полупроводник: о сужении релятивистской запрещенной зоны в самых тяжелых твердых телах из благородных газов". Angewandte Chemie. 58 (40): 14260–64. Дои:10.1002 / anie.201908327. ЧВК 6790653. PMID 31343819.
- ^ Scerri 2007, стр. 24
- ^ Месслер, Р. В. (2010). Суть материалов для инженеров. Садбери, Массачусетс: Jones & Bartlett Publishers. п. 32. ISBN 978-0-7637-7833-0.
- ^ Багналл, К. В. (1967). «Последние достижения в химии актинидов и лантаноидов». In Fields, P. R .; Меллер Т. (ред.). Успехи химии, химии лантанидов / актинидов. Успехи химии. 71. Американское химическое общество. С. 1–12. Дои:10.1021 / ba-1967-0071. ISBN 978-0-8412-0072-2.
- ^ Day, M.C., Jr .; Селбин, Дж. (1969). Теоретическая неорганическая химия (2-е изд.). Нью-Йорк: Книжная корпорация Ностранд-Ринхольд. п. 103. ISBN 978-0-7637-7833-0.
- ^ Holman, J .; Хилл, Г.С. (2000). Химия в контексте (5-е изд.). Уолтон-он-Темз: Нельсон Торнс. п. 40. ISBN 978-0-17-448276-5.
- ^ а б Коннелли, Н.Г .; Damhus, T .; Hartshorn, R.M .; Хаттон, А. Т. (2005). Номенклатура неорганической химии: Рекомендации ИЮПАК 2005 г. (PDF). Издательство РСК. п. 51. ISBN 978-0-85404-438-2. В архиве (PDF) из оригинала 23 ноября 2018 г.. Получено 26 ноября 2018.
- ^ Флак, Э. (1988). «Новые обозначения в Периодической таблице» (PDF). Pure Appl. Chem. 60 (3): 431–36. Дои:10.1351 / pac198860030431. S2CID 96704008. В архиве (PDF) из оригинала 25 марта 2012 г.. Получено 24 марта 2012.
- ^ а б Мур, стр. 111
- ^ а б c Гринвуд и Эрншоу, стр. 30
- ^ «Состав группы 3 периодической таблицы». ИЮПАК. 18 декабря 2015.
- ^ Стокер, С. Х. (2007). Общая, органическая и биологическая химия. Нью-Йорк: Хоутон Миффлин. п.68. ISBN 978-0-618-73063-6. OCLC 52445586.
- ^ Маскетта, Дж. (2003). Химия - легкий путь (4-е изд.). Нью-Йорк: Hauppauge. п.50. ISBN 978-0-7641-1978-1. OCLC 52047235.
- ^ Kotz, J .; Treichel, P .; Таунсенд, Джон (2009). Химия и химическая реакционная способность, Том 2 (7-е изд.). Бельмонт: Томсон Брукс / Коул. п. 324. ISBN 978-0-495-38712-1. OCLC 220756597.
- ^ Дженсен, Уильям Б. (21 марта 2015 г.). «Положение лантана (актиний) и лютеция (лоуренсий) в периодической таблице: обновление». Основы химии. 17: 23–31. Дои:10.1007 / s10698-015-9216-1. S2CID 98624395.
- ^ Джонс, К. (2002). химия d- и f-блоков. Нью-Йорк: J. Wiley & Sons. п.2. ISBN 978-0-471-22476-1. OCLC 300468713.
- ^ а б Майерс, Р. (2003). Основы химии. Вестпорт, Коннектикут: Издательская группа Гринвуд. стр.61 –67. ISBN 978-0-313-31664-7.
- ^ а б Чанг, Р. (2002). Химия (7-е изд.). Нью-Йорк: Макгроу-Хилл. стр.289–310, 340–42. ISBN 978-0-07-112072-2.
- ^ а б c Имянитов, Н. С. (2011). «Применение новой формулировки периодического закона для предсказания протонного сродства элементов». Российский журнал неорганической химии. 56 (5): 745–48. Дои:10.1134 / S003602361105010X. S2CID 98328428.
- ^ Гринвуд и Эрншоу, стр. 27–28.
- ^ Глотцель, Д. (1978). «Основные свойства металлов f-диапазона: лантана, церия и тория». Журнал физики F: физика металлов. 8 (7): L163 – L168. Bibcode:1978JPhF .... 8L.163G. Дои:10.1088/0305-4608/8/7/004.
- ^ а б Веселый, В. Л. (1991). Современная неорганическая химия (2-е изд.). Макгроу-Хилл. п. 22. ISBN 978-0-07-112651-9.
- ^ а б c Гринвуд и Эрншоу, стр. 28
- ^ Гринвуд и Эрншоу, стр. 1234
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "Электроотрицательность ". Дои:10.1351 / goldbook.E01990
- ^ Полинг, Л. (1932). «Природа химической связи. IV. Энергия одинарных связей и относительная электроотрицательность атомов». Журнал Американского химического общества. 54 (9): 3570–82. Дои:10.1021 / ja01348a011.
- ^ Оллред, А. Л. (1960). «Значения электроотрицательности по термохимическим данным». Журнал неорганической и ядерной химии. 17 (3–4): 215–21. Дои:10.1016/0022-1902(61)80142-5.
- ^ Хухи, Кейтер и Кейтер, стр. 42
- ^ Siekierski, S .; Берджесс, Дж. (2002). Краткая химия элементов. Чичестер: Издательство Хорвуд. С. 35‒36. ISBN 978-1-898563-71-6.
- ^ а б Чанг, стр. 307–09.
- ^ Huheey, Keiter & Keiter, стр. 42, 880–81.
- ^ Yoder, C.H .; Suydam, F.H .; Снавели, Ф.А. (1975). Химия (2-е изд.). Харкорт Брейс Йованович. п.58. ISBN 978-0-15-506465-2.
- ^ Huheey, Keiter & Keiter, стр. 880–85.
- ^ Сакс, О. (2009). Дядя Вольфрам: Воспоминания о химическом детстве. Нью-Йорк: Альфред А. Кнопф. С. 191, 194. ISBN 978-0-375-70404-8.
- ^ Серый, стр. 9
- ^ Fernelius, W .; С. (1986). «Некоторые размышления о периодической таблице и ее использовании». Журнал химического образования. 63 (3): 263–66. Bibcode:1986JChEd..63..263F. Дои:10.1021 / ed063p263.
- ^ Мейер, Герд .; Корбетт, Джон Д. (1981). «Восстановленные тройные галогениды скандия: RbScX3 (X = хлор, бром) и CsScX3 (X = хлор, бром, йод)». Неорганическая химия. 20 (8): 2627–31. Дои:10.1021 / ic50222a047. ISSN 0020-1669.
- ^ Виберг, Н. (2001). Неорганическая химия. Сан-Диего: Academic Press. С. 1644–45. ISBN 978-0-12-352651-9.
- ^ а б MacKay, K. M .; MacKay, R.A .; Хендерсон, В. (2002). Введение в современную неорганическую химию (6-е изд.). Челтнем: Нельсон Торнс. С. 194–96. ISBN 978-0-7487-6420-4.
- ^ Реми, Х. (1956). Клейнберг, Дж. (Ред.). Трактат по неорганической химии. 2. Амстердам: Эльзевир. п. 30.
- ^ Phillips, C. S. G .; Уильямс, Р. Дж. П. (1966). Неорганическая химия. Оксфорд: Clarendon Press. С. 4–5.
- ^ Кинг, Р. Б. (1995). Неорганическая химия элементов основных групп. Нью-Йорк: Wiley-VCH. п. 289.
- ^ Гринвуд и Эрншоу, стр. 957
- ^ Гринвуд и Эрншоу, стр. 947
- ^ Гринвуд и Эрншоу, стр. 909
- ^ Spedding, F.H .; Бидри, Б. Дж. (1968). "Лютеций". В Хэмпеле, К. А. (ред.). Энциклопедия химических элементов. Reinhold Book Corporation. стр.374–78.
- ^ Settouti, N .; Аураг, Х. (2014). «Исследование физических и механических свойств лютеция по сравнению со свойствами переходных металлов: метод интеллектуального анализа данных». JOM. 67 (1): 87–93. Bibcode:2015JOM .... 67a..87S. Дои:10.1007 / s11837-014-1247-х. S2CID 136782659.
- ^ а б Сильва, Роберт Дж. (2011). «Глава 13. Фермий, менделевий, нобелий и лоуренсий». In Morss, Lester R .; Эдельштейн, Норман М .; Фугер, Жан (ред.). Химия актинидных и трансактинидных элементов. Нидерланды: Спрингер. стр.1621–51. Дои:10.1007/978-94-007-0211-0_13. ISBN 978-94-007-0210-3.
- ^ Sato, T. K .; Asai, M .; Борщевский, А .; Stora, T .; Сидел на.; Kaneya, Y .; Tsukada, K .; Düllman, Ch. E .; Eberhardt, K .; Eliav, E .; Ichikawa, S .; Kaldor, U .; Kratz, J. V .; Мияшита, С .; Nagame, Y .; Ooe, K .; Оса, А .; Renisch, D .; Runke, J .; Schädel, M .; Thörle-Pospiech, P .; Toyoshima, A .; Траутманн, Н. (9 апреля 2015 г.). «Измерение первого потенциала ионизации лоуренсия, элемент 103» (PDF). Природа. 520 (7546): 209–11. Bibcode:2015Натура. 520..209S. Дои:10.1038 / природа14342. PMID 25855457. S2CID 4384213. В архиве (PDF) с оригинала 30 октября 2018 г.. Получено 25 октября 2017.
- ^ Стил, Д. Химия металлических элементов. Оксфорд: Pergamon Press. п. 67.
- ^ Greenwood, N. N .; Эрншоу, А. (2001). Химия элементов (2-е изд.). Оксфорд: Elsevier Science Ltd. стр. 1206. ISBN 978-0-7506-3365-9.
- ^ MacKay, K. M .; MacKay, R.A .; Хендерсон, В. (2002). Введение в современную неорганическую химию (6-е изд.). Челтнем: Нельсон Торнс. С. 194–96, 385. ISBN 978-0-7487-6420-4.
- ^ Каупп, Мартин (1 декабря 2006 г.). «Роль радиальных узлов атомных орбиталей для химической связи и периодической таблицы» (PDF). Журнал вычислительной химии. 28 (1): 320–25. Дои:10.1002 / jcc.20522. PMID 17143872. S2CID 12677737. Получено 7 февраля 2018.
- ^ а б Кульша, Андрей (2004). "Периодическая система химических элементов Д. И. Менделеева" [Д. Периодическая система химических элементов И. Менделеева. (PDF). primefan.ru (на русском). Получено 17 мая 2020.
- ^ Зигфрид, Р. (2002). От элементов к атомам история химического состава. Филадельфия, Пенсильвания: Каталог публикаций Библиотеки Конгресса. п. 92. ISBN 978-0-87169-924-4.
- ^ а б Мяч, стр. 100
- ^ Хорвиц, Л. (2002). Эврика!: Научные открытия, которые изменили мир. Нью-Йорк: Джон Вили. п. 43. Bibcode:2001esbt.book ..... H. ISBN 978-0-471-23341-1. OCLC 50766822.
- ^ Август Кекуле (1857 г.). "Über die s. G. Gepaarten Verbindungen und die Theorie der mehratomigen Radicale". Annalen der Chemie und Pharmacie. 104 (2): 129–50. Дои:10.1002 / jlac.18571040202.
- ^ ван Спронсен, Дж. У. (1969). Периодическая система химических элементов. Амстердам: Эльзевир. п. 19. ISBN 978-0-444-40776-4.
- ^ "Александр-Эмиль Бельгье де Шанкуртуа (1820–1886)" (На французском). Страница истории Annales des Mines. В архиве из оригинала 27 ноября 2014 г.. Получено 18 сентября 2014.
- ^ а б Мейер, Юлий Лотар; «Современная теория» (1864); таблица на странице 137, https://reader.digitale-sammlungen.de/de/fs1/object/goToPage/bsb10073411.html?pageNo=147 В архиве 2 января 2019 в Wayback Machine
- ^ Одлинг, В. (2002). «О пропорциональном количестве элементов». Ежеквартальный научный журнал. 1: 642–48 (643).
- ^ а б Шерри, Э. (2011). Таблица Менделеева: очень краткое введение. Оксфорд: Издательство Оксфордского университета. ISBN 978-0-19-958249-5.
- ^ Кадзи, М. (2004). «Открытие периодического закона: Менделеев и другие исследователи по классификации элементов в 1860-х годах». In Rouvray, D. H .; Кинг, Р. Брюс (ред.). Таблица Менделеева: в 21 век. Research Studies Press. С. 91–122 [95]. ISBN 978-0-86380-292-8.
- ^ Ньюлендс, Дж. А. Р. (20 августа 1864 г.). «Об отношениях между аналогами». Химические новости. 10: 94–95. В архиве из оригинала от 1 января 2011 г.
- ^ Ньюлендс, Дж. А. Р. (18 августа 1865 г.). «О законе октав». Химические новости. 12: 83. В архиве из оригинала от 1 января 2011 г.
- ^ Брайсон, Б. (2004). Краткая история почти всего. Черный лебедь. стр.141 –42. ISBN 978-0-552-15174-0.
- ^ Scerri 2007, стр. 306
- ^ Brock, W. H .; Найт, Д. М. (1965). «Атомные дебаты: памятные и интересные вечера из жизни химического общества»'". Исида. 56 (1): 5–25. Дои:10.1086/349922.
- ^ Scerri 2007, стр. 87, 92
- ^ Кауфман, Г. Б. (март 1969 г.). «Американские предшественники периодического закона». Журнал химического образования. 46 (3): 128–35 [132]. Bibcode:1969JChEd..46..128K. Дои:10.1021 / ed046p128.
- ^ Менделеев, Д. (1869). "Über die Beziehungen der Eigenschaften zu den Atomgewichten der Elemente". Zeitschrift für Chemie (на немецком языке): 405–06.
- ^ Менделеев Дмитрий (27 июля 2018 г.). Периодический закон [Периодический закон] (на русском). AST. п. 16. ISBN 978-5-04-124495-8. В архиве с оригинала 28 марта 2019 г.. Получено 22 февраля 2019.
17 февраля (1 марта) 1869
- ^ Venable, стр. 96–97, 100–02.
- ^ Болл, стр. 100–02.
- ^ Пуллман, Б. (1998). Атом в истории человеческой мысли. Перевод Акселя Райзингера. Издательство Оксфордского университета. п. 227. Bibcode:1998ahht.book ..... P. ISBN 978-0-19-515040-7.
- ^ Мяч, стр. 105.
- ^ Гош, Абхик; Кипарский, Пол (2019). «Грамматика стихий». Американский ученый. 107 (6): 350. Дои:10.1511/2019.107.6.350. ISSN 0003-0996.
- ^ Аткинс, П.В. (1995). Периодическое царство. HarperCollins Publishers, Inc. стр.87. ISBN 978-0-465-07265-1.
- ^ Samanta, C .; Чоудхури, П. Рой; Басу, Д. Н. (2007). «Прогнозы периодов полураспада тяжелых и сверхтяжелых элементов при альфа-распаде». Nucl. Phys. А. 789 (1–4): 142–54. arXiv:nucl-th / 0703086. Bibcode:2007НуФА.789..142С. CiteSeerX 10.1.1.264.8177. Дои:10.1016 / j.nuclphysa.2007.04.001. S2CID 7496348.
- ^ Scerri 2007, стр. 112
- ^ Кадзи, М. (2002). "Концепция химических элементов Д. И. Менделеева и принцип химии" (PDF). Бык. Hist. Chem. 27 (1): 4–16. В архиве (PDF) из оригинала от 6 июля 2016 г.
- ^ Adloff, JP .; Кауфман, Г. Б. (25 сентября 2005 г.). «Франций (атомный номер 87), последний обнаруженный природный элемент». Химический педагог. Архивировано из оригинал 4 июня 2013 г.. Получено 26 марта 2007.
- ^ Hoffman, D. C .; Lawrence, F. O .; Mewherter, J. L .; Рурк, Ф. М. (1971). «Обнаружение плутония-244 в природе». Природа. 234 (5325): 132–34. Bibcode:1971 г., природа. 234..132H. Дои:10.1038 / 234132a0. S2CID 4283169.
- ^ Серый, стр. 12
- ^ Деминг, Х. Г. (1923). Общая химия: элементарный обзор. Нью-Йорк: J. Wiley & Sons. С. 160, 165.
- ^ Abraham, M .; Coshow, D .; Фикс, В. Периодичность: модуль справочника, версия 1.0. (PDF). Нью-Йорк: Chemsource, Inc. стр. 3. Архивировано из оригинал (PDF) 14 мая 2012 г.
- ^ Эмсли, Дж. (7 марта 1985 г.). «Таблица мечты Менделеева». Новый ученый: 32–36 [36].
- ^ Флак, Э. (1988). «Новые обозначения в таблице периодов». Чистая и прикладная химия. 60 (3): 431–36 [432]. Дои:10.1351 / pac198860030431.
- ^ Мяч, стр. 111
- ^ Scerri 2007, стр. 270–71.
- ^ Masterton, W. L .; Hurley, C.N .; Нет, Э. Дж. (31 января 2011 г.). Химия: принципы и реакции (7-е изд.). Бельмонт, Калифорния: Обучение Брукс / Коула Сенсэджа. п.173. ISBN 978-1-111-42710-8.
- ^ а б c Эмсли, Дж. (2011). Строительные блоки природы: руководство по элементам от А до Я (Новое изд.). Нью-Йорк: Издательство Оксфордского университета. ISBN 978-0-19-960563-7.
- ^ Мяч, стр. 123
- ^ Barber, R.C .; Karol, P.J .; Накахара, Хиромити; Вардачи, Эмануэле; Фогт, Э. У. (2011). «Обнаружение элементов с атомными номерами больше или равными 113 (Технический отчет IUPAC)». Pure Appl. Chem. 83 (7): 1485. Дои:10.1351 / PAC-REP-10-05-01.
- ^ Эксперимент по синтезу 117-го элемента получает продолжение [Эксперимент по синтезу 117-го элемента будет продолжен] (на русском). ОИЯИ. 2012 г. В архиве из оригинала от 1 августа 2013 г.
- ^ Бриггс, Хелен (29 января 2019 г.). "С днем рождения, таблица Менделеева". В архиве из оригинала 9 февраля 2019 г.. Получено 8 февраля 2019.
- ^ Вернер, Альфред (1905). "Beitrag zum Ausbau des periodischen Systems". Berichte der Deutschen Chemischen Gesellschaft. 38: 914–21. Дои:10.1002 / cber.190503801163.
- ^ Шерри, Эрик (2013). «Элемент 61 - Прометий». Повесть о 7 стихиях. Нью-Йорк: Oxford University Press (НАС). стр.175–94 [, 190], . ISBN 978-0-19-539131-2.
... никаких прерываний в последовательности возрастающих атомных номеров ...
- ^ Ньюэлл, С. Б. (1980). Химия: Введение. Бостон: Литтл, Браун и компания. п. 196. ISBN 978-0-316-60455-0. В архиве с оригинала 28 марта 2019 г.. Получено 27 августа 2016.
- ^ а б Дженсен, Уильям Б. (1986). «Классификация, симметрия и таблица Менделеева» (PDF). Комп. И математика. С приложениями. 12B (I / 2). В архиве (PDF) с оригинала 31 января 2017 г.. Получено 18 января 2017.
- ^ Лич, М. Р. (2012). «Относительно электроотрицательности как основного свойства элемента и почему периодическая таблица обычно представлена в ее средней форме». Основы химии. 15 (1): 13–29. Дои:10.1007 / s10698-012-9151-3. S2CID 33024121.
- ^ Thyssen, P .; Биннеманс, К. (2011). Gschneidner Jr., K. A .; Bünzli, J-C.G; Вечарский, Бюнцли (ред.). Размещение редких земель в Периодической таблице: исторический анализ. Справочник по физике и химии редких земель. 41. Амстердам: Эльзевир. п. 76. ISBN 978-0-444-53590-0.
- ^ а б Мейя, Юрис; и другие. (2016). «Атомный вес элементов 2013 (Технический отчет IUPAC)». Чистая и прикладная химия. 88 (3). Таблица 1: Стандартные атомные веса 2013, стр. 272–274. Дои:10.1515 / pac-2015-0305.
- ^ Серый, стр. 12
- ^ Кокс, П. А. (2004). Неорганическая химия (2-е изд.). Лондон: Bios Scientific. п.149. ISBN 978-1-85996-289-3.
- ^ Rayner-Canham, G .; Овертон, Т. (1 января 2006 г.). Описательная неорганическая химия (4-е изд.). Нью-Йорк: У. Фриман. стр.203. ISBN 978-0-7167-8963-5.
- ^ Уилсон, П. (2013). «Водород занимает позицию щелочного металла». Мир химии. Королевское химическое общество. В архиве с оригинала 12 апреля 2019 г.. Получено 12 апреля 2019.
- ^ а б Шерри, Э. (2012). «Некоторые комментарии к недавно предложенной периодической таблице, в которой элементы упорядочены по подоболочкам». Журнал биологической физики и химии. 12 (2): 69–70.
- ^ Сиборг, Г. (1945). «Химические и радиоактивные свойства тяжелых элементов». Новости химии и машиностроения. 23 (23): 2190–93. Дои:10.1021 / cen-v023n023.p2190.
- ^ Льюарс, Эррол Г. (2008). Моделирование чудес: вычислительное ожидание новых молекул. Springer Science & Business Media. С. 69–71. ISBN 978-1-4020-6973-4. В архиве из оригинала 19 мая 2016 г.
- ^ ИЮПАК (1 мая 2013 г.). «Периодическая таблица элементов ИЮПАК» (PDF). iupac.org. ИЮПАК. Архивировано из оригинал (PDF) 22 августа 2015 г.. Получено 20 сентября 2015.
- ^ Гринвуд и Эрншоу на протяжении всей книги
- ^ Грохала, Войцех (1 ноября 2017 г.). «О положении гелия и неона в Периодической таблице элементов». Основы химии. 20 (2018): 191–207. Дои:10.1007 / s10698-017-9302-7.
- ^ Бент Веберг, Либби (18 января 2019 г.). """Таблица Менделеева". Новости химии и машиностроения. 97 (3). Получено 27 марта 2020.
- ^ Грандинетти, Феличе (23 апреля 2013 г.). «Неон за вывесками». Химия природы. 5 (2013): 438. Bibcode:2013НатЧ ... 5..438Г. Дои:10.1038 / nchem.1631. PMID 23609097. Получено 27 марта 2019.
- ^ Thyssen, P .; Биннеманс, К. (2011). Gschneidner Jr., K. A .; Bünzli, J-C.G; Вечарский, Бюнцли (ред.). Размещение редких земель в Периодической таблице: исторический анализ. Справочник по физике и химии редких земель. 41. Амстердам: Эльзевир. С. 1–94. Дои:10.1016 / B978-0-444-53590-0.00001-7. ISBN 978-0-444-53590-0.
- ^ Флак, Э. (1988). «Новые обозначения в Периодической таблице» (PDF). Pure Appl. Chem. ИЮПАК. 60 (3): 431–436. Дои:10.1351 / pac198860030431. S2CID 96704008. Получено 24 марта 2012.
- ^ Aylward, G .; Финдли, Т. (2008). SI химические данные (6-е изд.). Милтон, Квинсленд: John Wiley & Sons. ISBN 978-0-470-81638-7.
- ^ Виберг, Н. (2001). Неорганическая химия. Сан-Диего: Academic Press. п. 119. ISBN 978-0-12-352651-9.
- ^ Уильям Б. Дженсен (1982). «Положение лантана (актиний) и лютеция (лоуренсий) в периодической таблице». J. Chem. Образовательный. 59 (8): 634–36. Bibcode:1982JChEd..59..634J. Дои:10.1021 / ed059p634.
- ^ Йоргенсен, Кристиан К. (1988). «Влияние редких земель на химическое понимание и классификацию». Справочник по физике и химии редких земель. 11. С. 197–292. Дои:10.1016 / S0168-1273 (88) 11007-6. ISBN 978-0444870803.
- ^ Кастельвекки, Д. (8 апреля 2015 г.). «Экзотический атом изо всех сил пытается найти свое место в периодической таблице». Природа. Дои:10.1038 / nature.2015.17275. S2CID 123548806. В архиве из оригинала 5 октября 2015 г.. Получено 20 сентября 2015.
- ^ Гамильтон, Дэвид С. (1965). «Положение лантана в Периодической таблице». Американский журнал физики. 33 (8): 637–640. Дои:10.1119/1.1972042.
- ^ «Состав группы 3 периодической таблицы». ИЮПАК. 2015 г. В архиве из оригинала 5 июля 2016 г.. Получено 30 июля 2016.
- ^ Фрейзер, К. (1978). «Сверхтяжелые элементы». Новости науки. 113 (15): 236–38. Дои:10.2307/3963006. JSTOR 3963006.
- ^ Fricke, B .; Greiner, W .; Вабер, Дж. Т. (1971). «Продолжение таблицы Менделеева до Z = 172. Химия сверхтяжелых элементов». Теоретика Chimica Acta. 21 (3): 235–60. Дои:10.1007 / BF01172015. S2CID 117157377.
- ^ Пююкко, П. (2011). «Предлагаемая таблица Менделеева до Z ≤ 172, основанная на расчетах Дирака – Фока для атомов и ионов». Физическая химия Химическая физика. 13 (1): 161–68. Bibcode:2011PCCP ... 13..161P. Дои:10.1039 / c0cp01575j. PMID 20967377. S2CID 31590563.
- ^ Сиборг, Г. (ок. 2006 г.). «трансурановый элемент (химический элемент)». Британская энциклопедия. В архиве из оригинала 30 ноября 2010 г.. Получено 16 марта 2010.
- ^ Bemis, C.E .; Никс, Дж. Р. (1977). «Сверхтяжелые элементы - квест в перспективе» (PDF). Комментарии к ядерной физике и физике элементарных частиц. 7 (3): 65–78. ISSN 0010-2709.
- ^ Болл, П. (Ноябрь 2010 г.). «Будет ли элемент 137 действительно означать конец периодической таблицы? Филип Болл исследует доказательства». Мир химии. В архиве из оригинала 21 октября 2012 г.. Получено 30 сентября 2012.
- ^ В поисках помощи Коллекция изображений периодических систем Эдварда Г. Мазурса. Институт истории науки. В архиве из оригинала 27 марта 2019 г.. Получено 2 октября 2018.
Нажмите «Поиск помощи», чтобы перейти к полной помощи.
- ^ а б Scerri 2007, стр. 20
- ^ "Странные слова науки: пейзажи с элементами лемнискаты". Области науки. fieldofscience.com. 22 марта 2009 г. В архиве из оригинала 4 марта 2016 г.. Получено 4 января 2016.
- ^ Emsely, J .; Шарп, Р. (21 июня, 2010 г.). «Таблица Менделеева: вершина хит-парадов». Независимый. В архиве с оригинала на 1 июля 2017 года.
- ^ Сиборг, Г. (1964). «Плутоний: элемент ужаса». Химия. 37 (6): 14.
- ^ Марк Р. Лич. «Периодическая классификация Куртин 1925 г.». В архиве из оригинала 16 мая 2016 г.. Получено 16 октября 2012.
- ^ Марк Р. Лич. "Система пластинок Рингли 1949 года". В архиве из оригинала от 3 декабря 2011 г.. Получено 16 октября 2012.
- ^ Мазурс, Э. Г. (1974). Графические изображения периодической системы за сто лет. Алабама: Университет Алабамы Press. п. 111. ISBN 978-0-8173-3200-6.
- ^ Марк Р. Лич. "Периодическое дерево Дюфура 1996 года". В архиве из оригинала 18 апреля 2010 г.. Получено 16 октября 2012.
- ^ Марк Р. Лич. "Периодическая таблица физика 1989 года Тимоти Стоу". В архиве из оригинала 5 июня 2012 г.. Получено 16 октября 2012.
- ^ Брэдли, Д. (20 июля 2011 г.). "Наконец, окончательная таблица Менделеева?". Журнал ChemViews. Дои:10.1002 / chemv.201000107. В архиве из оригинала от 1 мая 2013 г.
- ^ Scerri 2007, стр. 285–86
- ^ Scerri 2007, стр. 285
- ^ Марк Р. Лич. "Таблица Менделеева-неорганика 2002 г.". В архиве из оригинала 9 марта 2013 г.. Получено 16 октября 2012.
- ^ Шерри, Э. (2008). «Роль триад в эволюции таблицы Менделеева: прошлое и настоящее». Журнал химического образования. 85 (4): 585–89 [589]. Bibcode:2008JChEd..85..585S. Дои:10.1021 / ed085p585.
- ^ Альпер, Р. (2010). «Упрощенная таблица Менделеева: элементы, упорядоченные по их подоболочкам». Журнал биологической физики и химии. 10 (2): 74–80. Дои:10.4024 / 43AL09F.jbpc.10.02.
- ^ Бент, Х. А .; Вайнхольд, Ф. (2007). Дополнительная информация: Новости периодической таблицы Менделеева: Введение в «Символы периодичности, таблицы и модели для валентности более высокого порядка и донорно-акцепторного родства."". Журнал химического образования. 84 (7): 3–4. Дои:10.1021 / ed084p1145.
- ^ Франкл М. (май 2009 г.). «Манеры за столом» (PDF). Химия природы. 1 (2): 97–98. Bibcode:2009НатЧ ... 1 ... 97F. Дои:10.1038 / nchem.183. PMID 21378810. В архиве (PDF) из оригинала 25 октября 2012 г.
- ^ Шерри, Эрик (9 августа 2013 г.). «Есть ли оптимальная таблица Менделеева и другие более важные вопросы в философии науки». ericscerri23.blogspot.com.au. Эрик Шерри. В архиве из оригинала 13 июня 2017 г.. Получено 4 сентября 2013.
- ^ Шерри, Эрик (29 января 2019 г.). "Счастливого полувекового юбилея Периодической таблицы элементов". Издательство Оксфордского университета. В архиве из оригинала 27 марта 2019 г.. Получено 12 апреля 2019.
Библиография
- Болл, П. (2002). Ингредиенты: знакомство с элементами. Оксфорд: Издательство Оксфордского университета. ISBN 978-0-19-284100-1.
- Чанг, Р. (2002). Химия (7-е изд.). Нью-Йорк: Высшее образование Макгроу-Хилла. ISBN 978-0-19-284100-1.
- Грей, Т. (2009). Элементы: визуальное исследование каждого известного атома во Вселенной. Нью-Йорк: Black Dog & Leventhal Publishers. ISBN 978-1-57912-814-2.
- Гринвуд, Н.; Эрншоу, А. (1984). Химия элементов. Оксфорд: Pergamon Press. ISBN 978-0-08-022057-4.
- Huheey, J. E .; Keiter, E. A .; Кейтер, Р. Л. (1993). Принципы строения и реактивности (4-е изд.). Нью-Йорк: издатели колледжа Харпер Коллинз. ISBN 978-0-06-042995-9.
- Мур, Дж. Т. (2003). Химия для чайников. Для чайников (1-е изд.). Нью-Йорк: публикации Wiley. ISBN 978-0-7645-5430-8.
- Шерри, Э. (2007). Таблица Менделеева: история и значение. Оксфорд: Издательство Оксфордского университета. ISBN 978-0-19-530573-9.
- Шерри, Э. (2011). Таблица Менделеева: очень краткое введение. Оксфорд: Издательство Оксфордского университета. ISBN 978-0-19-958249-5.
- Венейбл, Ф. (1896). Развитие периодического закона. Истон, Пенсильвания: Химическая издательская компания. OCLC 776059614.
дальнейшее чтение
- Кальво, Мигель (2019). Construyendo la Tabla Periódica. Сарагоса, Испания: Prames. п. 407. ISBN 978-84-8321-908-9.
- Эмсли, Дж. (2011). «Периодическая таблица». Строительные блоки природы: руководство по элементам от А до Я (Новое изд.). Оксфорд: Издательство Оксфордского университета. С. 634–51. ISBN 978-0-19-960563-7.
- Фонтани, Марко; Коста, Мариагразия; Орна, Мэри Вирджиния (2007). Утраченные элементы: теневая сторона Периодической таблицы. Оксфорд: Издательство Оксфордского университета. п. 508. ISBN 978-0-19-938334-4.
- Мазурс, Э. (1974). Графические изображения периодической системы за сто лет. Алабама: Университет Алабамы Press. ISBN 978-0-19-960563-7.
- Rouvray, D.H .; Кинг, Р. Б., ред. (2004). Периодическая таблица: в 21 век. Материалы 2-й Международной конференции по Периодической таблице, часть 1, гостевое ранчо Кананаскиса, Альберта, 14–20 июля 2003 г. Болдок, Хартфордшир: Research Studies Press. ISBN 978-0-86380-292-8.
- Rouvray, D.H .; Кинг, Р. Б., ред. (2006). Математика периодической таблицы. Труды 2-й Международной конференции по Периодической таблице, часть 2, гостевое ранчо Кананаскиса, Альберта, 14–20 июля 2003 г. Нью-Йорк: Nova Science. ISBN 978-1-59454-259-6.
- Шерри, Э (нет данных). "Книги по элементам и периодической таблице" (PDF). Получено 9 июля 2018.
- Scerri, E .; Рестрепо, G, ред. (2018). Менделеев - Оганессон: мультидисциплинарный взгляд на периодическую таблицу. Труды 3-й Международной конференции по Периодической таблице, Куско, Перу, 14–16 августа 2012 г. Оксфорд: Oxford University Press. ISBN 978-0-86380-292-8.
- ван Спронсен, Дж. У. (1969). Периодическая система химических элементов: история первых ста лет. Амстердам: Эльзевир. ISBN 978-0-444-40776-4.
- Верде, М., изд. (1971). Атти дель конвеньо Менделеевиано: Periodicità e simmetrie nella struttura elementare della materia [Труды Менделеевской конференции: Периодичность и симметрия в элементарной структуре материи]. 1-я Международная конференция по Периодической таблице, Турин-Рим, 15–21 сентября 1969 г. Турин: Accademia delle Scienze di Torino.
внешняя ссылка
- Периодическая таблица страница избранной темы на Институт истории науки Цифровые коллекции с избранными визуальными представлениями периодической таблицы элементов с акцентом на альтернативные схемы, включая круглые, цилиндрические, пирамидальные, спиральные и треугольные формы.
- Периодическая таблица элементов ИЮПАК
- Динамическая таблица Менделеева, с интерактивными макетами
- Эрик Шерри, ведущий философ науки, специализирующийся на истории и философии периодической таблицы Менделеева.
- Интернет-база данных периодических таблиц
- Периодическая таблица исчезающих элементов
- Периодическая таблица образцов
- Периодическая таблица видео
- WebElements
