Ретросинтетический анализ - Retrosynthetic analysis - Wikipedia
Ретросинтетический анализ метод решения проблем при планировании органический синтез. Это достигается путем преобразования целевой молекулы в более простые структуры-предшественники независимо от любой потенциальной реакционной способности / взаимодействия с реагентами. Каждый материал-прекурсор исследуют одним и тем же методом. Эта процедура повторяется до тех пор, пока не будут получены простые или коммерчески доступные структуры. Эти более простые / коммерчески доступные соединения можно использовать для синтеза целевой молекулы. E.J. Кори формализовал эту концепцию в своей книге Логика химического синтеза.[1][2][3]
Сила ретросинтетического анализа становится очевидной в плане синтеза. Целью ретросинтетического анализа является структурное упрощение. Часто синтез будет иметь более одного возможного пути синтеза. Ретросинтез хорошо подходит для открытия различных синтетических маршрутов и их логического и простого сравнения.[4] С базой данных можно обращаться на каждом этапе анализа, чтобы определить, существует ли уже компонент в литературе. В этом случае дальнейшее исследование этого комплекса не потребуется. Если это соединение существует, это может быть отправной точкой для дальнейших шагов по достижению синтеза.
Определения
- Отключение
- Этап ретросинтеза, включающий разрыв связи с образованием двух (или более) синтоны.
- Ретрон
- Минимальная молекулярная субструктура, допускающая определенные преобразования.
- Ретросинтетическое дерево
- А ориентированный ациклический граф нескольких (или всех) возможных ретросинтезов одной мишени.
- Synthon
- Фрагмент соединения, которое способствует синтезу, полученный из этой целевой молекулы. Синтон и соответствующий коммерчески доступный синтетический эквивалент показаны ниже:
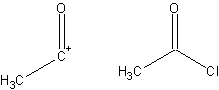
- Цель
- Желаемое конечное соединение.
- Преобразовать
- Обратная синтетическая реакция; формирование исходных материалов из единого продукта.
Пример
Пример позволит легко понять концепцию ретросинтетического анализа.

Планируя синтез фенилуксусная кислота, идентифицированы два синтона. Нуклеофильная группа «-COOH» и электрофильная группа «PhCH»2+"группа. Конечно, оба синтона не существуют как таковые; синтетические эквиваленты, соответствующие синтонам, вступают в реакцию с образованием желаемого продукта. В этом случае цианид анион синтетический эквивалент −COOH-синтон, а бензилбромид синтетический эквивалент бензилсинтона.
Таким образом, синтез фенилуксусной кислоты, определенный ретросинтетическим анализом:
- PhCH2Br + NaCN → PhCH2CN + NaBr
- PhCH2CN + 2 H2O → PhCH2COOH + NH3

Фактически, фенилуксусная кислота была синтезирована из бензилцианид,[5] сам подготовлен аналогичной реакцией бензилхлорид с цианид натрия.[6]
Стратегии
Функциональные групповые стратегии
Манипулирование функциональные группы может привести к значительному снижению молекулярной сложности.
Стереохимические стратегии
Многочисленные химические мишени имеют разные стереохимический требования. Стереохимические превращения (такие как Перестановка Клейзена и Мицунобу реакция ) может удалить или передать желаемую хиральность, что упростит задачу.
Структурно-целевые стратегии
Направление синтеза к желаемому промежуточному звену может значительно сузить фокус анализа. Это позволяет использовать методы двунаправленного поиска.
Стратегии на основе преобразований
Применение преобразований к ретросинтетическому анализу может привести к значительному снижению молекулярной сложности. К сожалению, мощные ретроны, основанные на трансформации, редко присутствуют в сложных молекулах, и часто требуются дополнительные этапы синтеза, чтобы установить их присутствие.
Топологические стратегии
Идентификация одного или нескольких разрывов ключевых связей может привести к идентификации ключевых подструктур или затруднить идентификацию преобразований перегруппировки, чтобы идентифицировать ключевые структуры.
- Приветствуются отключения, сохраняющие кольцевые структуры.
- Отключения, которые создают кольца, состоящие из более чем 7 элементов, не приветствуются.
- Отключение требует творчества.
Смотрите также
Рекомендации
- ^ Э. Дж. Кори, X-M. Ченг (1995). Логика химического синтеза. Нью-Йорк: Вили. ISBN 978-0-471-11594-6.
- ^ Э. Дж. Кори (1988). «Ретросинтетическое мышление - основы и примеры». Chem. Soc. Ред. 17: 111–133. Дои:10.1039 / CS9881700111.
- ^ Э. Дж. Кори (1991). «Логика химического синтеза: многоступенчатый синтез сложных карбогенных молекул (Нобелевская лекция)» (Перепечатка). Angewandte Chemie International Edition на английском языке. 30 (5): 455–465. Дои:10.1002 / anie.199104553.
- ^ Джеймс Лоу и др.: «Дизайнер маршрутов: инструмент ретросинтетического анализа, использующий автоматическое создание ретросинтетических правил», Журнал химической информации и моделирования (ACS JCIM) Дата публикации (Интернет): 6 февраля 2009 г .; Дои:10.1021 / ci800228y, http://pubs.acs.org/doi/abs/10.1021/ci800228y
- ^ Вильгельм Веннер (1963). «Фенилацетамид». Органический синтез.; Коллективный объем, 4, п. 760
- ^ Роджер Адамс; А. Ф. Таль (1941). «Цианид бензила». Органический синтез.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 1, п. 107
внешняя ссылка
- Центр молекулярной и биомолекулярной информатики
- Презентация ARChem Route Designer, ACS, Филадельфия, сентябрь 2008 г. для получения дополнительной информации об ARChem см. SimBioSys страниц.
- Инструмент планирования ретросинтеза: ICSynth от InfoChem
- Spaya, Бесплатное программное обеспечение, предложенное Iktos
