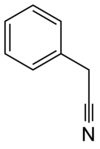
Бензил цианид - Benzyl cyanide
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Фенилацетонитрил[1] | |
| Другие имена | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.004.919 |
| КЕГГ | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C8ЧАС7N | |
| Молярная масса | 117,15 г / моль |
| Внешность | Бесцветная маслянистая жидкость |
| Плотность | 1,015 г / см3 |
| Температура плавления | -24 ° С (-11 ° F, 249 К) |
| Точка кипения | От 233 до 234 ° C (от 451 до 453 ° F, от 506 до 507 K) |
| -76.87·10−6 см3/ моль | |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Бензил цианид (сокращенно BnCN) является органическое соединение с химическая формула C6ЧАС5CH2CN. Эта бесцветная маслянистая ароматическая жидкость является важным предшественник к многочисленным соединениям в органическая химия.[2]
Подготовка и реакции
Бензилцианид может производиться Синтез нитрила Кольбе между бензилхлорид и цианид натрия[3] и по окислительное декарбоксилирование из фенилаланин.[4]
Цианид бензила претерпевает множество реакций, характерных для нитрилов. Может быть гидролизованный давать фенилуксусная кислота[5] или его можно использовать в Пиннер реакция с образованием фенилуксусной кислоты сложные эфиры.[6] Гидрирование дает β-фенэтиламин.[7]
Соединение содержит «активный метиленовая установка Происходит бромирование, дает PhCHBrCN.[8] Различные реакции, вызванные основанием, приводят к образованию новых углерод-углеродные связи.[9][10][11]
Использует
Бензилцианид используется в качестве растворителя.[12] и как исходный материал при синтезе фунгициды,[13] ароматы (фенэтиловый спирт ), антибиотики,[2] и другие фармацевтические препараты. Частичный гидролиз BnCN приводит к 2-фенилацетамид,[14] известный противосудорожное средство.
Фармацевтические препараты
Цианид бензила является полезным предшественник к многочисленным фармацевтическим препаратам. Примеры включают:
- Аноректики (например. сибутрамин )[15]
- Анальгетики (например. этогептазин, кетобемидон, петидин, и феноперидин )[15]
- Антиаритмические средства (например. дизопирамид )[15]
- Антидепрессанты (например. венлафаксин )[15]
- Антигистаминные препараты (например. левокабастин и хлорфенамин )[15][16]
- Противомалярийные препараты (например. пириметамин )[15]
- Противокашлевые (например. изоаминил, окселадин, бутетамат, пентапиперид, и пентоксиверин )[17]
- Диуретики (например. триамтерен )[18]
- Снотворные (например. алонимид и фенобарбитал )[15][19]
- Спазмолитики (например. пентапиперид и дрофенин )[15][20]
- Стимуляторы (например. метилфенидат )[15]
- Азатадин
Регулирование
Поскольку бензилцианид является полезным предшественник многочисленным наркотики с рекреационным потенциалом, многие страны строго регулируют состав.
Соединенные Штаты
Бензилцианид регулируется в США как DEA Список I химикатов.
Безопасность
Цианид бензила, как и родственные производные бензила, раздражает кожу и глаза.[2]
Рекомендации
- ^ а б Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 16. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ а б c Поллак, Питер; Ромедер, Жерар; Хагедорн, Фердинанд; Гелбке, Хайнц-Петер (2000). «Нитрилы». Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a17_363.
- ^ Адамс, Роджер; Тал, А. Ф. (1922). «Бензилцианид». Органический синтез. 2: 9. Дои:10.15227 / orgsyn.002.0009.
- ^ Хигель, Джин; Льюис, Джастин; Бэ, Джейсон (2004). «Превращение α-аминокислот в нитрилы путем окислительного декарбоксилирования с помощью трихлоризоциануровой кислоты». Синтетические коммуникации. 34 (19): 3449–3453. Дои:10.1081 / SCC-200030958.
- ^ Адамс, Роджер; Тал, А. Ф. (1922). «Фенилуксусная кислота». Органический синтез. 2: 59. Дои:10.15227 / orgsyn.002.0059.
- ^ Адамс, Роджер; Тал, А. Ф. (1922). «Этилфенилацетат». Органический синтез. 2: 27. Дои:10.15227 / orgsyn.002.0027.
- ^ Робинсон младший, Джон К.; Снайдер, Х. Р. (1943). «β-Фенилэтиламин». Органический синтез. 23: 71. Дои:10.15227 / orgsyn.023.0071.
- ^ Robb, C.M .; Шульц, Э. М. (1948). «Дифенилацетонитрил». Органический синтез. 28: 55. Дои:10.15227 / orgsyn.028.0055.
- ^ Макоша, М .; Йончик, А (1976). «Фазовое алкилирование нитрилов: 2-фенилбутиронитрил». Органический синтез. 55: 91. Дои:10.15227 / orgsyn.055.0091.
- ^ Ито, Масуми; Хагивара, Дайдзиро; Камия, Такаши (1988). «Новый реагент для трет-бутоксикарбонилирования: 2-трет-бутоксикарбонилоксиимино-2-фенилацетонитрил». Органический синтез. 6: 199. Дои:10.15227 / orgsyn.059.0095.
- ^ Вавзонек, Стэнли; Смолин, Эдвин М. (1955). «α-Фенилциннамонитрил». Органический синтез. 3: 715. Дои:10.15227 / orgsyn.029.0083.
- ^ Бьен, Ханс-Самуэль; Ставиц, Йозеф; Вундерлих, Клаус (2000). «Антрахиноновые красители и промежуточные продукты». Энциклопедия промышленной химии Ульмана: 29. Дои:10.1002 / 14356007.a02_355.
- ^ Акерманн, Питер; Марго, Пол; Мюллер, Франц (2000). «Фунгициды сельскохозяйственные». Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a12_085.
- ^ «ФЕНИЛАЦЕТАМИД». Органический синтез. 32: 92. 1952. Дои:10.15227 / orgsyn.032.0092. ISSN 0078-6209.
- ^ а б c d е ж грамм час я Издательство Уильяма Эндрю (2008). Энциклопедия фармацевтического производства (3-е изд.). Норвич, Нью-Йорк: Elsevier Science. С. 182, 936, 1362, 1369, 1505, 2036, 2157, 2259, 2554, 2620, 2660, 2670, 2924, 3032 и 3410. ISBN 9780815515265.
- ^ Беркофф, Чарльз Э .; Ривард, Дональд Э .; Киркпатрик, Дэвид; Айвз, Джеффри Л. (1980). "Восстановительное децианирование нитрилов с помощью щелочного синтеза". Синтетические коммуникации. 10 (12): 939–945. Дои:10.1080/00397918008061855.
- ^ Буб, Оскар; Фридрих, Людвиг (2000). «Средства от кашля». Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a08_013.
- ^ Хропот, Макс; Ланг, Ханс-Йохен (2000). «Диуретики». Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a09_029.
- ^ Фернисс, Брайан; Ханнафорд, Энтони; Смит, Питер и Тэтчелл, Остин (1996). Учебник практической органической химии Фогеля, 5-е изд.. Лондон: Longman Science & Technical. С. 1174–1179. ISBN 9780582462366.
- ^ Бунгардт, Эдвин; Мучлер, Эрнст (2000). «Спазмолитики». Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a24_515.
