Молекулярная биология - Molecular biology
| Часть серии по |
| Биохимия |
|---|
 |
| Ключевые компоненты |
| История биохимии |
| Глоссарии |
| Порталы: Биохимия |
Молекулярная биология /мəˈлɛkjʊлər/ это филиал биология что касается молекулярный базис биологическая активность в и между клетки, включая молекулярный синтез, модификация, механизмы и взаимодействия.[1][2] В центральная догма молекулярной биологии описывает процесс, в котором ДНК транскрибируется в РНК, а затем транслируется в белок. [2][3]
Уильям Эстбери описал молекулярную биологию в 1961 г. Природа, в качестве:
... не столько техника, сколько подход, подход с точки зрения так называемых фундаментальных наук с ведущей идеей поиска под крупномасштабными проявлениями классической биологии соответствующего молекулярного плана. Это особенно касается формы биологических молекул и [...] является преимущественно трехмерным и структурным, что, однако, не означает, что это просто уточнение морфологии. Он должен одновременно исследовать происхождение и функцию.[4]
Некоторые клинические исследования и медицинские методы лечения, основанные на молекулярной биологии, подпадают под генная терапия тогда как использование молекулярной биологии или молекулярная клеточная биология в медицине теперь называется молекулярная медицина. Молекулярная биология также играет важную роль в понимании образований, действий и регуляций различных частей организма. клетки которые можно использовать для эффективного нацеливания новых наркотики, диагностировать болезнь и понимать физиологию клетки. [5]
История
Хотя молекулярная биология стала официальной отраслью науки в 1930-х годах, этот термин появился только в 1938 году. Уоррен Уивер. В то время Уивер был директором естественных наук в Фонд Рокфеллера и считал, что биология вот-вот претерпит значительные изменения из-за последних достижений в области технологий, таких как Рентгеновская кристаллография.[6][7]
Молекулярная биология возникла как попытка ответить на вопросы о механизмах генетическая наследственность и структура ген. В 1953 г. Джеймс Уотсон и Фрэнсис Крик опубликовал двойную спиральную структуру ДНК любезно Рентгеновская кристаллография работа сделана Розалинд Франклин и Морис Уилкинс. Уотсон и Крик описали структуру ДНК и взаимодействия внутри молекулы. Эта публикация дала толчок исследованиям в области молекулярной биологии и повысила интерес к этой теме. [8]
Связь с другими биологическими науками
В следующем списке представлена точка зрения на междисциплинарные отношения между молекулярной биологией и другими смежными областями.[9]
- Молекулярная биология это изучение молекулярных основ процессов репликация, транскрипция, перевод, и функции клеток.[1]
- Биохимия изучение химических веществ и жизненно важных процессов, происходящих в живых организмы. Биохимики сосредоточить внимание на роли, функциях и структуре биомолекулы Такие как белки, липиды, углеводы и нуклеиновые кислоты.[10]
- Генетика это исследование того, как генетические различия влияют на организмы. Генетика пытается предсказать, как мутации, индивидуальный гены и генетические взаимодействия может повлиять на выражение фенотип [11]
Хотя исследователи практикуют методы, характерные для молекулярной биологии, их обычно комбинируют с методами из генетика и биохимия. Большая часть молекулярной биологии носит количественный характер, и в последнее время значительный объем работы был выполнен с использованием таких методов информатики, как биоинформатика и вычислительная биология. Молекулярная генетика, изучение структуры и функции генов, с начала 2000-х годов входит в число наиболее важных разделов молекулярной биологии. Другие отрасли биологии основаны на молекулярной биологии либо путем непосредственного изучения взаимодействий самих молекул, например, клеточная биология и биология развития, или косвенно, когда молекулярные методы используются для вывода исторических атрибутов население или же разновидность, как в полях в эволюционная биология Такие как популяционная генетика и филогенетика. Также существует давняя традиция обучения биомолекулы "с нуля" или молекулярно в биофизика.[12]
Методы молекулярной биологии

Молекулярное клонирование
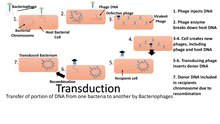
Одним из основных методов молекулярной биологии для изучения функции белков является молекулярное клонирование. В этом методе ДНК, кодирующая интересующий белок, клонированный с помощью полимеразной цепной реакции (ПЦР) и / или рестрикционные ферменты в плазмида (вектор выражения ). Вектор имеет 3 отличительных признака: ориджин репликации, сайт множественного клонирования (MCS) и селективный маркер обычно устойчивость к антибиотикам. Перед сайтом множественного клонирования расположены промоутерские регионы и транскрипция стартовый сайт, который регулирует экспрессию клонированного гена. Эта плазмида может быть вставлена как в бактериальные, так и в животные клетки. Введение ДНК в бактериальные клетки можно осуществить с помощью трансформация за счет поглощения голой ДНК, спряжение через межклеточный контакт или трансдукция через вирусный вектор. Введение ДНК в эукариотический клетки, такие как клетки животных, физическими или химическими способами называются трансфекция. Доступно несколько различных методов трансфекции, таких как трансфекция фосфатом кальция, электропорация, микроинъекция и трансфекция липосом. Плазмида может быть интегрирована в геном, что приводит к стабильной трансфекции или может оставаться независимым от генома, что называется временной трансфекцией.[13][14]
ДНК, кодирующая интересующий белок, теперь находится внутри клетки, и белок теперь можно выразить. Доступны различные системы, такие как индуцибельные промоторы и специфические клеточные сигнальные факторы, которые помогают экспрессировать представляющий интерес белок на высоких уровнях. Затем из бактериальной или эукариотической клетки можно экстрагировать большие количества белка. Белок может быть протестирован на ферментативную активность в различных ситуациях, белок может быть кристаллизован, поэтому его третичная структура можно изучать, или, в фармацевтической промышленности, можно изучать активность новых лекарств против белка.[15]
Полимеразной цепной реакции
Полимеразной цепной реакции (ПЦР) - чрезвычайно универсальный метод копирования ДНК. Короче говоря, ПЦР позволяет Последовательность ДНК быть скопированным или измененным заранее определенным образом. Реакция чрезвычайно мощная и в идеальных условиях может усилить одну молекулу ДНК до 1,07 миллиарда молекул менее чем за два часа. Метод ПЦР может быть использован для введения сайты рестрикционных ферментов к концам молекул ДНК или для мутации определенных оснований ДНК, последний метод, называемый сайт-направленный мутагенез. ПЦР также можно использовать для определения того, обнаружен ли конкретный фрагмент ДНК в библиотека кДНК. ПЦР имеет множество разновидностей, например ПЦР с обратной транскрипцией (ОТ-ПЦР ) для амплификации РНК, а в последнее время количественная ПЦР которые позволяют количественно измерять молекулы ДНК или РНК.[16][17]
Гель-электрофорез

Гель-электрофорез является одним из основных инструментов молекулярной биологии. Основной принцип состоит в том, что ДНК, РНК и белки можно разделить с помощью электрического поля и размера. В электрофорез в агарозном геле ДНК и РНК можно разделить по размеру, пропустив ДНК через электрически заряженный агарозный гель. Белки можно разделить по размеру с помощью SDS-СТРАНИЦА гель, или в зависимости от размера и их электрический заряд используя то, что известно как 2D гель-электрофорез.[18]
Блоттинг и зондирование макромолекул
Условия северный, западный и восточный блоттинг произошел от того, что изначально было шуткой молекулярной биологии, которая сыграла с этим термином Саузерн-блоттинг, после техники, описанной Эдвин Саузерн для гибридизации блотированной ДНК. Патрисия Томас, разработчик блота РНК, который затем стал известен как северное пятно, на самом деле не использовал этот термин.[19]
Саузерн-блоттинг
Назван в честь изобретателя, биолога. Эдвин Саузерн, то Саузерн-блот представляет собой метод проверки наличия определенной последовательности ДНК в образце ДНК. Образцы ДНК до или после рестрикционный фермент (рестрикционной эндонуклеазой) расщепление разделяют с помощью гель-электрофореза и затем переносят на мембрану путем блоттинга через капиллярное действие. Затем на мембрану воздействуют меченым ДНК-зондом, который имеет последовательность оснований комплемента к последовательности на интересующей ДНК.[20] Саузерн-блоттинг реже используется в лабораторных исследованиях из-за возможностей других методов, таких как ПЦР, чтобы обнаружить конкретные последовательности ДНК из образцов ДНК. Эти кляксы все еще используются для некоторых приложений, например, для измерения трансген копировать номер в трансгенные мыши или в разработке нокаут гена линии эмбриональных стволовых клеток.[21]
Нозерн-блоттинг
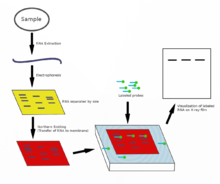
В северное пятно используется для изучения паттернов экспрессии конкретного типа молекулы РНК в качестве относительного сравнения между набором различных образцов РНК. По сути, это комбинация денатурирующий гель-электрофорез РНК, а пятно. В этом процессе РНК разделяется по размеру и затем переносится на мембрану, которую затем исследуют меченым дополнять интересующей последовательности. Результаты могут быть визуализированы различными способами в зависимости от используемой метки; однако в большинстве случаев обнаруживаются полосы, представляющие размеры РНК, обнаруженной в образце. Интенсивность этих полос связана с количеством целевой РНК в анализируемых образцах. Эта процедура обычно используется для изучения того, когда и в какой степени происходит экспрессия гена, путем измерения того, сколько этой РНК присутствует в разных образцах. Это один из основных инструментов для определения того, в какое время и при каких условиях определенные гены экспрессируются в живых тканях.[22][23]
Вестерн-блоттинг
В вестерн-блоттинг, белки сначала разделяются по размеру в тонком геле, зажатом между двумя стеклянными пластинами с помощью метода, известного как SDS-СТРАНИЦА. Затем белки в геле переносятся в поливинилиденфторид (ПВДФ), нитроцеллюлоза, нейлон или другая поддерживающая мембрана. Затем эту мембрану можно исследовать растворами антитела. Антитела, которые специфически связываются с интересующим белком, затем можно визуализировать с помощью различных методов, включая окрашенные продукты, хемилюминесценция, или же авторадиография. Часто антитела помечают ферментами. Когда хемилюминесцентный субстрат подвергается воздействию фермент это позволяет обнаруживать. Использование методов вестерн-блоттинга позволяет не только обнаруживать, но и проводить количественный анализ. Методы, аналогичные вестерн-блоттингу, можно использовать для прямого окрашивания конкретных белков в живых организмах. клетки или же ткань разделы.[24][25]
Восточный блоттинг
В восточный блоттинг техника используется для обнаружения посттрансляционная модификация белков. Белки, нанесенные на PVDF или нитроцеллюлозную мембрану, исследуются на предмет модификаций с использованием определенных субстратов.[26]
Микрочипы

А ДНК-микрочип представляет собой набор пятен, прикрепленных к твердой опоре, такой как предметное стекло микроскопа где каждое пятно содержит одну или несколько одноцепочечных ДНК олигонуклеотид фрагменты. Матрицы позволяют наносить большое количество очень маленьких (диаметром 100 микрометров) пятен на одном предметном стекле. Каждое пятно содержит молекулу фрагмента ДНК, которая комплементарна одному Последовательность ДНК. Вариант этого метода позволяет экспрессия гена организма на определенной стадии развития, чтобы быть квалифицированным (профилирование выражений ). В этом методе РНК в ткани выделяется и превращается в меченую комплементарная ДНК (кДНК). Эта кДНК затем гибридизируется с фрагментами на массиве, и может быть выполнена визуализация гибридизации. Поскольку можно создать несколько массивов с одним и тем же положением фрагментов, они особенно полезны для сравнения экспрессии генов в двух разных тканях, таких как здоровая и раковая ткань. Кроме того, можно измерить, какие гены экспрессируются и как эта экспрессия изменяется со временем или с другими факторами. Существует множество различных способов изготовления микрочипов; наиболее распространенными являются кремниевые чипы, предметные стекла для микроскопов с пятнами диаметром ~ 100 микрометров, нестандартные матрицы и матрицы с более крупными пятнами на пористых мембранах (макроматрицы). В одном массиве может быть от 100 до более 10 000 точек. Массивы также могут быть сделаны из других молекул, кроме ДНК.[27][28][29][30]
Аллель-специфический олигонуклеотид
Аллель-специфический олигонуклеотид (ASO) - это метод, который позволяет обнаруживать мутации единичных оснований без необходимости ПЦР или гель-электрофореза. Короткие (20-25 нуклеотидов в длину) меченые зонды подвергаются воздействию нефрагментированной целевой ДНК, гибридизация происходит с высокой специфичностью из-за малой длины зондов, и даже одно изменение основания будет препятствовать гибридизации. Затем целевая ДНК промывается и меченые зонды, которые не гибридизуются, удаляются. Затем ДНК-мишень анализируется на наличие зонда по радиоактивности или флуоресценции. В этом эксперименте, как и в большинстве методов молекулярной биологии, необходимо использовать контроль для обеспечения успешного эксперимента.[31][32]

В молекулярной биологии постоянно развиваются процедуры и технологии, а от старых технологий отказываются. Например, до появления ДНК гель-электрофорез (агароза или же полиакриламид ) размер молекул ДНК обычно определялся скоростью осаждение в градиенты сахарозы, медленная и трудоемкая техника, требующая дорогостоящего оборудования; до градиентов сахарозы, вискозиметрия использовался. Помимо их исторического интереса, часто стоит знать о более старых технологиях, поскольку иногда бывает полезно решить другую новую проблему, для которой новые методы не подходят.[33]
Смотрите также
Рекомендации
- ^ а б Альбертс Б., Джонсон А., Льюис Дж, Морган Д., Рафф М., Робертс К., Уолтер П. (2014). Молекулярная биология клетки, шестое издание. Наука о гирляндах. С. 1–10. ISBN 978-1-317-56375-4.
- ^ а б Гэннон Ф (февраль 2002 г.). "Молекулярная биология - что в названии?". EMBO отчеты. 3 (2): 101. Дои:10.1093 / embo-reports / kvf039. ЧВК 1083977. PMID 11839687.
- ^ Кокс, Майкл М. (2015-03-16). Молекулярная биология: принципы и практика. Дудна, Дженнифер А. ,, О'Доннелл, Майкл (биохимик) (второе изд.). Нью-Йорк. ISBN 978-1-4641-2614-7. OCLC 905380069.
- ^ Astbury WT (июнь 1961 г.). «Молекулярная биология или ультраструктурная биология?». Природа. 190 (4781): 1124. Bibcode:1961Натура.190.1124А. Дои:10.1038 / 1901124a0. PMID 13684868. S2CID 4172248.
- ^ Белло Э.А., Швинн Д.А. (декабрь 1996 г.). «Молекулярная биология и медицина. Учебник для клинициста». Анестезиология. 85 (6): 1462–78. Дои:10.1097/00000542-199612000-00029. PMID 8968195. S2CID 29581630.
- ^ Уивер W (ноябрь 1970 г.). «Молекулярная биология: происхождение термина». Наука. 170 (3958): 581–2. Bibcode:1970Sci ... 170R.581W. Дои:10.1126 / science.170.3958.581-а. PMID 4919180.
- ^ Байнум В. (1 февраля 1999 г.). «История молекулярной биологии». Природа Медицина. 5 (2): 140. Дои:10.1038/5498. ISSN 1078-8956. S2CID 1497333.
- ^ Табери, Моника, Джеймс, Пиотровска; Дарден, Линдли (2019), "Молекулярная биология", в Залте, Эдвард Н. (ред.), Стэнфордская энциклопедия философии (Издание осенью 2019 г.), Исследовательская лаборатория метафизики Стэнфордского университета., получено 2020-04-19
- ^ Лодиш Х, Берк А, Зипурски С.Л., Мацудаира П., Балтимор Д., Дарнелл Дж. (2000). Молекулярная клеточная биология (4-е изд.). Нью-Йорк: Книги Scientific American. ISBN 978-0-7167-3136-8.
- ^ Берг, Джереми (2002). Биохимия. Тимочко, Джон Л .; Страйер, Люберт (5-е изд.). Нью-Йорк: W.H. Фримен. ISBN 0-7167-3051-0. OCLC 48055706.
- ^ Справка, Дом генетики. "Помогите мне понять генетику". Домашний справочник по генетике. Получено 31 декабря 2016.
- ^ Тиан Дж., Изд. (2013). Молекулярная визуализация: основы и приложения. Springer-Verlag Berlin & Heidelberg GmbH & Co. K. p. 542. ISBN 9783642343032. Получено 2019-07-08.
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. Выделение, клонирование и секвенирование ДНК. Получено 31 декабря 2016.
- ^ Лессард, Джулиана К. (1 января 2013 г.). «Молекулярное клонирование». Лабораторные методы в энзимологии: ДНК. Методы в энзимологии. 529. С. 85–98. Дои:10.1016 / B978-0-12-418687-3.00007-0. ISBN 978-0-12-418687-3. ISSN 1557-7988. PMID 24011038.
- ^ Кокате С., Jalalpure SS, Hurakadle PJ (2016). Учебник фармацевтической биотехнологии. Клонирование экспрессии. Эльзевир. п. 125. ISBN 9788131239872. Получено 2019-07-08.
- ^ «Полимеразная цепная реакция (ПЦР)». Национальный центр биотехнологической информации. Национальная медицинская библиотека США. Получено 31 декабря 2016.
- ^ «Информационный бюллетень по полимеразной цепной реакции (ПЦР)». Национальный институт исследования генома человека (NHGRI). Получено 31 декабря 2016.
- ^ Ли PY, Costumbrado J, Hsu CY, Kim YH (апрель 2012 г.). «Электрофорез в агарозном геле для разделения фрагментов ДНК». Журнал визуализированных экспериментов (62). Дои:10.3791/3923. ЧВК 4846332. PMID 22546956.
- ^ Томас PS (сентябрь 1980 г.). «Гибридизация денатурированной РНК и небольших фрагментов ДНК, перенесенных на нитроцеллюлозу». Труды Национальной академии наук Соединенных Штатов Америки. 77 (9): 5201–5. Bibcode:1980PNAS ... 77.5201T. Дои:10.1073 / pnas.77.9.5201. ЧВК 350025. PMID 6159641.
- ^ Браун Т (май 2001 г.). «Саузерн-блоттинг». Текущие протоколы в иммунологии. Глава 10: Блок 10.6A. Дои:10.1002 / 0471142735.im1006as06. ISBN 978-0-471-14273-7. PMID 18432697. S2CID 20686993.
- ^ Тиан Дж., Изд. (2013). Молекулярная визуализация: основы и приложения. Springer-Verlag Berlin & Heidelberg GmbH & Co. K. p. 550. ISBN 9783642343032. Получено 2019-07-08.
- ^ Йозефсен К., Нильсен Х (2011). Нильсен Х (ред.). Методы и протоколы РНК. Методы молекулярной биологии. 703. Нью-Йорк: Humana Press. С. 87–105. Дои:10.1007/978-1-59745-248-9_7. ISBN 978-1-59745-248-9. PMID 21125485.
- ^ He SL, Green R (1 января 2013 г.). «Нозерн-блоттинг». Методы в энзимологии. 530: 75–87. Дои:10.1016 / B978-0-12-420037-1.00003-8. ISBN 978-0-12-420037-1. ЧВК 4287216. PMID 24034315.
- ^ Махмуд Т., Ян П.К. (сентябрь 2012 г.). «Вестерн-блоттинг: техника, теория и устранение неполадок». Североамериканский журнал медицинских наук. 4 (9): 429–34. Дои:10.4103/1947-2714.100998. ЧВК 3456489. PMID 23050259.
- ^ Куриен Б.Т., Скофилд Р.Х. (апрель 2006 г.). «Вестерн-блоттинг». Методы. 38 (4): 283–93. Дои:10.1016 / j.ymeth.2005.11.007. PMID 16483794. - через ScienceDirect (Может потребоваться подписка или контент может быть доступен в библиотеках.)
- ^ Томас С., Тирумалапура Н., Кроссли Е.К., Исмаил Н., Уокер Д.Х. (июнь 2009 г.). «Модификации антигенного белка у Эрлихии». Иммунология паразитов. 31 (6): 296–303. Дои:10.1111 / j.1365-3024.2009.01099.x. ЧВК 2731653. PMID 19493209.
- ^ «Микроматрицы». Национальный центр биотехнологической информации. Национальная медицинская библиотека США. Получено 31 декабря 2016.
- ^ Бумгарнер Р. (январь 2013 г.). Фредерик М. Осубель и др. (ред.). «Обзор ДНК-микрочипов: типы, приложения и их будущее». Текущие протоколы в молекулярной биологии. Глава 22: Раздел 22.1. Дои:10.1002 / 0471142727.mb2201s101. ISBN 978-0-471-14272-0. ЧВК 4011503. PMID 23288464.
- ^ Говиндараджан Р., Дурайян Дж., Калиаппан К., Паланисами М. (август 2012 г.). «Микромассив и его приложения». Журнал фармации и биологических наук. 4 (Приложение 2): S310-2. Дои:10.4103/0975-7406.100283. ЧВК 3467903. PMID 23066278.
- ^ Тарка А. Л., Ромеро Р., Драгичи С. (август 2006 г.). «Анализ микроматричных экспериментов по профилированию экспрессии генов». Американский журнал акушерства и гинекологии. 195 (2): 373–88. Дои:10.1016 / j.ajog.2006.07.001. ЧВК 2435252. PMID 16890548.
- ^ Cheng L, Zhang DY, ред. (2008). Молекулярно-генетическая патология. Тотова, Нью-Джерси: Humana. п. 96. ISBN 978-1-59745-405-6. Получено 31 декабря 2016.
- ^ Леонард Д.Г. (2016). Молекулярная патология в клинической практике. Springer. п. 31. ISBN 978-3-319-19674-9. Получено 31 декабря 2016.
- ^ Тиан Дж., Изд. (2013). Молекулярная визуализация: основы и приложения. Springer-Verlag Berlin & Heidelberg GmbH & Co. K. p. 552. ISBN 9783642343032. Получено 2019-07-08.
дальнейшее чтение
- Коэн С.Н., Чанг А.С., Бойер Х.В., Хеллинг, РБ (ноябрь 1973 г.). «Конструирование биологически функциональных бактериальных плазмид in vitro». Труды Национальной академии наук Соединенных Штатов Америки. 70 (11): 3240–4. Bibcode:1973PNAS ... 70.3240C. Дои:10.1073 / пнас.70.11.3240. ЧВК 427208. PMID 4594039.
- Роджерс М (июнь 1975 г.). "Ящик Пандоры съезд". Катящийся камень. 189: 37–77.
- Робертс К., Рафф М., Альбертс Б., Уолтер П., Льюис Дж, Джонсон А. (2002). Молекулярная биология клетки. Наука о гирляндах. ISBN 978-0-8153-3218-3.
внешняя ссылка
| Библиотечные ресурсы о Молекулярная биология |
 СМИ, связанные с Молекулярная биология в Wikimedia Commons
СМИ, связанные с Молекулярная биология в Wikimedia Commons- Биохимия и молекулярная биология в Керли



