Lac оперон - Lac operon
В лактоза оперон (лак оперон) оперон требуется для транспортировки и метаболизм из лактоза в Кишечная палочка и многие другие кишечные бактерии. Несмотря на то что глюкоза является предпочтительным источником углерода для большинства бактерий, лак оперон обеспечивает эффективное переваривание лактозы, когда глюкоза недоступна из-за активности бета-галактозидаза.[1] Генная регуляция из лак оперон был первым механизмом генетической регуляции, который был четко понят, поэтому он стал ярким примером прокариотический генная регуляция. Это часто обсуждается во вводной молекулярный и клеточная биология классы по этой причине. Эта система метаболизма лактозы использовалась Франсуа Жакоб и Жак Моно чтобы определить, как биологическая клетка знает, какой фермент синтезировать. Их работа над lac-опероном принесла им Нобелевская премия по физиологии в 1965 г.[1]
Бактериальные опероны полицистронный стенограммы которые способны производить несколько белков из одного мРНК стенограмма. В этом случае, когда лактоза требуется в качестве сахар В качестве источника бактерии могут быть экспрессированы три гена lac-оперона и транслироваться их последующие белки: lacZ, лысый, и lacA. Генный продукт lacZ является β-галактозидаза который расщепляет лактозу, a дисахарид, в глюкоза и галактоза. лысый кодирует Бета-галактозид пермеаза, а мембранный белок который становится встроенным в цитоплазматическая мембрана чтобы позволить сотовый транспорт лактозы в клетку. Ну наконец то, lacA кодирует Галактозид ацетилтрансфераза.


1: РНК-полимераза, 2: Репрессор, 3: Промоутер, 4: Оператор, 5: Лактоза, 6: lacZ, 7: лысый, 8: lacA.
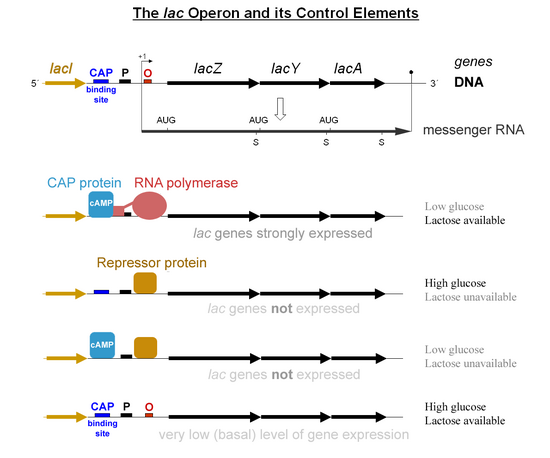
Было бы расточительно производить ферменты при отсутствии лактозы или при наличии предпочтительного источника энергии, такого как глюкоза. В лак оперон использует двухкомпонентный механизм контроля, чтобы гарантировать, что клетка расходует энергию, производя ферменты, кодируемые лак оперон только при необходимости.[2] В отсутствие лактозы лак репрессор, lacI, останавливает производство ферментов, кодируемых лак оперон.[3] Lac-репрессор экспрессируется всегда, если с ним не связывается соиндуктор. Другими словами, он транскрибируется только в присутствии низкомолекулярного соиндуктора. В присутствии глюкозы протеин-активатор катаболита (CAP), необходимый для производства ферментов, остается неактивным и EIIAGlc отключает пермеазу лактозы, чтобы предотвратить перенос лактозы в клетку. Этот механизм двойного контроля вызывает последовательное использование глюкозы и лактозы в двух различных фазах роста, известных как Diauxie.
Структура

- В лак оперон состоит из 3 структурные гены, а промоутер, а терминатор, регулятор, и оператор. Три структурных гена: lacZ, лысый, и lacA.
- lacZ кодирует β-галактозидаза (LacZ), внутриклеточный фермент что рассекает дисахарид лактоза в глюкоза и галактоза.
- лысый кодирует Бета-галактозид пермеаза (LacY), трансмембранный сторонник это насосы β-галактозиды включение лактозы в клетку с использованием протонного градиента в том же направлении. Пермеаза увеличивает проницаемость клетки для β-галактозиды.
- lacA кодирует β-галактозид трансацетилаза (LacA), фермент, переносящий ацетильная группа от ацетил-КоА до β-галактозидов.
Только lacZ и лысый кажется необходимым для лактозы катаболизм.
Генетическая номенклатура
Трехбуквенные сокращения используются для описания фенотипов бактерий, включая Кишечная палочка.
Примеры включают:
- Lac (способность использовать лактозу),
- His (способность синтезировать аминокислоту гистидин)
- Мот (плавательная моторика)
- Смр (устойчивость к антибиотику стрептомицин )
В случае Lac клетками дикого типа являются Lac+ и могут использовать лактозу в качестве источника углерода и энергии, в то время как Lac− мутантные производные не могут использовать лактозу. Те же три буквы обычно используются (строчные, курсив) для обозначения генов, участвующих в конкретном фенотипе, где каждый другой ген дополнительно выделяется дополнительной буквой. В лак гены, кодирующие ферменты, lacZ, лысый, и lacA. Четвертый лак ген lacI, кодирующий репрессор лактозы - «I» означает индуцируемость.
Можно различать структурный гены, кодирующие ферменты, и регуляторные гены, кодирующие белки, влияющие на экспрессию генов. Текущее использование расширяет фенотипическую номенклатуру для применения к белкам: таким образом, LacZ является белковым продуктом lacZ ген, β-галактозидаза. Различные короткие последовательности, которые не являются генами, также влияют на экспрессию генов, включая лак промоутер, lac p, а лак оператор lac o. Хотя это не совсем стандартное использование, мутации, влияющие на lac o упоминаются как lac oc, по историческим причинам.
Регулирование
Особый контроль лак гены зависит от наличия субстрат лактоза бактериям. Белки не производятся бактериями, когда лактоза недоступна в качестве источника углерода. лак гены организованы в оперон; то есть они ориентированы в одном направлении, непосредственно примыкающем к хромосоме, и транскрибируются в одну полицистронный молекула мРНК. Транскрипция всех генов начинается со связывания фермента РНК-полимераза (RNAP), а ДНК-связывающий белок, который связывается со специфическим участком связывания ДНК, промоутер, немедленно вверх по течению генов. Связыванию РНК-полимеразы с промотором способствует лагерь -граница протеин-активатор катаболита (CAP, также известный как белок рецептора цАМФ).[4] Тем не менее lacI ген (регуляторный ген для лак operon) продуцирует белок, который блокирует связывание RNAP с оператором оперона. Этот белок можно удалить только при аллолактоза связывается с ним и инактивирует его. Белок, который образуется lacI ген известен как lac-репрессор. Тип регулирования, который лак оперон называется отрицательно индуцибельным, что означает, что ген отключается регулирующим фактором (лак репрессор), если не добавлена какая-либо молекула (лактоза). Из-за наличия лак белок-репрессор, генные инженеры, которые заменяют lacZ ген с другим геном придется выращивать экспериментальные бактерии на агаре с доступной на нем лактозой. В противном случае ген, который они пытаются экспрессировать, не будет экспрессироваться, поскольку белок-репрессор все еще блокирует связывание RNAP с промотором и транскрибирование гена. После удаления репрессора RNAP затем приступает к транскрипции всех трех генов (lacZYA) в мРНК. Каждый из трех генов в цепи мРНК имеет свой собственный Последовательность Шайна-Далгарно, поэтому гены транслируются независимо.[5] Последовательность ДНК Кишечная палочка лак оперон, то lacZYA мРНК, а lacI гены доступны из GenBank (Посмотреть).
Первый механизм контроля - это регуляторный ответ на лактозу, в котором используется внутриклеточный регуляторный белок называется репрессор лактозы препятствовать производству β-галактозидаза при отсутствии лактозы. В lacI ген, кодирующий репрессор, находится рядом с лак оперон и всегда выражен (учредительный). Если лактоза отсутствует в среде для выращивания, репрессор очень плотно связывается с короткой последовательностью ДНК сразу после промотора в начале lacZ называется оператор lac. Связывание репрессора с оператором мешает связыванию РНКП с промотором, и поэтому мРНК, кодирующая LacZ и LacY, создается только на очень низких уровнях. Однако, когда клетки выращивают в присутствии лактозы, метаболит лактозы, называемый аллолактозой, производится из лактозы продуктом lacZ ген связывается с репрессором, вызывая аллостерический сдвиг. Измененный таким образом репрессор не может связываться с оператором, позволяя RNAP транскрибировать лак гены и, таким образом, приводит к более высоким уровням кодируемых белков.
Второй механизм контроля - это реакция на глюкозу, которая использует протеин-активатор катаболита (CAP) гомодимер для значительного увеличения продукции β-галактозидазы в отсутствие глюкозы. Циклический аденозинмонофосфат (цАМФ) представляет собой сигнальную молекулу, распространенность которой обратно пропорциональна уровню глюкозы. Он связывается с CAP, что, в свою очередь, позволяет CAP связываться с сайтом связывания CAP (последовательность ДНК длиной 16 п.н. перед промотором слева на диаграмме ниже, примерно на 60 п.н. выше сайта начала транскрипции),[6] который помогает RNAP связываться с ДНК. В отсутствие глюкозы концентрация цАМФ высока, и связывание ЦАП-цАМФ с ДНК значительно увеличивает производство β-галактозидазы, позволяя клетке гидролизовать лактоза и высвобождение галактозы и глюкозы.
Совсем недавно было показано, что исключение индуктора блокирует экспрессию лак оперон, когда присутствует глюкоза. Глюкоза транспортируется в клетку PEP-зависимая фосфотрансферазная система. Фосфатная группа фосфоенолпируват передается через каскад фосфорилирования, состоящий из общих белков PTS (фосфотрансферазной системы) HPr и EIA и белков PTS, специфичных для глюкозы, EIIAGlc и EIIBGlc, цитоплазматический домен транспортера глюкозы EII. Транспорт глюкозы сопровождается ее фосфорилированием EIIB.Glc, отводя фосфатную группу от других белков PTS, включая EIIAGlc. Нефосфорилированная форма EIIAGlc связывается с лак permease и предотвращает попадание лактозы в клетку. Следовательно, если присутствуют и глюкоза, и лактоза, транспорт глюкозы блокирует транспорт индуктора лак оперон.[7]
Структура репрессора

В лак репрессор представляет собой четырехкомпонентный белок, тетрамер, с идентичными субъединицами. Каждая субъединица содержит мотив спираль-поворот-спираль (HTH), способный связываться с ДНК. Сайт оператора, где связывается репрессор, представляет собой последовательность ДНК с инвертированной симметрией повтора. Два полусайта ДНК оператора вместе связываются с двумя субъединицами репрессора. Хотя две другие субъединицы репрессора ничего не делают в этой модели, это свойство не понималось в течение многих лет.
В конце концов было обнаружено, что в лак регулирование.[8] Один (O3) лежит примерно на -90 п.н. перед O1 в конце lacI ген, а другой (O2) составляет примерно +410 п.н. ниже O1 в начале lacZ. Эти два сайта не были обнаружены в ранних работах, потому что они имеют повторяющиеся функции, а отдельные мутации не сильно влияют на репрессию. Единичные мутации либо O2 или O3 имеют только 2-3-кратный эффект. Однако их важность демонстрируется тем фактом, что двойной мутант, дефектный как по O2 и O3 резко депрессивно (примерно в 70 раз).
В текущей модели лак репрессор связан одновременно с основным оператором O1 и либо O2 или O3. Промежуточная ДНК выходит из комплекса. Избыточный характер двух второстепенных операторов предполагает, что важен не конкретный зацикленный комплекс. Одна идея состоит в том, что система работает через модем; если связанный репрессор высвобождается из O1 на мгновение привязка к второстепенному оператору удерживает его поблизости, чтобы он мог быстро восстановить связь. Это увеличило бы сродство репрессора к O1.
Механизм индукции
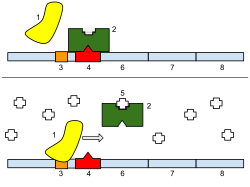
Репрессор - это аллостерический белок, т.е. он может принимать одну из двух слегка разных форм, находящихся в равновесии друг с другом. В одной форме репрессор будет связываться с ДНК оператора с высокой специфичностью, а в другой форме он потерял свою специфичность. Согласно классической модели индукции, связывание индуктора, аллолактозы или IPTG, с репрессором влияет на распределение репрессора между двумя формами. Таким образом, репрессор со связанным индуктором стабилизируется в конформации, не связывающейся с ДНК. Однако эта простая модель не может быть исчерпывающей, потому что репрессор довольно стабильно связан с ДНК, но он быстро высвобождается при добавлении индуктора. Следовательно, кажется очевидным, что индуктор также может связываться с репрессором, когда репрессор уже связан с ДНК. До сих пор не совсем известно, каков точный механизм связывания.[9]
Роль неспецифического связывания
Неспецифическое связывание репрессора с ДНК играет решающую роль в репрессии и индукции Lac-оперона. Сайт специфического связывания белка-репрессора Lac является оператором. Неспецифическое взаимодействие опосредуется, главным образом, заряд-зарядовыми взаимодействиями, в то время как связывание с оператором усиливается гидрофобными взаимодействиями. Кроме того, существует множество неспецифических последовательностей ДНК, с которыми репрессор может связываться. По сути, любая последовательность, не являющаяся оператором, считается неспецифической. Исследования показали, что без наличия неспецифического связывания индукция (или нерепрессия) Lac-оперона не может происходить даже при насыщенных уровнях индуктора. Было продемонстрировано, что без неспецифического связывания базальный уровень индукции в десять тысяч раз меньше, чем обычно. Это связано с тем, что неспецифическая ДНК действует как своего рода «сток» для белков-репрессоров, отвлекая их от оператора. Неспецифические последовательности уменьшают количество доступного репрессора в клетке. Это, в свою очередь, уменьшает количество индуктора, необходимого для разжима системы.[10]
Аналоги лактозы
Описан ряд производных или аналогов лактозы, которые полезны для работы с lac-опероном. Эти соединения в основном представляют собой замещенные галактозиды, в которых глюкозный фрагмент лактозы заменен другой химической группой.
- Изопропил-β-D-тиогалактопиранозид (IPTG) часто используется в качестве индуктора лак оперон для физиологической работы.[1] IPTG связывается с репрессором и инактивирует его, но не является субстратом для β-галактозидазы. Одно из преимуществ IPTG для in vivo исследований заключается в том, что, поскольку он не может метаболизироваться Кишечная палочка его концентрация остается постоянной, а скорость выражения лак п / о-контролируемые гены, не является переменной в эксперименте. Потребление IPTG зависит от действия пермеазы лактозы в P. fluorescens, но не в Кишечная палочка.[11]
- Фенил-β-D-галактоза (фенил-Gal) является субстратом для β-галактозидазы, но не инактивирует репрессор и, следовательно, не является индуктором. Поскольку клетки дикого типа продуцируют очень мало β-галактозидазы, они не могут расти на фенил-галле в качестве источника углерода и энергии. Мутанты, лишенные репрессора, способны расти на фенил-гале. Таким образом, минимальная среда, содержащая только фенил-Gal в качестве источника углерода и энергии, является селективной для мутантов-репрессоров и мутантов-операторов. Если 108 клетки штамма дикого типа высевают на чашки с агаром, содержащим фенил-Gal; редкие растущие колонии в основном являются спонтанными мутантами, влияющими на репрессор. Относительное распределение мутантов-репрессоров и операторов зависит от размера мишени. Поскольку ген lacI кодирующий репрессор примерно в 50 раз больше, чем оператор, при отборе преобладают мутанты репрессора.
- Тиометилгалактозидаза [TMG] - еще один аналог лактозы. Они подавляют репрессор lacI. При низких концентрациях индуктора и TMG, и IPTG могут проникать в клетку через пермеазу лактозы. Однако при высоких концентрациях индуктора оба аналога могут проникать в клетку независимо. TMG может снижать скорость роста при высоких внеклеточных концентрациях.[12]
- Другие соединения служат яркими индикаторами активности β-галактозидазы.
- ONPG расщепляется с образованием ярко-желтого соединения, ортонитрофенол и галактоза, и обычно используется в качестве субстрата для анализа β-галактозидазы in vitro.[13]
- Колонии, вырабатывающие β-галактозидазу, становятся синими из-за X-gal (5-бром-4-хлор-3-индолил-β-D-галактозид), который является искусственным субстратом для B-галактозидазы, расщепление которой приводит к образованию галактозы и 4-Cl, 3-Br индиго, что дает темно-синий цвет.[14]
- Аллолактоза является изомер лактозы и является индуктором лактозного оперона. Лактоза - это галактоза- (β1-> 4) -глюкоза, тогда как аллолактоза - это галактоза- (β1-> 6) -глюкоза. Лактоза превращается в аллолактозу β-галактозидазой в реакции, альтернативной гидролитической. Физиологический эксперимент, демонстрирующий роль LacZ в производстве «истинного» индуктора в Кишечная палочка клеток - это наблюдение, что нулевой мутант lacZ все еще может продуцировать пермеазу LacY при выращивании с IPTG, негидролизуемым аналогом аллолактозы, но не при выращивании с лактозой. Объяснение заключается в том, что преобразование лактозы в аллолактозу (катализируемое β-галактозидазой) необходимо для производства индуктора внутри клетки.
Разработка классической модели
Экспериментальный микроорганизм использован Франсуа Жакоб и Жак Моно была обычная лабораторная бактерия, Кишечная палочка, но многие из основных регуляторных концепций, открытых Джейкобом и Моно, являются фундаментальными для сотовый регуляция у всех организмов.[15] Ключевая идея состоит в том, что белки не синтезируются, когда они не нужны -Кишечная палочка сохраняет клеточные ресурсы и энергию, не производя три белка Lac, когда нет необходимости метаболизировать лактозу, например, когда другие сахара, такие как глюкоза доступны. В следующем разделе обсуждается, как Кишечная палочка контролирует определенные гены в ответ на метаболические потребности.
В течение Вторая Мировая Война, Monod проверяла влияние комбинаций сахаров в качестве источников питательных веществ для Кишечная палочка и Б. subtilis. Моно продолжил аналогичные исследования, которые были проведены другими учеными с бактериями и дрожжами. Он обнаружил, что бактерии, выращенные с двумя разными сахарами, часто демонстрируют две фазы роста. Например, если были предоставлены и глюкоза, и лактоза, сначала метаболизировалась глюкоза (фаза роста I, см. Рисунок 2), а затем лактоза (фаза роста II). Лактоза не метаболизировалась в течение первой части диауксической кривой роста, потому что β-галактозидаза не образовывалась, когда в среде присутствовали и глюкоза, и лактоза. Моно назвал это явление Diauxie.[16]

Затем Моно сосредоточил свое внимание на индукции образования β-галактозидазы, которая происходила, когда лактоза была единственным сахаром в культуральной среде.[17]
Классификация регуляторных мутантов
Концептуальный прорыв Иакова и Моно[18] заключалась в распознавании различия между регуляторными веществами и сайтами, в которых они действуют, изменяя экспрессию генов. Бывший солдат, Джейкоб использовал аналогию с бомбардировщиком, который выпускал смертельный груз после получения специальной радиопередачи или сигнала. Для работающей системы требуются как наземный передатчик, так и приемник в самолете. Теперь предположим, что обычный передатчик сломан. Эту систему можно заставить работать, введя второй работающий передатчик. Для сравнения, по его словам, рассмотрим бомбардировщик с неисправной ствольной коробкой. Поведение это бомбардировщик не может быть заменен введением второго исправного самолета.
Для анализа регуляторных мутантов лак оперон, Джейкоб разработал систему, с помощью которой вторая копия лак гены (lacI со своим промоутером, и lacZYA с промотором и оператором) могут быть введены в одну ячейку. Культура таких бактерий, диплоидных для лак гены, но в остальном нормальные, затем проверяется на регуляторный фенотип. В частности, определяется, производятся ли LacZ и LacY даже при отсутствии IPTG (из-за репрессор лактозы продуцируемый нефункциональным мутантным геном). Этот эксперимент, в котором гены или кластеры генов тестируются попарно, называется тест на дополнение.

Этот тест показан на рисунке (lacA опущено для простоты). Во-первых, показаны определенные гаплоидные состояния (т. Е. Клетка несет только одну копию лак гены). Панель (a) показывает репрессию, (b) показывает индукцию IPTG, и (c) и (d) демонстрируют эффект мутации в lacI гену или оператору соответственно. На панели (е) показан тест комплементации для репрессора. Если один экземпляр лак гены несут мутацию в lacI, но вторая копия является диким типом для lacI, результирующий фенотип нормален, но lacZ экспрессируется при воздействии индуктора IPTG. Говорят, что мутации, влияющие на репрессор, рецессивный к дикому типу (и этот дикий тип доминирующий), и это объясняется тем, что репрессор - это небольшой белок, который может диффундировать в клетке. Копия лак оперон, прилегающий к дефектному lacI ген эффективно отключается белком, произведенным из второй копии lacI.
Если тот же эксперимент проводится с использованием мутации оператора, получается другой результат (панель (f)). Фенотип клетки, несущей один мутантный и один операторный сайт дикого типа, состоит в том, что LacZ и LacY продуцируются даже в отсутствие индуктора IPTG; поскольку поврежденный сайт оператора не позволяет связывать репрессор, чтобы ингибировать транскрипцию структурных генов. Операторная мутация является доминирующей. Когда сайт оператора, с которым должен связываться репрессор, поврежден мутацией, присутствие второго функционального сайта в той же клетке не влияет на экспрессию генов, контролируемых мутантным сайтом.
В более сложной версии этого эксперимента используется отмечен опероны, чтобы различать две копии лак гены и показать, что нерегулируемый структурный ген (ы) является (являются) одним (ами) рядом с мутантным оператором (панель (g). Например, предположим, что одна копия отмечена мутацией, инактивирующей lacZ так что он может производить только белок LacY, в то время как вторая копия несет мутацию, влияющую на лысый и может производить только LacZ. В этой версии только копия лак оперон, соседствующий с мутантным оператором, экспрессируется без IPTG. Мы говорим, что оператор мутации цис-доминантный, он является доминантным по отношению к дикому типу, но влияет только на копию оперона, непосредственно прилегающую к нему.
Это объяснение вводит в заблуждение в важном смысле, потому что оно исходит из описания эксперимента, а затем объясняет результаты в терминах модели. Но на самом деле часто бывает так, что модель на первом месте, и эксперимент проводится специально для проверки модели. Джейкоб и Моно сначала предположили, что должна быть сайт в ДНК со свойствами оператора, а затем разработали свои тесты дополнения, чтобы показать это.
Доминирование мутантов-операторов также предполагает процедуру их особого отбора. Если регуляторные мутанты выбираются из культуры дикого типа с использованием фенил-Gal, как описано выше, операторные мутации редки по сравнению с мутантами-репрессорами, поскольку размер мишени очень мал. Но если вместо этого мы начнем со штамма, который несет две копии целого лак регион (диплоидный для лак), репрессорные мутации (которые все еще возникают) не восстанавливаются, потому что комплементация вторым, диким типом lacI ген придает фенотип дикого типа. Напротив, мутация одной копии оператора дает мутантный фенотип, потому что он доминирует над второй копией дикого типа.
Регулирование циклическим AMP[19]
Объяснение диауксии зависело от характеристики дополнительных мутаций, влияющих на лак гены, отличные от тех, которые объясняются классической моделью. Два других гена, Cya и crp, впоследствии были идентифицированы, нанесенные на карту далеко от лак, и что при мутации приводит к снижению уровня экспрессии в присутствие IPTG и даже в штаммах бактерий, лишенных репрессора или оператора. Открытие лагерь в Кишечная палочка привело к демонстрации того, что мутанты нарушают Cya ген, но не crp гена можно было восстановить до полной активности путем добавления цАМФ в среду.
В Cya Ген кодирует аденилатциклазу, продуцирующую цАМФ. В Cya мутант, отсутствие цАМФ делает экспрессию lacZYA гены более чем в десять раз ниже нормы. Добавление цАМФ корректирует низкую экспрессию Lac, характерную для Cya мутанты. Второй ген, crp, кодирует белок, называемый протеин-активатор катаболита (CAP) или белок рецептора цАМФ (CRP).[20]
Однако ферменты метаболизма лактозы производятся в небольших количествах в присутствии как глюкозы, так и лактозы (иногда называемой протекающей экспрессией) из-за того, что репрессор LacI быстро связывается / диссоциирует с ДНК, а не прочно связывается с ней, что может дать время для РНКП для связывания и транскрипции мРНК lacZYA. Утечка экспрессии необходима для того, чтобы обеспечить метаболизм некоторого количества лактозы после того, как источник глюкозы израсходован, но до лак выражение полностью активировано.
В итоге:
- Когда лактоза отсутствует, фермент Lac продуцируется очень мало (оператор связывает с ним репрессор Lac).
- Когда присутствует лактоза, но также присутствует предпочтительный источник углерода (например, глюкоза), вырабатывается небольшое количество фермента (репрессор Lac не связан с оператором).
- Когда глюкоза отсутствует, CAP-cAMP связывается со специфическим участком ДНК перед промотором и осуществляет прямое межбелковое взаимодействие с RNAP, что облегчает связывание RNAP с промотором.
Задержка между фазами роста отражает время, необходимое для выработки достаточного количества ферментов, метаболизирующих лактозу. Во-первых, регуляторный белок CAP должен собраться на лак промотора, что приводит к увеличению продукции лак мРНК. Более доступные копии лак мРНК приводит к продукции (см. перевод ) значительно большего количества копий LacZ (β-галактозидаза, для метаболизма лактозы) и LacY (пермеаза лактозы для транспортировки лактозы в клетку). После задержки, необходимой для повышения уровня ферментов метаболизма лактозы, бактерии вступают в новую быструю фазу рост клеток.
Две загадки катаболическая репрессия связаны с тем, как уровни цАМФ связаны с присутствием глюкозы, и, во-вторых, почему клетки должны беспокоить. После расщепления лактозы фактически образуется глюкоза и галактоза (легко превращаются в глюкозу). В метаболическом отношении лактоза ничем не хуже хороший углерод и источник энергии в виде глюкозы. Уровень цАМФ связан не с внутриклеточной концентрацией глюкозы, а со скоростью транспорта глюкозы, которая влияет на активность аденилатциклазы. (Кроме того, транспорт глюкозы также ведет к прямому ингибированию пермеазы лактозы.) Что касается того, почему Кишечная палочка так работает, можно только догадываться. Все кишечные бактерии ферментируют глюкозу, что говорит о том, что они часто с ней сталкиваются. Возможно, что небольшая разница в эффективности транспорта или метаболизма глюкозы по сравнению с лактозой дает возможность клеткам регулировать лак оперон таким образом.[21]
Использование в молекулярной биологии
В лак ген и его производные можно использовать в качестве репортерный ген в ряде методов отбора на основе бактерий, таких как два гибрида анализ, в котором успешное связывание активатор транскрипции к конкретной промоторной последовательности.[14] В ФУНТ тарелки, содержащие X-gal изменение цвета от белых колоний к оттенку синего соответствует примерно 20–100 единицам β-галактозидазы, тогда как тетразолий лактоза и Лактозная среда MacConkey имеют диапазон 100–1000 единиц, будучи наиболее чувствительными в верхней и нижней частях этого диапазона соответственно.[14] Поскольку лактозная и тетразолиевая лактозные среды MacConkey зависят от продуктов распада лактозы, они требуют присутствия обоих lacZ и лысый гены. Многие лак методы слияния, которые включают только lacZ гены, таким образом, подходят для пластин X-gal[14] или же ONPG жидкие бульоны.[22]
Смотрите также
Рекомендации
- ^ а б Гриффитс, Энтони Дж. Ф .; Wessler, Susan R .; Кэрролл, Шон Б.; Добли, Джон (2015). Введение в генетический анализ (11-е изд.). Фриман, W.H. & Компания. С. 400–412. ISBN 9781464109485.
- ^ МакКлин, Филлип (1997). «Экспрессия прокариотического гена». ndsu.edu. Получено 19 мая 2017.
- ^ «Экспрессия прокариотического гена». ndsu.edu. Получено 19 мая 2017.
- ^ Басби С., Эбрайт RH. (2001). «Активация транскрипции белком-активатором катаболита (CAP)». J. Mol. Биол. 293 (2): 199–213. Дои:10.1006 / jmbi.1999.3161. PMID 10550204.
- ^ Кеннелл, Дэвид; Рицман, Ховард (июль 1977 г.). «Частоты инициации транскрипции и трансляции lac-оперона Escherichia coli». Журнал молекулярной биологии. 114 (1): 1–21. Дои:10.1016/0022-2836(77)90279-0. PMID 409848.
- ^ Малан, Т. Филип; Колб, Энни; Бук, Анри; МакКлюр, Уильям (декабрь 1984 г.). «Механизм активации CRP-cAMP lac-оперона. Активация инициации транскрипции промотора P1». J. Mol. Биол. 180 (4): 881–909. Дои:10.1016/0022-2836(84)90262-6. PMID 6098691.
- ^ Гёрке Б., Штюльке Дж. (Август 2008 г.). «Подавление катаболитов углерода в бактериях: многие способы максимально использовать питательные вещества». Обзоры природы. Микробиология. 6 (8): 613–24. Дои:10.1038 / nrmicro1932. PMID 18628769. S2CID 8782171.
- ^ Oehler, S .; Eismann, E. R .; Krämer, H .; Мюллер-Хилл, Б. (1990). «Три оператора lac-оперона сотрудничают в репрессиях». Журнал EMBO. 9 (4): 973–979. Дои:10.1002 / j.1460-2075.1990.tb08199.x. ЧВК 551766. PMID 2182324.
- ^ Гриффитс, Энтони Дж. Ф.; Гелбарт, Уильям М .; Миллер, Джеффри Х .; Левонтин, Ричард С. (1999). «Регулирование лактозной системы». Современный генетический анализ. Нью-Йорк: У. Х. Фриман. ISBN 0-7167-3118-5.
- ^ von Hippel, P.H .; Ревзин, А .; Gross, C.A .; Ван, A.C. (декабрь 1974 г.). «Неспецифическое связывание ДНК белков, регулирующих геном, как биологический механизм контроля: I. lac-оперон: аспекты равновесия». PNAS. 71 (12): 4808–12. Дои:10.1073 / пнас.71.12.4808. ЧВК 433986. PMID 4612528.
- ^ Хансен Л.Х., Кнудсен С., Соренсен С.Дж. (июнь 1998 г.). «Влияние гена lacY на индукцию индуцибельных промоторов IPTG, изученное в кишечная палочка и Pseudomonas fluorescens". Curr. Микробиол. 36 (6): 341–7. Дои:10.1007 / s002849900320. PMID 9608745. S2CID 22257399. Архивировано из оригинал 18 октября 2000 г.
- ^ Марбах А., Беттенброк К. (январь 2012 г.). «Индукция lac-оперона в Escherichia coli: систематическое сравнение индукции IPTG и TMG и влияние трансацетилазы LacA». Журнал биотехнологии. 157 (1): 82–88. Дои:10.1016 / j.jbiotec.2011.10.009. PMID 22079752.
- ^ «Тест ONPG (β-галактозидаза)». Сентябрь 2000 г. Архивировано с оригинал 3 ноября 2007 г.. Получено 25 октября 2007.
- ^ а б c d Джунг Дж, Рамм Э., Пабо С. (2000). «Бактериальная двухгибридная селекционная система для изучения белок-ДНК и белок-белковых взаимодействий». Proc Natl Acad Sci USA. 97 (13): 7382–7. Дои:10.1073 / pnas.110149297. ЧВК 16554. PMID 10852947.
- ^ «Веха 2 - Пара дальновидных: вехи природы в экспрессии генов». www.nature.com. Получено 27 декабря 2015.
- ^ Мюллер-Хилл, Бенно (1996). Лак-оперон, краткая история генетической парадигмы. Берлин: Вальтер де Грюйтер. С. 7–10. ISBN 3-11-014830-7.
- ^ Макнайт, Стивен Л. (1992). Транскрипционная регуляция. Колд-Спринг-Харбор, Нью-Йорк: Лаборатория Колд-Спринг-Харбор. стр.3–24. ISBN 0-87969-410-6.
- ^ Джейкоб Ф.; Monod J (Июнь 1961 г.). «Генетические механизмы регуляции синтеза белков». Дж Мол Биол. 3 (3): 318–56. Дои:10.1016 / S0022-2836 (61) 80072-7. PMID 13718526.
- ^ Монмини, М. (1997). «Регуляция транскрипции циклическим AMP». Ежегодный обзор биохимии. 66: 807–822. Дои:10.1146 / annurev.biochem.66.1.807. ISSN 0066-4154. PMID 9242925.
- ^ Ботсфорд, Дж. Л.; Харман, Дж. Г. (март 1992 г.). «Циклический АМФ в прокариотах». Микробиологические обзоры. 56 (1): 100–122. Дои:10.1128 / MMBR.56.1.100-122.1992. ISSN 0146-0749. ЧВК 372856. PMID 1315922.
- ^ Васкес А., Бег К.К., Деменезес М.А. и др. (2008). «Влияние ограничения емкости растворителя на метаболизм E. coli». BMC Syst Biol. 2: 7. Дои:10.1186/1752-0509-2-7. ЧВК 2270259. PMID 18215292.
- ^ «Индукция lac-оперона в кишечной палочке» (PDF). SAPS. Получено 29 июн 2016.
внешняя ссылка
- Лак + Оперон в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- lac operon на книжной полке NCBI [2]
- Коллекция анимации виртуальной ячейки Представляем: Lac Operon
- Лак-оперон: наука Бозмана
- Окрашивание целых эмбрионов мыши на активность β-галактозидазы (lacZ)