Кишечная флора - Gut flora - Wikipedia

Кишечная флора или же кишечная микробиота являются микроорганизмы включая бактерии, археи и грибы которые живут в пищеварительный тракт людей[1] и других животных, включая насекомые. Желудочно-кишечный тракт метагеном это совокупность всех геномы кишки микробиота.[2][3] Кишечник - основное место расположения человеческая микробиота.[4]
Обзор
У людей кишечная микробиота насчитывает наибольшее количество бактерий и наибольшее количество видов по сравнению с другими частями тела.[5] У людей кишечная флора устанавливается через один-два года после рождения, к этому времени кишечный эпителий и барьер слизистой оболочки кишечника секреты, которые он секретирует, совместно развились таким образом, чтобы они были толерантны к кишечной флоре и даже поддерживали ее, а также создавали барьер для патогенных организмов.[6][7]
Отношения между какой-то кишкой Флора и люди не просто комменсальный (безвредное сосуществование), а скорее мутуалистический отношение.[4]:700 Некоторые кишечные микроорганизмы человека приносят пользу хозяину: брожение пищевые волокна в короткоцепочечные жирные кислоты (SCFA), такие как уксусная кислота и Масляная кислота, которые затем поглощаются хозяином.[5][8] Кишечник бактерии также играют роль в синтезе витамин B и витамин К а также метаболизм желчные кислоты, стеролы, и ксенобиотики.[4][8] Системное значение SCFA и других производимых ими соединений похоже на гормоны и сама кишечная флора, кажется, функционирует как эндокринный орган,[8] а нарушение регуляции кишечной флоры коррелирует с множеством воспалительных и аутоиммунных состояний.[5][9]
Состав микробиоты кишечника человека меняется со временем, когда меняется диета и общее состояние здоровья.[5][9] А регулярный обзор с 2016 г. изучали доклинические и небольшие испытания на людях, которые были проведены с некоторыми коммерчески доступными штаммами пробиотических бактерий, и определили те, которые имеют наибольший потенциал для использования в определенных расстройства центральной нервной системы.[10]
Классификации
Микробный состав микробиоты кишечника варьируется в зависимости от пищеварительного тракта. в желудок и тонкий кишечник обычно присутствует относительно немного видов бактерий.[11][12] В двоеточие, напротив, содержит самую высокую плотность микробов, зарегистрированную в любой среде обитания на Земле.[13] до 1012 клеток на грамм кишечного содержимого.[11] Эти бактерии представляют от 300 до 1000 различных разновидность.[11][12] Однако 99% бактерий происходят от 30-40 видов.[14] Вследствие их обилия в кишечнике бактерии также составляют до 60% сухой массы кал.[15] Грибы, протисты, археи, и вирусы также присутствуют в кишечной флоре, но об их деятельности известно меньше.[16]
Более 99% бактерий в кишечнике анаэробы, но в слепая кишка, аэробные бактерии достигают высокой плотности.[4] По оценкам, этой кишечной флоры примерно в сто раз больше гены в целом, как и в человеческий геном.[17]
Многие виды в кишечнике не изучались за пределами их хозяев, потому что большинство из них невозможно культивировать.[12][14][18] Хотя существует небольшое количество основных видов микробов, общих для большинства людей, популяции микробов могут широко варьироваться у разных людей.[19] Популяции микробов внутри человека остаются довольно постоянными с течением времени, даже если некоторые изменения могут произойти с изменениями образа жизни, диеты и возраста.[11][20] В Проект человеческого микробиома решил лучше описать микрофлора кишечника человека и других участков тела.
Четыре доминирующих бактериальных тип в кишечнике человека Фирмикуты, Bacteroidetes, Актинобактерии, и Протеобактерии.[21] Большинство бактерий относятся к родам Бактероиды, Clostridium, Faecalibacterium,[11][14] Эубактерии, Руминококк, Пептококк, Пептострептококк, и Бифидобактерии.[11][14] Другие роды, такие как Эшерихия и Лактобациллы, присутствуют в меньшей степени.[11] Виды из рода Бактероиды одни составляют около 30% всех бактерий в кишечнике, что позволяет предположить, что этот род особенно важен для функционирования хозяина.[12]
Грибковые виды, обнаруженные в кишечнике, включают: Candida, Сахаромицеты, Аспергиллы, Пенициллий, Родоторула, Траметес, Плеоспора, Склеротиния, Bullera, и Галактомицеты, среди прочего.[22][23] Родоторула чаще всего встречается у людей с воспалительное заболевание кишечника пока Candida чаще всего встречается у людей с циррозом гепатита В и хроническим гепатитом В.[22]
Археи составляют еще один большой класс кишечной флоры, которая играет важную роль в метаболизме бактериальных продуктов ферментации.
Индустриализация связано с изменениями в микробиоте, и сокращение разнообразия может привести к исчезновению некоторых видов; в 2018 году исследователи предложили биобанк репозиторий микробиоты человека.[24]
Энтеротип
An энтеротип классификация живых организмов на основе их бактериологического экосистема в микробиоме кишечника человека не зависит от возраста, пола, массы тела или национальных особенностей.[25] Есть признаки того, что длительная диета влияет на энтеротип.[26] Было предложено три человеческих энтеротипа,[25][27] но их ценность подвергалась сомнению.[28]
Сочинение
Бактериом
Желудок
Из-за высокой кислотности желудка большинство микроорганизмов не могут там выжить. К основным бактериальным обитателям желудка относятся: Стрептококк, Стафилококк, Лактобациллы, Пептострептококк.[4]:720 Helicobacter pylori это грамотрицательный спиральная бактерия что устанавливается на слизистая желудка вызывая хронический гастрит, и язвенная болезнь, и является канцероген за рак желудка.[4]:904
Кишечник
| Бактерии, обычно встречающиеся в толстой кишке человека[29] | |
| Бактерия | Заболеваемость (%) |
|---|---|
| Bacteroides fragilis | 100 |
| Bacteroides melaninogenicus | 100 |
| Bacteroides oralis | 100 |
| Enterococcus faecalis | 100 |
| кишечная палочка | 100 |
| Энтеробактер sp. | 40–80 |
| Клебсиелла sp. | 40–80 |
| Бифидобактерии бифидум | 30–70 |
| Золотистый стафилококк | 30–50 |
| Лактобациллы | 20–60 |
| Clostridium perfringens | 25–35 |
| Протей мирабилис | 5–55 |
| Clostridium tetani | 1–35 |
| Clostridium septicum | 5–25 |
| Синегнойная палочка | 3–11 |
| Salmonella enterica | 3–7 |
| Faecalibacterium prausnitzii | ?общий |
| Пептострептококк sp. | ?общий |
| Пептококк sp. | ?общий |
Тонкий кишечник содержит незначительное количество микроорганизмов из-за близости и влияния желудка. Грамположительный кокки и палочковидные бактерии являются преобладающими микроорганизмами в тонком кишечнике.[4] Однако в дистальной части тонкого кишечника щелочные условия поддерживают грамотрицательные бактерии Энтеробактерии.[4] Бактериальная флора тонкого кишечника способствует широкому спектру функций кишечника. Бактериальная флора обеспечивает регулирующие сигналы, которые позволяют развитию кишечника и его полезности. Чрезмерный рост бактерий в тонком кишечнике может привести к кишечной недостаточности.[30] Вдобавок толстая кишка содержит крупнейшую бактериальную экосистему в организме человека.[4] Около 99% флоры толстого кишечника и кала состоят из облигатных анаэробов, таких как Бактероиды и Бифидобактерии.[31] Факторы, нарушающие популяцию микроорганизмов в толстой кишке, включают антибиотики, стресс и паразитов.[4]
Бактерии составляют большую часть флоры в двоеточие[32] и 60% сухой массы кал.[11] Этот факт делает фекалии идеальным источником кишечной флоры для любых тестов и экспериментов путем извлечения нуклеиновой кислоты из образцов фекалий, а последовательности бактериального гена 16S рРНК генерируются с помощью бактериальных праймеров. Эта форма тестирования также часто предпочтительнее более инвазивных методов, таких как биопсия. Где-то между 300[11] и 1000 разных разновидность жить в кишечнике,[12] с большинством оценок около 500.[33][34] Однако вполне вероятно, что 99% бактерий происходят от 30-40 видов, причем Faecalibacterium prausnitzii являясь наиболее распространенным видом у здоровых взрослых.[14][35]
Исследования показывают, что связь между кишечником Флора и люди не просто комменсальный (безвредное сосуществование), а скорее мутуалистический, симбиотический отношение.[12] Хотя люди могут выжить без кишечной флоры,[33] микроорганизмы выполняют множество полезных функций, таких как брожение неиспользованные энергетические субстраты, обучение иммунная система через конечные продукты метаболизма, такие как пропионат и ацетат, предотвращая рост вредных видов, регулируя развитие кишечника, производя витамины для хозяина (например, биотин и витамин К ) и вырабатывают гормоны, которые заставляют хозяина накапливать жиры.[4] Обширные модификации и дисбаланс микробиоты кишечника и его микробиома или коллекции генов связаны с ожирением.[36] Однако в определенных условиях считается, что некоторые виды способны вызывать болезнь вызывая инфекционное заболевание или увеличение рак риск для хозяина.[11][32]
Микобиом
Грибы и протисты также составляют часть кишечной флоры, но об их деятельности известно меньше.[37]
Виром
В человеческий виром в основном бактериофаги.[38]
Вариация
Возраст
Было продемонстрировано, что существуют общие закономерности эволюции состава микробиома в течение жизни.[39] В целом, разнообразие микробиоты в образцах фекалий у взрослых значительно выше, чем у детей, хотя межличностные различия у детей выше, чем у взрослых.[40] Большая часть созревания микробиоты до конфигурации, подобной взрослой, происходит в течение трех первых лет жизни.[40]
По мере изменения состава микробиома меняется и состав бактериальных белков, вырабатываемых в кишечнике. Во взрослых микробиомах обнаружена высокая распространенность ферментов, участвующих в ферментации, метаногенезе и метаболизме аргинина, глутамата, аспартата и лизина. Напротив, в микробиомах младенцев доминирующие ферменты участвуют в метаболизме цистеина и путях ферментации.[40]
Рацион питания
Исследования и статистический анализ выявили различные роды бактерий в микробиоте кишечника и их связи с потреблением питательных веществ. Микрофлора кишечника в основном состоит из трех энтеротипы: Prevotella, Бактероиды, и Руминококк. Существует связь между концентрацией каждого микробного сообщества и диетой. Например, Prevotella относится к углеводам и простым сахарам, а Бактероиды связан с белками, аминокислотами и насыщенными жирами. Специализированные микробы, расщепляющие муцин, выживают за счет выделения углеводов хозяином.[41] В зависимости от диеты преобладает один энтеротип. Изменение рациона приведет к соответствующему изменению количества видов.[26]
Вегетарианские и веганские диеты
Хотя растительные диеты имеют некоторые вариации, вегетарианец и веган схемы диет являются наиболее распространенными. Вегетарианские диеты исключают мясные продукты, но по-прежнему позволяют употреблять яйца и молочные продукты, в то время как веганские диеты исключают все формы продуктов животного происхождения. Диеты вегетарианцев и веганов создают микробиом, отличный от мясоедов, однако между ними нет значительного различия.[42][ненадежный медицинский источник? ] В диетах, основанных на мясе и продуктах животного происхождения, большое количество Алистипес, Билофила и Бактероиды все они толерантны к желчи и могут вызвать воспаление в кишечнике. В этом типе диеты группа Фирмикуты, который связан с метаболизмом полисахаридов пищевых растений, обнаружен в низких концентрациях.[43] И наоборот, диеты, богатые растительными материалами, связаны с большим разнообразием микробиома кишечника в целом и имеют большее количество Prevotella, ответственный за долгосрочную переработку волокон, а не желчеустойчивых видов.[44][ненадежный медицинский источник? ] Диета может использоваться для изменения состава микробиома кишечника в относительно короткие сроки. Однако, если вы хотите изменить микробиом для борьбы с болезнью или недугом, долгосрочные изменения в диете оказались наиболее успешными.[43]
География
Состав микробиома кишечника зависит от географического происхождения населения. Варианты компромисса Prevotella, представление уреаза ген и представление генов, кодирующих глутаматсинтазу / деградацию или другие ферменты, участвующие в деградации аминокислот или биосинтезе витаминов, демонстрируют существенные различия между популяциями из США, Малави или индейцев.[40]
Население США широко представлено ферментами, кодирующими деградацию глутамин и ферменты, участвующие в витамине и липоевая кислота биосинтез; тогда как в популяциях Малави и американских индейцев высока представленность ферментов, кодирующих глутаматсинтазу, а также преобладают α-амилаза в их микробиомах. Поскольку у населения США диета богаче жирами, чем у индейцев или малавийцев, которые придерживаются диеты, богатой кукурузой, диета, вероятно, является основным фактором, определяющим бактериальный состав кишечника.[40]
Дальнейшие исследования показали большую разницу в составе микробиоты европейских и сельских африканских детей. Каловые бактерии детей из Флоренция сравнивали с детьми из небольшой сельской деревни Boulpon в Буркина-Фасо. В рационе типичного ребенка, живущего в этой деревне, в основном отсутствуют жиры и животные белки, а в рационе много полисахаридов и растительных белков. В фекальных бактериях европейских детей преобладали Фирмикуты и продемонстрировали заметное сокращение биоразнообразия, в то время как в фекальных бактериях детей Боулпона преобладали Bacteroidetes. Повышенное биоразнообразие и различный состав кишечной флоры у африканского населения могут способствовать перевариванию обычно неусвояемых растительных полисахаридов, а также могут привести к снижению заболеваемости неинфекционными заболеваниями толстой кишки.[45]
В меньшем масштабе было показано, что совместное использование множества общих факторов окружающей среды в семье является сильным фактором, определяющим индивидуальный состав микробиома. Этот эффект не имеет генетического влияния и постоянно наблюдается в разных культурах популяций.[40]
Недоедание
Недоедает у детей менее зрелая и менее разнообразная кишечная микробиота, чем у здоровых детей, и изменения в микробиоме, связанные с дефицитом питательных веществ, могут, в свою очередь, быть патофизиологической причиной недоедания.[46][47] Дети с недостаточным питанием также обычно имеют более потенциально патогенную кишечную флору и многое другое. дрожжи во рту и в глотке.[48] Изменение диеты может привести к изменению состава и разнообразия кишечной микробиоты.[41]
Раса и этническая принадлежность
Исследователи из Американского проекта кишечника и Проекта микробиома человека обнаружили, что двенадцать семейств микробов различались по численности в зависимости от расы или этнической принадлежности человека. Сила этих ассоциаций ограничена небольшим размером выборки: Американский проект кишечника собрал данные от 1375 человек, 90% из которых были белыми.[49] Исследование «Здоровая жизнь в городских условиях» (HELIUS) в Амстердаме показало, что люди голландского происхождения имеют самый высокий уровень разнообразия кишечной микробиоты, в то время как жители Южной Азии и Южной Азии Суринамский происхождение имело наименьшее разнообразие. Результаты исследования показали, что люди одной расы или этнического происхождения имеют больше схожих микробиомов, чем люди разного расового происхождения.[49]
Социоэкономический статус
По состоянию на 2020 год как минимум два исследования продемонстрировали связь между индивидуальным социоэкономический статус (SES) и их микробиота кишечника. Исследование в Чикаго обнаружили, что люди в районах с более высоким уровнем SES имели большее разнообразие микробиоты. У людей из районов с более высоким уровнем SES также было больше Бактероиды бактерии. Точно так же исследование двойняшки в Соединенном Королевстве обнаружили, что более высокий уровень SES также связан с большим разнообразием кишечника.[49]
Приобретение у младенцев
Установление кишечной флоры имеет решающее значение для здоровья взрослого человека, а также для функционирования желудочно-кишечного тракта.[50] У людей кишечная флора, аналогичная флоре взрослого человека, формируется в течение одного-двух лет после рождения, поскольку микробиота передается от родителей к ребенку и переносится из пищи, воды и других источников окружающей среды.[51][6]
Традиционный взгляд на желудочно-кишечный тракт нормального плод заключается в том, что он бесплоден, хотя в последние несколько лет эта точка зрения подверглась сомнению.[52] Начали появляться многочисленные доказательства того, что во внутриутробной среде могут быть бактерии. Исследования показали, что у человека может происходить микробная колонизация плода.[53] с одним исследованием, показывающим Лактобациллы и Бифидобактерии виды присутствовали в биоптатах плаценты.[54] Несколько исследования грызунов продемонстрировали наличие бактерий в околоплодных водах и плаценте, а также в меконии младенцев, рожденных путем стерильного кесарева сечения.[55][56] В другом исследовании исследователи вводили культуру бактерий орально беременной матери и обнаружили бактерии в потомстве, вероятно, в результате передачи между пищеварительным трактом и околоплодными водами через кровоток.[57] Однако исследователи предупреждают, что источник этих внутриутробных бактерий, живы ли они, и их роль еще не изучены.[58][54]
Во время родов и быстро после этого бактерии матери и окружающей среды колонизируют кишечник младенца.[6] Точные источники бактерий до конца не изучены, но могут включать родовые пути, других людей (родителей, братьев и сестер, работников больниц), грудное молоко, пищу и общую среду, с которой взаимодействует младенец.[59] Однако по состоянию на 2013 год остается неясным, происходит ли большая часть колонизации от матери или нет.[6] Младенцы, рожденные кесарево сечение могут также подвергаться воздействию микрофлоры своих матерей, но первоначальное воздействие, скорее всего, будет исходить от окружающей среды, такой как воздух, других младенцев и медперсонал, которые служат переносчиками инфекции.[53] В течение первого года жизни состав кишечной флоры, как правило, прост и сильно меняется со временем, а не у разных людей.[6] Начальная бактериальная популяция обычно факультативные анаэробные организмы; исследователи полагают, что эти первые колонизаторы снижают концентрацию кислорода в кишечнике, что, в свою очередь, способствует образованию анаэробных бактерий, таких как Бактероиды, Актинобактерии, и Фирмикуты утвердиться и процветать.[6] У детей, вскармливаемых грудью, преобладают бифидобактерии, возможно, из-за содержания факторы роста бифидобактерий в грудном молоке и тем фактом, что грудное молоко содержит пребиотические компоненты, способствующие здоровому росту бактерий.[54][60] Напротив, микробиота на искусственном вскармливании младенцы более разнообразны, с большим количеством Энтеробактерии, энтерококки, бифидобактерии, Бактероиды, и клостридии.[61]
Кесарево сечение, антибиотики, и кормление смесью может изменить состав микробиома кишечника.[54] У детей, получавших антибиотики, менее стабильные и менее разнообразные цветочные сообщества.[62] Было показано, что кесарево сечение препятствует передаче бактерий от матери к потомству, что влияет на общее состояние здоровья потомства, повышая риск таких заболеваний, как целиакия, астма и диабет 1 типа.[54] Это еще раз доказывает важность здорового микробиома кишечника. Изучаются различные методы восстановления микробиома, обычно включающие воздействие на младенца содержимого влагалища матери и пероральные пробиотики.[54]
Функции
Когда началось изучение кишечной флоры, считалось, что у нее есть три ключевые роли: прямая защита от патогены, усиление защиты хозяина своей ролью в развитии и поддержании кишечный эпителий и стимулирование выработки антител и метаболизм в других случаях неперевариваемых соединений в пище; последующая работа открыла его роль в тренировке развивающейся иммунной системы, и все же дальнейшая работа была сосредоточена на его роли в развитии иммунной системы. ось кишечник-мозг.[63]
Прямое подавление патогенов
Сообщество кишечной флоры играет непосредственную роль в защите от патогенов, полностью колонизируя пространство, используя все доступные питательные вещества и выделяя соединения, которые убивают или подавляют нежелательные организмы, которые будут конкурировать с ним за питательные вещества, эти соединения известны как цитокины.[64] Различные штаммы кишечных бактерий вызывают выработку разных цитокинов. Цитокины - это химические соединения, вырабатываемые нашей иммунной системой для инициирования воспалительная реакция против инфекций. Нарушение микрофлоры кишечника позволяет конкурировать с такими организмами, как Clostridium difficile установить, что в противном случае остается в состоянии ожидания.[64]
Развитие кишечной защиты и иммунной системы
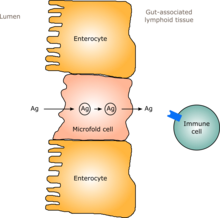
У человека кишечная флора, подобная флоре взрослого человека, формируется в течение одного-двух лет после рождения.[6] По мере того, как кишечная флора устанавливается, слизистая оболочка кишечника - кишечный эпителий и слизистая оболочка кишечника, которую он выделяет, - также развиваются таким образом, чтобы они были толерантны к комменсалистическим микроорганизмам и даже поддерживали их в определенной степени, а также обеспечивает преграду патогенным.[6] Конкретно, бокаловидные клетки которые вызывают разрастание слизистой оболочки, и слой слизистой оболочки утолщается, образуя внешний слой слизистой оболочки, в котором «дружественные» микроорганизмы могут закрепляться и питаться, и внутренний слой, в который даже эти организмы не могут проникнуть.[6][7] Кроме того, разработка лимфоидная ткань, ассоциированная с кишечником (GALT), который является частью кишечного эпителия и который обнаруживает патогены и реагирует на них, появляется и развивается в то время, когда развивается и устанавливается кишечная флора.[6] Развивающийся GALT устойчив к видам кишечной флоры, но не к другим микроорганизмам.[6] GALT также обычно становится толерантным к пище, которой подвергается младенец, а также к пищеварительным продуктам пищи и кишечной флоре. метаболиты (молекулы, образованные в результате метаболизма), получаемые из пищи.[6]
Человек иммунная система создает цитокины которые могут заставить иммунную систему вызывать воспаление, чтобы защитить себя, и которые могут подавлять иммунный ответ для поддержания гомеостаз и позволить исцелить после оскорбления или травмы.[6] Было показано, что различные виды бактерий, которые появляются во флоре кишечника, могут управлять иммунной системой для избирательного создания цитокинов; Например Bacteroides fragilis и немного Clostridia виды животных вызывают противовоспалительную реакцию, в то время как некоторые сегментированные нитчатые бактерии управлять производством воспалительных цитокинов.[6][65] Флора кишечника также может регулировать производство антитела иммунной системой.[6][66] Одна из функций этого регулирования - вызвать В-клетки перейти в класс IgA. В большинстве случаев В-клетки нуждаются в активации от Т-хелперные клетки побудить переключение классов; однако по другому пути кишечная флора вызывает NF-kB передача сигналов эпителиальными клетками кишечника, что приводит к секреции дополнительных сигнальных молекул.[67] Эти сигнальные молекулы взаимодействуют с В-клетками, чтобы вызвать переключение класса на IgA.[67] IgA - это важный тип антител, который используется в слизистой оболочке, например в кишечнике. Было показано, что IgA может помочь разнообразить кишечное сообщество и помогает избавиться от бактерий, вызывающих воспалительные реакции.[68] В конечном итоге IgA поддерживает здоровую среду между хозяином и кишечными бактериями.[68] Эти цитокины и антитела могут действовать за пределами кишечника, в легких и других тканях.[6]
Иммунная система также может быть изменена из-за способности кишечных бактерий производить метаболиты которые могут повлиять на клетки иммунной системы. Например короткоцепочечные жирные кислоты (SCFA) может вырабатываться некоторыми кишечными бактериями через ферментация.[69] SCFAs стимулируют быстрое увеличение выработки врожденных иммунных клеток, таких как нейтрофилы, базофилы и эозинофилы.[69] Эти клетки являются частью врожденной иммунной системы, которая пытается ограничить распространение инфекции.
Метаболизм
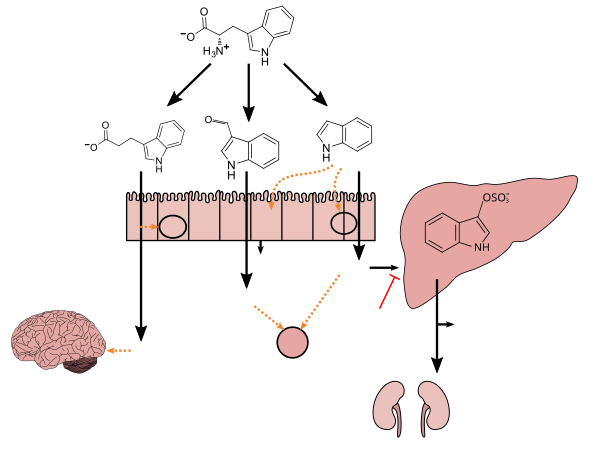
Метаболизм триптофана микробиота желудочно-кишечного тракта человека () |
Без кишечной флоры человеческий организм не смог бы использовать часть непереваренной углеводы он потребляет, потому что некоторые типы кишечной флоры имеют ферменты что человеческим клеткам не хватает для разрушения определенных полисахариды.[8] Грызуны, выращенные в стерильный окружающей среде и недостаток кишечной флоры необходимо есть на 30% больше калории просто чтобы сохранить тот же вес, что и их обычные аналоги.[8] Углеводы, недоступные человеку переваривать без бактериальной помощи включают определенные крахмалы, волокно, олигосахариды, и сахара что организм не смог переварить и усвоить лактоза в случае непереносимость лактозы и сахарные спирты, слизь вырабатывается кишечником и белками.[5][8]
Бактерии превращают ферментированные углеводы в короткоцепочечные жирные кислоты путем ферментации, называемой сахаролитическое брожение.[34] Продукты включают уксусная кислота, пропионовая кислота и Масляная кислота.[14][34] Эти материалы могут использоваться клетками-хозяевами, являясь основным источником энергии и питательных веществ.[34] Газы (которые вызывают метеоризм ) и органические кислоты, Такие как молочная кислота, также производятся путем ферментации.[14] Уксусная кислота используется мышца, пропионовая кислота способствует печень изготовление АТФ, а масляная кислота обеспечивает энергией клетки кишечника.[34]
Флора кишечника также синтезирует такие витамины, как биотин и фолиевая кислота, и облегчить абсорбцию диетические минералы, включая магний, кальций и железо.[11][20] Метанобревибактер кузнец уникален, потому что это не вид бактерий, а член домен Archeae, и является наиболее распространенным метан -продуцирующие виды архей в желудочно-кишечной микробиоте человека.[74]
Микробиота кишечника также служит источником витаминов К и В12, которые не производятся организмом или производятся в незначительных количествах.[75][76]
Фармакомикробиомика
Человек метагеном (т. е. генетический состав человека и всех микроорганизмов, которые обитают на теле человека или внутри него) значительно различается у разных людей.[77][78] Поскольку общее количество микробных и вирусных клеток в организме человека (более 100 триллионов) значительно превышает Homo sapiens клетки (десятки триллионов),[примечание 1][77][79] существует значительный потенциал для взаимодействия между лекарствами и микробиомом человека, включая: лекарства, изменяющие состав человеческий микробиом, метаболизм лекарств микробными ферментами, изменяющими действие препарата фармакокинетический профиль и микробный метаболизм лекарства, влияющие на клиническую эффективность и токсичность профиль.[77][78][80]
Помимо углеводов, микробиота кишечника может также метаболизировать другие ксенобиотики такие как наркотики, фитохимические вещества, и пищевые токсиканты. Было показано, что более 30 лекарств метаболизируются микробиотой кишечника.[81] Микробный метаболизм лекарств иногда может инактивировать лекарство.[82]
Ось кишечник-мозг
Ось кишечник-мозг - это биохимическая передача сигналов, которая происходит между желудочно-кишечный тракт и Центральная нервная система.[63] Этот термин был расширен и теперь включает роль кишечной флоры во взаимодействии; термин «ось микробиом-кишечник-мозг» иногда используется для описания парадигм, явно включающих флору кишечника.[63][83][84] В широком смысле ось кишечник-мозг включает центральную нервную систему, нейроэндокринный и нейроиммунный системы, включая гипоталамо-гипофизарно-надпочечниковая ось (Ось HPA), симпатические и парасимпатические руки автономная нервная система в том числе кишечная нервная система, то блуждающий нерв, и кишечник микробиота.[63][84]
А регулярный обзор с 2016 года изучили доклинические и небольшие испытания на людях, которые были проведены с некоторыми коммерчески доступными штаммами пробиотик бактерии и обнаружили, что среди протестированных, Бифидобактерии и Лактобациллы роды (Б. лонгум, B. breve, B. infantis, L. helveticus, L. rhamnosus, L. plantarum, и L. casei ), имел наибольший потенциал, чтобы быть полезным расстройства центральной нервной системы.[10]
Нарушения баланса флоры
Последствия употребления антибиотиков
Изменение количества кишечных бактерий, например, путем приема антибиотики широкого спектра действия, может повлиять на здоровье хозяина и его способность переваривать пищу.[85] Антибиотики могут вызывать диарея, связанная с антибиотиками (AAD), раздражая кишечник напрямую, изменяя уровни кишечной флоры или позволяя патогенный бактерии расти.[14] Еще один вредный эффект антибиотиков - увеличение количества устойчивые к антибиотикам бактерии обнаруживаются после их употребления, которые при вторжении в организм хозяина вызывают заболевания, которые трудно лечить антибиотиками.[85]
Изменение количества и видов кишечной флоры может снизить способность организма ферментировать углеводы и метаболизировать желчь кислоты и могут вызвать понос. Не расщепленные углеводы могут поглощать слишком много воды и вызывать жидкий стул, или недостаток SCFAs, продуцируемых кишечной флорой, может вызвать диарею.[14]
Снижение уровня местных видов бактерий также нарушает их способность подавлять рост вредных видов, таких как C. difficile и Сальмонелла кедугу, и эти виды могут выйти из-под контроля, хотя их чрезмерный рост может быть случайным и не быть истинной причиной диареи.[11][14][85] Новые протоколы лечения инфекций, вызванных C. difficile, включают трансплантацию фекальной микробиоты донорских фекалий. (видеть Пересадка кала ). Первоначальные отчеты о лечении описывают 90% успешных результатов при небольшом количестве побочных эффектов. Предполагается, что эффективность является результатом восстановления бактериального баланса классов бактероидов и фирмикутов.[86]
Состав кишечной флоры также изменяется при тяжелых заболеваниях не только из-за использования антибиотиков, но и из-за таких факторов, как ишемия кишечника, отказ от еды и иммунный компромисс. Отрицательные эффекты от этого вызвали интерес к селективная дезактивация пищеварительного тракта (SDD), лечение, которое убивает только патогенные бактерии и позволяет восстановить здоровые.[87]
Антибиотики меняют популяцию желудочно-кишечный тракт (ЖКТ) микробиота, может изменить метаболические взаимодействия внутри сообщества, изменить потребление калорий за счет использования углеводов и в глобальном масштабе влияет на метаболический, гормональный и иммунный гомеостаз хозяина.[88]
Есть разумные доказательства того, что прием пробиотиков, содержащих Лактобациллы виды могут помочь предотвратить диарею, связанную с антибиотиками, и прием пробиотиков с Сахаромицеты (например., Saccharomyces boulardii ) может помочь предотвратить Clostridium difficile инфекция после системного лечения антибиотиками.[89]
Беременность
Микробиота кишечника женщин изменяется по мере наступления беременности, причем изменения аналогичны тем, которые наблюдаются при беременности. метаболические синдромы например диабет. Изменение флоры кишечника не вызывает никаких побочных эффектов. Биота кишечника новорожденного напоминает образцы, взятые у матери в первом триместре. Разнообразие флоры уменьшается с первого по третий триместр по мере увеличения численности определенных видов.[54][90]
Пробиотики, пребиотики, синбиотики и фармабиотики.
Пробиотики находятся микроорганизмы которые считаются полезными для здоровья при употреблении.[91][92] Что касается кишечной флоры, пребиотики обычно не усваиваются, волокно соединения, которые проходят непереваренными через верхнюю часть желудочно-кишечный тракт и стимулировать рост или активность полезной кишечной флоры, действуя как субстрат для них.[34][93]
Синбиотики относится к пищевые ингредиенты или же пищевые добавки сочетание пробиотиков и пребиотиков в форме синергизм.[94]
Термин «фармабиотики» используется по-разному для обозначения: фармацевтические препараты (стандартизованное производство, которое может получить разрешение регулирующих органов в качестве лекарственного препарата) пробиотиков, пребиотики, или же синбиотики;[95] пробиотики, которые были генетически модифицированы или оптимизированы иным образом для достижения наилучших результатов (срок годности, выживаемость в пищеварительном тракте и т. д.);[96] и натуральные продукты метаболизма кишечной флоры (витамины и др.).[97]
Есть некоторые свидетельства того, что лечение некоторыми пробиотическими штаммами бактерий может быть эффективным при синдром раздраженного кишечника и хронический идиопатический запор. Эти организмы, которые, скорее всего, приведут к уменьшению симптомов, включают:
- Enterococcus faecium
- Lactobacillus plantarum
- Lactobacillus rhamnosus
- Propionibacterium freudenreichii
- Bifidobacterium breve
- Lactobacillus reuteri
- Lactobacillus salivarius
- Bifidobacterium infantis
- Термофильный стрептококк[98][99][100]
Исследование
Испытания на то, могут ли неантибиотические препараты воздействовать на кишечные бактерии человека, были выполнены in vitro анализ более 1000 имеющихся на рынке лекарств против 40 штаммов кишечных бактерий, демонстрирующий, что 24% препаратов подавляли рост по крайней мере одного из штаммов бактерий.[101]
Роль в болезни
Бактерии в пищеварительном тракте могут способствовать заболеванию и влиять на него по-разному. Наличие или переизбыток некоторых видов бактерий может способствовать воспалительным заболеваниям, таким как: воспалительное заболевание кишечника.[11] Кроме того, метаболиты некоторых представителей кишечной флоры могут влиять на сигнальные пути хозяина, способствуя таким нарушениям, как ожирение и рак толстой кишки.[11] В качестве альтернативы, в случае расстройства кишечника эпителий проникновение компонентов кишечной флоры в другие компартменты хозяина может привести к сепсис.[11]
Язвы
Helicobacter pylori Инфекция может инициировать образование язвы желудка, когда бактерии проникают через эпителиальную выстилку желудка, вызывая затем воспалительный фагоцитотический ответ.[102] В свою очередь, воспаление повреждает париетальные клетки, которые выделяют чрезмерное количество соляной кислоты в желудок и производят меньше защитной слизи.[103] Травма слизистой оболочки желудка, приводящая к язвы, развивается, когда желудочная кислота подавляет защитные свойства клеток и подавляет эндогенные простагландин синтез, уменьшает секрецию слизи и бикарбоната, уменьшает кровоток через слизистые оболочки и снижает сопротивляемость травмам.[103] Снижение защитных свойств слизистой оболочки желудка увеличивает уязвимость к дальнейшим травмам и образованию язв под воздействием желудочной кислоты, пепсина и желчных солей.[102][103]
Перфорация кишечника
Обычно-комменсальные бактерии могут нанести вред хозяину, если они выйдут из кишечного тракта.[6][7] Перемещение, который возникает, когда бактерии покидают кишечник через его слизистая оболочка подкладки, может возникнуть при ряде различных заболеваний.[7] Если кишечник перфорирован, бактерии проникают в интерстиций, вызывая потенциально смертельный инфекционное заболевание.[4]:715
Воспалительные заболевания кишечника
Два основных типа воспалительные заболевания кишечника, болезнь Крона и язвенный колит, находятся хронический воспалительные заболевания кишечника; причины этих заболеваний неизвестны, и проблемы с кишечной флорой и ее взаимоотношениями с хозяином были связаны с этими состояниями.[9][104][105][106] Кроме того, оказывается, что взаимодействие кишечной флоры с осью кишечник-мозг играет роль в ВЗК, при этом физиологический стресс опосредуется через гипоталамо-гипофизарно-надпочечниковая ось вызывая изменения кишечного эпителия и кишечной флоры, в свою очередь, высвобождая факторы и метаболиты, которые запускают передачу сигналов в кишечная нервная система и блуждающий нерв.[3]
У людей с воспалительными заболеваниями кишечника разнообразие кишечной флоры, по-видимому, значительно меньше, чем у здоровых людей; кроме того, у людей с язвенным колитом доминируют протеобактерии и актинобактерии; у людей с болезнью Крона, Enterococcus faecium и несколько Proteobacteria, кажется, перепредставлены.[3]
Есть разумные доказательства того, что устранение дисбаланса кишечной флоры путем приема пробиотиков с Лактобациллы и Бифидобактерии может уменьшить висцеральную боль и воспаление кишечника при ВЗК.[89]
Синдром раздраженного кишечника
Синдром раздраженного кишечника is a result of stress and chronic activation of the HPA axis; its symptoms include abdominal pain, changes in bowel movements, and an increase in proinflammatory cytokines. Overall, studies have found that the luminal and mucosal microbiota are changed in irritable bowel syndrome individuals, and these changes can relate to the type of irritation such as diarrhea or запор. Also, there is a decrease in the diversity of the microbiome with low levels of fecal Lactobacilli and Bifidobacteria, high levels of facultative anaerobic bacteria Такие как кишечная палочка, and increased ratios of Firmicutes: Bacteroidetes.[84]
Other inflammatory or autoimmune conditions
Аллергия, астма, и сахарный диабет находятся аутоиммунный и воспалительные расстройства of unknown cause, but have been linked to imbalances in the gut flora and its relationship with the host.[9] As of 2016 it was not clear if changes to the gut flora cause these auto-immune and inflammatory disorders or are a product of or adaptation to them.[9][107]
Астма
With asthma, two hypotheses have been posed to explain its rising prevalence in the developed world. В гипотеза гигиены posits that children in the developed world are not exposed to enough microbes and thus may contain lower prevalence of specific bacterial taxa that play protective roles.[108] The second hypothesis focuses on the Диета по западному образцу, which lacks цельное зерно и волокно and has an overabundance of простые сахара.[9] Both hypotheses converge on the role of short-chain fatty acids (SCFAs) in иммуномодуляция. These bacterial fermentation metabolites are involved in immune signalling that prevents the triggering of asthma and lower SCFA levels are associated with the disease.[108][109] Lacking protective genera such as Lachnospira, Veillonella, Ротия и Faecalibacterium has been linked to reduced SCFA levels.[108] Further, SCFAs are the product of bacterial fermentation of fiber, which is low in the Western pattern diet.[9][109] SCFAs offer a link between gut flora and immune disorders, and as of 2016, this was an active area of research.[9] Similar hypotheses have also been posited for the rise of food and other allergies.[110]
Сахарный диабет 1 типа
The connection between the gut microbiota and diabetes mellitus type 1 has also been linked to SCFAs, such as бутират and acetate. Diets yielding butyrate and acetate from bacterial fermentation show increased Трег выражение.[111] Трег клетки downregulate эффекторные Т-клетки, which in turn reduces the воспалительная реакция в кишечнике.[112] Butyrate is an energy source for colon cells. butyrate-yielding diets thus decrease gut permeability by providing sufficient energy for the formation of узкие стыки.[113] Additionally, butyrate has also been shown to decrease insulin resistance, suggesting gut communities low in butyrate-producing microbes may increase chances of acquiring сахарный диабет 2 типа.[114] Butyrate-yielding diets may also have potential колоректальный рак suppression effects.[113]
Obesity and metabolic syndrome
The gut flora has also been implicated in obesity and метаболический синдром due to the key role it plays in the digestive process; the Western pattern diet appears to drive and maintain changes in the gut flora that in turn change how much energy is derived from food and how that energy is used.[106][115] One aspect of a Здоровая диета that is often lacking in the Western-pattern diet is fiber and other complex carbohydrates that a healthy gut flora require flourishing; changes to gut flora in response to a Western-pattern diet appear to increase the amount of energy generated by the gut flora which may contribute to obesity and metabolic syndrome.[89] There is also evidence that microbiota influence eating behaviours based on the preferences of the microbiota, which can lead to the host consuming more food eventually resulting in obesity. It has generally been observed that with higher gut microbiome diversity, the microbiota will spend energy and resources on competing with other microbiota and less on manipulating the host. The opposite is seen with lower gut microbiome diversity, and these microbiotas may work together to create host food cravings.[41]
Additionally, the liver plays a dominant role in глюкоза в крови homeostasis by maintaining a balance between the uptake and storage of glucose through the metabolic pathways of glycogenesis и глюконеогенез. Intestinal lipids regulate glucose homeostasis involving a gut-brain-liver axis. The direct administration of lipids into the upper intestine increases the long chain fatty acyl-coenzyme A (LCFA-CoA) levels in the upper intestines and suppresses glucose production even under subdiaphragmatic ваготомия or gut vagal деафферентация. This interrupts the neural connection between the brain and the gut and blocks the upper intestinal lipids' ability to inhibit glucose production. The gut-brain-liver axis and gut microbiota composition can regulate the glucose homeostasis in the liver and provide potential therapeutic methods to treat obesity and diabetes.[116]
Just as gut flora can function in a feedback loop that can drive the development of obesity, there is evidence that restricting intake of calories (i.e., на диете ) can drive changes to the composition of the gut flora.[106]
Болезнь печени
As the liver is fed directly by the воротная вена, whatever crosses the intestinal epithelium and the intestinal mucosal barrier enters the liver, as do cytokines generated there.[117] Дисбактериоз in the gut flora has been linked with the development of цирроз и неалкогольная жировая болезнь печени.[117]
Рак
Some genera of bacteria, such as Бактероиды и Clostridium, have been associated with an increase in опухоль growth rate, while other genera, such as Лактобациллы и Бифидобактерии, are known to prevent tumor formation.[11] As of December 2017 there was preliminary and indirect evidence that gut microbiota might mediate response to PD-1 inhibitors; the mechanism was unknown.[118]
Психоневрологический
Interest in the relationship between gut flora and neuropsychiatric issues was sparked by a 2004 study showing that germ-free mice showed an exaggerated HPA axis response to stress compared to non-GF laboratory mice.[63] As of January 2016, most of the work that has been done on the role of gut flora in the gut-brain axis had been conducted in animals, or characterizing the various neuroactive compounds that gut flora can produce, and studies with humans measuring differences between people with various psychiatric and neurological differences, or changes to gut flora in response to stress, or measuring effects of various probiotics (dubbed "psychobiotics in this context), had generally been small and could not be generalized; whether changes to gut flora are a result of disease, a cause of disease, or both in any number of possible feedback loops in the gut-brain axis, remained unclear.[63][89]
A systematic review from 2016 examined the preclinical and small human trials that have been conducted with certain commercially available strains of probiotic bacteria and found that among those tested, the genera Бифидобактерии и Лактобациллы (B. longum, B. breve, B. infantis, L. helveticus, L. rhamnosus, L. plantarum, и L. casei) had the most potential to be useful for certain central nervous system disorders.[10]
Другие животные
The composition of the human gut microbiome is similar to that of the other great apes. However, humans’ gut biota has decreased in diversity and changed in composition since our evolutionary split from Сковорода.[119] Humans display increases in Bacteroidetes, a bacterial phylum associated with diets high in animal protein and fat, and decreases in Methanobrevibacter and Fibrobacter, groups that ferment complex plant polysaccharides.[119] These changes are the result of the combined dietary, genetic, and cultural changes humans have undergone since evolutionary divergence from Сковорода.
In addition to humans and vertebrates, some insects also possess complex and diverse gut microbiota that play key nutritional roles.[120] Microbial communities associated with termites can constitute a majority of the weight of the individuals and perform important roles in the digestion of лигноцеллюлоза и азотфиксация.[121] These communities are host-specific, and closely related insect species share comparable similarities in gut microbiota composition.[122][123] В тараканы, gut microbiota have been shown to assemble in a deterministic fashion, irrespective of the инокулят;[124] the reason for this host-specific assembly remains unclear. Bacterial communities associated with insects like termites and cockroaches are determined by a combination of forces, primarily diet, but there is some indication that host филогения may also be playing a role in the selection of lineages.[122][123]
For more than 51 years it has been known that the administration of low doses of antibacterial agents promotes the growth of farm animals to increase weight gain.[88]
In a study carried out on мышей соотношение Фирмикуты и Lachnospiraceae was significantly elevated in animals treated with subtherapeutic doses of different antibiotics. By analyzing the caloric content of faeces and the concentration of small chain fatty acids (SCFAs) in the GI tract, it was concluded that the changes in the composition of microbiota lead to an increased capacity to extract calories from otherwise indigestible constituents, and to an increased production of SCFAs. These findings provide evidence that antibiotics perturb not only the composition of the GI microbiome but also its metabolic capabilities, specifically with respect to SCFAs.[88]
Смотрите также
- Colonisation resistance
- List of human flora
- Список видов микробиоты нижних половых путей женщин
- Флора кожи
- Verotoxin-producing кишечная палочка
Примечания
Рекомендации
- ^ Moszak, M; Szulińska, M; Bogdański, P (15 April 2020). "You Are What You Eat-The Relationship between Diet, Microbiota, and Metabolic Disorders-A Review". Питательные вещества. 12 (4): 1096. Дои:10.3390/nu12041096. PMID 32326604. S2CID 216108564.
- ^ Segata, N; Boernigen, D; Tickle, TL; Morgan, XC; Garrett, WS; Huttenhower, C (14 May 2013). "Computational meta'omics for microbial community studies". Молекулярная системная биология. 9: 666. Дои:10.1038/msb.2013.22. PMID 23670539.
- ^ а б c Saxena, R.; Sharma, V.K (2016). "A Metagenomic Insight Into the Human Microbiome: Its Implications in Health and Disease". In D. Kumar; S. Antonarakis (eds.). Medical and Health Genomics. Elsevier Science. п. 117. Дои:10.1016/B978-0-12-420196-5.00009-5. ISBN 978-0-12-799922-7.
- ^ а б c d е ж грамм час я j k л Шервуд, Линда; Уилли, Джоанна; Вулвертон, Кристофер (2013). Микробиология Прескотта (9-е изд.). Нью-Йорк: Макгроу Хилл. С. 713–21. ISBN 9780073402406. OCLC 886600661.
- ^ а б c d е Quigley, E. M (2013). "Gut bacteria in health and disease". Гастроэнтерология и гепатология. 9 (9): 560–9. ЧВК 3983973. PMID 24729765.
- ^ а б c d е ж грамм час я j k л м п о п q Sommer, Felix; Bäckhed, Fredrik (2013). "The gut microbiota — masters of host development and physiology". Обзоры природы Микробиология. 11 (4): 227–38. Дои:10.1038/nrmicro2974. PMID 23435359. S2CID 22798964.
- ^ а б c d Faderl, Martin; Noti, Mario; Corazza, Nadia; Mueller, Christoph (2015). "Keeping bugs in check: The mucus layer as a critical component in maintaining intestinal homeostasis". IUBMB Life. 67 (4): 275–85. Дои:10.1002/iub.1374. PMID 25914114. S2CID 25878594.
- ^ а б c d е ж Clarke, Gerard; Stilling, Roman M; Kennedy, Paul J; Stanton, Catherine; Cryan, John F; Dinan, Timothy G (2014). "Minireview: Gut Microbiota: The Neglected Endocrine Organ". Молекулярная эндокринология. 28 (8): 1221–38. Дои:10.1210/me.2014-1108. ЧВК 5414803. PMID 24892638.
- ^ а б c d е ж грамм час Shen, Sj; Wong, Connie HY (2016). "Bugging inflammation: Role of the gut microbiota". Clinical & Translational Immunology. 5 (4): e72. Дои:10.1038/cti.2016.12. ЧВК 4855262. PMID 27195115.
- ^ а б c Wang, Huiying; Lee, In-Seon; Braun, Christoph; Enck, Paul (2016). "Effect of Probiotics on Central Nervous System Functions in Animals and Humans: A Systematic Review". Журнал нейрогастроэнтерологии и моторики. 22 (4): 589–605. Дои:10.5056/jnm16018. ЧВК 5056568. PMID 27413138.
- ^ а б c d е ж грамм час я j k л м п о п Guarner, F; Malagelada, J (2003). «Флора кишечника в здоровье и болезни». Ланцет. 361 (9356): 512–19. Дои:10.1016/S0140-6736(03)12489-0. PMID 12583961. S2CID 38767655.
- ^ а б c d е ж Sears, Cynthia L. (2005). "A dynamic partnership: Celebrating our gut flora". Анаэроб. 11 (5): 247–51. Дои:10.1016 / j.anaerobe.2005.05.001. PMID 16701579.
- ^ Shapira, Michael (2016-07-01). "Gut Microbiotas and Host Evolution: Scaling Up Symbiosis". Тенденции в экологии и эволюции. 31 (7): 539–549. Дои:10.1016/j.tree.2016.03.006. ISSN 0169-5347. PMID 27039196.
- ^ а б c d е ж грамм час я j Beaugerie, Laurent; Petit, Jean-Claude (2004). "Antibiotic-associated diarrhoea". Передовая практика и исследования в клинической гастроэнтерологии. 18 (2): 337–52. Дои:10.1016 / j.bpg.2003.10.002. PMID 15123074.
- ^ Stephen, A. M.; Cummings, J. H. (1980). "The Microbial Contribution to Human Faecal Mass". Журнал медицинской микробиологии. 13 (1): 45–56. Дои:10.1099/00222615-13-1-45. PMID 7359576.
- ^ Lozupone, Catherine A.; Stombaugh, Jesse I.; Gordon, Jeffrey I.; Jansson, Janet K.; Knight, Rob (2012). "Diversity, stability and resilience of the human gut microbiota". Природа. 489 (7415): 220–30. Bibcode:2012Natur.489..220L. Дои:10.1038/nature11550. ЧВК 3577372. PMID 22972295.
- ^ Qin, Junjie; Li, Ruiqiang; Raes, Jeroen; Arumugam, Manimozhiyan; Burgdorf, Kristoffer Solvsten; Manichanh, Chaysavanh; Nielsen, Trine; Pons, Nicolas; Левенес, Флоренция; Yamada, Takuji; Mende, Daniel R.; Li, Junhua; Xu, Junming; Li, Shaochuan; Li, Dongfang; Cao, Jianjun; Ван, Бо; Liang, Huiqing; Zheng, Huisong; Xie, Yinlong; Tap, Julien; Lepage, Patricia; Bertalan, Marcelo; Batto, Jean-Michel; Hansen, Torben; Ле Пелье, Дени; Линнеберг, Аллан; Nielsen, H. Bjørn; Пеллетье, Эрик; Renault, Pierre (2010). «Каталог микробных генов кишечника человека, созданный с помощью метагеномного секвенирования». Природа. 464 (7285): 59–65. Bibcode:2010Natur.464...59.. Дои:10.1038 / природа08821. ЧВК 3779803. PMID 20203603.
- ^ Shanahan, Fergus (2002). "The host–microbe interface within the gut". Передовая практика и исследования в клинической гастроэнтерологии. 16 (6): 915–31. Дои:10.1053/bega.2002.0342. PMID 12473298.
- ^ Tap, Julien; Mondot, Stanislas; Левенес, Флоренция; Пеллетье, Эрик; Caron, Christophe; Furet, Jean-Pierre; Ugarte, Edgardo; Muñoz-Tamayo, Rafael; Paslier, Denis L. E.; Nalin, Renaud; Dore, Joel; Leclerc, Marion (2009). "Towards the human intestinal microbiota phylogenetic core". Экологическая микробиология. 11 (10): 2574–84. Дои:10.1111/j.1462-2920.2009.01982.x. PMID 19601958.
- ^ а б O'Hara, Ann M; Shanahan, Fergus (2006). "The gut flora as a forgotten organ". Отчеты EMBO. 7 (7): 688–93. Дои:10.1038/sj.embor.7400731. ЧВК 1500832. PMID 16819463.
- ^ Khanna, Sahil; Tosh, Pritish K (2014). "A Clinician's Primer on the Role of the Microbiome in Human Health and Disease". Труды клиники Мэйо. 89 (1): 107–14. Дои:10.1016/j.mayocp.2013.10.011. PMID 24388028.
- ^ а б Cui, Lijia; Morris, Alison; Ghedin, Elodie (2013). «Микобиом человека в здоровье и болезнях». Геномная медицина. 5 (7): 63. Дои:10,1186 / г 467. ЧВК 3978422. PMID 23899327.
- ^ Erdogan, Askin; Rao, Satish S. C (2015). "Small Intestinal Fungal Overgrowth". Текущие отчеты гастроэнтерологии. 17 (4): 16. Дои:10.1007 / s11894-015-0436-2. PMID 25786900. S2CID 3098136.
- ^ Bello, Maria G. Dominguez; Knight, Rob; Гилберт, Джек А .; Blaser, Martin J. (4 October 2018). "Preserving microbial diversity". Наука. 362 (6410): 33–34. Bibcode:2018Sci...362...33B. Дои:10.1126/science.aau8816. PMID 30287652. S2CID 52919917.
- ^ а б Arumugam, Manimozhiyan; Raes, Jeroen; Пеллетье, Эрик; Ле Пелье, Дени; Yamada, Takuji; Mende, Daniel R.; Fernandes, Gabriel R.; Tap, Julien; Bruls, Thomas; Batto, Jean-Michel; Bertalan, Marcelo; Borruel, Natalia; Casellas, Francesc; Fernandez, Leyden; Готье, Лоран; Hansen, Torben; Hattori, Masahira; Хаяси, Тэцуя; Kleerebezem, Michiel; Kurokawa, Ken; Leclerc, Marion; Левенес, Флоренция; Manichanh, Chaysavanh; Nielsen, H. Bjørn; Nielsen, Trine; Pons, Nicolas; Poulain, Julie; Qin, Junjie; Sicheritz-Ponten, Thomas; Tims, Sebastian (2011). "Enterotypes of the human gut microbiome". Природа. 473 (7346): 174–80. Bibcode:2011Natur.473..174.. Дои:10.1038/nature09944. ЧВК 3728647. PMID 21508958.
- ^ а б Wu, G. D.; Chen, J .; Hoffmann, C .; Bittinger, K.; Chen, Y.-Y.; Keilbaugh, S. A.; Bewtra, M.; Knights, D.; Walters, W. A.; Knight, R.; Sinha, R.; Gilroy, E.; Gupta, K.; Baldassano, R.; Nessel, L.; Li, H .; Bushman, F. D.; Lewis, J. D. (2011). "Linking Long-Term Dietary Patterns with Gut Microbial Enterotypes". Наука. 334 (6052): 105–08. Bibcode:2011Sci...334..105W. Дои:10.1126/science.1208344. ЧВК 3368382. PMID 21885731.
- ^ Zimmer, Carl (April 20, 2011). "Bacteria Divide People Into 3 Types, Scientists Say". Нью-Йорк Таймс. Получено 21 апреля, 2011.
a group of scientists now report just three distinct ecosystems in the guts of people they have studied.
- ^ Knights, Dan; Ward, Tonya; McKinlay, Christopher; Miller, Hannah; Гонсалес, Антонио; McDonald, Daniel; Knight, Rob (8 October 2014). "Rethinking "Enterotypes"". Клеточный хозяин и микроб. 16 (4): 433–37. Дои:10.1016/j.chom.2014.09.013. ЧВК 5558460. PMID 25299329.
- ^ Kenneth Todar (2012). "The Normal Bacterial Flora of Humans". Интернет-учебник по бактериологии Тодара. Получено 25 июня, 2016.
- ^ Quigley, Eamonn M.M; Quera, Rodrigo (2006). "Small Intestinal Bacterial Overgrowth: Roles of Antibiotics, Prebiotics, and Probiotics". Гастроэнтерология. 130 (2): S78–90. Дои:10.1053/j.gastro.2005.11.046. PMID 16473077. S2CID 16904501.
- ^ Adams, M. R.; Moss, M. O. (2007). Пищевая микробиология. Дои:10.1039/9781847557940. ISBN 978-0-85404-284-5.
- ^ а б Университет Глазго. 2005 г. Нормальная кишечная флора. Доступно в веб-архиве. Доступ 22 мая 2008 г.
- ^ а б Steinhoff, U (2005). "Who controls the crowd? New findings and old questions about the intestinal microflora". Письма иммунологии. 99 (1): 12–16. Дои:10.1016/j.imlet.2004.12.013. PMID 15894105.
- ^ а б c d е ж Gibson, Glenn R (2004). "Fibre and effects on probiotics (the prebiotic concept)". Добавки для клинического питания. 1 (2): 25–31. Дои:10.1016/j.clnu.2004.09.005.
- ^ Miquel, S; Martín, R; Rossi, O; Bermúdez-Humarán, LG; Chatel, JM; Sokol, H; Thomas, M; Wells, JM; Langella, P (2013). "Faecalibacterium prausnitzii and human intestinal health". Текущее мнение в микробиологии. 16 (3): 255–61. Дои:10.1016/j.mib.2013.06.003. PMID 23831042.
- ^ Ley, Ruth E (2010). "Obesity and the human microbiome". Текущее мнение в гастроэнтерологии. 26 (1): 5–11. Дои:10.1097/MOG.0b013e328333d751. PMID 19901833. S2CID 23329156.
- ^ Nash, Andrea K; Auchtung, Thomas A; Wong, Matthew C; Smith, Daniel P; Gesell, Jonathan R; Ross, Matthew C; Stewart, Christopher J; Metcalf, Ginger A; Музны, Донна М; Gibbs, Richard A; Ajami, Nadim J; Petrosino, Joseph F (2017). "The gut mycobiome of the Human Microbiome Project healthy cohort". Микробиом. 5 (1): 153. Дои:10.1186/s40168-017-0373-4. ЧВК 5702186. PMID 29178920.
- ^ Scarpellini, Emidio; Ianiro, Gianluca; Attili, Fabia; Bassanelli, Chiara; De Santis, Adriano; Gasbarrini, Antonio (2015). "The human gut microbiota and virome: Potential therapeutic implications". Digestive and Liver Disease. 47 (12): 1007–12. Дои:10.1016/j.dld.2015.07.008. PMID 26257129.
- ^ Gerritsen, Jacoline; Smidt, Hauke; Rijkers, Ger; de Vos, Willem (27 May 2011). "Intestinal microbiota in human health and disease: the impact of probiotics". Genes & Nutrition. 6 (3): 209–40. Дои:10.1007/s12263-011-0229-7. ЧВК 3145058. PMID 21617937.
- ^ а б c d е ж Yatsunenko, T.; Rey, F. E.; Manary, M. J.; Trehan, I.; Dominguez-Bello, M. G.; Contreras, M.; Magris, M.; Hidalgo, G.; Baldassano, R. N.; Anokhin, A. P.; Heath, A. C.; Warner, B .; Reeder, J.; Kuczynski, J.; Caporaso, J. G.; Lozupone, C. A.; Lauber, C.; Clemente, J. C.; Knights, D.; Knight, R.; Gordon, J. I. (2012). "Human gut microbiome viewed across age and geography". Природа. 486 (7402): 222–27. Bibcode:2012Natur.486..222Y. Дои:10.1038/nature11053. ЧВК 3376388. PMID 22699611.
- ^ а б c Alcock, Joe; Maley, Carlo C; Aktipis, C. Athena (2014). "Is eating behavior manipulated by the gastrointestinal microbiota? Evolutionary pressures and potential mechanisms". BioEssays. 36 (10): 940–9. Дои:10.1002/bies.201400071. ЧВК 4270213. PMID 25103109.
- ^ Yeh, Ming-Chin; Glick-Bauer, Marian (November 2014). "The Health Advantage of a Vegan Diet: Exploring the Gut Microbiota Connection". Питательные вещества. 6 (11): 4822–4838. Дои:10.3390/nu6114822. ЧВК 4245565. PMID 25365383.
- ^ а б David, Lawrence A.; Maurice, Corinne F.; Carmody, Rachel N.; Gootenberg, David B.; Button, Julie E.; Wolfe, Benjamin E.; Ling, Alisha V.; Devlin, A. Sloan; Varma, Yug; Fischbach, Michael A .; Biddinger, Sudha B.; Dutton, Rachel J.; Turnbaugh, Peter J. (11 December 2013). "Diet rapidly and reproducibly alters the human gut microbiome". Природа. 505 (7484): 559–563. Дои:10.1038/nature12820. ЧВК 3957428. PMID 24336217.
- ^ Jeffery, Ian; O'Toole, Paul (17 January 2013). "Diet-Microbiota Interactions and Their Implications for Healthy Living". Питательные вещества. 5 (1): 234–252. Дои:10.3390/nu5010234. ЧВК 3571646. PMID 23344252.
- ^ Де Филиппо, К; Cavalieri, D; Di Paola, M; Ramazzotti, M; Poullet, J. B; Massart, S; Collini, S; Pieraccini, G; Lionetti, P (2010). "Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa". Труды Национальной академии наук. 107 (33): 14691–6. Bibcode:2010PNAS..10714691D. Дои:10.1073/pnas.1005963107. ЧВК 2930426. PMID 20679230.
- ^ Jonkers, Daisy M.A.E. (2016). "Microbial perturbations and modulation in conditions associated with malnutrition and malabsorption". Передовая практика и исследования в клинической гастроэнтерологии. 30 (2): 161–72. Дои:10.1016/j.bpg.2016.02.006. PMID 27086883.
- ^ Million, Matthieu; Diallo, Aldiouma; Raoult, Didier (May 2017). "Gut microbiota and malnutrition". Микробный патогенез. 106: 127–138. Дои:10.1016/j.micpath.2016.02.003. PMID 26853753.
- ^ Rytter, Maren Johanne Heilskov; Kolte, Lilian; Briend, André; Friis, Henrik; Christensen, Vibeke Brix (2014). "The Immune System in Children with Malnutrition—A Systematic Review". PLOS ONE. 9 (8): e105017. Bibcode:2014PLoSO...9j5017R. Дои:10.1371/journal.pone.0105017. ЧВК 4143239. PMID 25153531.
- ^ а б c Renson, Audrey; Herd, Pamela; Dowd, Jennifer B. (2020). "Sick Individuals and Sick (Microbial) Populations: Challenges in Epidemiology and the Microbiome". Ежегодный обзор общественного здравоохранения. 41: 63–80. Дои:10.1146/annurev-publhealth-040119-094423. PMID 31635533.
- ^ Turroni, Francesca; Пеано, Клелия; Pass, Daniel A; Foroni, Elena; Severgnini, Marco; Claesson, Marcus J; Kerr, Colm; Hourihane, Jonathan; Murray, Deirdre; Fuligni, Fabio; Gueimonde, Miguel; Margolles, Abelardo; De Bellis, Gianluca; o'Toole, Paul W; Van Sinderen, Douwe; Marchesi, Julian R; Ventura, Marco (2012). "Diversity of Bifidobacteria within the Infant Gut Microbiota". PLOS ONE. 7 (5): e36957. Bibcode:2012PLoSO...736957T. Дои:10.1371/journal.pone.0036957. ЧВК 3350489. PMID 22606315.
- ^ Davenport, Emily R.; Sanders, Jon G.; Song, Se Jin; Amato, Katherine R.; Кларк, Эндрю Дж .; Knight, Rob (2017-12-27). "The human microbiome in evolution". BMC Биология. 15 (1): 127. Дои:10.1186/s12915-017-0454-7. ISSN 1741-7007. ЧВК 5744394. PMID 29282061.
- ^ Перес-Муньос, Мария Элиза; Арриета, Мария-Клэр; Ramer-Tait, Amanda E; Уолтер, Йенс (2017). "A critical assessment of the 'sterile womb' and 'in utero colonization' hypotheses: Implications for research on the pioneer infant microbiome". Микробиом. 5 (1): 48. Дои:10.1186 / s40168-017-0268-4. ЧВК 5410102. PMID 28454555.
- ^ а б Matamoros, Sebastien; Gras-Leguen, Christele; Le Vacon, Françoise; Potel, Gilles; de la Cochetiere, Marie-France (2013). "Development of intestinal microbiota in infants and its impact on health". Тенденции в микробиологии. 21 (4): 167–73. Дои:10.1016/j.tim.2012.12.001. PMID 23332725.
- ^ а б c d е ж грамм Mueller, Noel T.; Bakacs, Elizabeth; Combellick, Joan; Grigoryan, Zoya; Dominguez-Bello, Maria G. (2015). "The infant microbiome development: mom matters". Trends in Molecular Medicine. 21 (2): 109–17. Дои:10.1016/j.molmed.2014.12.002. ЧВК 4464665. PMID 25578246.
- ^ Jiménez, Esther; Fernández, Leonides; Marín, María L; Martín, Rocío; Odriozola, Juan M; Nueno-Palop, Carmen; Narbad, Arjan; Olivares, Mónica; Xaus, Jordi; Rodríguez, Juan M (2005). "Isolation of Commensal Bacteria from Umbilical Cord Blood of Healthy Neonates Born by Cesarean Section". Современная микробиология. 51 (4): 270–4. Дои:10.1007/s00284-005-0020-3. PMID 16187156. S2CID 43438656.
- ^ Collado, Maria Carmen; Rautava, Samuli; Aakko, Juhani; Isolauri, Erika; Salminen, Seppo (2016). "Human gut colonisation may be initiated in utero by distinct microbial communities in the placenta and amniotic fluid". Научные отчеты. 6: 23129. Bibcode:2016NatSR...623129C. Дои:10.1038/srep23129. ЧВК 4802384. PMID 27001291.
- ^ Jiménez, Esther; Marín, María L.; Martín, Rocío; Odriozola, Juan M.; Olivares, Mónica; Xaus, Jordi; Fernández, Leonides; Rodríguez, Juan M. (2008). "Is meconium from healthy newborns actually sterile?". Исследования в области микробиологии. 159 (3): 187–93. Дои:10.1016/j.resmic.2007.12.007. PMID 18281199.
- ^ Перес-Муньос, Мария Элиза; Арриета, Мария-Клэр; Ramer-Tait, Amanda E; Уолтер, Йенс (2017). "A critical assessment of the "sterile womb" and "in utero colonization" hypotheses: Implications for research on the pioneer infant microbiome". Микробиом. 5 (1): 48. Дои:10.1186 / s40168-017-0268-4. ЧВК 5410102. PMID 28454555.
- ^ Adlerberth, I; Wold, AE (2009). "Establishment of the gut microbiota in Western infants". Acta Paediatrica. 98 (2): 229–38. Дои:10.1111/j.1651-2227.2008.01060.x. PMID 19143664. S2CID 205859933.
- ^ Coppa, G.V; Zampini, L; Galeazzi, T; Gabrielli, O (2006). "Prebiotics in human milk: A review". Digestive and Liver Disease. 38: S291–4. Дои:10.1016/S1590-8658(07)60013-9. PMID 17259094.
- ^ Fanaro, S; Chierici, R; Guerrini, P; Vigi, V (2007). "Intestinal microflora in early infancy: Composition and development". Acta Paediatrica. 92 (441): 48–55. Дои:10.1111/j.1651-2227.2003.tb00646.x. PMID 14599042. S2CID 10316311.
- ^ Yassour, Moran; Vatanen, Tommi; Siljander, Heli; Hämäläinen, Anu-Maaria; Härkönen, Taina; Ryhänen, Samppa J; Franzosa, Eric A; Vlamakis, Hera; Huttenhower, Curtis; Gevers, Dirk; Lander, Eric S; Knip, Mikael; Xavier, Ramnik J (2016). "Natural history of the infant gut microbiome and impact of antibiotic treatment on bacterial strain diversity and stability". Научная трансляционная медицина. 8 (343): 343ra81. Дои:10.1126/scitranslmed.aad0917. ЧВК 5032909. PMID 27306663.
- ^ а б c d е ж Ван, Ян; Kasper, Lloyd H (2014). "The role of microbiome in central nervous system disorders". Мозг, поведение и иммунитет. 38: 1–12. Дои:10.1016/j.bbi.2013.12.015. ЧВК 4062078. PMID 24370461.
- ^ а б Yoon, My Young; Lee, Keehoon; Yoon, Sang Sun (2014). "Protective role of gut commensal microbes against intestinal infections". Журнал микробиологии. 52 (12): 983–9. Дои:10.1007/s12275-014-4655-2. PMID 25467115. S2CID 54622675.
- ^ Reinoso Webb, Cynthia; Koboziev, Iurii; Furr, Kathryn L; Grisham, Matthew B (2016). "Protective and pro-inflammatory roles of intestinal bacteria". Патофизиология. 23 (2): 67–80. Дои:10.1016/j.pathophys.2016.02.002. ЧВК 4867289. PMID 26947707.
- ^ Mantis, N J; Rol, N; Corthésy, B (2011). "Secretory IgA's complex roles in immunity and mucosal homeostasis in the gut". Иммунология слизистой оболочки. 4 (6): 603–11. Дои:10.1038/mi.2011.41. ЧВК 3774538. PMID 21975936.
- ^ а б Peterson, Lance W; Artis, David (2014). "Intestinal epithelial cells: Regulators of barrier function and immune homeostasis". Nature Reviews Иммунология. 14 (3): 141–53. Дои:10.1038/nri3608. PMID 24566914. S2CID 3351351.
- ^ а б Honda, Kenya; Littman, Dan R (2016). "The microbiota in adaptive immune homeostasis and disease". Природа. 535 (7610): 75–84. Bibcode:2016Natur.535...75H. Дои:10.1038/nature18848. PMID 27383982. S2CID 4461492.
- ^ а б Леви, М .; Thaiss, C.A.; Elinav, E. (2016). "Metabolites: messengers between the microbiota and the immune system". Гены и развитие. 30 (14): 1589–97. Дои:10.1101/gad.284091.116. ЧВК 4973288. PMID 27474437.
- ^ а б c d е ж грамм час я Zhang LS, Davies SS (April 2016). "Microbial metabolism of dietary components to bioactive metabolites: opportunities for new therapeutic interventions". Genome Med. 8 (1): 46. Дои:10.1186/s13073-016-0296-x. ЧВК 4840492. PMID 27102537.
Лактобациллы виды convert tryptophan to indole-3-aldehyde (I3A) through unidentified enzymes [125]. Clostridium sporogenes convert tryptophan to IPA [6], likely via a tryptophan deaminase. ... IPA also potently scavenges hydroxyl radicals
Table 2: Microbial metabolites: their synthesis, mechanisms of action, and effects on health and disease
Figure 1: Molecular mechanisms of action of indole and its metabolites on host physiology and disease - ^ Wikoff WR, Anfora AT, Liu J, Schultz PG, Lesley SA, Peters EC, Сюздак Г (Март 2009 г.). "Metabolomics analysis reveals large effects of gut microflora on mammalian blood metabolites". Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 106 (10): 3698–3703. Дои:10.1073/pnas.0812874106. ЧВК 2656143. PMID 19234110.
Production of IPA was shown to be completely dependent on the presence of gut microflora and could be established by colonization with the bacterium Clostridium sporogenes.
IPA metabolism diagram - ^ "3-Indolepropionic acid". Human Metabolome Database. Университет Альберты. Получено 12 июн 2018.
Indole-3-propionate (IPA), a deamination product of tryptophan formed by symbiotic bacteria in the gastrointestinal tract of mammals and birds. 3-Indolepropionic acid has been shown to prevent oxidative stress and death of primary neurons and neuroblastoma cells exposed to the amyloid beta-protein in the form of amyloid fibrils, one of the most prominent neuropathologic features of Alzheimer's disease. 3-Indolepropionic acid also shows a strong level of neuroprotection in two other paradigms of oxidative stress. (PMID 10419516 ) ... More recently it has been found that higher indole-3-propionic acid levels in serum/plasma are associated with reduced likelihood of type 2 diabetes and with higher levels of consumption of fiber-rich foods (PMID 28397877 )
Origin: • Endogenous • Microbial - ^ Chyan YJ, Poeggeler B, Omar RA, Chain DG, Frangione B, Ghiso J, Pappolla MA (July 1999). "Potent neuroprotective properties against the Alzheimer beta-amyloid by an endogenous melatonin-related indole structure, indole-3-propionic acid". J. Biol. Chem. 274 (31): 21937–21942. Дои:10.1074/jbc.274.31.21937. PMID 10419516.
[Indole-3-propionic acid (IPA)] has previously been identified in the plasma and cerebrospinal fluid of humans, but its functions are not known. ... In kinetic competition experiments using free radical-trapping agents, the capacity of IPA to scavenge hydroxyl radicals exceeded that of melatonin, an indoleamine considered to be the most potent naturally occurring scavenger of free radicals. In contrast with other antioxidants, IPA was not converted to reactive intermediates with pro-oxidant activity.
- ^ Rajilić-Stojanović, Mirjana; De Vos, Willem M (2014). «Первые 1000 культивируемых видов микробиоты желудочно-кишечного тракта человека». Обзор микробиологии FEMS. 38 (5): 996–1047. Дои:10.1111/1574-6976.12075. ЧВК 4262072. PMID 24861948.
- ^ Hill, M. J. (March 1997). "Intestinal flora and endogenous vitamin synthesis". European journal of cancer prevention: the official journal of the European Cancer Prevention Organisation (ECP). 6 Suppl 1: S43–45. Дои:10.1097/00008469-199703001-00009. ISSN 0959-8278. PMID 9167138.
- ^ "The Microbiome". Пучки сейчас. 2013-09-17. Получено 2020-12-09.
- ^ а б c d е ElRakaiby M, Dutilh BE, Rizkallah MR, Boleij A, Cole JN, Aziz RK (July 2014). "Pharmacomicrobiomics: the impact of human microbiome variations on systems pharmacology and personalized therapeutics". Омикс. 18 (7): 402–414. Дои:10.1089/omi.2014.0018. ЧВК 4086029. PMID 24785449.
The hundred trillion microbes and viruses residing in every human body, which outnumber human cells and contribute at least 100 times more genes than those encoded on the human genome (Ley et al., 2006), offer an immense accessory pool for inter-individual genetic variation that has been underestimated and largely unexplored (Savage, 1977; Medini et al., 2008; Minot et al., 2011; Wylie et al., 2012). ... Meanwhile, a wealth of literature has long been available about the biotransformation of xenobiotics, notably by gut bacteria (reviewed in Sousa et al., 2008; Rizkallah et al., 2010; Johnson et al., 2012; Haiser and Turnbaugh, 2013). This valuable information is predominantly about drug metabolism by unknown human-associated microbes; however, only a few cases of inter-individual microbiome variations have been documented [e.g., digoxin (Mathan et al., 1989) and acetaminophen (Clayton et al., 2009)].
- ^ а б c Cho I, Blaser MJ (March 2012). "The human microbiome: at the interface of health and disease". Обзоры природы. Генетика. 13 (4): 260–270. Дои:10.1038/nrg3182. ЧВК 3418802. PMID 22411464.
The composition of the microbiome varies by anatomical site (Figure 1). The primary determinant of community composition is anatomical location: interpersonal variation is substantial23,24 and is higher than the temporal variability seen at most sites in a single individual25. ... How does the microbiome affect the pharmacology of medications? Can we “micro-type” people to improve pharmacokinetics and/or reduce toxicity? Can we manipulate the microbiome to improve pharmacokinetic stability?
- ^ Hutter T, Gimbert C, Bouchard F, Lapointe FJ (2015). "Being human is a gut feeling". Микробиом. 3: 9. Дои:10.1186/s40168-015-0076-7. ЧВК 4359430. PMID 25774294.
Some metagenomic studies have suggested that less than 10% of the cells that comprise our bodies are Homo sapiens cells. The remaining 90% are bacterial cells. The description of this so-called human microbiome is of great interest and importance for several reasons. For one, it helps us redefine what a biological individual is. We suggest that a human individual is now best described as a super-individual in which a large number of different species (including Homo sapiens) coexist.
- ^ Kumar K, Dhoke GV, Sharma AK, Jaiswal SK, Sharma VK (January 2019). "Mechanistic elucidation of amphetamine metabolism by tyramine oxidase from human gut microbiota using molecular dynamics simulations". Журнал клеточной биохимии. 120 (7): 11206–11215. Дои:10.1002/jcb.28396. PMID 30701587. S2CID 73413138.
Particularly in the case of the human gut, which harbors a large diversity of bacterial species, the differences in microbial composition can significantly alter the metabolic activity in the gut lumen.4 Различная метаболическая активность из-за различий в видах кишечных микробов недавно была связана с различными метаболическими нарушениями и заболеваниями.5-12 Помимо влияния микробного разнообразия кишечника или дисбактериоза на различные заболевания человека, появляется все больше доказательств того, что кишечные микробы могут влиять на биодоступность и эффективность различных молекул лекарств, вводимых перорально, посредством беспорядочного ферментативного метаболизма.13,14 ... Настоящее исследование атомистических деталей связывания амфетамина и аффинности связывания с тираминоксидазой, а также сравнение с двумя природными субстратами этого фермента, а именно тирамином и фенилаланином, предоставляет убедительные доказательства беспорядочного метаболизма амфетамина тираминоксидазой. фермент кишечной палочки. Полученные результаты будут иметь решающее значение при разработке суррогатной молекулы амфетамина, которая может помочь либо в повышении эффективности и биодоступности амфетаминового препарата посредством конкурентного ингибирования, либо в изменении конструкции препарата для улучшения фармакологических эффектов. Это исследование также будет иметь полезные клинические последствия в снижении микробиоты кишечника, вызванной вариабельностью реакции на лекарства среди разных групп населения.
- ^ Соуза, Тьяго; Патерсон, Ронни; Мур, Ванесса; Карлссон, Андерс; Абрахамссон, Бертил; Басит, Абдул В. (2008). «Микробиота желудочно-кишечного тракта как место биотрансформации лекарств». Международный журнал фармацевтики. 363 (1–2): 1–25. Дои:10.1016 / j.ijpharm.2008.07.009. PMID 18682282.
- ^ Haiser, H.J; Гутенберг, Д. Б.; Чатман, К; Sirasani, G; Бальскус, Э. П; Тернбо, П. Дж (2013). «Прогнозирование и управление инактивацией сердечных лекарств кишечной бактерией человека Eggerthella lenta». Наука. 341 (6143): 295–8. Bibcode:2013Наука ... 341..295H. Дои:10.1126 / science.1235872. ЧВК 3736355. PMID 23869020.
- ^ Майер, Э. А; Рыцарь, R; Мазманян, С.К .; Cryan, J. F; Тиллиш, К. (2014). «Кишечные микробы и мозг: смена парадигмы в нейробиологии». Журнал неврологии. 34 (46): 15490–6. Дои:10.1523 / JNEUROSCI.3299-14.2014. ЧВК 4228144. PMID 25392516.
- ^ а б c Динан, Тимоти Г; Крайан, Джон Ф (2015). «Влияние микробиоты кишечника на мозг и поведение». Текущее мнение о клиническом питании и метаболическом лечении. 18 (6): 552–8. Дои:10.1097 / MCO.0000000000000221. PMID 26372511. S2CID 21424690.
- ^ а б c Карман, Роберт Дж .; Саймон, Мэри Элис; Фернандес, Хайде; Миллер, Маргарет А .; Варфоломей, Мэри Дж. (2004). «Ципрофлоксацин в низких дозах нарушает устойчивость к колонизации фекальной микрофлоры человека, растущей в хемостатах». Нормативная токсикология и фармакология. 40 (3): 319–26. Дои:10.1016 / j.yrtph.2004.08.005. PMID 15546686.
- ^ Брандт, Лоуренс Дж .; Бороды, Томас Юлиус; Кэмпбелл, Джордана (2011). «Эндоскопическая трансплантация фекальной микробиоты». Журнал клинической гастроэнтерологии. 45 (8): 655–57. Дои:10.1097 / MCG.0b013e3182257d4f. PMID 21716124.
- ^ Рыцарь, DJW; Гирлинг, KJ (2003). «Флора кишечника в здоровье и болезни». Ланцет. 361 (9371): 512–19. Дои:10.1016 / S0140-6736 (03) 13438-1. PMID 12781578. S2CID 40683723.
- ^ а б c Чо, И .; Yamanishi, S .; Cox, L .; Methé, B.A .; Zavadil, J .; Ли, К .; Gao, Z .; Mahana, D .; Raju, K .; Тейтлер, I .; Li, H .; Алексеенко, А. В .; Блазер, М. Дж. (2012). «Антибиотики в раннем возрасте изменяют микробиом толстой кишки и ожирение мышей». Природа. 488 (7413): 621–26. Bibcode:2012Натура.488..621C. Дои:10.1038 / природа11400. ЧВК 3553221. PMID 22914093.
- ^ а б c d Schneiderhan, J; Мастер-Охотник, Т; Локк, А (2016). «Ориентация на кишечную флору для лечения и профилактики заболеваний». Журнал семейной практики. 65 (1): 34–8. PMID 26845162.
- ^ Бейкер, Моня (2012). «Беременность изменяет резидентные микробы кишечника». Природа. Дои:10.1038 / природа.2012.11118. S2CID 87078157.
- ^ Хилл, Колин; Гварнер, Франсиско; Рид, Грегор; Гибсон, Гленн Р.; Меренштейн, Даниэль Дж; Горшок, Бруно; Морелли, Лоренцо; Канани, Роберто Берни; Флинт, Гарри Дж; Салминен, Сеппо; Колдер, Филип С; Сандерс, Мэри Эллен (2014). «Консенсусное заявление Международной научной ассоциации пробиотиков и пребиотиков относительно области применения и надлежащего использования термина пробиотик». Nature Reviews Гастроэнтерология и гепатология. 11 (8): 506–14. Дои:10.1038 / nrgastro.2014.66. PMID 24912386.
- ^ Райкерс, Гер Т.; Де Вос, Виллем М.; Брюммер, Роберт-Ян; Морелли, Лоренцо; Кортье, Жерар; Марто, Филипп (2011). «Польза для здоровья и утверждения пробиотиков: связь науки и маркетинга». Британский журнал питания. 106 (9): 1291–6. Дои:10.1017 / S000711451100287X. PMID 21861940.
- ^ Хаткинс, Роберт В. Крамбек, Янина А; Биндельс, Лауре Б; Кани, Патрис Д.; Фэйи, Джордж; Го, Йонг Джун; Хамакер, Брюс; Мартенс, Эрик С; Миллс, Дэвид А; Растал, Роберт А; Воан, Элейн; Сандерс, Мэри Эллен (2016). «Пребиотики: почему важны определения». Текущее мнение в области биотехнологии. 37: 1–7. Дои:10.1016 / j.copbio.2015.09.001. ЧВК 4744122. PMID 26431716.
- ^ Пандей, Кавита. Р; Наик, Суреш. Р; Вакиль, Бабу. V (2015). «Пробиотики, пребиотики и синбиотики - обзор». Журнал пищевой науки и технологий. 52 (12): 7577–87. Дои:10.1007 / s13197-015-1921-1. ЧВК 4648921. PMID 26604335.
- ^ Брэкс, Жеральдин; Ванденхёвель, Дитер; Клаас, Ингмар Дж.Дж .; Лебир, Сара; Кикенс, Филип (2016). «Методы сушки пробиотических бактерий как важный шаг к разработке новых фармабиотиков». Международный журнал фармацевтики. 505 (1–2): 303–18. Дои:10.1016 / j.ijpharm.2016.04.002. HDL:10067/1328840151162165141. PMID 27050865.
- ^ Слейтор, Рой Д.; Хилл, Колин (2009). «Рациональный дизайн улучшенных фармабиотиков». Журнал биомедицины и биотехнологии. 2009: 275287. Дои:10.1155/2009/275287. ЧВК 2742647. PMID 19753318.
- ^ Паттерсон, Элейн; Крайан, Джон Ф; Фитцджеральд, Джеральд Ф; Росс, Р. Пол; Динан, Тимоти Г; Стэнтон, Кэтрин (2014). «Микробиота кишечника, производимые ими фармакологические препараты и здоровье». Труды Общества питания. 73 (4): 477–89. Дои:10.1017 / S0029665114001426. PMID 25196939.
- ^ Форд, Александр С; Куигли, Имонн М. М.; Лейси, Брайан Э; Лембо, Энтони Дж; Сайто, Юрий А; Шиллер, Лоуренс R; Соффер, Эди Э; Шпигель, Бреннан М. Р.; Моайеди, Пол (2014). «Эффективность пребиотиков, пробиотиков и синбиотиков при синдроме раздраженного кишечника и хронических идиопатических запорах: систематический обзор и метаанализ». Американский журнал гастроэнтерологии. 109 (10): 1547–61, викторина 1546, 1562. Дои:10.1038 / ajg.2014.202. PMID 25070051. S2CID 205100508.
- ^ Дюпон, Эндрю; Ричардс; Елинек, Кэтрин А; Крил, Джозеф; Рахими, Эрик; Гури, Йезаз (2014). «Систематический обзор рандомизированных контролируемых исследований пробиотиков, пребиотиков и синбиотиков при воспалительном заболевании кишечника». Клиническая и экспериментальная гастроэнтерология. 7: 473–87. Дои:10.2147 / CEG.S27530. ЧВК 4266241. PMID 25525379.
- ^ Ю, Чэн Гун; Хуан, Цинь (2013). «Недавние успехи в изучении роли кишечной микробиоты в патогенезе воспалительных заболеваний кишечника». Журнал болезней органов пищеварения. 14 (10): 513–7. Дои:10.1111/1751-2980.12087. PMID 23848393. S2CID 26982085.
- ^ Майер, Лиза; Прутяну, Михаэла; Кун, Майкл; Целлер, Георг; Тельцеров, Аня; Андерсон, Эксин Эрин; Брочадо, Ана Рита; Фернандес, Кейт Конрад; Доза, Хитоми; Мори, Хиротада; Патил, Киран Раосахеб; Борк, Пер; Типас, Афанасий (2018). «Обширное влияние неантибиотических препаратов на кишечные бактерии человека». Природа. 555 (7698): 623–628. Bibcode:2018Натура.555..623M. Дои:10.1038 / природа25979. ЧВК 6108420. PMID 29555994.
- ^ а б Камбой, АК; Коттер, Т.Г .; Оксентенко, А.С. (2017). «Helicobacter pylori: прошлое, настоящее и будущее в управлении». Труды клиники Мэйо. 92 (4): 599–604. Дои:10.1016 / j.mayocp.2016.11.017. ISSN 0025-6196. PMID 28209367.
- ^ а б c «Язвенная болезнь» (PDF). Медицинский факультет Университета Джонса Хопкинса. 2013. Получено 21 октября 2020.
- ^ Буриш, Йохан; Джесс, Тайн; Мартинато, Маттео; Лакатос, Питер L (2013). «Бремя воспалительных заболеваний кишечника в Европе». Журнал болезни Крона и колита. 7 (4): 322–37. Дои:10.1016 / j.crohns.2013.01.010. PMID 23395397.
- ^ Бландино, G; Inturri, R; Lazzara, F; Di Rosa, M; Малагуарнера, Л. (2016). «Влияние микробиоты кишечника на сахарный диабет». Диабет и метаболизм. 42 (5): 303–315. Дои:10.1016 / j.diabet.2016.04.004. PMID 27179626.
- ^ а б c Boulangé, Claire L; Невес, Ана Луиза; Шиллу, Жюльен; Николсон, Джереми К.; Дюма, Марк-Эммануэль (2016). «Влияние микробиоты кишечника на воспаление, ожирение и нарушение обмена веществ». Геномная медицина. 8 (1): 42. Дои:10.1186 / s13073-016-0303-2. ЧВК 4839080. PMID 27098727.
- ^ Спиллер, Робин (2016). «Синдром раздраженного кишечника: новый взгляд на механизмы симптомов и достижения в лечении». F1000 Исследования. 5: 780. Дои:10.12688 / f1000research.7992.1. ЧВК 4856111. PMID 27158477.
- ^ а б c Арриета, Мария-Клэр; Stiemsma, Leah T; Димитриу, Педро А; Торсон, Лиза; Рассел, Шеннон; Юрист-Дауч, Софи; Кузельевич, Борис; Голд, Мэтью Дж; Бриттон, Хайди М; Лефевр, Диана Л; Суббарао, Падмаджа; Мандхане, Пиуш; Беккер, Аллан; МакНэгни, Келли М; Sears, Malcolm R; Коллманн, Тобиас; Мон, Уильям В; Турви, Стюарт Э; Бретт Финли, Б. (2015). «Микробные и метаболические изменения в раннем младенчестве влияют на риск детской астмы». Научная трансляционная медицина. 7 (307): 307ra152. Дои:10.1126 / scitranslmed.aab2271. PMID 26424567. S2CID 206687974.
- ^ а б Stiemsma, Leah T; Турви, Стюарт Э (2017). «Астма и микробиом: определение критического окна в раннем возрасте». Аллергия, астма и клиническая иммунология. 13: 3. Дои:10.1186 / s13223-016-0173-6. ЧВК 5217603. PMID 28077947.
- ^ Ипчи, Каган; Алтынтопрак, Ниязи; Мулук, Нурай Баяр; Сентурк, Мехмет; Чинги, Джемаль (2016). «Возможные механизмы микробиома человека при аллергических заболеваниях». Европейский архив оторино-ларингологии. 274 (2): 617–626. Дои:10.1007 / s00405-016-4058-6. PMID 27115907. S2CID 27328940.
- ^ Мариньо, Э., Ричардс, Дж. Л., Маклеод, К. Х., Стэнли, Д., Яп, Ю. А., Найт, Дж., Маккензи, К., Кранич, Дж., Оливейра, А. С., Росселло, Ф. Дж., Кришнамурти, Б., Нефзгер, С.М., Масиа, Л., Торберн, А., Бакстер, А.Г., Морахан, Г., Вонг, Л.Х., Поло, Дж. М., Мур, Р. Дж.,… Маккей, К. Р. (2017). Метаболиты кишечных микробов ограничивают частоту аутоиммунных Т-клеток и защищают от диабета 1 типа. Иммунология природы, 18 (5), 552–562. https://doi.org/10.1038/ni.3713
- ^ Bettelli E, Carrier Y, Gao W., Korn T., Strom TB, Oukka M, Weiner HL, Kuchroo VK (май 2006 г.). «Взаимные пути развития для генерации патогенных эффекторных TH17 и регуляторных Т-клеток». Природа. 441 (7090): 235–8. Bibcode: 2006Natur.441..235B. Дои: 10.1038 / природа04753. PMID 16648838.
- ^ а б ЗЕМАНН, М. Д., БЁМИГ, Г. А., ЭСТЕРРАЙХЕР, К. Х., БЕРТШЕР, Х., ПАРОЛИНИ, О., ДИАКОС, К., ШТЁКЛЬ, Дж., ХЁРЛЬ, В. Х., & ЗЛАБИНГЕР, Г. Дж. (2000). Противовоспалительное действие бутирата натрия на моноциты человека: сильное ингибирование IL-12 и усиление выработки IL-10. Журнал FASEB, 14 (15), 2380–2382. https://doi.org/10.1096/fj.00-0359fje
- ^ Гао, Z; Инь, Дж; Чжан, Дж; Ward, R.E; Мартин, Р. Дж; Лефевр, М; Чефалу, В. Т; Йе, Дж (2009). «Бутират улучшает чувствительность к инсулину и увеличивает расход энергии у мышей». Сахарный диабет. 58 (7): 1509–17. Дои:10.2337 / db08-1637. ЧВК 2699871. PMID 19366864.
- ^ Мазиди, Мохсен; Резаи, Пейман; Kengne, Андре Паскаль; Мобархан, Маджид Гайур; Папоротники, Гордон А (2016). «Микробиом кишечника и метаболический синдром». Диабет и метаболический синдром: клинические исследования и обзоры. 10 (2): S150–7. Дои:10.1016 / j.dsx.2016.01.024. PMID 26916014.
- ^ Чен, Сяо; д'Суза, Рошан; Хонг, Сон-Тшул (2013). «Роль микробиоты кишечника в оси кишечник-мозг: текущие проблемы и перспективы». Белки и клетки. 4 (6): 403–14. Дои:10.1007 / s13238-013-3017-х. ЧВК 4875553. PMID 23686721.
- ^ а б Минемура, Масами (2015). «Микробиота кишечника и заболевания печени». Всемирный журнал гастроэнтерологии. 21 (6): 1691–702. Дои:10.3748 / wjg.v21.i6.1691. ЧВК 4323444. PMID 25684933.
- ^ Синь Николай Л; Teng, Michele W L; Мок, Тони С. К.; Су, Росс А. (2017). «De-novo и приобретенная устойчивость к нацеливанию на иммунные контрольные точки». Ланцет онкологии. 18 (12): e731–41. Дои:10.1016 / с1470-2045 (17) 30607-1. PMID 29208439.
- ^ а б Moeller, Andrew H .; Ли, Иньин; Нголе, Эйтель Мпуди; Ахука-Мундеке, Стив; Lonsdorf, Elizabeth V .; Pusey, Anne E .; Петерс, Мартина; Hahn, Beatrice H .; Охман, Ховард (18 ноября 2014 г.). «Быстрые изменения микробиома кишечника в процессе эволюции человека». Труды Национальной академии наук. 111 (46): 16431–16435. Bibcode:2014ПНАС..11116431М. Дои:10.1073 / pnas.1419136111. ISSN 0027-8424. ЧВК 4246287. PMID 25368157.
- ^ Engel, P .; Моран, Н. (2013). «Микробиота кишечника насекомых - разнообразие строения и функций». Обзор микробиологии FEMS. 37 (5): 699–735. Дои:10.1111/1574-6976.12025. PMID 23692388.
- ^ Брюн, А. (2014). «Симбиотическое переваривание лигноцеллюлозы в кишечнике термитов». Обзоры природы Микробиология. 12 (3): 168–80. Дои:10.1038 / nrmicro3182. PMID 24487819. S2CID 5220210.
- ^ а б Дитрих, С .; Köhler, T .; Брюн, А. (2014). «Тараканьи происхождение микробиоты кишечника термитов: закономерности в структуре бактериального сообщества отражают основные эволюционные события». Прикладная и экологическая микробиология. 80 (7): 2261–69. Дои:10.1128 / AEM.04206-13. ЧВК 3993134. PMID 24487532.
- ^ а б Микаелян, А .; Дитрих, С .; Köhler, T .; Poulsen, M .; Силлам-Дюссес, Д .; Брюн, А. (2015). «Диета является основным фактором, определяющим структуру бактериального сообщества в кишечнике высших термитов». Молекулярная экология. 24 (20): 5824–95. Дои:10.1111 / mec.13376. PMID 26348261. S2CID 206182668.
- ^ Микаелян, А .; Thompson, C .; Hofer, M .; Брюн, А. (2016). «Детерминированная сборка сложных бактериальных сообществ в кишечнике тараканов без микробов». Прикладная и экологическая микробиология. 82 (4): 1256–63. Дои:10.1128 / AEM.03700-15. ЧВК 4751828. PMID 26655763.
дальнейшее чтение
- Обзорные статьи
- Марандуба, Карлуш Маньо да Кошта; Де Кастро, Сандра Бертелли Рибейро; Соуза, Густаво Торрес де; Россато, Криштиану; Да Гиа, Франсиско Карлос; Валенте, Мария Анете Сантана; Ретторе, Жоао Витор Паес; Марандуба, Клаудинейя Перейра; Соуза, Камила Морманн де; Карму, Антониу Марсиу Ресенде ду; МакЭдо, Гилсон Коста; Сильва, Фернандо де Са (2015). «Кишечная микробиота как модуляторы иммунной системы и нейроиммунной системы: влияние на здоровье хозяина и гомеостаз». Журнал иммунологических исследований. 2015: 931574. Дои:10.1155/2015/931574. ЧВК 4352473. PMID 25759850.
- Де Претер, Вики; Hamer, Henrike M; Уинди, Карен; Вербеке, Кристин (2011). «Влияние пре- и / или пробиотиков на метаболизм толстой кишки человека: влияет ли это на здоровье человека?». Молекулярное питание и пищевые исследования. 55 (1): 46–57. Дои:10.1002 / mnfr.201000451. PMID 21207512.
- Пракаш, Сатья; Родес, Летиция; Кусса-Чарли, Майкл; Томаро-Дюшено, Катерина; Томаро-Дюшено, Екатерина; Кусса-Чарли; Родес (2011). «Микробиота кишечника: новый рубеж в понимании здоровья человека и разработке биотерапевтических средств». Биологические препараты: цели и терапия. 5: 71–86. Дои:10.2147 / BTT.S19099. ЧВК 3156250. PMID 21847343.
- Wu, G.D .; Chen, J .; Hoffmann, C .; Биттингер, К .; Chen, Y.-Y .; Keilbaugh, S.A .; Bewtra, M .; Рыцари, Д .; Walters, W. A .; Knight, R .; Sinha, R .; Gilroy, E .; Gupta, K .; Baldassano, R .; Nessel, L .; Li, H .; Бушман, Ф. Д .; Льюис, Дж. Д. (2011). «Связь долгосрочных диетических моделей с кишечными микробными энтеротипами». Наука. 334 (6052): 105–08. Bibcode:2011Sci ... 334..105W. Дои:10.1126 / science.1208344. ЧВК 3368382. PMID 21885731.