Аллель-специфический олигонуклеотид - Allele-specific oligonucleotide
An аллель-специфический олигонуклеотид (ASO) представляет собой короткий кусок синтетического ДНК комплементарен последовательности вариабельной целевой ДНК. Он действует как зонд на наличие цели в Саузерн-блот проба или, чаще, в более простом Точечный блот проба. Это обычный инструмент, используемый в генетическое тестирование, криминалистика, и Молекулярная биология исследование.
ASO обычно олигонуклеотид из 15–21 нуклеотидные основания в длину. Он разработан (и используется) таким образом, что делает его специфичным только для одной версии, или аллель, тестируемой ДНК. Длина ASO, из какой нити она выбрана, и условия, при которых она привязан к (и отмытые) ДНК-мишени все играют роль в ее специфичности. Эти зонды обычно могут быть разработаны для обнаружения различий всего в 1 основание в генетической последовательности мишени, что является основной способностью при анализе однонуклеотидные полиморфизмы (SNP), важные в анализ генотипа и Проект "Геном человека". Чтобы быть обнаруженным после того, как он привязался к своей мишени, ASO должен быть помечен радиоактивной, ферментативной или флуоресцентной меткой. В Анализ метилирования Illumina технология использует преимущества ASO для обнаружения разницы в одной паре оснований (цитозин по сравнению с тимином) для измерения метилирования в определенном сайте CpG.
Пример
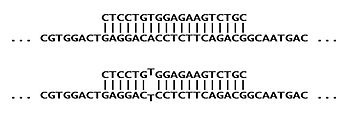
Болезнь человека серповидноклеточная анемия вызвано генетическим мутация в кодон на шестой аминокислота белка крови бета-гемоглобин. Нормальная последовательность ДНК G-A-G кодирует аминокислоту глутамат, а мутация меняет середину аденин к тимин, что приводит к последовательности G-T-G (G-U-G в мРНК ). Эта измененная последовательность заменяет валин в конечный белок, искажая его структуру.
Чтобы проверить наличие мутации в образце ДНК, зонд ASO должен быть синтезирован, чтобы быть комплементарным измененной последовательности,[1] здесь обозначено как "S". В качестве контроля другой ASO будет синтезирован для нормальной последовательности «A». Каждый ASO полностью комплементарен своей целевой последовательности (и будет сильно связываться), но имеет одно несоответствие со своим нецелевым аллелем (что приводит к более слабому взаимодействию). На первой диаграмме показано, как зонд «S» полностью дополняет цель «S» (вверху), но частично не соответствует цели «A» (внизу).
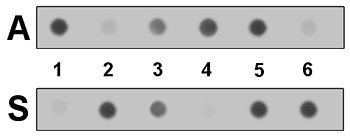
Сегмент генов бета-гемоглобина в образце (ах) ДНК будет амплифицирован с помощью ПЦР, и полученные продукты будут применяться для дублирования поддерживающих мембран в качестве Точечные пятна. Нити ДНК образца разделяются щелочью, и каждый зонд ASO наносится на отдельный блот. После гибридизации используется протокол промывки, который позволяет различать полностью комплементарные и несовместимые гибриды. Несоответствующие ASO смываются с блотов, в то время как согласованные ASO (и их метки) остаются.
На второй диаграмме шесть образцов амплифицированной ДНК были нанесены на каждый из двух блотов. Обнаружение этикетки ASO, оставшейся после стирки, позволяет непосредственно считывать генотип образцов, каждый с двумя копиями гена бета-гемоглобина. Образцы 1 и 4 имеют только нормальный аллель «A», тогда как образцы 3 и 5 имеют аллели «A» и «S» (и поэтому гетерозиготный перевозчики этого рецессивная мутация ). Образцы 2 и 6 имеют только аллель «S» и будут поражены этим заболеванием. Показанная небольшая степень «перекрестной гибридизации» является типичной и учитывается в процессе интерпретации окончательных результатов.
Альтернативы
ASO-анализ - это лишь один из методов, используемых для выявления генетических полиморфизмов. Прямой Секвенирование ДНК используется для первоначальной характеристики мутации, но слишком трудоемок для рутинного скрининга. Более ранний метод, Полиморфизма длин рестрикционных фрагментов (RFLP) не нужно было заранее знать изменение последовательности, но требовалось, чтобы мутация влияла на сайт расщепления Рестрикционный фермент. Анализ RFLP был кратко адаптирован для использования олигонуклеотидов. зонды,[2] но этот метод был быстро вытеснен анализом ASO полимеразной цепной реакции (ПЦР) амплифицированная ДНК. Сама методика ПЦР была адаптирована для обнаружения полиморфизмов, так как аллель-специфическая ПЦР. Однако простота и универсальность комбинированного метода ПЦР / ASO привела к его постоянному использованию, в том числе с нерадиоактивными метками, и в формате «обратного дот-блоттинга», где зонды ASO связаны с мембраной и амплифицированным образцом ДНК. используется для гибридизация.
История
Использование синтетических олигонуклеотидов в качестве специфических зондов для вариаций генетической последовательности было впервые предложено Р. Брюсом Уоллесом, работающим в Национальный медицинский центр "Город надежды" в Дуарте, Калифорния. В 1979 году Уоллес и его коллеги сообщили об использовании зондов ASO для обнаружения разновидностей одноцепочечного бактериального вируса,[3] и позже применил эту технику к клонированным человеческим генам. В 1983 г.[4] и 1985[1] Лаборатория Уоллеса сообщила об обнаружении мутации для серповидноклеточная анемия в образцах цельной геномной ДНК, хотя этому применению мешало небольшое количество метки, которую мог переносить ASO.[1]
К счастью, в 1985 году также было сообщено о ПЦР, методе значительной амплификации определенного сегмента ДНК.[2] Менее чем через год ПЦР была соединена с анализом ASO.[5] Эта комбинация решила проблему маркировки ASO, поскольку количество целевой ДНК можно было амплифицировать более чем в миллион раз. Кроме того, специфичность самого процесса ПЦР может быть добавлена к специфичности ASO-зондов, что значительно снижает проблему ложного связывания ASO с нецелевыми последовательностями. Комбинация была достаточно конкретной, чтобы ее можно было использовать в простом Точечный блот, избегая трудоемких и неэффективных Саузерн-блот метод.
Другое использование
ASO-PCR также может использоваться для обнаружения минимальная остаточная болезнь при раке крови, таком как множественная миелома.[6]
Рекомендации
- ^ а б c Студенки А.Б., Коннер Б.Дж., Импраим С.С., Теплитц Р.Л. и Уоллес Р.Б. «Дискриминация генов бета-A, бета-S и бета-C-глобина человека с использованием зондов для аллель-специфической гибридизации олигонуклеотидов». Am J Hum Genet об. 37 (1), стр. 42–51 (1985).
- ^ а б Сайки, РК; Scharf S; Faloona F; Муллис КБ; Рог GT; Erlich HA; Arnheim N (20 декабря 1985 г.). «Ферментативная амплификация геномных последовательностей бета-глобина и анализ сайтов рестрикции для диагностики серповидноклеточной анемии». Наука. 230 (4732): 1350–4. Bibcode:1985Научный ... 230.1350S. Дои:10.1126 / science.2999980. PMID 2999980. Архивировано из оригинал 19 декабря 2008 г.
- ^ Уоллес, РБ; Шаффер, Дж; Мерфи, РФ; Боннер, Дж; Hirose, T; Itakura, K (1979). «Гибридизация синтетических олигодезоксирибонуклеотидов с ДНК Phi-X 174: эффект несоответствия одной пары оснований». Исследования нуклеиновых кислот. 6 (11): 3543–3558. Дои:10.1093 / nar / 6.11.3543. ЧВК 327955. PMID 158748.
- ^ Коннер Б.Дж., Рейес А.А., Морин С., Итакура К., Теплиц Р.Л. и Уоллес Р.Б. «Обнаружение аллеля бета-S-глобина серповидных клеток путем гибридизации с синтетическими олигонуклеотидами». Proc Natl Acad Sci USA. т. 80 (1), стр. 278–282 (1983).
- ^ Сайки Р.К., Бугаван Т.Л., Хорн Г.Т., Маллис К.Б. и Эрлих Х.Э. "Анализ ферментативно амплифицированной ДНК бета-глобина и HLA-DQ с помощью аллель-специфичных олигонуклеотидных зондов" Nature vol. 324 (6093), стр. 163–166 (1986).
- ^ Каерс, Джо; Гардере, Лоран; Кортум, К. Мартин; О'Дуайер, Майкл Э .; van de Donk, Niels W.C.J .; Биндер, Маша; Долд, Сандра Мария; Гей, Франческа; Корре, Джилл; Бегин, Ив; Людвиг, Хайнц (ноябрь 2018 г.). «Рекомендации Европейской сети миеломы по инструментам для диагностики и мониторинга множественной миеломы: что использовать и когда». Haematologica. 103 (11): 1772–1784. Дои:10.3324 / haematol.2018.189159. ISSN 0390-6078. ЧВК 6278986. PMID 30171031.
