Мутация - Mutation
Эта статья может требовать уборка встретиться с Википедией стандарты качества. Конкретная проблема: Обрежьте раздел соматических мутаций, потому что подробности могут быть в собственной статье (Сентябрь 2020) (Узнайте, как и когда удалить этот шаблон сообщения) |
| Часть серия на |
| Генетика |
|---|
 |
| Ключевые компоненты |
| История и темы |
| Исследование |
| Персонализированная медицина |
| Персонализированная медицина |

В биология, а мутация это изменение в нуклеотидная последовательность из геном из организм, вирус, или же внехромосомная ДНК.[1] Вирусные геномы содержат либо ДНК или же РНК. Мутации возникают в результате ошибок во время ДНК или же вирусная репликация, митоз, или же мейоз или другие типы повреждать к ДНК (например, димеры пиримидина вызвано воздействием ультрафиолетовый излучение), который затем может быть исправлен с ошибками (особенно соединение концов, опосредованное микрогомологией[2]), вызвать ошибку при других формах ремонта,[3][4] или вызвать ошибку при репликации (транслезионный синтез ). Мутации также могут быть результатом вставка или же удаление сегментов ДНК за счет мобильные генетические элементы.[5][6][7]
Мутации могут вызывать или не вызывать заметные изменения в наблюдаемых характеристиках (фенотип ) организма. Мутации играют роль как в нормальных, так и в аномальных биологических процессах, включая: эволюция, рак, и развитие иммунная система, включая функциональное разнообразие. Мутация - главный источник всего генетическая вариация, предоставляя сырье, на которое могут действовать эволюционные силы, такие как естественный отбор.
Мутация может привести к множеству различных типов изменений в последовательностях. Мутации в гены не может иметь никакого эффекта, измените продукт гена, или препятствовать правильному или полному функционированию гена. Мутации также могут происходить в негенные регионы. Исследование 2007 г. генетические вариации между разными разновидность из Дрозофила предположил, что если мутация изменяет белок произведенный геном, результат, вероятно, будет вредным, примерно 70% аминокислота полиморфизмы которые имеют разрушительные эффекты, а остальные являются либо нейтральными, либо незначительно полезными.[8] Из-за разрушительного воздействия мутаций на гены у организмов есть такие механизмы, как Ремонт ДНК чтобы предотвратить или исправить мутации, вернув мутированную последовательность обратно в исходное состояние.[5]
Обзор
Мутации могут включать дублирование больших участков ДНК, обычно через генетическая рекомбинация.[9] Эти дупликации являются основным источником сырья для развития новых генов, причем каждый миллион лет в геномах животных дублируются десятки и сотни генов.[10] Большинство генов принадлежат более крупным генные семьи общей родословной, обнаруживаемой по их гомология последовательностей.[11] Новые гены производятся несколькими способами, обычно путем дупликации и мутации наследственного гена или путем рекомбинации частей разных генов для образования новых комбинаций с новыми функциями.[12][13]
Здесь, белковые домены действуют как модули, каждый из которых выполняет определенную и независимую функцию, которые могут быть смешаны вместе для получения генов, кодирующих новые белки с новыми свойствами.[14] Например, человек Глаз использует четыре гена для создания структур, воспринимающих свет: три гена для конусная ячейка или же цветовое зрение и один для стержневая ячейка или ночное видение; все четыре произошли от одного предкового гена.[15] Еще одно преимущество дублирования гена (или даже всего генома) заключается в том, что это увеличивает инженерная избыточность; это позволяет одному гену в паре приобретать новую функцию, в то время как другая копия выполняет исходную функцию.[16][17] Другие типы мутаций иногда создают новые гены из ранее некодирующая ДНК.[18][19]
Изменения в хромосома число может включать еще более крупные мутации, когда сегменты ДНК в хромосомах ломаются, а затем перестраиваются. Например, в Гоминины, две хромосомы слились, чтобы произвести человека хромосома 2; это слияние не произошло в родословная другого обезьяны, и они сохраняют эти отдельные хромосомы.[20] В эволюции наиболее важная роль таких хромосомных перестроек может заключаться в ускорении дивергенции популяции в новые виды снижая вероятность скрещивания популяций, тем самым сохраняя генетические различия между этими популяциями.[21]
Последовательности ДНК, которые могут перемещаться по геному, например транспозоны, составляют основную часть генетического материала растений и животных и, возможно, сыграли важную роль в эволюции геномов.[22] Например, более миллиона копий Последовательность Alu присутствуют в человеческий геном, и теперь эти последовательности задействованы для выполнения таких функций, как регулирование экспрессия гена.[23] Другой эффект этих мобильных последовательностей ДНК заключается в том, что, перемещаясь в пределах генома, они могут мутировать или удалять существующие гены и тем самым производить генетическое разнообразие.[6]
Несмертельные мутации накапливаются в Генофонд и увеличить количество генетических вариаций.[24] Обилие некоторых генетических изменений в генофонде можно уменьшить за счет естественный отбор, в то время как другие «более благоприятные» мутации могут накапливаться и приводить к адаптивным изменениям.

Например, бабочка может произвести потомство с новыми мутациями. Большинство этих мутаций не действуют; но можно изменить цвет одного из потомков бабочки, что делает его труднее (или легче) увидеть хищникам. Если это изменение цвета благоприятно, шансы этой бабочки выжить и произвести собственное потомство немного выше, и со временем количество бабочек с этой мутацией может составить больший процент популяции.
Нейтральные мутации определяются как мутации, эффекты которых не влияют на фитнес человека. Частота их появления со временем может увеличиваться из-за генетический дрейф. Считается, что подавляющее большинство мутаций не оказывает существенного влияния на приспособленность организма.[25][26] Кроме того, механизмы репарации ДНК способны исправить большинство изменений до того, как они станут постоянными мутациями, и у многих организмов есть механизмы для устранения в противном случае навсегда мутировавших. соматические клетки.
Полезные мутации могут улучшить репродуктивный успех.[27][28]
Причины
Четыре класса мутаций: (1) спонтанные мутации (молекулярный распад), (2) мутации из-за подверженного ошибкам обхода репликации естественное повреждение ДНК (также называемый предрасположенным к ошибкам синтезом транслезии), (3) ошибки, возникающие при репарации ДНК, и (4) индуцированные мутации, вызванные мутагены. Ученые также могут намеренно вводить мутант последовательности с помощью манипуляций с ДНК для научных экспериментов.
В одном исследовании 2017 года утверждалось, что 66% мутаций, вызывающих рак, являются случайными, 29% связаны с окружающей средой (исследованное население охватывает 69 стран) и 5% наследуются.[29]
В среднем люди передают своим детям 60 новых мутаций, но отцы передают больше мутаций в зависимости от их возраста, каждый год добавляя к ребенку две новые мутации.[30]
Спонтанная мутация
Спонтанные мутации происходят с ненулевой вероятностью даже в здоровой незагрязненной клетке. По оценкам, естественное окислительное повреждение ДНК происходит 10 000 раз на клетку в день у человека и 100 000 раз на клетку в день у человека. крысы.[31] Спонтанные мутации можно охарактеризовать специфическим изменением:[32]
- Таутомерия - База изменена путем изменения положения водород атом, изменяя структуру водородных связей этого основания, что приводит к неправильному базовая пара во время репликации.
- Депуринизация - потеря пурин основание (A или G) с образованием апуринового сайта (Сайт AP ).
- Дезаминирование – Гидролиз изменяет нормальную базу на нетипичную, содержащую кето группа вместо оригинала амин группа. Примеры включают C → U и A → HX (гипоксантин ), которые можно исправить с помощью механизмов репарации ДНК; и 5MeC (5-метилцитозин ) → T, который с меньшей вероятностью будет обнаружен как мутация, поскольку тимин нормальная основа ДНК.
- Ошибочное спаривание прядей со смещением - Денатурация новой нити из шаблона во время репликации с последующей ренатурацией в другом месте («сползание»). Это может привести к вставке или удалению.
- Проскальзывание репликации
Обход репликации, подверженной ошибкам
Появляется все больше свидетельств того, что большинство спонтанно возникающих мутаций происходит из-за подверженной ошибкам репликации (транслезионный синтез ) прошлое повреждение ДНК в матричной цепи. В мышей, большинство мутаций вызвано трансфузионным синтезом.[33] Точно так же в дрожжи, Kunz et al.[34] обнаружили, что более 60% спонтанных замен и делеций одиночных пар оснований были вызваны синтезом транслезии.
Ошибки, возникающие при восстановлении ДНК
Хотя естественные двухцепочечные разрывы происходят в ДНК с относительно низкой частотой, их восстановление часто вызывает мутации. Негомологичное соединение концов (NHEJ) - основной путь восстановления двухцепочечных разрывов. NHEJ предполагает удаление нескольких нуклеотиды чтобы позволить несколько неточное совмещение двух концов для повторного соединения с последующим добавлением нуклеотидов для заполнения пробелов. Как следствие, NHEJ часто вносит мутации.[35]

Индуцированная мутация
Индуцированные мутации - это изменения в гене после того, как он вступил в контакт с мутагенами и факторами окружающей среды.
Индуцированные мутации на молекулярном уровне могут быть вызваны:
- Химикаты
- Гидроксиламин
- Базовые аналоги (например., Бромдезоксиуридин (BrdU))
- Алкилирующие агенты (например., N-этил-N-нитрозомочевина (ЕНУ). Эти агенты могут мутировать как реплицирующуюся, так и не реплицирующуюся ДНК. Напротив, аналог основания может мутировать ДНК только тогда, когда аналог включен в репликацию ДНК. Каждый из этих классов химических мутагенов имеет определенные эффекты, которые затем приводят к переходы, трансверсии, или удаления.
- Агенты, образующие Аддукты ДНК (например., охратоксин А )[37]
- ДНК вставка агенты (например, этидиум бромид )
- Сшивающие агенты ДНК
- Окислительное повреждение
- Азотистая кислота преобразует аминогруппы на A и C в диазо группы, изменяя свои модели водородных связей, что приводит к неправильному спариванию оснований во время репликации.
- Радиация
- Ультрафиолетовый свет (УФ) (неионизирующее излучение ). Два нуклеотидных основания в ДНК -цитозин и тимин - наиболее уязвимы для излучения, которое может изменить их свойства. УФ-свет может вызвать соседние пиримидин оснований в цепи ДНК, чтобы стать ковалентно соединенными в димер пиримидина. УФ-излучение, особенно длинноволновое УФ-А, также может вызывать окислительное повреждение ДНК.[38]
- Ионизирующего излучения. Воздействие ионизирующего излучения, например гамма-излучение, может привести к мутации, что может привести к раку или смерти.
В то время как раньше предполагалось, что мутации происходят случайно или вызваны мутагенами, молекулярные механизмы мутаций были обнаружены у бактерий и по всему древу жизни. Как заявляет С. Розенберг: «Эти механизмы раскрывают картину строго регулируемого мутагенеза, который временно активируется стрессовыми реакциями и активируется, когда клетки / организмы плохо адаптируются к окружающей среде - при стрессе - потенциально ускоряющий адаптацию».[39] Поскольку они представляют собой самоиндуцированные мутагенные механизмы, которые увеличивают скорость адаптации организмов, их несколько раз называли механизмами адаптивного мутагенеза, и они включают SOS-ответ у бактерий,[40] эктопическая внутрихромосомная рекомбинация[41] и другие хромосомные события, такие как дупликации.[39]
Классификация типов
По влиянию на структуру
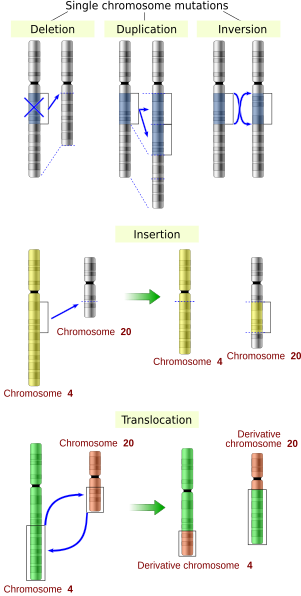
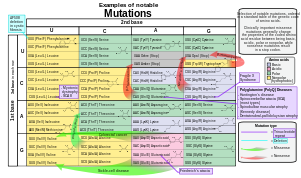
Последовательность гена можно изменить несколькими способами.[43] Генные мутации по-разному влияют на здоровье в зависимости от того, где они возникают и изменяют ли они функцию основных белков. Мутации в структуре генов можно разделить на несколько типов.
Масштабные мутации
Масштабные мутации в хромосомный В состав входят:
- Усиления (или дупликации генов ) или повторение хромосомного сегмента или наличие лишнего фрагмента хромосомного сломанного фрагмента хромосомы может быть прикреплено к гомологичной или негомологичной хромосоме, так что некоторые из генов присутствуют более чем в двух дозах, что приводит к множественным копиям всех хромосомные области, увеличивая дозировку находящихся в них генов.
- Делеции крупных хромосомных областей, приводящие к потере генов в этих областях.
- Мутации, результатом которых является сопоставление ранее отдельных фрагментов ДНК, потенциально объединяющих отдельные гены для образования функционально различных гены слияния (например., bcr-abl ).
- Масштабные изменения в структуре хромосомы называется хромосомная перестройка что может привести к ухудшению физической формы, но также к видообразование в изолированных, инбредных популяциях. К ним относятся:
- Хромосомные транслокации: обмен генетическими частями негомологичных хромосом.
- Хромосомные инверсии: изменение ориентации хромосомного сегмента.
- Негомологичный хромосомный кроссовер.
- Интерстициальные делеции: внутрихромосомная делеция, которая удаляет сегмент ДНК из одной хромосомы, тем самым накладывая ранее удаленные гены. Например, клетки, изолированные от человека астроцитома, тип опухоли головного мозга, как было обнаружено, имеет последовательности удаления хромосомных делеций между геном Fused in Glioblastoma (FIG) и рецепторной тирозинкиназой (ROS), продуцирующей слитый белок (FIG-ROS). Аномальный слитый белок FIG-ROS имеет конститутивно активную киназную активность, которая вызывает онкогенный трансформация (трансформация нормальных клеток в раковые).
- Утрата гетерозиготности: потеря одного аллель либо в результате делеции, либо в результате генетической рекомбинации в организме, который ранее имел два разных аллеля.
Мелкомасштабные мутации
Мелкомасштабные мутации влияют на ген в одном или нескольких нуклеотидах. (Если поражен только один нуклеотид, они называются точечные мутации.) Мелкомасштабные мутации включают:
- Вставки добавить в ДНК один или несколько дополнительных нуклеотидов. Обычно они вызваны сменные элементы, или ошибки при репликации повторяющихся элементов. Вставки в кодирующую область гена могут изменить сращивание из мРНК (мутация сайта сплайсинга ) или вызвать смещение рамка чтения (сдвиг рамки ), оба из которых могут значительно изменить генный продукт. Вставки могут быть отменены путем удаления подвижного элемента.
- Удаления удалить один или несколько нуклеотидов из ДНК. Подобно вставкам, эти мутации могут изменять рамку считывания гена. В общем, они необратимы: хотя одна и та же последовательность теоретически может быть восстановлена вставкой, мобильные элементы способны восстанавливать очень короткую делецию (скажем, 1-2 основания) в любой местоположение либо маловероятно, либо вообще не существует.
- Замещающие мутации, часто вызванные химическими веществами или нарушением репликации ДНК, заменяют один нуклеотид другим.[44] Эти изменения классифицируются как переходы или трансверсии.[45] Наиболее распространен переход, при котором пурин заменяется пурином (A ↔ G) или пиримидин для пиримидина (C ↔ T). Переход может быть вызван азотистой кислотой, ошибочным спариванием оснований или мутагенными аналогами оснований, такими как BrdU. Менее распространена трансверсия, при которой пурин заменяется пиримидином или пиримидином пурином (C / T ↔ A / G). Примером трансверсии является преобразование аденин (A) в цитозин (C). Точечные мутации - это модификации одной пары оснований ДНК или других небольших пар оснований в гене. Точечная мутация может быть обращена другой точечной мутацией, при которой нуклеотид возвращается в исходное состояние (истинная реверсия), или реверсией второго сайта (комплементарная мутация в другом месте, которая приводит к восстановлению функциональности гена). Как обсуждалось ниже, точечные мутации, происходящие в белке кодирующая область гена можно классифицировать как синоним или же несинонимичные замены, последние, в свою очередь, можно разделить на промах или же бессмысленные мутации.
По влиянию на последовательность белка

Влияние мутации на последовательность белка частично зависит от того, где в геноме она встречается, особенно от того, находится ли она в кодирование или же некодирующая область. Мутации в некодировании регуляторные последовательности гена, такие как промоторы, энхансеры и сайленсеры, могут изменять уровни экспрессии гена, но с меньшей вероятностью изменяют последовательность белка. Мутации внутри интроны и в регионах с неизвестной биологической функцией (например, псевдогены, ретротранспозоны ) обычно нейтральный, не влияя на фенотип - хотя мутации интронов могут изменять белковый продукт, если они влияют на сплайсинг мРНК.
Мутации, которые происходят в кодирующих областях генома, с большей вероятностью изменяют белковый продукт, и их можно классифицировать по их влиянию на аминокислотную последовательность:
- А мутация сдвига рамки вызывается вставкой или удалением ряда нуклеотидов, которые не делятся равномерно на три из последовательности ДНК. Из-за триплетной природы экспрессии генов по кодонам вставка или делеция может нарушить рамку считывания или группировку кодонов, что приведет к совершенно другому перевод с оригинала.[46] Чем раньше в последовательности происходит делеция или вставка, тем больше изменяется продуцируемый белок. (Например, код CCU GAC UAC CUA кодирует аминокислоты пролин, аспарагиновую кислоту, тирозин и лейцин. Если U в CCU был удален, результирующая последовательность была бы CCG ACU ACC UAx, которая вместо этого кодировала бы пролин, треонин, треонин и часть другой аминокислоты или, возможно, стоп-кодон (где x обозначает следующий нуклеотид).) Напротив, любая вставка или делеция, которая делится на три без остатка, называется внутрикадровая мутация.
- Мутация с точечной заменой приводит к изменению одного нуклеотида и может быть синонимичной или несинонимичной.
- А синонимичная замена заменяет кодон другим кодоном, который кодирует ту же аминокислоту, так что полученная аминокислотная последовательность не изменяется. Синонимичные мутации происходят из-за выродиться характер генетический код. Если эта мутация не приводит к каким-либо фенотипическим эффектам, ее называют тихий, но не все синонимичные замены молчат. (Также могут быть молчащие мутации в нуклеотидах вне кодирующих областей, таких как интроны, потому что точная нуклеотидная последовательность не так важна, как в кодирующих областях, но они не считаются синонимичными заменами.)
- А несинонимичная замена заменяет кодон другим кодоном, который кодирует другую аминокислоту, так что полученная аминокислотная последовательность модифицируется. Несинонимичные замены можно классифицировать как бессмысленные или миссенс-мутации:
- А миссенс-мутация изменяет нуклеотид, чтобы вызвать замену другой аминокислотой. Это, в свою очередь, может сделать полученный белок нефункциональным. Такие мутации ответственны за такие заболевания, как Буллезный эпидермолиз, серповидноклеточная анемия, и SOD1 -опосредованный ALS.[47] С другой стороны, если в кодоне аминокислоты возникает миссенс-мутация, которая приводит к использованию другой, но химически подобной аминокислоты, то иногда в белке не происходит никаких изменений или незначительные изменения. Например, изменение с AAA на AGA приведет к кодированию аргинин, химически подобная молекула предполагаемой лизин. В последнем случае мутация будет иметь незначительное влияние на фенотип или совсем не повлиять на него, и поэтому нейтральный.
- А бессмысленная мутация точечная мутация в последовательности ДНК, которая приводит к преждевременному стоп-кодону, или бессмысленный кодон в транскрибируемой мРНК и, возможно, в усеченном и часто нефункциональном белковом продукте. Этот вид мутации был связан с различными заболеваниями, такими как врожденная гиперплазия надпочечников. (Видеть Стоп-кодон.)
По влиянию на функцию
- Мутации с потерей функции, также называемые инактивирующими мутациями, приводят к тому, что генный продукт имеет меньшую функцию или не выполняет ее (частично или полностью инактивируется). Когда аллель имеет полную потерю функции (нулевой аллель ), его часто называют аморф или аморфная мутация в Морфы Мюллера схема. Фенотипы, связанные с такими мутациями, чаще всего рецессивный. Исключение составляют случаи, когда организм гаплоидный, или когда уменьшенной дозировки продукта нормального гена недостаточно для нормального фенотипа (это называется гаплонедостаточность ).
- Мутации с усилением функции, также называемые активирующими мутациями, изменяют продукт гена таким образом, что его эффект усиливается (усиленная активация) или даже заменяется другой аномальной функцией. Когда создается новый аллель, гетерозигота содержащий вновь созданный аллель, а также исходный будет выражать новый аллель; генетически это определяет мутации как доминирующий фенотипы. Некоторые морфы Мюллера соответствуют усилению функции, включая гиперморф (повышенная экспрессия генов) и неоморф (новая функция). В декабре 2017 года правительство США сняло временный запрет, введенный в 2014 году, который запретил федеральное финансирование любых новых экспериментов по увеличению функциональности, которые усиливают патогены, «такие как птичий грипп, SARS и ближневосточный респираторный синдром или вирусы MERS».[48][49]
- Доминантные отрицательные мутации (также называемые антиморфный мутации) имеют измененный генный продукт, который действует антагонистически по отношению к аллелю дикого типа. Эти мутации обычно приводят к изменению молекулярной функции (часто неактивной) и характеризуются доминантным или полудоминантный фенотип. У людей доминантно-отрицательные мутации вызывают рак (например, мутации в генах p53,[50] Банкомат,[51] CEBPA[52] и PPARgamma[53]). Синдром Марфана вызвано мутациями в FBN1 ген, расположенный на хромосома 15, который кодирует фибриллин-1, a гликопротеин компонент внеклеточный матрикс.[54] Синдром Марфана также является примером доминантно-отрицательной мутации и гаплонедостаточности.[55][56]
- Гипоморфы, после классификации Мюллера, характеризуются измененными генными продуктами, которые действуют с пониженным экспрессия гена по сравнению с дикого типа аллель. Обычно гипоморфные мутации рецессивны, но из-за гаплонедостаточности некоторые аллели становятся доминантными.
- Неоморфы характеризуются контролем новых белок синтез продукта.
- Смертельные мутации мутации, которые приводят к гибели организмов, несущих мутации.
- Обратная мутация или реверсия - это точечная мутация, которая восстанавливает исходную последовательность и, следовательно, исходный фенотип.[57]
По влиянию на фитнес
В прикладной генетика о мутациях принято говорить как о вредных, так и о полезных.
- Вредная или вредная мутация снижает физическую форму организма.
- Полезная или полезная мутация увеличивает приспособленность организма.
- Нейтральная мутация не оказывает вредного или полезного воздействия на организм. Такие мутации происходят с постоянной скоростью, формируя основу для молекулярные часы. в нейтральная теория молекулярной эволюции нейтральные мутации обеспечивают генетический дрейф как основу для большинства вариаций на молекулярном уровне.
- Почти нейтральная мутация - это мутация, которая может быть немного вредной или полезной, хотя большинство почти нейтральных мутаций слегка вредны.
Распределение фитнес-эффектов
Были предприняты попытки вывести распределение эффектов приспособленности (DFE), используя мутагенез эксперименты и теоретические модели, применяемые к данным молекулярной последовательности. DFE, используемый для определения относительного количества различных типов мутаций (т. Е. Сильно вредных, почти нейтральных или полезных), имеет отношение ко многим эволюционным вопросам, таким как поддержание генетическая вариация,[58] скорость геномный распад,[59] поддержание ауткроссинг половое размножение в отличие от инбридинг[60] и эволюция секс и генетическая рекомбинация.[61] DFE также можно отслеживать, отслеживая асимметрию распределения мутаций с предположительно тяжелыми эффектами по сравнению с распределением мутаций с предположительно легким или отсутствующим эффектом.[62] Таким образом, DFE играет важную роль в прогнозировании эволюционная динамика.[63][64] Для изучения DFE использовались различные подходы, включая теоретические, экспериментальные и аналитические методы.
- Эксперимент по мутагенезу: прямой метод исследования DFE - это вызвать мутации и затем измерить эффекты мутационной пригодности, что уже было сделано для вирусов, бактерии, дрожжи и Дрозофила. Например, большинство исследований DFE в вирусах использовали сайт-направленный мутагенез для создания точечных мутаций и измерения относительной приспособленности каждого мутанта.[65][66][67][68] В кишечная палочка, в одном исследовании использовалось транспозонный мутагенез непосредственно измерить пригодность случайной вставки производной от Tn10.[69] У дрожжей комбинированный мутагенез и глубокое секвенирование подход был разработан для создания высококачественных систематических библиотек мутантов и измерения приспособленности с высокой пропускной способностью.[70] Однако, учитывая, что эффекты многих мутаций слишком малы, чтобы их можно было обнаружить[71] и что эксперименты по мутагенезу могут обнаруживать только мутации умеренно большого эффекта; ДНК анализ данных последовательности может предоставить ценную информацию об этих мутациях.
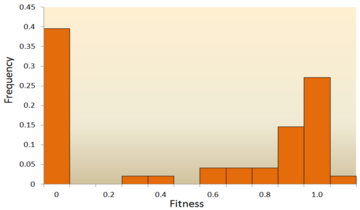
- Анализ молекулярной последовательности: с быстрым развитием Секвенирование ДНК технологии доступно огромное количество данных о последовательностях ДНК, и в будущем их станет еще больше. Были разработаны различные методы для вывода DFE из данных последовательности ДНК.[72][73][74][75] Изучая различия в последовательности ДНК внутри и между видами, мы можем сделать вывод о различных характеристиках DFE для нейтральных, вредных и полезных мутаций.[24] Чтобы быть конкретным, подход анализа последовательности ДНК позволяет нам оценивать эффекты мутаций с очень небольшими эффектами, которые трудно обнаружить с помощью экспериментов по мутагенезу.
Одно из первых теоретических исследований распределения эффектов приспособленности было выполнено Мотоо Кимура, влиятельное теоретическое население генетик. Его нейтральная теория молекулярной эволюции предполагает, что большинство новых мутаций будут очень вредными, а небольшая их часть будет нейтральной.[76][25] Хироши Акаши недавно предложил бимодальный модель для DFE, с модами, сосредоточенными вокруг очень вредных и нейтральных мутаций.[77] Обе теории согласны с тем, что подавляющее большинство новых мутаций нейтральны или вредны, а полезные мутации редки, что подтверждено экспериментальными результатами. Одним из примеров является исследование DFE случайных мутаций в вирус везикулярного стоматита.[65] Из всех мутаций 39,6% оказались летальными, 31,2% - несмертельными, а 27,1% - нейтральными. Другой пример - результат высокопроизводительного эксперимента по мутагенезу с дрожжами.[70] В этом эксперименте было показано, что общий DFE является бимодальным, с кластером нейтральных мутаций и широким распределением вредных мутаций.
Хотя относительно небольшое количество мутаций является полезным, те, которые играют важную роль в эволюционных изменениях.[78] Как и нейтральные мутации, слабо отобранные полезные мутации могут быть потеряны из-за случайного генетического дрейфа, но сильно отобранные полезные мутации с большей вероятностью будут исправлены. Знание DFE полезных мутаций может повысить способность предсказывать эволюционную динамику. Теоретическая работа над DFE для полезных мутаций была проведена Джон Х. Гиллеспи[79] и Х. Аллен Орр.[80] Они предложили, чтобы распределение полезных мутаций было экспоненциальный в широком диапазоне условий, что, в целом, подтверждено экспериментальными исследованиями, по крайней мере, для строго отобранных полезных мутаций.[81][82][83]
В целом, считается, что большинство мутаций являются нейтральными или вредными, а полезные мутации редки; однако пропорция типов мутаций варьируется между видами. Это указывает на два важных момента: во-первых, доля эффективно нейтральных мутаций может варьироваться между видами в результате зависимости от эффективная численность населения; во-вторых, средний эффект вредных мутаций сильно различается между видами.[24] Кроме того, DFE также различается между кодирующими областями и некодирующие области, с DFE некодирующей ДНК, содержащей более слабо отобранные мутации.[24]
По наследству

В многоклеточные организмы с посвященным репродуктивные клетки мутации можно разделить на мутации зародышевой линии, которые могут передаваться потомкам через их репродуктивные клетки, и соматический мутации (также называемые приобретенными мутациями),[84] которые включают клетки вне выделенной репродуктивной группы и обычно не передаются потомкам.
Диплоидные организмы (например, люди) содержат по две копии каждого гена - отцовский и материнский аллели. Основываясь на возникновении мутации на каждой хромосоме, мы можем классифицировать мутации на три типа. А дикого типа или гомозиготный немутантный организм - это организм, в котором ни один аллель не мутирован.
- Гетерозиготная мутация - это мутация только одного аллеля.
- Гомозиготная мутация - это идентичная мутация как отцовского, так и материнского аллелей.
- Соединение гетерозиготное Мутации или генетическое соединение состоит из двух разных мутаций в отцовских и материнских аллелях.[85]
Мутация зародышевой линии
Мутация зародышевой линии в репродуктивных клетках человека вызывает конституциональная мутация в потомстве, то есть мутация, которая присутствует в каждой клетке. Конституциональная мутация также может произойти очень скоро после оплодотворение, или продолжить предыдущую конституциональную мутацию в родительском элементе.[86] Мутация зародышевой линии может передаваться через последующие поколения организмов.
Различие между мутациями зародышевой линии и соматическими мутациями важно для животных, которые имеют выделенную зародышевую линию для производства репродуктивных клеток. Однако это не имеет большого значения для понимания эффектов мутаций у растений, у которых отсутствует выделенная зародышевая линия. Различие также размыто у тех животных, которые размножаться бесполым путем через такие механизмы, как подающий надежды, потому что клетки, которые дают начало дочерним организмам, также дают начало зародышевой линии этого организма.
Новая мутация зародышевой линии, не унаследованная ни от одного из родителей, называется de novo мутация.
Соматическая мутация
Изменение генетической структуры, которое не унаследовано от родителя, а также не передается потомству, называется изменением. соматический мутация.[84] Соматические мутации не наследуются потомками организма, потому что они не влияют на зародышевый. Однако они передаются всему потомству мутировавшей клетки в одном организме во время митоза. Следовательно, большая часть организма может нести ту же мутацию. Эти типы мутаций обычно вызваны экологическими причинами, такими как ультрафиолетовое излучение или любое воздействие определенных вредных химических веществ, и могут вызывать заболевания, включая рак.[87]
С помощью растений некоторые соматические мутации можно размножать без необходимости производства семян, например, путем прививка и стеблевые черенки. Эти мутации привели к появлению новых видов фруктов, таких как «Вкусный» яблоко и «вашингтонский» пупок апельсин.[88]
Человек и мышь соматические клетки имеют скорость мутаций более чем в десять раз выше, чем зародышевый частота мутаций для обоих видов; мыши имеют более высокий уровень как соматических, так и зародышевых мутаций на деление клеток чем люди. Несоответствие в частоте мутаций между зародышевой линией и соматическими тканями, вероятно, отражает большую важность геном поддержание в зародышевой линии, чем в соме.[89]
Специальные классы
- Условная мутация представляет собой мутацию, которая имеет фенотип дикого типа (или менее тяжелый) при определенных «разрешающих» условиях окружающей среды и мутантный фенотип при определенных «ограничительных» условиях. Например, чувствительная к температуре мутация может вызвать гибель клеток при высокой температуре (ограничительное условие), но может не иметь пагубных последствий при более низкой температуре (допустимое состояние).[90] Эти мутации не автономны, так как их проявление зависит от наличия определенных условий, в отличие от других мутаций, которые появляются автономно.[91] Разрешительные условия могут быть температура,[92] определенные химические вещества,[93] свет[93] или мутации в других частях геном.[91] В vivo такие механизмы, как переключатели транскрипции, могут создавать условные мутации. Например, ассоциация стероид-связывающего домена может создавать транскрипционный переключатель, который может изменять экспрессию гена на основе присутствия стероидного лиганда.[94] Условные мутации находят применение в исследованиях, поскольку они позволяют контролировать экспрессию генов. Это особенно полезно при изучении болезней у взрослых, позволяя экспрессии после определенного периода роста, тем самым устраняя вредный эффект экспрессии генов, наблюдаемый на стадиях развития у модельных организмов.[93] Системы ДНК-рекомбиназы, такие как Cre-Lox рекомбинация используется в сочетании с промоутеры которые активируются при определенных условиях, могут генерировать условные мутации. Технология двойной рекомбиназы может использоваться для индуцирования нескольких условных мутаций с целью изучения заболеваний, которые проявляются в результате одновременных мутаций в нескольких генах.[93] Определенный интеины были идентифицированы, которые сплавляются только при определенных допустимых температурах, что приводит к неправильному синтезу белка и, следовательно, к мутациям потери функции при других температурах.[95] Условные мутации также могут использоваться в генетических исследованиях, связанных со старением, поскольку их экспрессия может измениться по прошествии определенного периода времени в течение жизни организма.[92]
- Локусы количественных признаков репликации влияет на репликацию ДНК.
Номенклатура
Чтобы классифицировать мутацию как таковую, «нормальная» последовательность должна быть получена из ДНК «нормального» или «здорового» организма (в отличие от «мутантного» или «больного»), ее следует идентифицировать и сообщил; в идеале, он должен быть общедоступным для прямого сравнения нуклеотид за нуклеотидом и согласован научным сообществом или группой экспертов-генетиков и биологи, которые несут ответственность за создание стандарт или так называемая «консенсусная» последовательность. Этот шаг требует огромных научных усилий. Как только консенсусная последовательность известна, мутации в геноме могут быть точно определены, описаны и классифицированы. Комитет Общества вариаций генома человека (HGVS) разработал стандартную номенклатуру вариантов последовательностей человека,[96] которые должны использоваться исследователями и ДНК-диагностика центры для создания однозначных описаний мутаций. В принципе, эту номенклатуру можно также использовать для описания мутаций у других организмов. В номенклатуре указывается тип мутации и изменения оснований или аминокислот.
- Замена нуклеотида (например, 76A> T). Число указывает положение нуклеотида с 5'-конца; первая буква представляет нуклеотид дикого типа, а вторая буква представляет нуклеотид, который заменил дикий тип. В данном примере аденин в 76 позиции заменен тимином.
- Если возникает необходимость различать мутации в геномная ДНК, митохондриальная ДНК, и РНК используется простое соглашение. Например, если 100-е основание нуклеотидной последовательности мутировало с G на C, то это будет записано как g.100G> C, если мутация произошла в геномной ДНК, m.100G> C, если мутация произошла в митохондриальной ДНК, или r.100g> c, если мутация произошла в РНК. Обратите внимание, что для мутаций в РНК код нуклеотидов пишется строчными буквами.
- Аминокислотная замена (например, D111E) - первая буква - это одна буква код аминокислоты дикого типа, номер - это положение аминокислоты от N-конец, а вторая буква - это однобуквенный код аминокислоты, присутствующей в мутации. Нонсенс-мутации представлены знаком X для второй аминокислоты (например, D111X).
- Аминокислотная делеция (например, ΔF508) - греческая буква Δ (дельта ) указывает на удаление. Буква относится к аминокислоте, присутствующей в организме дикого типа, а число - это положение от N-конца аминокислоты, где она должна присутствовать, как в случае аминокислоты дикого типа.
Скорость мутации
Скорость мутации существенно различаются у разных видов, и эволюционные силы, которые обычно определяют мутации, являются предметом постоянных исследований.
В люди, то скорость мутации около 50-90 de novo мутаций на геном на поколение, то есть каждый человек накапливает около 50-90 новых мутаций, которых не было у его или ее родителей. Этот номер был установлен последовательность действий тысячи человеческих троек, то есть двое родителей и хотя бы один ребенок.[97]
Геномы РНК-вирусы основаны на РНК а не ДНК. Вирусный геном РНК может быть двухцепочечным (как в ДНК) или одноцепочечным. В некоторых из этих вирусов (например, одноцепочечных Вирус иммунодефицита человека ), репликация происходит быстро, а механизмы проверки точности генома отсутствуют. Этот подверженный ошибкам процесс часто приводит к мутациям.
Причина болезни
Изменения в ДНК, вызванные мутацией в кодирующей области ДНК, могут вызвать ошибки в последовательности белка, что может привести к частично или полностью нефункциональным белкам. Правильное функционирование каждой клетки зависит от тысяч белков, которые функционируют в нужных местах в нужное время. Когда мутация изменяет белок, который играет важную роль в организме, это может привести к заболеванию. Одно исследование по сравнению генов между разными видами Дрозофила предполагает, что если мутация действительно изменяет белок, мутация, скорее всего, будет вредной, при этом около 70 процентов полиморфизмов аминокислот имеют повреждающие эффекты, а остальные либо нейтральны, либо слабо полезны.[8] Некоторые мутации изменяют базовую последовательность ДНК гена, но не изменяют белок, производимый геном. Исследования показали, что только 7% точечных мутаций в некодирующей ДНК дрожжей являются вредными, а 12% - в кодирующей ДНК. Остальные мутации либо нейтральны, либо немного полезны.[98]
Наследственные расстройства
Если мутация присутствует в половая клетка, он может дать потомство, которое несет мутацию во всех своих клетках. Так обстоит дело с наследственными заболеваниями. В частности, если есть мутация в гене репарации ДНК в зародышевой клетке, люди, несущие такие мутации зародышевой линии, могут иметь повышенный риск рака. Список из 34 таких мутаций зародышевой линии приведен в статье. Расстройство дефицита репарации ДНК. Примером одного из них является альбинизм, мутация, встречающаяся в генах OCA1 или OCA2. Люди с этим расстройством более предрасположены ко многим типам рака, другим расстройствам и имеют нарушение зрения.
Повреждение ДНК может вызвать ошибку при репликации ДНК, и эта ошибка репликации может вызвать мутацию гена, которая, в свою очередь, может вызвать генетическое нарушение. Повреждения ДНК восстанавливаются системой репарации ДНК клетки. Каждая клетка имеет ряд путей, с помощью которых ферменты распознают и восстанавливают повреждения ДНК. Поскольку ДНК может быть повреждена разными способами, процесс восстановления ДНК является важным способом защиты организма от болезней. Если повреждение ДНК привело к мутации, ее нельзя исправить.
Роль в канцерогенезе
С другой стороны, мутация может произойти в соматической клетке организма. Такие мутации будут присутствовать у всех потомков этой клетки в одном организме. Накопление определенных мутаций на протяжении поколений соматических клеток является частью причины злокачественная трансформация, от нормальной клетки к раковой клетке.[99]
Клетки с гетерозиготными мутациями потери функции (одна хорошая копия гена и одна мутированная копия) могут нормально функционировать с неизмененной копией до тех пор, пока хорошая копия не будет спонтанно соматически мутирована. Этот вид мутации часто случается у живых организмов, но измерить частоту трудно. Измерение этого показателя важно для прогнозирования скорости, с которой у людей может развиться рак.[100]
Точечные мутации могут возникать в результате спонтанных мутаций, возникающих во время репликации ДНК. Скорость мутации может увеличиваться мутагенами. Мутагены могут быть физическими, например, излучение от УФ-лучи, Рентгеновские лучи или сильное нагревание, или химическое (молекулы, которые несут пары оснований или нарушают спиральную форму ДНК). Мутагены, связанные с раком, часто изучаются, чтобы узнать о раке и его профилактике.
Прионные мутации
Прионы являются белками и не содержат генетического материала. Однако было показано, что репликация прионов подвержена мутации и естественному отбору, как и другие формы репликации.[101] Человеческий ген PRNP кодирует главный прионный белок PrP и подвержен мутациям, которые могут приводить к возникновению прионов, вызывающих заболевание.
Полезные мутации
Хотя мутации, вызывающие изменения в белковых последовательностях, могут быть вредными для организма, в некоторых случаях эффект может быть положительным в данной среде. В этом случае мутация может позволить мутантному организму противостоять определенным стрессам окружающей среды лучше, чем организмы дикого типа, или быстрее воспроизводиться. В этих случаях мутация становится более распространенной в популяции в результате естественного отбора. Примеры включают следующее:
Устойчивость к ВИЧ: специфическая делеция 32 пар оснований у человека CCR5 (CCR5-Δ32 ) дает ВИЧ сопротивление гомозиготы и задержки СПИД начало у гетерозигот.[102] Одно из возможных объяснений этиология относительно высокой частоты CCR5-Δ32 в Европейский населения в том, что оно оказало сопротивление бубонная чума в середине 14 века Европа. Люди с этой мутацией с большей вероятностью пережили инфекцию; таким образом, его частота среди населения увеличилась.[103] Эта теория могла бы объяснить, почему эта мутация не обнаружена в Южная Африка, который остался нетронутым бубонной чумой. Более новая теория предполагает, что селективное давление в CCR5 Delta 32 мутация была вызвана оспа вместо бубонной чумы.[104]
Устойчивость к малярии: Пример вредной мутации серповидноклеточная анемия, заболевание крови, при котором в организме вырабатывается ненормальный тип переносящего кислород вещества. гемоглобин в красные кровяные тельца. Треть всех местный жители К югу от Сахары несут аллель, потому что в районах, где малярия обычное дело, есть ценность выживания в переносе только одного аллеля серповидноклеточной системы (серповидноклеточная черта ).[105] Те, у кого есть только один из двух аллелей серповидноклеточной анемии, более устойчивы к малярии, так как заражение малярией Плазмодий останавливается серповидным действием клеток, которые он поражает.
Устойчивость к антибиотикам: Практически все бактерии развивают устойчивость к антибиотикам при воздействии антибиотиков. Фактически, бактериальные популяции уже имеют такие мутации, которые отбираются при выборе антибиотиков.[106] Очевидно, что такие мутации полезны только для бактерий, но не для инфицированных.
Стойкость лактазы. Мутация позволила людям экспрессировать фермент лактаза после естественного отлучения от грудного молока, позволяя взрослым переваривать лактоза, что, вероятно, является одной из самых полезных мутаций за последнее время эволюция человека.[107]
История

Мутационизм один из нескольких альтернативы эволюции путем естественного отбора которые существовали как до, так и после публикации Чарльз Дарвин книга 1859 г., О происхождении видов. В теории мутации были источником новизны, создавая новые формы и новые виды, потенциально мгновенно,[108] во внезапном прыжке.[109] Это рассматривалось как движущая сила эволюции, которая ограничивалась количеством мутаций.
До Дарвина биологи обычно верили в сальтационизм, возможность больших эволюционных скачков, в том числе немедленных видообразование. Например, в 1822 г. Этьен Жоффруа Сен-Илер утверждал, что виды могут образоваться в результате внезапных трансформаций или того, что позже будет названо макромутацией.[110] Дарвин выступал против сальтации, настаивая на постепенность в эволюции как в геологии. В 1864 г. Альберт фон Кёлликер возродил теорию Жоффруа.[111] В 1901 г. генетик Уго де Врис дал название «мутации», казалось бы, новым формам, которые внезапно возникли в его экспериментах на примуле вечерней. Oenothera lamarckiana, а в первом десятилетии ХХ века мутационизм, или, как его называл де Фрис, мутации,[112][108] стал соперником дарвинизма, некоторое время поддерживавшегося генетиками, в том числе Уильям Бейтсон,[113] Томас Хант Морган, и Реджинальд Паннетт.[114][108]
Понимание мутационизма омрачено изображением первых мутационистов в середине 20-го века сторонниками современный синтез как противники дарвиновской эволюции и соперники школы биометрии, которые утверждали, что отбор основан на непрерывных вариациях. В этом изображении мутационизм был побежден синтезом генетики и естественного отбора, который предположительно начался позже, примерно в 1918 году, с работы математика. Рональд Фишер.[115][116][117][118] Однако согласование менделевской генетики и естественного отбора началось еще в 1902 году с работы А. Удный Йоль,[119] и основан на теоретической и экспериментальной работе в Европе и Америке. Несмотря на разногласия, первые мутационисты к 1918 году уже приняли естественный отбор и объяснили непрерывную изменчивость результатом того, что несколько генов действуют на одну и ту же характеристику, например рост.[116][117]
Мутационизм, наряду с другими альтернативами дарвинизма, такими как Ламаркизм и ортогенез, было отвергнуто большинством биологов, поскольку они пришли к выводу, что менделевская генетика и естественный отбор могут легко работать вместе; Мутации заняли свое место в качестве источника генетической изменчивости, необходимой для работы естественного отбора. Однако мутационизм не исчез полностью. В 1940 г. Ричард Гольдшмидт снова выступал за одноэтапное видообразование посредством макромутации, описывая организмы, полученные таким образом, как «обнадеживающих монстров», что вызвало всеобщую насмешку.[120][121] В 1987 г. Масатоши Ней утверждал, спорно, что эволюция часто мутации ограничены.[122] Современные биологи, такие как Дуглас Дж. Футуйма пришли к выводу, что по существу все утверждения об эволюции, вызванной большими мутациями, можно объяснить дарвиновской эволюцией.[123]
Смотрите также
Рекомендации
- ^ «мутация | Изучение науки в Scitable». Природа. Природное образование. Получено 24 сентября 2018.
- ^ Шарма С., Джавадекар С.М., Пандей М., Шривастава М., Кумари Р., Рагхаван С.К. (март 2015 г.). «Гомология и ферментативные требования к альтернативному соединению концов в зависимости от микрогомологии». Смерть и болезнь клеток. 6 (3): e1697. Дои:10.1038 / cddis.2015.58. ЧВК 4385936. PMID 25789972.
- ^ Чен Дж, Миллер Б.Ф., Фурано А.В. (апрель 2014 г.). «Ремонт встречающихся в природе несовпадений может вызвать мутации во фланкирующей ДНК». eLife. 3: e02001. Дои:10.7554 / elife.02001. ЧВК 3999860. PMID 24843013.
- ^ Роджерс К., Маквей М. (январь 2016 г.). «Подверженная ошибкам репарация двухцепочечных разрывов ДНК». Журнал клеточной физиологии. 231 (1): 15–24. Дои:10.1002 / jcp.25053. ЧВК 4586358. PMID 26033759.
- ^ а б Bertram JS (декабрь 2000 г.). «Молекулярная биология рака». Молекулярные аспекты медицины. 21 (6): 167–223. Дои:10.1016 / S0098-2997 (00) 00007-8. PMID 11173079.
- ^ а б Аминецах Ю.Т., Макферсон Дж.М., Петров Д.А. (июль 2005 г.). «Устойчивость к пестицидам посредством транспозиции-опосредованного усечения адаптивного гена у дрозофилы». Наука. 309 (5735): 764–7. Bibcode:2005Наука ... 309..764A. Дои:10.1126 / наука.1112699. PMID 16051794. S2CID 11640993.
- ^ Буррус V, Waldor MK (июнь 2004 г.). «Формирование бактериального генома с интегративными и конъюгативными элементами». Исследования в области микробиологии. 155 (5): 376–86. Дои:10.1016 / j.resmic.2004.01.012. PMID 15207870.
- ^ а б Сойер С.А., Парш Дж., Чжан З., Хартл Д.Л. (апрель 2007 г.). «Преобладание положительного отбора среди почти нейтральных аминокислотных замен у дрозофилы». Труды Национальной академии наук Соединенных Штатов Америки. 104 (16): 6504–10. Bibcode:2007ПНАС..104.6504С. Дои:10.1073 / pnas.0701572104. ЧВК 1871816. PMID 17409186.
- ^ Гастингс П.Дж., Lupski JR, Розенберг С.М., Ира Г. (август 2009 г.). «Механизмы изменения числа копий гена». Обзоры природы. Генетика. 10 (8): 551–64. Дои:10.1038 / nrg2593. ЧВК 2864001. PMID 19597530.
- ^ Кэрролл С.Б., Гренье Дж. К., Уэтерби С. Д. (2005). От ДНК к разнообразию: молекулярная генетика и эволюция дизайна животных (2-е изд.). Мальден, Массачусетс: Blackwell Publishing. ISBN 978-1-4051-1950-4. LCCN 2003027991. OCLC 53972564.
- ^ Харрисон П.М., Герштейн М (Май 2002 г.). «Изучение геномов через эоны: семейства белков, псевдогены и эволюция протеома». Журнал молекулярной биологии. 318 (5): 1155–74. Дои:10.1016 / S0022-2836 (02) 00109-2. PMID 12083509.
- ^ Оренго CA, Торнтон Дж. М. (Июль 2005 г.). «Семейства белков и их эволюция - структурная перспектива». Ежегодный обзор биохимии. 74: 867–900. Дои:10.1146 / annurev.biochem.74.082803.133029. PMID 15954844.
- ^ Лонг М., Бетран Э, Торнтон К., Ван В. (ноябрь 2003 г.). «Происхождение новых генов: взгляды молодых и старых». Обзоры природы. Генетика. 4 (11): 865–75. Дои:10.1038 / nrg1204. PMID 14634634. S2CID 33999892.
- ^ Ван М, Каэтано-Аноллес G (Январь 2009 г.). «Эволюционная механика организации домена в протеомах и рост модульности в мире белков». Структура. 17 (1): 66–78. Дои:10.1016 / j.str.2008.11.008. PMID 19141283.
- ^ Bowmaker JK (май 1998 г.). «Эволюция цветового зрения у позвоночных». Глаз. 12 (Pt 3b): 541–7. Дои:10.1038 / глаз.1998.143. PMID 9775215. S2CID 12851209.
- ^ Грегори Т.Р., Hebert PD (Апрель 1999 г.). «Модуляция содержания ДНК: непосредственные причины и конечные последствия». Геномные исследования. 9 (4): 317–24. Дои:10.1101 / гр.9.4.317 (неактивно 10 октября 2020 г.). PMID 10207154.CS1 maint: DOI неактивен по состоянию на октябрь 2020 г. (связь)
- ^ Hurles M (июль 2004 г.). «Дублирование генов: торговля геномными запчастями». PLOS Биология. 2 (7): E206. Дои:10.1371 / journal.pbio.0020206. ЧВК 449868. PMID 15252449.
- ^ Лю Н., Окамура К., Тайлер Д.М., Филлипс М.Д., Чанг В.Дж., Лай ЕС (октябрь 2008 г.). «Эволюция и функциональная диверсификация генов микроРНК животных». Клеточные исследования. 18 (10): 985–96. Дои:10.1038 / кр.2008.278. ЧВК 2712117. PMID 18711447.
- ^ Siepel A (Октябрь 2009 г.). «Дарвиновская алхимия: человеческие гены из некодирующей ДНК». Геномные исследования. 19 (10): 1693–5. Дои:10.1101 / гр.098376.109. ЧВК 2765273. PMID 19797681.
- ^ Чжан Дж, Ван Х, Подлаха О (май 2004 г.). «Проверка гипотезы хромосомного видообразования на людях и шимпанзе». Геномные исследования. 14 (5): 845–51. Дои:10.1101 / гр.1891104. ЧВК 479111. PMID 15123584.
- ^ Ayala FJ, Coluzzi M (май 2005 г.). «Видообразование хромосом: люди, дрозофила и комары». Труды Национальной академии наук Соединенных Штатов Америки. 102 Дополнение 1 (Дополнение 1): 6535–42. Bibcode:2005ПНАС..102.6535А. Дои:10.1073 / pnas.0501847102. ЧВК 1131864. PMID 15851677.
- ^ Hurst GD, Werren JH (август 2001 г.). «Роль эгоистичных генетических элементов в эволюции эукариот». Природа Обзоры Генетика. 2 (8): 597–606. Дои:10.1038/35084545. PMID 11483984. S2CID 2715605.
- ^ Häsler J, Strub K (ноябрь 2006 г.). «Элементы Alu как регуляторы экспрессии генов». Исследования нуклеиновых кислот. 34 (19): 5491–7. Дои:10.1093 / нар / gkl706. ЧВК 1636486. PMID 17020921.
- ^ а б c d Эйр-Уокер А, Кейтли PD (Август 2007 г.). «Распределение фитнес-эффектов новых мутаций» (PDF). Природа Обзоры Генетика. 8 (8): 610–8. Дои:10,1038 / nrg2146. PMID 17637733. S2CID 10868777. Архивировано из оригинал (PDF) 4 марта 2016 г.. Получено 6 сентября 2010.
- ^ а б Кимура М (1983). Нейтральная теория молекулярной эволюции. Кембридж, Великобритания; Нью-Йорк: Издательство Кембриджского университета. ISBN 978-0-521-23109-1. LCCN 82022225. OCLC 9081989.CS1 maint: ref = harv (связь)
- ^ Богидар HB (январь 2015 г.). Основы физики полимеров и молекулярной биофизики. Издательство Кембриджского университета. ISBN 978-1-316-09302-3.
- ^ Довер Г.А., Дарвин С. (2000). Уважаемый мистер Дарвин: Письма об эволюции жизни и человеческой природы. Калифорнийский университет Press. ISBN 9780520227903.
- ^ Тибайренк, Мишель (12 января 2017 г.). Генетика и эволюция инфекционных заболеваний. Эльзевир. ISBN 9780128001530.
- ^ «Рак отчасти вызван неудачей, как показывают исследования». В архиве из оригинала от 13 июля 2017 г.
- ^ Джа, Алок (22 августа 2012 г.). «Старшие отцы передают больше генетических мутаций, как показывают исследования». Хранитель.
- ^ Эймс, Б.Н.; Shigenaga, MK; Hagen, TM (1 сентября 1993 г.). «Окислители, антиоксиданты и дегенеративные заболевания старения». Proc Natl Acad Sci U S A. 90 (17): 7915–22. Bibcode:1993PNAS ... 90.7915A. Дои:10.1073 / пнас.90.17.7915. ЧВК 47258. PMID 8367443.
- ^ Монтелоне Б.А. (1998). «Мутация, мутагены и восстановление ДНК». www-personal.ksu.edu. Архивировано из оригинал 26 сентября 2015 г.. Получено 2 октября 2015.
- ^ Стюарт Г.Р., Ода Й., де Бур Дж. Г., Гликман Б. В. (март 2000 г.). «Частота и специфичность мутаций с возрастом в печени, мочевом пузыре и мозге трансгенных мышей lacI». Генетика. 154 (3): 1291–300. ЧВК 1460990. PMID 10757770.
- ^ Kunz BA, Ramachandran K, Vonarx EJ (апрель 1998 г.). «Анализ последовательности ДНК спонтанного мутагенеза в Saccharomyces cerevisiae». Генетика. 148 (4): 1491–505. ЧВК 1460101. PMID 9560369.
- ^ Либер MR (июль 2010 г.). «Механизм репарации двухцепочечных разрывов ДНК по пути негомологичного соединения концов ДНК». Ежегодный обзор биохимии. 79: 181–211. Дои:10.1146 / annurev.biochem.052308.093131. ЧВК 3079308. PMID 20192759.
- ^ Создано из PDB 1JDG В архиве 31 декабря 2015 г. Wayback Machine
- ^ Пфоль-Лешкович А., Мандервиль, РА (январь 2007 г.). «Охратоксин А: обзор токсичности и канцерогенности для животных и людей». Молекулярное питание и пищевые исследования. 51 (1): 61–99. Дои:10.1002 / mnfr.200600137. PMID 17195275.
- ^ Kozmin S, Slezak G, Reynaud-Angelin A, Elie C, de Rycke Y, Boiteux S, Sage E (сентябрь 2005 г.). «UVA-излучение оказывает сильное мутагенное действие на клетки, которые не могут восстанавливать 7,8-дигидро-8-оксогуанин в Saccharomyces cerevisiae». Труды Национальной академии наук Соединенных Штатов Америки. 102 (38): 13538–43. Bibcode:2005PNAS..10213538K. Дои:10.1073 / pnas.0504497102. ЧВК 1224634. PMID 16157879.
- ^ а б Фитцджеральд Д.М., Розенберг С.М. (апрель 2019 г.). «Что такое мутация? Глава из серии: Как микробы« ставят под угрозу »современный синтез». PLOS Genetics. 15 (4): e1007995. Дои:10.1371 / journal.pgen.1007995. ЧВК 6443146. PMID 30933985.
- ^ Гальхардо Р.С., Гастингс П.Дж., Розенберг С.М. (1 января 2007 г.). «Мутация как реакция на стресс и регуляция эволюционируемости». Критические обзоры в биохимии и молекулярной биологии. 42 (5): 399–435. Дои:10.1080/10409230701648502. ЧВК 3319127. PMID 17917874.
- ^ Quinto-Alemany D, Canerina-Amaro A, Hernández-Abad LG, Machín F, Romesberg FE, Gil-Lamaignere C (31 июля 2012 г.). Стертевант Дж (ред.). «Дрожжи приобретают резистентность вторично к лечению противогрибковыми препаратами за счет адаптивного мутагенеза». PLOS ONE. 7 (7): e42279. Bibcode:2012PLoSO ... 742279Q. Дои:10.1371 / journal.pone.0042279. ЧВК 3409178. PMID 22860105.
- ^ Ссылки на изображение находятся на странице Wikimedia Commons по адресу: Commons: File: Notable mutations.svg # Ссылки.
- ^ Рахман, Назнин. «Клиническое влияние изменений последовательности ДНК». Инициатива трансформации генетической медицины. Архивировано из оригинал 4 августа 2017 г.. Получено 27 июн 2017.
- ^ Freese E (Апрель 1959 г.). «Разница между спонтанными мутациями фага Т4, индуцированными основанием-аналогом». Труды Национальной академии наук Соединенных Штатов Америки. 45 (4): 622–33. Bibcode:1959ПНАС ... 45..622Ф. Дои:10.1073 / пнас.45.4.622. ЧВК 222607. PMID 16590424.
- ^ Freese E (июнь 1959 г.). «Специфическое мутагенное действие аналогов основания на фаг Т4». Журнал молекулярной биологии. 1 (2): 87–105. Дои:10.1016 / S0022-2836 (59) 80038-3.
- ^ Хоган CM (12 октября 2010 г.). «Мутация». В Monosson E (ред.). Энциклопедия Земли. Вашингтон, округ Колумбия: Коалиция экологической информации, Национальный совет по науке и окружающей среде. OCLC 72808636. В архиве из оригинала 14 ноября 2015 г.. Получено 8 октября 2015.
- ^ Boillée S, Vande Velde C, Cleveland DW (октябрь 2006 г.). «БАС: болезнь двигательных нейронов и их ненейронных соседей». Нейрон. 52 (1): 39–59. CiteSeerX 10.1.1.325.7514. Дои:10.1016 / j.neuron.2006.09.018. PMID 17015226. S2CID 12968143.
- ^ Steenhuysen J (19 декабря 2017 г.). «США снимают запрет на финансирование исследований, способствующих распространению опасных микробов». U.S. News & World Report. Получено 15 января 2018.
- ^ Коллинз, Фрэнсис С. (19 декабря 2017 г.). «NIH отменяет паузу в финансировании исследований по увеличению функциональности». Национальные институты здоровья. В архиве из оригинала от 22 декабря 2017 года.
- ^ Гох AM, Коффилл CR, Переулок DP (Январь 2011 г.). «Роль мутантного p53 в раке человека». Журнал патологии. 223 (2): 116–26. Дои:10.1002 / path.2784. PMID 21125670. S2CID 23998813.
- ^ Ченевикс-Тренч G, Spurdle AB, Gatei M, Kelly H, Marsh A, Chen X, Donn K, Cummings M, Nyholt D, Jenkins MA, Scott C, Pupo GM, Dörk T, Bendix R, Kirk J, Tucker K, McCredie MR, Hopper JL, Sambrook J, Mann GJ, Khanna KK (февраль 2002 г.). «Доминирующие отрицательные мутации ATM в семьях рака груди». Журнал Национального института рака. 94 (3): 205–15. CiteSeerX 10.1.1.557.6394. Дои:10.1093 / jnci / 94.3.205. PMID 11830610.
- ^ Паз-Приэль I, Фридман А (2011). «Нарушение регуляции C / EBPα при ОМЛ и ОЛЛ». Критические обзоры онкогенеза. 16 (1–2): 93–102. Дои:10.1615 / critrevoncog.v16.i1-2.90. ЧВК 3243939. PMID 22150310.
- ^ Capaccio D, Ciccodicola A, Sabatino L, Casamassimi A, Pancione M, Fucci A, Febbraro A, Merlino A, Graziano G, Colantuoni V (июнь 2010 г.). «Новая мутация зародышевой линии в гамма-гене рецептора, активируемого пролифератором пероксисом, связанная с образованием полипа толстой кишки и дислипидемией». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1802 (6): 572–81. Дои:10.1016 / j.bbadis.2010.01.012. PMID 20123124.
- ^ МакКусик В.А. (Июль 1991 г.). «Дефект синдрома Марфана». Природа. 352 (6333): 279–81. Bibcode:1991Натура.352..279М. Дои:10.1038 / 352279a0. PMID 1852198. S2CID 4341743.
- ^ Судья Д.П., Биери Н.Дж., Кин Д.Р., Гойбтнер Дж., Майерс Л., Хусо Д.Л., Сакаи Л.Ю., Дитц ХК (июль 2004 г.). «Доказательства критического вклада гаплонедостаточности в сложный патогенез синдрома Марфана». Журнал клинических исследований. 114 (2): 172–81. Дои:10.1172 / JCI20641. ЧВК 449744. PMID 15254584.
- ^ Судья Д.П., Дитц ХК (декабрь 2005 г.). «Синдром Марфана». Ланцет. 366 (9501): 1965–76. Дои:10.1016 / S0140-6736 (05) 67789-6. ЧВК 1513064. PMID 16325700.
- ^ Эллис Н.А., Чоччи С., Герман Дж. (Февраль 2001 г.). «Обратные мутации могут вызвать реверсию фенотипа в соматических клетках синдрома Блума». Генетика человека. 108 (2): 167–73. Дои:10.1007 / s004390000447. PMID 11281456. S2CID 22290041.
- ^ Чарльзуорт Д., Чарльзуорт Б., Morgan MT (декабрь 1995 г.). «Паттерн нейтральной молекулярной изменчивости в рамках модели выбора фона». Генетика. 141 (4): 1619–32. ЧВК 1206892. PMID 8601499.
- ^ Loewe L (апрель 2006 г.). «Количественная оценка парадокса геномного распада из-за храповика Мюллера в митохондриальной ДНК человека». Генетические исследования. 87 (2): 133–59. Дои:10.1017 / S0016672306008123. PMID 16709275.
- ^ Бернштейн Х., Хопф Ф.А., Мишод РЭ (1987). «Молекулярные основы эволюции пола». Молекулярная генетика развития. Достижения в генетике. 24. С. 323–70. Дои:10.1016 / с0065-2660 (08) 60012-7. ISBN 9780120176243. PMID 3324702.
- ^ Пек Дж. Р., Барро Дж., Хит СК (апрель 1997 г.). «Несовершенные гены, мутации Фишера и эволюция пола». Генетика. 145 (4): 1171–99. ЧВК 1207886. PMID 9093868.
- ^ Симчикова Д., Хенеберг П. (декабрь 2019 г.). «Уточнение прогнозов эволюционной медицины на основе клинических данных о проявлениях менделевских болезней». Научные отчеты. 9 (1): 18577. Bibcode:2019НатСР ... 918577С. Дои:10.1038 / s41598-019-54976-4. ЧВК 6901466. PMID 31819097.
- ^ Кейтли PD, Линч М (Март 2003 г.). «К реалистичной модели мутаций, влияющих на приспособленность». Эволюция; Международный журнал органической эволюции. 57 (3): 683–5, обсуждение 686–9. Дои:10.1554 / 0014-3820 (2003) 057 [0683: tarmom] 2.0.co; 2. JSTOR 3094781. PMID 12703958.
- ^ Бартон NH, Keightley PD (январь 2002 г.). «Понимание количественной генетической изменчивости». Природа Обзоры Генетика. 3 (1): 11–21. Дои:10,1038 / nrg700. PMID 11823787. S2CID 8934412.
- ^ а б c Санхуан Р., Моя А., Елена С.Ф. (июнь 2004 г.). «Распределение эффектов приспособленности, вызванных однонуклеотидными заменами в РНК-вирусе». Труды Национальной академии наук Соединенных Штатов Америки. 101 (22): 8396–401. Bibcode:2004ПНАС..101.8396С. Дои:10.1073 / pnas.0400146101. ЧВК 420405. PMID 15159545.
- ^ Карраско П., де ла Иглесиа Ф, Елена С.Ф. (декабрь 2007 г.). «Распределение эффектов приспособленности и вирулентности, вызванных однонуклеотидными заменами в вирусе Tobacco Etch». Журнал вирусологии. 81 (23): 12979–84. Дои:10.1128 / JVI.00524-07. ЧВК 2169111. PMID 17898073.
- ^ Санхуан Р. (июнь 2010 г.). «Эффекты мутационной пригодности в РНК и вирусах с одноцепочечной ДНК: общие закономерности, выявленные исследованиями сайт-направленного мутагенеза». Философские труды Лондонского королевского общества. Серия B, Биологические науки. 365 (1548): 1975–82. Дои:10.1098 / rstb.2010.0063. ЧВК 2880115. PMID 20478892.
- ^ Перис Дж. Б., Дэвис П., Куэвас Дж. М., Небот М. Р., Санхуан Р. (июнь 2010 г.). «Распределение эффектов приспособленности, вызванных однонуклеотидными заменами в бактериофаге f1». Генетика. 185 (2): 603–9. Дои:10.1534 / генетика.110.115162. ЧВК 2881140. PMID 20382832.
- ^ Елена С.Ф., Экунве Л., Хаджела Н., Оден С.А., Ленский Р.Э. (Март 1998 г.). «Распределение эффектов приспособленности, вызванных случайными вставками мутаций в Escherichia coli». Genetica. 102–103 (1–6): 349–58. Дои:10.1023 / А: 1017031008316. PMID 9720287. S2CID 2267064.
- ^ а б Hietpas RT, Jensen JD, Bolon DN (май 2011 г.). «Экспериментальное освещение фитнес-ландшафта». Труды Национальной академии наук Соединенных Штатов Америки. 108 (19): 7896–901. Bibcode:2011PNAS..108.7896H. Дои:10.1073 / pnas.1016024108. ЧВК 3093508. PMID 21464309.
- ^ Дэвис Е.К., Питерс А.Д., Кейтли П.Д. (сентябрь 1999 г.). «Высокая частота скрытых вредоносных мутаций у Caenorhabditis elegans». Наука. 285 (5434): 1748–51. Дои:10.1126 / наука.285.5434.1748. PMID 10481013.
- ^ Loewe L, Charlesworth B (сентябрь 2006 г.). «Выявление распределения мутационных эффектов на приспособленность у дрозофилы». Письма о биологии. 2 (3): 426–30. Дои:10.1098 / rsbl.2006.0481. ЧВК 1686194. PMID 17148422.
- ^ Эйр-Уокер А., Вулфит М., Фелпс Т. (июнь 2006 г.). «Распределение фитнес-эффектов новых вредных мутаций аминокислот у людей». Генетика. 173 (2): 891–900. Дои:10.1534 / генетика.106.057570. ЧВК 1526495. PMID 16547091.
- ^ Сойер С.А., Кулатинал Р.Дж., Bustamante CD, Хартл DL (август 2003 г.). «Байесовский анализ показывает, что большинство замен аминокислот у Drosophila вызвано положительным отбором». Журнал молекулярной эволюции. 57 Приложение 1 (1): S154–64. Bibcode:2003JMolE..57S.154S. CiteSeerX 10.1.1.78.65. Дои:10.1007 / s00239-003-0022-3. PMID 15008412. S2CID 18051307.
- ^ Пигано Г., Эйр-Уокер А. (сентябрь 2003 г.). «Оценка распределения эффектов приспособленности по данным последовательности ДНК: последствия для молекулярных часов». Труды Национальной академии наук Соединенных Штатов Америки. 100 (18): 10335–40. Bibcode:2003ПНАС..10010335П. Дои:10.1073 / pnas.1833064100. ЧВК 193562. PMID 12925735.
- ^ Кимура М (Февраль 1968 г.). «Скорость эволюции на молекулярном уровне». Природа. 217 (5129): 624–6. Bibcode:1968Натура.217..624К. Дои:10.1038 / 217624a0. PMID 5637732. S2CID 4161261.
- ^ Акаши Х (сентябрь 1999 г.). «Внутривидовые и межвидовые вариации последовательности ДНК и« след »естественного отбора». Ген. 238 (1): 39–51. Дои:10.1016 / S0378-1119 (99) 00294-2. PMID 10570982.
- ^ Эйр-Уокер А (октябрь 2006 г.). «Геномный темп адаптивной эволюции». Тенденции в экологии и эволюции. 21 (10): 569–75. Дои:10.1016 / j.tree.2006.06.015. PMID 16820244.
- ^ Гиллеспи Дж. (Сентябрь 1984 г.). «Молекулярная эволюция над мутационным ландшафтом». Эволюция. 38 (5): 1116–1129. Дои:10.2307/2408444. JSTOR 2408444. PMID 28555784.
- ^ Orr HA (Апрель 2003 г.). «Распределение фитнес-эффектов среди полезных мутаций». Генетика. 163 (4): 1519–26. ЧВК 1462510. PMID 12702694.
- ^ Кассен Р., Батайон Т. (апрель 2006 г.). «Распределение эффектов приспособленности среди полезных мутаций до отбора в экспериментальных популяциях бактерий». Природа Генетика. 38 (4): 484–8. Дои:10,1038 / ng1751. PMID 16550173. S2CID 6954765.
- ^ Рокита Д.Р., Джойс П., Кодл С.Б., Вичман Х.А. (апрель 2005 г.). «Эмпирический тест модели мутационного ландшафта адаптации с использованием одноцепочечной ДНК вируса». Природа Генетика. 37 (4): 441–4. Дои:10,1038 / ng1535. PMID 15778707. S2CID 20296781.
- ^ Имхоф М., Шлоттерер С. (январь 2001 г.). «Фитнес-эффекты выгодных мутаций в развивающихся популяциях Escherichia coli». Труды Национальной академии наук Соединенных Штатов Америки. 98 (3): 1113–7. Bibcode:2001ПНАС ... 98.1113И. Дои:10.1073 / пнас.98.3.1113. ЧВК 14717. PMID 11158603.
- ^ а б «Генетическая мутация соматических клеток». Словарь генома. Афины, Греция: Партнеры по информационным технологиям. 30 июня 2007 г. Архивировано с оригинал 24 февраля 2010 г.. Получено 6 июн 2010.
- ^ «Составная гетерозигота». MedTerms. Нью-Йорк: WebMD. 14 июня 2012. Архивировано с оригинал 4 марта 2016 г.. Получено 9 октября 2015.
- ^ "RB1 Генетика ». Фонд рака глаза Дейзи. Оксфорд, Великобритания. Архивировано из оригинал 26 ноября 2011 г.. Получено 9 октября 2015.
- ^ «соматическая мутация | генетика». Британская энциклопедия. В архиве из оригинала 31 марта 2017 г.. Получено 31 марта 2017.
- ^ Хартл Д.Л., Джонс Е.В. (1998). Принципы и анализ генетики. Садбери, Массачусетс: издательство «Джонс и Бартлетт». стр.556. ISBN 978-0-7637-0489-6.
- ^ Милхолланд Б., Донг Х, Чжан Л., Хао Х, Сух Y, Видж Дж. (2017). «Различия между зародышевой линией и частотой соматических мутаций у людей и мышей». Nat Commun. 8: 15183. Bibcode:2017НатКо ... 815183M. Дои:10.1038 / ncomms15183. ЧВК 5436103. PMID 28485371.
- ^ Альбертс (2014). Молекулярная биология клетки (6 изд.). Наука о гирляндах. п. 487. ISBN 9780815344322.
- ^ а б Чадов Б.Ф., Федорова Н.Б., Чадова Е.В. (1 июля 2015 г.). «Условные мутации у Drosophila melanogaster: К 150-летию отчета Г. Менделя в Брюнне». Мутации / Обзоры в Мутационных исследованиях. 765: 40–55. Дои:10.1016 / j.mrrev.2015.06.001. PMID 26281767.
- ^ а б Лэндис Дж., Боле Д., Лу Л., Башня Дж. (Июль 2001 г.). «Высокочастотная генерация условных мутаций, влияющих на развитие и продолжительность жизни Drosophila melanogaster». Генетика. 158 (3): 1167–76. ЧВК 1461716. PMID 11454765. Архивировано из оригинал 22 марта 2017 г.. Получено 21 марта 2017.
- ^ а б c d Гиерут Дж. Дж., Джекс Т. Е., Хейгис К. М. (апрель 2014 г.). «Стратегии достижения условной генной мутации у мышей». Протоколы Колд-Спринг-Харбор. 2014 (4): 339–49. Дои:10.1101 / pdb.top069807. ЧВК 4142476. PMID 24692485.
- ^ Спенсер DM (май 1996 г.). «Создание условных мутаций у млекопитающих». Тенденции в генетике. 12 (5): 181–7. Дои:10.1016/0168-9525(96)10013-5. PMID 8984733.
- ^ Тан Г., Чен М., Фут С., Тан С. (сентябрь 2009 г.). «Чувствительные к температуре мутации стали проще: создание условных мутаций с помощью чувствительных к температуре интеинов, которые функционируют в различных температурных диапазонах». Генетика. 183 (1): 13–22. Дои:10.1534 / генетика.109.104794. ЧВК 2746138. PMID 19596904.
- ^ ден Даннен JT Антонаракис SE (Январь 2000 г.). «Расширения номенклатуры мутаций и предложения для описания сложных мутаций: обсуждение». Человеческая мутация. 15 (1): 7–12. Дои:10.1002 / (SICI) 1098-1004 (200001) 15: 1 <7 :: AID-HUMU4> 3.0.CO; 2-N. PMID 10612815.
- ^ Йонссон, Хакон; Сулем, Патрик; Кер, Бирте; Кристмундсдоттир, Снаэдис; Цинк, Флориан; Хьяртарсон, Эйрикур; Hardarson, Marteinn T .; Hjorleifsson, Kristjan E .; Eggertsson, Hannes P .; Гудьонссон, Сигурджон Аксель; Уорд, Лукас Д. (сентябрь 2017 г.). «Влияние родителей на de novo мутации зародышевой линии человека в 1548 трио из Исландии». Природа. 549 (7673): 519–522. Bibcode:2017Натура.549..519J. Дои:10.1038 / природа24018. ISSN 1476-4687. PMID 28959963. S2CID 205260431.
- ^ Донигер С.В., Ким Х.С., Суэйн Д., Коркуера Д., Уильямс М., Янг С.П., Фэй Джей Си (август 2008 г.). Причард Дж. К. (ред.). «Каталог нейтрального и вредного полиморфизма дрожжей». PLOS Genetics. 4 (8): e1000183. Дои:10.1371 / journal.pgen.1000183. ЧВК 2515631. PMID 18769710.
- ^ Ионов Ю., Пейнадо М.А., Малхосян С., Шибата Д., Перучо М. (июнь 1993 г.). «Повсеместные соматические мутации в простых повторяющихся последовательностях раскрывают новый механизм канцерогенеза толстой кишки». Природа. 363 (6429): 558–61. Bibcode:1993Натура.363..558I. Дои:10.1038 / 363558a0. PMID 8505985. S2CID 4254940.
- ^ Araten DJ, Golde DW, Zhang RH, Thaler HT, Gargiulo L, Notaro R, Luzzatto L (сентябрь 2005 г.). «Количественное измерение скорости соматических мутаций человека». Исследования рака. 65 (18): 8111–7. Дои:10.1158 / 0008-5472.CAN-04-1198. PMID 16166284.
- ^ "'Безжизненные прионные белки способны эволюционировать'". Здоровье. Новости BBC. Лондон. 1 января 2010 г. В архиве из оригинала 25 сентября 2015 г.. Получено 10 октября 2015.
- ^ Салливан А.Д., Виггинтон Дж., Киршнер Д. (август 2001 г.). «Мутация корецептора CCR5Delta32 влияет на динамику эпидемии ВИЧ и выбирается ВИЧ». Труды Национальной академии наук Соединенных Штатов Америки. 98 (18): 10214–9. Bibcode:2001ПНАС ... 9810214С. Дои:10.1073 / pnas.181325198. ЧВК 56941. PMID 11517319.
- ^ "Тайна черной смерти". Тайны мертвых. Сезон 3. Эпизод 2. 30 октября 2002 г. PBS. В архиве из оригинала 12 октября 2015 г.. Получено 10 октября 2015. Фон эпизода.
- ^ Гальвани А.П., Слаткин М (Декабрь 2003 г.). «Оценка чумы и оспы как исторических факторов селективного воздействия на аллель устойчивости к ВИЧ CCR5-Delta 32». Труды Национальной академии наук Соединенных Штатов Америки. 100 (25): 15276–9. Bibcode:2003ПНАС..10015276Г. Дои:10.1073 / pnas.2435085100. ЧВК 299980. PMID 14645720.
- ^ Конотей-Ахулу Ф. «Часто задаваемые вопросы [FAQ's]». Sicklecell.md. Архивировано из оригинал 30 апреля 2011 г.. Получено 16 апреля 2010.
- ^ Хьюз Д., Андерссон Д.И. (сентябрь 2017 г.). «Эволюционные траектории устойчивости к антибиотикам». Ежегодный обзор микробиологии. 71: 579–596. Дои:10.1146 / annurev-micro-090816-093813. PMID 28697667.
- ^ Сегурель Л., Бон С. (август 2017 г.). «Об эволюции персистенции лактазы у людей». Ежегодный обзор геномики и генетики человека. 18: 297–319. Дои:10.1146 / annurev-genom-091416-035340. PMID 28426286.
- ^ а б c Bowler PJ (1992) [1983]. Затмение дарвинизма. п. 198.
- ^ Смоковитис В.Б. (1996). «Объединяющая биология: эволюционный синтез и эволюционная биология». Журнал истории биологии. Издательство Принстонского университета. 25 (1): 1–65. Дои:10.1007 / bf01947504. ISBN 978-0-691-03343-3. LCCN 96005605. OCLC 34411399. PMID 11623198. S2CID 189833728.
- ^ Халльгримссон Б., Холл Б.К. (2011). Вариация: центральное понятие в биологии. Академическая пресса. п. 18.
- ^ Сьюэлл Райт. (1984). Эволюция и генетика популяций: генетика и биометрические основы Том 1. Издательство Чикагского университета. п. 10
- ^ De Vries H (1905). Виды и разновидности: их происхождение от мутации.
- ^ Бейтсон В (1894). Материалы для изучения изменчивости, рассматриваемой с особым вниманием к неоднородности происхождения видов.
- ^ Punnett RC (1915). Мимикрия у бабочек. Издательство Кембриджского университета.
- ^ Mayr E (2007). В чем уникальность биологии ?: соображения об автономности научной дисциплины. Издательство Кембриджского университета.
- ^ а б Provine WB (2001). Истоки теоретической популяционной генетики, с новым послесловием. Издательство Чикагского университета, Чикаго. С. 56–107.
- ^ а б Штольцфус А, Кабель К (2014). «Менделирующий мутационизм: забытый эволюционный синтез». Журнал истории биологии. 47 (4): 501–46. Дои:10.1007 / s10739-014-9383-2. PMID 24811736. S2CID 23263558.
- ^ Халл DL (1985). «Дарвинизм как историческая сущность: историографическое предложение». В Кон Д. (ред.). Дарвиновское наследие. Издательство Принстонского университета. стр.773–812.
- ^ Йоль ГУ (1902 г.). «Законы Менделя и их вероятные отношения к межрасовой наследственности». Новый Фитолог. 1 (10): 226–227. Дои:10.1111 / j.1469-8137.1902.tb07336.x.
- ^ Гулд SJ (1982). Использование heresey; введение в книгу Ричарда Гольдшмидта Материальная основа эволюции. Издательство Йельского университета. стр. xiii – xlii. ISBN 0300028237.
- ^ Русе М (1996). Монада человеку: концепция прогресса в эволюционной биологии. Издательство Гарвардского университета. стр.412–413. ISBN 978-0-674-03248-4.
- ^ Штольцфус А (2014). «В поисках эволюции, управляемой мутациями». Эволюция и развитие. 16: 57–59. Дои:10.1111 / ede.12062.
- ^ Futuyma DJ (2015). Серрелли Э., Гонтье Н. (ред.). Может ли современная эволюционная теория объяснить макроэволюцию? (PDF). Макроэволюция. Springer. С. 29–85.
внешняя ссылка
- Джонс С, Вулфсон А, Куропатка L (6 декабря 2007 г.). «Генетическая мутация». В наше время. BBC Radio 4. Получено 18 октября 2015.
- Лиу, Стефани (5 февраля 2011 г.). "Все о мутациях". НАДЕЖДЫ. Образовательный проект Хантингтона в области образования в Стэнфорде. Получено 18 октября 2015.
- «Базы данных локус-специфических мутаций». Лейден, Нидерланды: Медицинский центр Лейденского университета. Получено 18 октября 2015.
- «Добро пожаловать на сайт Mutalyzer». Лейден, Нидерланды: Медицинский центр Лейденского университета. Получено 18 октября 2015. - The Мутализатор интернет сайт.


