Адаптивное излучение - Adaptive radiation
В эволюционная биология, адаптивное излучение это процесс, в котором организмы быстро диверсифицируются от предковых видов к множеству новых форм, особенно когда изменение окружающей среды делает доступными новые ресурсы, изменяет биотические взаимодействия или открывает новые экологические ниши.[1][2] Начиная с одного предка, этот процесс приводит к видообразование и фенотипический адаптация множества видов, демонстрирующих различные морфологический и физиологические особенности. Прототипным примером адаптивной радиации является вид вьюрков на Галапагосских островах ("Зяблики Дарвина "), но примеры известны со всего мира.
Характеристики
Для идентификации адаптивного излучения можно использовать четыре функции:[2]
- Общая родословная составляющих видов: в частности, недавний происхождение. Обратите внимание, что это не то же самое, что монофилия в котором все потомки общего предка включены.
- Связь фенотипа и окружающей среды: a существенный связь между средой и морфологическими и физиологическими особенностями, используемыми для эксплуатации этой среды.
- Полезность черты: производительность или фитнес преимущества значений черт в соответствующей среде.
- Быстрое видообразование: наличие одного или нескольких всплески в появлении новых видов примерно в то время, когда происходит экологическое и фенотипическое расхождение.
Условия
Считается, что адаптивная радиация вызывается экологической возможностью[3] или новая адаптивная зона.[4] Источниками экологической возможности может быть потеря антагонистов (конкуренты или же хищники ), эволюция ключевой инновации или распространение в новой среде. Любая из этих экологических возможностей может привести к увеличению численности населения и ослаблению стабилизирующий (сдерживающий) выбор. В качестве генетическое разнообразие положительно коррелированный с численностью населения[5] расширенная популяция будет иметь большее генетическое разнообразие по сравнению с предковой популяцией. С уменьшенным выбором стабилизации фенотипический разнообразие также может увеличиваться. Кроме того, усилится внутривидовая конкуренция, способствуя дивергентному отбору с целью использования более широкого диапазона ресурсов. Этот экологический выпуск дает возможность экологическое видообразование и, следовательно, адаптивное излучение.[3]
Захват новой среды может происходить при следующих условиях:[6]
- Открылась новая среда обитания: например, вулкан может создать новую землю посреди океана. Это имеет место в таких местах, как Гавайи и Галапагосские острова. Для водных видов создание новой большой озерной среды обитания могло бы служить той же цели; тектоническое движение, сформировавшее Восточноафриканский рифт, что в конечном итоге привело к созданию Озера Рифт-Валли, является примером этого. An событие вымирания могут эффективно достичь того же результата, открывая ниши, которые ранее были заняты видами, которые больше не существуют.
- Эта новая среда обитания относительно изолирована. Когда на материке извергается вулкан и разрушает прилегающий лес, вполне вероятно, что наземные виды растений и животных, которые раньше жили в разрушенном регионе, будут повторно заселены без значительного развития. Однако, если новообразованная среда обитания изолирована, виды, которые ее колонизируют, скорее всего, будут случайными и необычными.
- В новой среде обитания много свободного места. Редкий колонист может только адаптивно излучать столько форм, сколько существует ниш.[4]
Примеры
Зяблики Дарвина
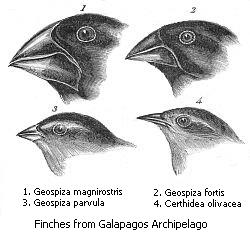
Зяблики Дарвина часто используются в учебниках по адаптивной радиации. Сегодня зяблики Дарвина, представленные примерно 15 видами, являются эндемиками Галапагосских островов, хорошо приспособленными к особому пищевому поведению (хотя один из видов, кокосовый вьюрок (Pinaroloxias inornata ), встречается не на Галапагосских островах, а на остров Кокос к югу от Коста-Рика ).[7] Зяблики Дарвина на самом деле не зяблики в истинном смысле, но являются членами семьи танагеров Thraupidae, и происходят от единственного предка, прибывшего на Галапагосские острова из материковой части Южной Америки, возможно, всего 3 миллиона лет назад.[8] За исключением кокосовых вьюрков, все виды дарвиновских вьюрков обычно широко распространены на Галапагосских островах и занимают одну и ту же нишу на каждом острове. Для наземных зябликов эта ниша представляет собой рацион из семян, и у них есть толстые клювы, чтобы облегчить потребление этих твердых материалов.[7] Наземные зяблики также специализируются на поедании семян определенного размера: крупный наземный зяблик (Geospiza magnirostris ) - самый крупный вид зябликов Дарвина и имеет самый толстый клюв, позволяющий вскрывать самые твердые семена, мелкий наземный зяблик (Geospiza fuliginosa ) имеет меньший клюв для поедания мелких семян, а зяблик среднего размера (Geospiza fortis ) имеет клюв среднего размера для оптимального потребления семян среднего размера (относительно G. magnirostris и G. fuliginosa).[7] Есть некоторое совпадение: например, самые крепкие наземные зяблики среднего размера могут иметь клювы больше, чем у самых маленьких крупных наземных зябликов.[7] Из-за этого совпадения бывает трудно отличить виды на глаз, хотя их песни различаются.[7] Эти три вида часто встречаются сочувственно, а во время сезона дождей на Галапагосских островах, когда еды много, они мало специализируются и едят те же легкодоступные продукты.[7] Было непонятно, почему их клювы были так приспособлены, пока Питер и Розмари Грант изучили их пищевое поведение в длительный засушливый сезон и обнаружили, что при недостатке пищи наземные зяблики используют свои специализированные клювы, чтобы поедать семена, которые они лучше всего подходят для еды, и таким образом избегают голода.[7]
Другие зяблики на Галапагосских островах точно так же уникально приспособлены к своей нише. Кактусовые зяблики (Геоспиза sp.) имеют несколько более длинные клювы, чем у наземных зябликов, которые служат двойной цели: позволяют им питаться Опунция нектар и пыльца кактусов во время цветения этих растений, но на семенах в остальное время года.[7] Славка-зяблик (Certhidea sp.) имеют короткие заостренные клювы для поедания насекомых.[7] Зяблик дятел (Camarhynchus pallidus ) имеет тонкий клюв, которым он ковыряет древесину в поисках насекомых; он также использует маленькие палочки, чтобы добраться до добычи насекомых внутри дерева, что делает его одним из немногих животные, которые используют инструменты.[7]
Механизм, с помощью которого зяблики первоначально диверсифицировались, все еще является областью активных исследований. Одно из предположений состоит в том, что зяблики могли иметь неадаптивную, аллопатрическое видообразование событие на отдельных островах архипелага, так что когда они снова слились на некоторых островах, они смогли сохранить репродуктивная изоляция.[8] Когда они возникли в симпатрии, предпочтение было отдано нишевой специализации, так что разные виды менее напрямую конкурировали за ресурсы.[8] Вторым, симпатрическим событием была адаптивная радиация.[8]
Цихлиды Великих африканских озер
В гаплохром цихлида рыбы в Великие озера из Восточноафриканский рифт (особенно в Озеро Танганьика, Озеро Малави, и Озеро Виктория ) образуют наиболее конкретный современный пример адаптивного излучения.[9][10][11] Считается, что в этих озерах обитает около 2000 различных видов цихлид, имеющих широкий спектр экологических ролей и морфологических характеристик.[12] Цихлиды в этих озерах выполняют почти все роли, которые обычно выполняются многими семействами рыб, в том числе хищниками, падальщиками и травоядными животными, с различными зубными рядами и формой головы, соответствующими их диетическим привычкам.[11] В каждом случае радиационные события произошли всего несколько миллионов лет назад, что делает особенно заметным высокий уровень видообразования.[11][10][9] Несколько факторов могли быть ответственны за это разнообразие: наличие множества ниш, вероятно, способствовало специализации, поскольку в озерах присутствует немного других таксонов рыб (это означает, что симпатрическое видообразование было наиболее вероятным механизмом для начальной специализации).[9] Кроме того, постоянные изменения уровня воды в озерах в течение плейстоцена (которые часто превращали самые большие озера в несколько меньших) могли создать условия для вторичного аллопатрического видообразования.[11][9]
Цихлиды Танганьики
Озеро Танганьика это место, откуда произошли почти все линии цихлид Восточной Африки (включая как речные, так и озерные виды).[13] Таким образом, виды в озере составляют единое адаптивное радиационное событие, но не образуют единого монофилетический клады.[13] Озеро Танганьика также является наименее специфичным из трех крупнейших африканских Великих озер, где обитает всего около 200 видов цихлид;[10] однако эти цихлиды более морфологически дивергентны и экологически отличны, чем их аналоги из озер Малави и Виктория, артефакта древней фауны цихлид озера Танганьика. Считается, что само озеро Танганьика образовалось 9–12 миллионов лет назад, что в последнее время ограничивает возраст фауны цихлид в озере.[10] Многие цихлиды Танганьики ведут очень специфический образ жизни. Гигантская или императорская цихлида (Boulengerochromis microlepis ) - рыбоядное животное, которое часто считается самым большим из всех цихлид (хотя за этот титул оно конкурирует с южноамериканскими Цихла теменсис, крапчатый павлиний окунь).[10] Считается, что гигантские цихлиды нерестятся только один раз, размножаясь на третьем году жизни и защищая своих детенышей, пока они не достигнут большого размера, прежде чем через некоторое время погибнуть от голода.[10] Три вида Альтолампрологус также являются рыбоядными, но со сжатым с боков телом и толстой чешуей, позволяющей им загонять добычу в тонкие трещины в скалах, не повреждая кожу.[10] Plecodus straeleni развились большие, странно изогнутые зубы, которые предназначены для того, чтобы соскребать чешую со сторон других рыб, которые являются ее основным источником пищи.[10] Гнатохромис пермаксиллярный обладает большим ртом с выступающей верхней губой и питается, открывая его вниз на песчаное дно озера, всасывая мелких беспозвоночных.[10] Некоторые цихлиды Танганьики выращивают раковины, а это означает, что пары откладывают и оплодотворяют свои яйца внутри пустых раковин на дне озера.[10] Lamprologus callipterus это самый уникальный вид, вынашивающий яйца: самцы длиной 15 см собирают коллекции раковин и охраняют их в надежде привлечь самок (длиной около 6 см) для откладывания яиц в этих раковинах.[10] Эти доминирующие самцы должны защищать свою территорию от трех типов соперников: (1) другие доминирующие самцы, стремящиеся украсть раковины; (2) молодые самцы-кроссовки, желающие оплодотворить яйца на территории доминирующего самца; и (3) крошечные, 2–4 см «паразитические карликовые» самцы, которые также пытаются ворваться и оплодотворить яйца на территории доминирующего самца.[10] Эти паразитические карликовые самцы никогда не вырастают до размеров доминантных самцов, а потомство самцов доминантных и паразитических карликовых самцов вырастает со стопроцентной точностью в форму своих отцов.[10] Помимо этих примеров существует ряд других узкоспециализированных цихлид Танганьики, в том числе адаптированных для жизни в открытой воде озера на глубине до 200 м.[10]
Цихлиды Малави
Цихлиды озера Малави составляют «стаю видов», насчитывающую до 1000 эндемичных видов.[11] Только семь видов цихлид в озере Малави не входят в состав видовой стаи: восточные счастливые (Astatotilapia calliptera ), сонгва (Серранохромис робустус ) и пять видов тилапии (роды Ореохромис и Коптодон ).[11] Все остальные виды цихлид в озере являются потомками одного первоначального вида колонистов, который сам произошел от предков Танганьика.[13] Считается, что общий предок стаи видов Малави достиг озера не ранее 3,4 миллиона лет назад, что сделало малавийские цихлиды особенно быстрой диверсификацией до их нынешнего количества.[11] Цихлиды Малави имеют такой же диапазон пищевого поведения, что и цихлиды Танганьики, но также имеют признаки гораздо более недавнего происхождения. Например, все представители стаи видов Малави являются пастухи, то есть самка держит яйца во рту, пока они не вылупятся; Почти у всех видов яйца также оплодотворяются во рту самки, а у некоторых видов самки продолжают охранять своих мальков во рту после вылупления.[11] Самцы большинства видов при спаривании демонстрируют преимущественно синюю окраску. Однако из Малави известен ряд особенно расходящихся видов, включая рыбоядных. Nimbochromis livingtonii, который лежит на боку в субстрате до тех пор, пока маленькие цихлиды, возможно, привлеченные его сломанным белым узором, не придут осмотреть хищника - после чего их быстро съедят.[11]
Виктория цихлиды
Цихлиды озера Виктория также представляют собой стаю видов, когда-то насчитывавших около 500 или более видов.[9] Преднамеренная интродукция нильского окуня (Поздний нилотический ) в 1950-х годах оказались катастрофическими для цихлид Виктория, а коллективная биомасса стаи разновидностей цихлид Виктория существенно снизилась, и неизвестное количество видов вымерло.[14] Тем не менее, первоначальный диапазон морфологического и поведенческого разнообразия, наблюдаемый в фауне цихлид озера, все еще в основном присутствует сегодня, если находится под угрозой исчезновения.[9] Сюда снова входят цихлиды, специализирующиеся на нишах по всему трофическому спектру, как в Танганьике и Малави, но опять же, есть выдающиеся. Виктория известна как место обитания многих видов рыбоядных цихлид, некоторые из которых питаются, высасывая содержимое изо рта самок.[14] Цихлиды Виктории представляют собой гораздо более молодую радиацию, чем даже у озера Малави, с оценками возраста стаи от 200000 лет до 14000 лет.[9]
Адаптивная радиация на Гавайях

Гавайи из-за своей изоляции, недавнего происхождения и большой площади суши здесь произошел ряд адаптивных радиационных событий. Три самых известных примера этих излучений представлены ниже, хотя такие насекомые, как гавайский дрозофилид мухи и Гипосмокома бабочки также подверглись адаптивной радиации.[15][16]
Гавайские медовые растения
В Гавайские медовые растения образуют большую, очень морфологически разнообразную группу видов, которая начала излучать свет еще в первые дни существования Гавайского архипелага. Хотя сегодня известно, что только 17 видов сохраняются на Гавайях (еще 3 могут исчезнуть или не вымереть), до полинезийской колонизации архипелага существовало более 50 видов (с момента открытия островов вымерло от 18 до 21 вида. западными людьми). Гавайские медолазы известны своими клювами, которые приспособлены для удовлетворения широкого диапазона диетических потребностей: например, клювом ʻakiapōlāʻau (Hemignathus wilsoni ) характеризуется короткой острой нижней челюстью для соскабливания коры с деревьев, а гораздо более длинная изогнутая верхняя челюсть используется для зондирования древесины на предмет насекомых.[7] Между тем, ʻiʻiwi (Drepanis coccinea ) имеет очень длинный изогнутый клюв для проникновения нектара глубоко в Лобелия цветы.[15] Целая стая гавайских медоносов, племя Пситтирострини, состоит из толстоклювых птиц, питающихся в основном семенами, таких как лайсанский зяблик (Telespiza cantans ).[15] По крайней мере, в некоторых случаях сходная морфология и поведение, по-видимому, конвергентно эволюционировали среди гавайских медоносов; например, короткие заостренные клювы Loxops и Ореомистис эволюционировали отдельно, несмотря на то, что однажды сформировали оправдание для объединения двух родов вместе.[17] Считается, что гавайские медоносы произошли от одного общего предка около 15-20 миллионов лет назад, хотя по оценкам, всего 3,5 миллиона лет назад.[18]
Гавайские серебряные мечи

Адаптивная радиация не является явлением строго позвоночных, и примеры известны также среди растений. Самый известный пример адаптивной радиации у растений - вполне вероятно, гавайский серебряные мечи, названный в честь обитателей альпийской пустыни Аргироксифий вид с длинными серебристыми листьями, которые живут до 20 лет, прежде чем вырастут на один цветущий стебель, а затем погибнут.[15] Гавайский альянс серебряных мечей состоит из двадцати восьми видов гавайских растений, которые, помимо одноименных серебряных мечей, включают деревья, кусты, виноградные лозы, подушки и многое другое.[18] Считается, что альянс серебряного меча возник на Гавайях не более 6 миллионов лет назад, что сделало это событие одним из самых молодых на Гавайях, связанных с адаптивной радиацией.[18] Это означает, что серебряные мечи эволюционировали на современных высоких островах Гавайев и произошли от одного общего предка, прибывшего на Кауаи из западной части Северной Америки.[18] Ближайшими современными родственниками серебряных мечей сегодня являются калифорнийские тарвины семейства. Сложноцветные.[18]
Гавайские лобелиоиды
Гавайи также являются местом отдельного крупного события адаптивной радиации растений: Гавайские лобелиоиды. Гавайские лобелиоиды значительно более специфичны, чем серебряные мечи, возможно, потому, что они присутствовали на Гавайях гораздо дольше: они произошли от единственного общего предка, который прибыл на архипелаг до 15 миллионов лет назад.[18] Сегодня гавайские лобелиоиды образуют кладу из более чем 125 видов, включая суккуленты, деревья, кустарники, эпифиты и т. Д.[19] Многие виды были потеряны до исчезновения, а многие из выживших видов оказались под угрозой исчезновения.
Карибские анолисы
Анол Ящерицы широко распространены в Новом Свете, от юго-востока США до Южной Америки. В настоящее время признано более 400 видов, часто относящихся к одному роду (Анолис ), они представляют собой одно из крупнейших радиационных событий среди всех ящериц.[20] Излучение анолов на материке в значительной степени было процессом видообразования и не в значительной степени адаптивным, но анолы на каждом из Большие Антильские острова (Куба, Hispaniola, Пуэрто-Рико, и Ямайка ) адаптивно излучались отдельными сходящимися способами.[21] На каждом из этих островов анолии эволюционировали с таким последовательным набором морфологических приспособлений, что каждый вид может быть отнесен к одному из шести ".экоморфы «: ствол – земля, ствол – крона, трава – куст, крона – великан, веточка и ствол.[21] Возьмем, к примеру, корону-гигантов с каждого из этих островов: Кубинского Anolis luteogularis, Эспаньола Анолис рикорди, Пуэрто-Рико Анолис Кувьери, и Ямайский Анолис Гармани (Куба и Эспаньола являются домом для более чем одного вида кроны-гиганта).[20] Все эти анолы представляют собой крупные виды, обитающие в куполе, с большими головами и большими пластинками (чешуйки на нижней стороне пальцев рук и ног, которые важны для тяги при лазании), и все же ни один из этих видов не имеет особенно близкого родства и, кажется, эволюционировал эти похожие черты независимо друг от друга.[20] То же самое можно сказать и о других пяти экоморфах на четырех крупнейших островах Карибского моря. Как и в случае с цихлидами трех крупнейших африканских Великих озер, каждый из этих островов является домом для своих сходящихся Анолис адаптивное радиационное событие.
Другие примеры
Выше представлены наиболее хорошо задокументированные примеры современного адаптивного излучения, но известны и другие примеры. На Мадагаскар, птицы семейства Vangidae отмечены очень отчетливой формой клюва, соответствующей их экологической роли.[22] Мадагасканец каминная полка лягушки излучались в формы, которые отражают другие тропические фауны лягушек, с ярко окрашенными мантеллами (Мантелла ), эволюционировав конвергентно с неотропическими ядовитыми лягушками-стрелками из Dendrobatidae, а древесный Boophis виды являются мадагаскарским эквивалентом древесные лягушки и стеклянные лягушки. В псевдоксирофин змеи Мадагаскара превратились в ископаемые, древесные, наземные и полуводные формы, которые сходятся с фаунами колуброидов в остальном мире. Эти мадагаскарские образцы значительно старше, чем большинство других представленных здесь примеров: фауна Мадагаскара развивалась изолированно с тех пор, как остров отделился от Индии около 88 миллионов лет назад, а Mantellidae возникли около 50 миллионов лет назад.[23][24] Известны более старые примеры: K-Pg вымирание, который вызвал исчезновение динозавров и большинства других рептилий мегафауны 65 миллионов лет назад, рассматривается как спровоцировавший глобальное событие адаптивной радиации, которое создало разнообразие млекопитающих, существующее сегодня.[6]
Смотрите также
- Кембрийский взрыв - наиболее заметное эволюционное радиационное событие
- Эволюционное излучение - более общий термин для описания любого излучения
- Список адаптивных излучаемых гавайских медоносов по форме
- Список адаптивных излучаемых сумчатых по форме
- Неадаптивное излучение
Рекомендации
- ^ Ларсен, Кларк С. (2011). Наши истоки: открытие физической антропологии (2-е изд.). Нортон. п. A11.
- ^ а б Шлютер, Дольф (2000). Экология адаптивного излучения. Издательство Оксфордского университета. С. 10–11. ISBN 0-19-850523-X.
- ^ а б Yoder, J. B .; Clancey, E .; Des Roches, S .; Eastman, J.M .; Gentry, L .; Godsoe, W .; Hagey, T. J .; Jochimsen, D .; Oswald, B.P .; Робертсон, Дж .; Сарвер, Б. А. Дж. (2010). «Экологические возможности и происхождение адаптивных излучений: экологические возможности и происхождение адаптивных излучений». Журнал эволюционной биологии. 23 (8): 1581–1596. Дои:10.1111 / j.1420-9101.2010.02029.x. PMID 20561138. S2CID 25334971.
- ^ а б Симпсон, Г. (1949). Темп и мода в эволюции. Нью-Йорк: издательство Колумбийского университета. PMID 21012247.
- ^ Гаага, штат Мэриленд; Рутман, Э. Дж (2016). «Влияет ли размер популяции на генетическое разнообразие? Тест с симпатрическими видами ящериц». Наследственность. 116 (1): 92–98. Дои:10.1038 / hdy.2015.76. ISSN 0018-067X. ЧВК 4675878. PMID 26306730.
- ^ а б Страуд и Лосос (2016). «Экологические возможности и адаптивная радиация». Ежегодный обзор экологии, эволюции и систематики. 47: 507–532. Дои:10.1146 / annurev-ecolsys-121415-032254.
- ^ а б c d е ж грамм час я j k Вайнер, Джонатан (1994). Клюв вьюрка: история эволюции в наше время. Нью-Йорк: Альфред А. Кнопф, Inc., стр.207. ISBN 0-679-40003-6.
- ^ а б c d Петрен, К .; Grant, P.R .; Grant, B.R .; Келлер, Л. Ф. (2005). «Сравнительная ландшафтная генетика и адаптивная радиация зябликов Дарвина: роль периферической изоляции». Молекулярная экология. 14 (10): 2943–2957. Дои:10.1111 / j.1365-294x.2005.02632.x. PMID 16101765. S2CID 20787729.
- ^ а б c d е ж грамм Зеехаузен, Оле (1996). Скальные цихлиды озера Виктория: таксономия, экология и распространение. Вердуйн Цихлиды. ISBN 90-800181-6-3.
- ^ а б c d е ж грамм час я j k л м п Konings, Ad (2015). Цихлиды Танганьики в их естественной среде обитания, 3-е издание. Эль-Пасо, Техас: Cichlid Press. С. 8, 325–328. ISBN 978-1-932892-18-5.
- ^ а б c d е ж грамм час я Konings, Ad (2016). Цихлиды Малави в их естественной среде обитания, 5-е издание. Эль-Пасо, Техас: Cichlid Press. ISBN 978-1-932892-23-9.
- ^ Лосос, Джонатан Б. (2010). «Адаптивная радиация, экологические возможности и эволюционный детерминизм». Американский натуралист. 175 (6): 623–639. Дои:10.1086/652433. PMID 20412015. S2CID 1657188.
- ^ а б c Зальцбургер; Мак; Верхейен; Мейер (2005). «Из Танганьики: генезис, взрывное видообразование, ключевые инновации и филогеография гаплохромовых цихлид». BMC Эволюционная биология. 5:17: 17. Дои:10.1186/1471-2148-5-17. ЧВК 554777. PMID 15723698.
- ^ а б Goldschmidt, Tijs (1996). Dreampond Дарвина: Драма на озере Виктория. Кембридж, Массачусетс: MIT Press. ISBN 978-0262071789.
- ^ а б c d Олсен, Стив (2004). Эволюция на Гавайях: дополнение к учению об эволюции и природе науки. Вашингтон, округ Колумбия: The National Academies Press. ISBN 0-309-52657-4.
- ^ Хейнс; Шмитц; Рубинофф (2014). «Древнее разнообразие бабочек гипосмокомы на Гавайях». Nature Communications. 5: 3502. Дои:10.1038 / ncomms4502. PMID 24651317.
- ^ Рединг, DM; Фостер, JT; Джеймс, ВЧ; Пратт, HD; Флейшер, RC (2009). «Конвергентная эволюция« лианы »в гавайской радиации медоносов». Письма о биологии. 5 (2): 221–224. Дои:10.1098 / рсбл.2008.0589. ЧВК 2665804. PMID 19087923.
- ^ а б c d е ж Болдуин, Брюс Дж .; Сандерсон, Майкл Дж. (1998). «Возраст и скорость диверсификации гавайского альянса серебряных мечей (Compositae)». Труды Национальной академии наук. 95 (16): 9402–9406. Bibcode:1998PNAS ... 95.9402B. Дои:10.1073 / пнас.95.16.9402. ЧВК 21350. PMID 9689092.
- ^ Гивниш, Томас Дж; Миллам, Кендра К.; Mast, Austin R; Патерсон, Томас Б; Theim, Terra J; Хипп, Эндрю Л; Хенсс, Джиллиан М; Смит, Джеймс Ф; Вуд, Кеннет Р.; Сыцма, Кеннет Дж (2008-10-14). «Происхождение, адаптивная радиация и разнообразие гавайских лобелиад (Asterales: Campanulaceae)». Труды Королевского общества B: биологические науки. 276 (1656): 407–416. Дои:10.1098 / rspb.2008.1204. ISSN 0962-8452. ЧВК 2664350. PMID 18854299.
- ^ а б c Лосос, Джонатан (2009). Ящерицы в эволюционном дереве: экология и адаптивная радиация анолиев. Окленд, Калифорния: Калифорнийский университет Press. ISBN 978-0520255913.
- ^ а б Иршик, Дункан Дж .; и другие. (1997). «Сравнение эволюционной радиации у ящериц анолиса на материке и Карибского моря». Экология. 78 (7): 2191–2203. Дои:10.2307/2265955. JSTOR 2265955.
- ^ Редди; Дрискелл; Рабоски; Хакетт; Шуленберг (2012). «Диверсификация и адаптивное излучение ванги Мадагаскара». Труды Королевского общества B. 279:1735 (1735): 2062–2071. Дои:10.1098 / rspb.2011.2380. ЧВК 3311898. PMID 22217720.
- ^ "Откуда произошли все виды Мадагаскара?". WebCite. Октябрь 2009 г. Архивировано с оригинал на 2011-03-19. Получено 3 июня, 2018.
- ^ Фэн; Блэкберн; Лян; Хиллис; Будить; Каннателла; Чжан (2017). «Филогеномика показывает быструю одновременную диверсификацию трех основных клад гондванских лягушек на границе мела и палеогена». PNAS. 114 (29): 5864–5870. Дои:10.1073 / pnas.1704632114. ЧВК 5530686. PMID 28673970.
дальнейшее чтение
- Wilson, E. et al. Жизнь на Земле, Wilson, E .; Eisner, T .; Briggs, W .; Dickerson, R .; Метценберг, Р .; O'Brien, R .; Susman, M .; Боггс, В. (Sinauer Associates, Inc., Publishers, Стэмфорд, Коннектикут), c 1974 г. Главы: Умножение видов; Биогеография, pp 824–877. 40 графиков, фотографии видов, а также таблицы, фотографии и т. Д. Галапагосские острова, Гавайи, и Австралия субконтинент, (плюс Св. Елены Остров и др.).
- Лики, Ричард. Происхождение человечества- об адаптивной радиации в биологии и эволюции человека, стр. 28–32, 1994, Orion Publishing.
- Грант, П.Р. 1999. Экология и эволюция зябликов Дарвина. Princeton University Press, Принстон, Нью-Джерси.
- Майр, Эрнст. 2001. Что такое эволюция. Основные книги, Нью-Йорк, штат Нью-Йорк.
- Кемп, A.C. (1978). «Обзор птиц-носорогов: биология и радиация». Живая птица. 17: 105–136.
- Гаврилец, С .; Восе, А. (2005). «Динамические паттерны адаптивного излучения». PNAS. 102 (50): 18040–18045. Bibcode:2005ПНАС..10218040Г. Дои:10.1073 / pnas.0506330102. ЧВК 1312382. PMID 16330783.
- Гаврилец С., Восе А. 2009 г. Динамические паттерны адаптивного излучения: эволюция брачных предпочтений. В Butlin, R.K., J. Bridle, and D. Schluter (eds) Specification and Patterns of Diversity, Cambridge University Press, page. 102–126.
- Болдуин, Брюс Дж .; Сандерсон, Майкл Дж. (1998). «Возраст и скорость диверсификации гавайского альянса серебряных мечей (Compositae)». Труды Национальной академии наук. 95 (16): 9402–9406. Bibcode:1998PNAS ... 95.9402B. Дои:10.1073 / пнас.95.16.9402. ЧВК 21350. PMID 9689092.
- Гаврилец, С .; Лосос, Дж. Б. (2009). «Адаптивное излучение: противопоставление теории данным». Наука. 323 (5915): 732–737. Bibcode:2009Научный ... 323..732G. Дои:10.1126 / science.1157966. PMID 19197052. S2CID 5601085.
- Иршик, Дункан Дж .; и другие. (1997). «Сравнение эволюционной радиации у ящериц анолиса на материке и Карибского моря». Экология. 78 (7): 2191–2203. Дои:10.2307/2265955. JSTOR 2265955.
- Лосос, Джонатан Б. (2010). «Адаптивная радиация, экологические возможности и эволюционный детерминизм». Американский натуралист. 175 (6): 623–639. Дои:10.1086/652433. PMID 20412015. S2CID 1657188.
- Петрен, К .; Grant, P.R .; Grant, B.R .; Келлер, Л. Ф. (2005). «Сравнительная ландшафтная генетика и адаптивная радиация зябликов Дарвина: роль периферической изоляции». Молекулярная экология. 14 (10): 2943–2957. Дои:10.1111 / j.1365-294x.2005.02632.x. PMID 16101765. S2CID 20787729.
- Пинто, Габриэль, Люк Малер, Люк Дж. Хармон и Джонатан Б. Лосос. «Проверка островного эффекта в адаптивной радиации: темпы и закономерности морфологической диверсификации у ящериц анолисов Карибского бассейна и материковой части». NCBI (2008): нет. стр. Интернет. 28 октября 2014 г.
- Рейни, П. Б .; Трависано, М. (1998). «Адаптивное излучение в неоднородной среде». Природа. 394 (6688): 69–72. Bibcode:1998Натура.394 ... 69р. Дои:10.1038/27900. PMID 9665128. S2CID 40896184.
- Шлютер, Д. (1995). «Адаптивная радиация у колюшек: компромиссы в кормлении и росте». Экология. 76 (1): 82–90. Дои:10.2307/1940633. JSTOR 1940633.
- Шлютер, Дольф. Экология адаптивного излучения. Издательство Оксфордского университета, 2000.
- Зеехаузен, О. (2004). «Гибридизация и адаптивная радиация». Тенденции в экологии и эволюции. 19 (4): 198–207. Дои:10.1016 / j.tree.2004.01.003. PMID 16701254.

