Эволюция старения - Evolution of ageing
Запрос в эволюция старения стремится объяснить, почему может развиваться такой пагубный процесс, как старение, и почему продолжительность жизни живых организмов так сильно варьируется. Классические теории эволюции (накопление мутаций, антагонистическая плейотропия и одноразовая сома)[1][2][3] предполагают, что факторы окружающей среды, такие как хищничество, несчастные случаи, болезни, голод и т. д., гарантируют, что большинство организмов, живущих в естественных условиях, не доживут до старости, и поэтому будет очень мало давления для сохранения генетических изменений, которые увеличивают продолжительность жизни. Вместо этого естественный отбор будет сильно отдавать предпочтение генам, которые обеспечивают раннее созревание и быстрое воспроизводство, а отбор по генетическим признакам, способствующим молекулярному и клеточному самоподдержанию, будет снижаться с возрастом для большинства организмов.[4]
Теории и гипотезы
Начало
Август Вейсманн отвечал за интерпретацию и формализацию механизмов Дарвиновский эволюция в современных теоретических рамках. В 1889 году он предположил, что старение является частью жизненной программы, позволяющей освободить место для следующего поколения, чтобы поддерживать жизнеспособность, необходимую для эволюции.[5] Идея о том, что характеристика старения была выбрана (адаптация) из-за ее пагубного воздействия, в значительной степени игнорировалась на протяжении большей части 20-го века, но теоретическая модель предполагает, что альтруистический старение может развиваться, если миграция населения будет незначительной.[6] Позже Вейсманн отказался от своей теории, а затем продолжил свою теорию «запрограммированной смерти».
Естественный отбор это процесс, который позволяет организмам лучше адаптироваться к окружающей среде; прогнозируется, что выживание наиболее приспособленных произведет больше потомства. Естественный отбор воздействует на особенности жизненного цикла, чтобы оптимизировать репродуктивный успех и жизнеспособность. Пригодность в этом контексте означает, насколько вероятно, что организм выживет и будет воспроизводиться. Он основан на окружающей среде, а также относительно других людей в популяции. Примеры жизненных черт включают; возраст и размер при первом размножении, размер и количество рожденных потомков, а также период репродуктивной жизни. Организмы вкладывают энергию в рост, воспроизводство и поддержание, следуя определенной схеме, которая меняется на протяжении всей их жизни из-за компромиссов, которые существуют между различными распределениями энергии. Например, инвестиции в воспроизводство в настоящее время по сравнению с будущим производятся за счет другого. Однако естественный отбор не так эффективен для организмов с возрастом. Накопление мутаций (MA) и антагонистическая плейотропия (AP) - два фактора, которые способствуют старение.[7] И MA, и AP способствуют возрастному ухудшению физической формы.[8] Накопление случайных, зародышевый связанные с возрастом мутировавшие аллели известны как накопление мутаций. Обратите внимание, что соматические мутации не передаются по наследству, они являются лишь источником вариаций в развитии. Исследования проведены на Drosophila melanogaster показали, что накопление мутаций управляет комбинацией аллелей, которые обладают «возрастными аддитивными эффектами», которые вызывают снижение стрессовой реакции и, в конечном итоге, ухудшение физической формы с возрастом.[7] Число делений зародышевых клеток на поколение варьируется среди клонов и относительно размера генома; для человека; На одно поколение у мужчин происходит 401 деление половых клеток, а у женщин - 31.[9]
Накопление мутаций
Первая современная теория млекопитающее старение было сформулировано Питер Медавар в 1952 г. Эта теория сформировалась в предыдущее десятилетие с Дж. Б. С. Холдейн и его тень выделения концепция. Развитие человеческой цивилизации сместило избирательную тень, поскольку условия, в которых сейчас живут люди, включают улучшение качества продуктов питания, условий жизни и здравоохранения. Это улучшенное здравоохранение включает современную медицину, такую как антибиотики и новые медицинские технологии.[10] Несколько исследований в Дрозофила показали, что возраст проявления новых вредных мутаций определяет их влияние на смертность. Однако в целом; хотя их частота увеличивается, их влияние и вариабельность с возрастом уменьшается.
Не существует теории, объясняющей, как эти вредные мутации влияют на приспособленность в разном возрасте и на эволюцию старения.[11][12] Их идея заключалась в том, что старение - это вопрос пренебрежения, поскольку природа - место высокой конкуренции. Почти все животные умирают в дикой природе от хищников, болезней или несчастных случаев, что снижает средний возраст смерти. Таким образом, нет особых причин, по которым тело должно оставаться в хорошей форме в течение длительного времени, потому что давление отбора низка для признаков, которые сохраняли бы жизнеспособность после того времени, когда большинство животных все равно погибло бы. Болезни обмена веществ возникают из-за низкого спроса на физическую активность в современной цивилизации по сравнению с тем временем, когда людям приходилось добывать корм в дикой природе, чтобы выжить.[10] Теперь, когда избирательная тень сместилась, люди должны иметь дело с этим новым давлением отбора.
Старение считается побочным продуктом физиологии, потому что метаболизм наших клеток создает токсичные продукты, мы получаем мутации с возрастом и у нас не хватает стволовых клеток, которые регенерируют. Почему отбор не обнаружил и не одобрил мутации, которые позволяют нам, например, регенерировать наши клетки или не производить токсический метаболизм? Почему наступила менопауза? Потому что отбор более эффективен в отношении признаков, которые проявляются в раннем возрасте. Мутации, которые сказываются на ранних этапах жизни, улучшают приспособленность гораздо больше, чем мутации, проявляющиеся поздно. Большинство людей уже размножаются до того, как проявятся какие-либо болезни; это означает, что родители передадут свои аллели своим потомкам до того, как у них появятся какие-либо проблемы с приспособленностью, и поэтому «слишком поздно» для отбора.
Две теории; неадаптивные и адаптивные, используются для объяснения эволюции старения, то есть снижения воспроизводства с возрастом.[8] Неадаптивная теория предполагает, что эволюционное ухудшение возраста человека происходит в результате накопления вредных мутаций в зародышевой линии.[8] Эти вредные мутации начинают проявляться в конце жизни, когда мы становимся слабыми / шатающимися и уже размножаемся, это означает, что Естественный отбор не могут воздействовать на них, потому что воспроизведение закончилось. Исследования выполнены один Drosophila melanogaster показали обратную зависимость между средним оптимальным возрастом зрелости и частотой мутаций на ген.[13] Накопление мутаций влияет на распределение энергии и времени, которые направляются на рост и размножение на протяжении всей жизни организма, особенно в период репродуктивной жизни из-за того, что накопление мутаций ускоряет старение, это означает, что организмы должны достичь оптимального возраста. зрелости в более молодом возрасте, поскольку продолжительность их репродуктивной жизни сокращается из-за накопленных мутаций.[13]
Мутации случаются, и они совершенно случайны в зависимости от потребностей в окружающей среде и приспособленности. Мутации могут быть полезными, когда они повышают приспособленность организма, нейтральными, когда они не влияют на приспособленность организма, или вредными, когда они отрицательно влияют на приспособленность организма. Ранее проведенные эксперименты показали, что большинство скоплений мутаций вредны, и лишь некоторые из них полезны. Мутации генов, которые взаимодействуют друг с другом в процессе развития, создают биологическое и, следовательно, фенотипическое разнообразие. Мутации - это генетическая информация, которая выражается между организмами через экспрессия гена, который представляет собой перевод генетической информации в фенотипический характер.[14] Эволюция - это изменение наследуемого признака в популяции из поколения в поколение, поскольку мутации порождают вариации наследуемых признаков; они считаются сырьем для эволюции. Следовательно, накопление полезных мутаций во время процессов развития может генерировать больше фенотипических вариаций, что увеличивает частоту их генов и влияет на способность фенотипической эволюции.[15]
Антагонистическая плейотропия
Теория Медавара подверглась критике и позже получила дальнейшее развитие. Джордж К. Уильямс в 1957 г. Уильямс отметил, что старение может быть причиной многих смертей, даже если животные не «умирают от старости».[1] Он начал свою гипотезу с идеи, что старение может вызвать более раннее старение из-за конкурентного характера жизни. Даже небольшое старение может быть фатальным; следовательно, естественный отбор действительно заботится, и старение не является бесплатным.[16]
В конце концов Уильямс предложил свою гипотезу, названную антагонистической. плейотропия. Сама по себе плейотропия означает одну мутацию, которая оказывает множественное воздействие на фенотип.[17] С другой стороны, антагонистическая плейотропия имеет дело с одним геном, который создает две черты, одна из которых полезна, а другая - вредна. По сути, это относится к генам, которые приносят пользу в начале жизни, но накапливают стоимость позже.[1] Другими словами, антагонистическая плейотропия - это когда результирующая связь между двумя чертами отрицательна. Это когда один фенотипический признак положительно влияет на текущее воспроизводство за счет ускоренного старения, роста и последующего поддержания. Антагонистическая плейотропия является постоянным, если не происходит мутация, изменяющая эффекты первичного локуса.[13]
Хотя сегодня преобладающей теорией является антагонистическая плейотропия, в основном это по умолчанию и не было хорошо проверено. Исследования показали, что это верно не для всех генов и может рассматриваться как частичное подтверждение теории, но это противоречит основной посылке: генетические компромиссы являются основной причиной старения.
В селекционных экспериментах Майкл Р. Роуз выбранный плодовые мошки на долгий срок службы. Основываясь на антагонистической плейотропии, Роуз ожидала, что это наверняка уменьшит их плодородие. Его команда обнаружила, что они могут разводить мух, которые живут более чем в два раза дольше, чем те, с которыми они начали, но, к их удивлению, долгоживущие инбредные мухи на самом деле откладывают больше яиц, чем мухи-недолговечные. Это было еще одной неудачей для теории плейотропии, хотя Роуз утверждает, что это может быть экспериментальный артефакт.[18]
Теория одноразовой сомы
Третья основная теория старения,'Одноразовая сома теория, предложенный в 1977 г. Томас Кирквуд, предполагает, что орган должен распределять доступные ему ресурсы. Организм использует ресурсы, полученные из окружающей среды, для обмена веществ, воспроизводства, ремонта и обслуживания, и тело должно идти на компромисс, когда есть ограниченный запас ресурсов. Теория утверждает, что этот компромисс заставляет организм перераспределять энергию на функцию восстановления, что приводит к постепенному ухудшению состояния организма с возрастом.[19]
Предостережение к этой теории предполагает, что это перераспределение энергии основано на времени, а не на ограничении ресурсов. Эта концепция фокусируется на эволюционном давлении для воспроизводства в установленный, оптимальный период времени, который продиктован возрастом и экологической нишей. Путь к успеху заключается в распределении времени и энергии на восстановление повреждений на клеточном уровне, что приводит к накоплению повреждений и сокращению продолжительности жизни по сравнению с организмами с более длительным сроком службы. беременность. Эта концепция проистекает из сравнительного анализа стабильности генома в клетках млекопитающих.[20][21]
Один противоположный аргумент основан на ограничение калорий (CR) эффект, который продемонстрировал увеличение жизни.[22][23][24] Но не было доказано, что диетические ограничения увеличивают репродуктивный успех (приспособленность) в течение всей жизни, потому что, когда доступность пищи ниже, репродуктивная способность также ниже. Более того, калории - не единственный ресурс, возможно ограниченное снабжение организма, которое может повлиять на многие аспекты физической подготовки.
Теория повреждений / ошибок ДНК
Подобно тому, как мутация и экспрессия ДНК оказывают фенотипическое воздействие на организмы, повреждение ДНК и накопление мутаций также имеют фенотипические последствия для пожилых людей. Повреждение макромолекул, таких как ДНК, РНК и белки, наряду с ухудшением состояния тканей и органов, являются основой старения. Скорость старения, специфичная для каждого вида, обусловлена пагубными изменениями, которые проявляются после репродуктивной фазы. "Митохондриальная ДНК (мтДНК) регулирует клеточный метаболизм, апоптоз и окислительный стресс контроль ».[25] Следовательно, повреждение мтДНК является еще одним фактором, способствующим фенотипам, связанным с старение. Нейродегенерация и рак два фактора, которые проявляются в повреждении ДНК; поэтому мы должны понимать изменение связи между повреждением ДНК и репарацией ДНК по мере старения, чтобы знать возрастные заболевания и разработать такой образ жизни, который, возможно, будет способствовать продлению здоровой жизни.[26]
В Теория повреждений ДНК старения постулирует, что повреждение ДНК повсеместно в биологическом мире и является основной причиной старения.[27] Теория основана на идее, что старение происходит с течением времени из-за повреждения ДНК. Например, исследования мозга и мышц млекопитающих показали, что способность к восстановлению ДНК относительно высока на раннем этапе развития, когда клетки делятся митотически, но существенно снижается, когда клетки входят в постмитотическое состояние.[28][29][30]
Эффект снижения экспрессии способности к репарации ДНК заключается в увеличении накопления повреждений ДНК. Это нарушает ген транскрипция и вызывает прогрессирующую потерю клеточных и тканевых функций, которые определяют старение. В ответ на повреждение ДНК одним из ответов, вызванных окислительным стрессом, является активация p53.[31] Белок p53 связывается с ДНК, а затем стимулирует выработку стр.21, который также известен как ингибитор циклин-зависимой киназы 1. Это гарантирует, что клетка не сможет перейти на следующую стадию деления клетки, если повреждение ДНК не будет восстановлено. Однако клетки p21 могут запускать апоптоз. Апоптоз или запрограммированная гибель клеток связаны с постепенной деградацией иммунной системы, скелетных мышц и нарушением функций, связанных со старением.[32]

Теломерная теория старения
Теломеры повторяются нуклеотид последовательности, защищающие концы нашей хромосомы; они чувствительны к окислительному стрессу и разрушаются во время репликации хромосом. Теломераза - это рибонуклеотид белок, который помогает восстанавливать и заменять деградированные теломеры. Однако с возрастом теломераза подводит нас; он теряет способность восстанавливать теломеры, и все наше тело начинает разваливаться. Это означает, что наши клетки больше не могут делиться или делиться с ошибками, и это является основой старения. Новое исследование также показало, что существует связь между укорочением теломер и митохондриальной дисфункцией.[33] Тем не менее чрезмерная экспрессия теломеразы увеличивает вероятность рака. Если теломеры продолжают восстанавливаться, есть больше шансов на долголетие, но также больше делений клеток и больше шансов мутации, которая может привести к раку. Следовательно, клетка-долгожитель - это просто бомба замедленного действия. Следовательно, повышение активности теломеразы не является решением проблемы; это только позволяет клеткам жить дольше. Однако, Голые землекопы обладают высокой теломеразной активностью; они живут долго и никогда не болеют раком; поэтому они являются исключением из этой гипотезы.[34]
Теории программного обслуживания
Теории, такие как теория «запрограммированной смерти» Вейсмана, предполагают, что ухудшение состояния и смерть из-за старения являются целенаправленным результатом эволюции организма и называются теориями запрограммированного старения или адаптивного старения.
Теория программного обслуживания, основанная на эволюционируемость[35] предполагает, что механизмы восстановления контролируются общим механизмом управления, способным определять условия, такие как ограничение калорийности, и могут быть ответственны за продолжительность жизни у определенных видов. В этой теории методы выживания основаны на механизмах управления, а не на индивидуальном механизме поддержания, который вы видите в непрограммируемой теории старения млекопитающих.
Непрограммируемая теория старения млекопитающих[36] заявляет, что разные виды обладают разными возможностями для обслуживания и ремонта. У долгоживущих видов есть множество механизмов компенсации повреждений, вызванных такими причинами, как окисление, укорочение теломер и другие процессы разрушения. Короткоживущие виды, имеющие более ранний возраст половой зрелости, меньше нуждаются в долгожительстве и, таким образом, не развивают и не сохраняют более эффективные механизмы восстановления. Поэтому повреждения накапливаются быстрее, что приводит к более ранним проявлениям и сокращению продолжительности жизни. Поскольку существует множество проявлений старения, которые, по-видимому, имеют самые разные причины, вполне вероятно, что существует множество различных функций обслуживания и ремонта.
Селективная тень
Избирательное слежение - одна из эволюционных теорий старения, основанная на предположении, что отбор индивидуума обычно уменьшается, когда он по существу проходит фазу полового созревания. В результате это образует тень без учета сексуальной пригодности, которая больше не считается индивидуальным возрастом. Это подтверждает идею о том, что сила естественного отбора уменьшается в зависимости от возраста, которую впервые представили Питер Б. Медевар и Дж. Б. С. Холдейн.
«Ключевое концептуальное открытие, которое позволило Медавару, Уильямсу и другим разработать эволюционную теорию старения, основано на представлении о том, что сила естественного отбора - мера того, насколько эффективно отбор влияет на выживаемость или выживаемость. плодовитость как функция возраста, уменьшается с возрастом ».[37]
Медевар разработал модель, которая подчеркивает это, показывая снижение выживаемости популяции с возрастом, однако скорость воспроизводства остается постоянной. Вероятность воспроизводства обычно достигает пика во время половой зрелости и уменьшается с возрастом индивидуума, в то время как остальная часть населения уменьшается с возрастом, когда они входят в тень отбора. Модель также поддерживает теорию Медеварса о том, что из-за опасных и непредсказуемых условий окружающей среды, таких как болезни, изменения климата и хищники, многие люди умирают вскоре после полового созревания. Следовательно, вероятность того, что человек выживет и пострадает от возрастных эффектов, относительно невелика.
Таким же образом отбираются многие полезные мутации, если они оказывают положительное влияние на человека в более позднем возрасте. Например, если полезная или вредная мутация происходит только после репродуктивной фазы индивидуума, то она не повлияет на приспособленность, которая, следовательно, не может быть выбрана. Впоследствии эти более поздние мутации и эффекты считаются находящимися в «теневой области» отбора ».[38]
Естественный отбор
Выбор группы
Групповой отбор основан на идее, что все члены данной группы либо добьются успеха, либо проиграют вместе в зависимости от обстоятельств. С помощью этого механизма генетический дрейф происходит коллективно для всех в группе и отделяет их от других групп своего собственного вида. Это отличается от индивидуального отбора, поскольку он фокусируется на группе, а не на отдельном человеке.[39]
Часто пострепродуктивные люди также переходят из поколения в поколение: афалины и киты охранять своих внуков; совместное разведение некоторых млекопитающих, многих насекомых и около 200 видов птиц; половые различия в выживаемости антропоидных приматов обычно коррелируют с заботой о потомстве; или Efe За младенцем часто обращаются более 10 человек. Ли разработал формальную теорию, объединяющую отбор по переселенцам (в любом возрасте) с отбором по рождаемости.[40]
Эволюционируемость
Эволюционируемость основана на идее, что организм генетически приспосабливается к окружающей среде.
Скулачева (1997)[41] предположил, что запрограммированное старение помогает процессу эволюции, создавая постепенно увеличивающуюся проблему или препятствие на пути к выживанию и воспроизводству и, следовательно, улучшая выбор полезных характеристик.
Голдсмит (2008)[42] предположил, что, хотя увеличение скорости генерации и скорости эволюции полезно для вида, важно также ограничить продолжительность жизни, чтобы пожилые люди не преобладали в Генофонд.
Модель Ян (2013)[6] также основана на идее о том, что старение ускоряет накопление новых адаптивных генов в местных популяциях. Однако Ян изменил терминологию «эволюционируемость» на «генетическую креативность» на протяжении всей своей статьи, чтобы облегчить понимание того, как старение может иметь более краткосрочные преимущества, чем подразумевает слово «эволюционируемость».
Ленарт и Вашку (2016) [43] также ссылались на способность к эволюции как на главный механизм эволюции старения. Однако они предположили, что даже если фактическая скорость старения может быть адаптацией, само старение неизбежно. Другими словами, эволюция может изменить скорость старения, но какое-то старение, независимо от того, насколько медленно, всегда будет происходить.
Смертность
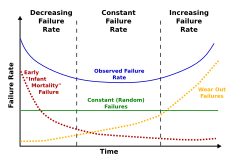
Смертность - это количество смертей в определенной группе за определенный период времени.[44] Существует два типа смертности: собственная и внешняя смертность. Считается, что внутренняя смертность является результатом старения, вызванного внутренними факторами, тогда как внешняя смертность является прямым результатом факторов окружающей среды. Примером может служить то, что у летучих мышей меньше хищников, и, следовательно, у них низкая внешняя смертность. Птицы теплокровны и похожи по размеру на многих мелких млекопитающих, но часто живут в 5–10 раз дольше. У них меньше хищников, чем у наземных млекопитающих, и у них более низкая внешняя смертность.
При исследовании зависимости размера тела от продолжительности жизни можно также заметить, что хищные млекопитающие, как правило, живут дольше, чем хищные, в контролируемой среде, такой как зоопарк или заповедник. Объяснение большой продолжительности жизни приматов (таких как люди, обезьяны и обезьяны) по сравнению с размером тела заключается в том, что их интеллект и их собственная смертность будут ниже.
Болезни
Прогероидные синдромы
Прогероидные синдромы - это генетические заболевания, связанные с преждевременным старением. Прогероидные синдромы характеризуются признаками, которые напоминают признаки физиологического старения, такие как выпадение волос и сердечно-сосудистые заболевания.[45]
Прогерия
Прогерия это генетическое заболевание с одним геном которые вызывают ускорение многих или большинства симптомов старения в детстве. Это поражает примерно 1 из 4-8 миллионов рождений.[46] Те, у кого это заболевание, известны неспособность процветать и имеют ряд симптомов, вызывающих патологии суставов, волос, кожи, глаз и лица.[47] Большинство из них доживают до 13 лет.[48] Хотя термин прогерия применяется, строго говоря, ко всем заболеваниям, характеризующимся симптомами преждевременного старения, и часто используется как таковой, он часто применяется конкретно в отношении синдрома прогерии Хатчинсона – Гилфорда (HGPS). У детей, у которых диагностирован синдром прогерии Хатчинсона-Гилфорда, появляются заметные черты лица, такие как маленькое лицо, тонкие губы, маленький подбородок и выступающие уши. Хотя прогерия может вызвать физические отклонения у ребенка, она не влияет на его моторику или интеллектуальное развитие.[49] Те, у кого есть HGPS, подвержены неврологическим и сердечно-сосудистым расстройствам.[50]
Синдром Вернера
Синдром Вернера, также известная как «прогерия у взрослых», представляет собой еще одно генетическое заболевание с одним геном. это вызвано мутацией в ген wrn.[50] Он поражает примерно 1 человека из 200 000 в США.[51] Этот синдром начинает поражать людей в подростковом возрасте, не позволяя подросткам расти в период полового созревания. Существует четыре общих черты синдрома Вернера: катаракта на обоих глазах изменения кожи, похожие на склеродермия, низкий рост, раннее поседение и выпадение волос.[50] Когда человек достигает двадцати лет, обычно меняется цвет волос, кожа и голос. Средняя продолжительность жизни человека с этим заболеванием составляет около 46 лет.[52] Это состояние также может повлиять на распределение веса между руками, ногами и туловищем.[53] Те, у кого синдром Вернера, подвержены повышенному риску катаракты. диабет 2 типа, различные виды рака и атеросклероз.[51]
Другие прогероидные синдромы
Синдром Блума это редкое аутосомно-рецессивное заболевание, которое характеризуется низким ростом, хромосомной нестабильностью, предрасположенностью к раку и чувствительностью к солнцу.[54] Люди с синдромом Блума также могут иметь проблемы с обучением и иметь повышенный риск развития хронической обструктивной болезни легких (ХОБЛ) и других заболеваний.[55]
Синдром Кокейна представляет собой гомозиготную или гетерозиготную мутацию, которая приводит к низкому росту, отклонениям в размере головы и медленному росту и развитию.[56]
Синдром Ротмунда-Томсона Редкое аутосомно-рецессивное заболевание, поражающее кожу. Для него характерны редкие волосы, ювенильная катаракта, аномалии скелета и задержка роста.[57]
Биогеронтология
Теории старения влияют на попытки понять и найти методы лечения возрастных состояний:
- Те, кто верит в идею о том, что старение является неизбежным побочным эффектом какой-то необходимой функции (антагонистическая плейотропия или теории одноразовой сомы), логически склонны полагать, что попытки замедлить старение приведут к неприемлемым побочным эффектам для необходимых функций. Следовательно, изменение старения "невозможно",[1] а изучение механизмов старения представляет только академический интерес.
- Те, кто верит в теории множественных механизмов обслуживания по умолчанию, склонны полагать, что можно найти способы улучшить работу некоторых из этих механизмов. Возможно, им могут помочь антиоксиданты или другие агенты.
- Те, кто верит в запрограммированное старение, полагают, что можно найти способы вмешаться в работу той части механизма старения, которая, кажется, является общей для множества симптомов, по сути «замедляя часы» и задерживая множественные проявления. Такой эффект можно получить, обманывая смысловую функцию. Одна из таких попыток - попытка найти «миметик», который бы «имитировал» антивозрастной эффект ограничение калорий без необходимости радикального ограничения диеты.[58]
Смотрите также
использованная литература
- ^ а б c d Уильямс, Джордж К. (декабрь 1957 г.). «Плейотропия, естественный отбор и эволюция старения». Эволюция. 11 (4): 398–411. Дои:10.1111 / j.1558-5646.1957.tb02911.x. JSTOR 2406060. S2CID 84556488.
- ^ Кирквуд, Т. Б. Л. (ноябрь 1977 г.). «Эволюция старения». Природа. 270 (5635): 301–4. Bibcode:1977Натура.270..301K. Дои:10.1038 / 270301a0. PMID 593350. S2CID 492012.
- ^ Медавар, П. (1952). Нерешенная проблема биологии. Издано для колледжа Х. К. Льюисом, Лондон
- ^ Johnson, Adiv A .; Шохирев, Максим Н .; Шошитаишвили, Борис (01.11.2019). «Обновление эволюционных теорий старения». Обзоры исследований старения. 55: 100947. Дои:10.1016 / j.arr.2019.100947. ISSN 1568-1637. PMID 31449890.
- ^ Вейсманн А. (1889). Очерки наследственности и родственных биологических проблем. Оксфорд: Clarendon Press. Работа, описывающая теорию Вейсмана об освобождении места для молодежи.
- ^ а б Ян Дж (2013). «Вязкие группы населения развивают альтруистическое запрограммированное старение в конфликте способностей в изменяющейся среде». Исследования эволюционной экологии. 15: 527–543.
- ^ а б Эверман, Элизабет Р .; Морган, Теодор Дж. (10 января 2018 г.). «Антагонистическая плейотропия и накопление мутаций способствуют возрастному снижению стрессовой реакции». Эволюция. 72 (2): 303–317. Дои:10.1111 / evo.13408. ISSN 0014-3820. PMID 29214647.
- ^ а б c Чарльзуорт, Б. (07.05.2001).«Модели возрастных средних и генетических вариаций показателей смертности, предсказываемых теорией мутации-накопления старения». Журнал теоретической биологии. 210 (1): 47–65. Дои:10.1006 / jtbi.2001.2296. ISSN 0022-5193. PMID 11343430.
- ^ Drost, J. B .; Ли, В. Р. (1995). «Биологические основы мутации зародышевой линии: сравнение частоты спонтанных мутаций зародышевой линии у дрозофилы, мыши и человека». Экологический и молекулярный мутагенез. 25 Дополнение 26: 48–64. Дои:10.1002 / em.2850250609. ISSN 0893-6692. PMID 7789362. S2CID 41023021.
- ^ а б Флатт, Томас; Куропатка, Линда (2018-08-20). «Горизонты эволюции старения». BMC Биология. 16 (1): 93. Дои:10.1186 / s12915-018-0562-z. ISSN 1741-7007. ЧВК 6100731. PMID 30124168.
- ^ Мурад, Джейкоб А .; Промислоу, Дэниел Э. Л. (27 июля 2008 г.). "Теория возрастной мутации и старения". Генетика. 179 (4): 2061–2073. Дои:10.1534 / genetics.108.088526. ISSN 0016-6731. ЧВК 2516080. PMID 18660535.
- ^ Kraemer, Susanne A .; Böndel, Katharina B .; Несс, Роберт В .; Кейтли, Питер Д .; Колгрейв, Ник (декабрь 2017 г.). «Изменение приспособленности в зависимости от количества мутаций в линиях спонтанного накопления мутаций Chlamydomonas reinhardtii». Эволюция; Международный журнал органической эволюции. 71 (12): 2918–2929. Дои:10.1111 / evo.13360. ISSN 0014-3820. ЧВК 5765464. PMID 28884790.
- ^ а б c Данько, Мацей Ян; Козловский, Ян; Ваупель, Джеймс Уолтон; Баудиш, Аннет (2012-04-06). «Накопление мутаций может быть незначительной силой в формировании особенностей жизненного цикла». PLOS ONE. 7 (4): e34146. Bibcode:2012PLoSO ... 734146D. Дои:10.1371 / journal.pone.0034146. ISSN 1932-6203. ЧВК 3320907. PMID 22493680.
- ^ Рифкин, Скотт А .; Хоул, Дэвид; Ким, Чунхён; Уайт, Кевин П. (ноябрь 2005 г.). «Анализ накопления мутаций показывает широкие возможности для быстрой эволюции экспрессии генов». Природа. 438 (7065): 220–223. Bibcode:2005Натура.438..220р. Дои:10.1038 / природа04114. ISSN 1476-4687. PMID 16281035. S2CID 4413696.
- ^ Неи, Масатоши (24 июля 2007 г.). «Новая мутационная теория фенотипической эволюции». Труды Национальной академии наук. 104 (30): 12235–12242. Bibcode:2007ПНАС..10412235Н. Дои:10.1073 / pnas.0703349104. ISSN 0027-8424. ЧВК 1941456. PMID 17640887.
- ^ Картер А.Дж., Нгуен А.К. (декабрь 2011 г.). «Антагонистическая плейотропия как широко распространенный механизм поддержания аллелей полиморфных заболеваний». BMC Medical Genetics. 12: 160. Дои:10.1186/1471-2350-12-160. ЧВК 3254080. PMID 22151998.
- ^ Куртсингер, Дж. (2001). «Старение: генетические теории». Международная энциклопедия социальных и поведенческих наук. С. 13897–902. Дои:10.1016 / B0-08-043076-7 / 03374-X. ISBN 978-0-08-043076-8.
- ^ Leroi AM, Chippindale AK, Rose MR (август 1994). "Долгосрочная лабораторная эволюция генетического компромисса с историей жизни Drosophila melanogaster. 1. Роль взаимодействия между генотипом и средой ». Эволюция; Международный журнал органической эволюции. 48 (4): 1244–1257. Дои:10.1111 / j.1558-5646.1994.tb05309.x. PMID 28564485. S2CID 22492109.
- ^ Кирквуд ТБ (ноябрь 1977 г.). «Эволюция старения». Природа. 270 (5635): 301–4. Bibcode:1977Натура.270..301K. Дои:10.1038 / 270301a0. PMID 593350. S2CID 492012. Происхождение теории одноразовой сомы.
- ^ Lorenzini A, Stamato T, Sell C (ноябрь 2011 г.). «Новый взгляд на теорию одноразовой сомы: время как ресурс в теориях старения». Клеточный цикл. 10 (22): 3853–6. Дои:10.4161 / cc.10.22.18302. PMID 22071624.
- ^ ван ден Хеувел Дж., Инглиш С., Уллер Т. (11 января 2016 г.). Criscuolo F (ред.). «Теория одноразовой сомы и эволюция материнского воздействия на старение». PLOS ONE. 11 (1): e0145544. Bibcode:2016PLoSO..1145544V. Дои:10.1371 / journal.pone.0145544. ЧВК 4709080. PMID 26752635.
- ^ Weindruch R, Walford IL (1986). Замедление старения и болезней путем ограничения диеты. Спрингфилд, Иллинойс: Томас.
- ^ Weindruch R (1996). «Замедление старения путем ограничения калорийности: исследования на грызунах и приматах». Токсикологическая патология. 24 (6): 742–5. Дои:10.1177/019262339602400618. PMID 8994305. S2CID 13212021.
- ^ Масоро EJ (сентябрь 2005 г.). «Обзор ограничения калорийности и старения». Механизмы старения и развития. 126 (9): 913–22. Дои:10.1016 / j.mad.2005.03.012. PMID 15885745. S2CID 8451228. Обзор ограничения калорийности и старения.
- ^ Атиг, Р. Кефи-Бен; Hsouna, S .; Beraud-Colomb, E .; Абдельхак, С. (2009). «[Митохондриальная ДНК: свойства и применение]». Archives de l'Institut Pasteur de Tunis. 86 (1–4): 3–14. ISSN 0020-2509. PMID 20707216.
- ^ Мейнард, Скотт; Фанг, Эвандро Фей; Шейбье-Кнудсен, Мортен; Croteau, Deborah L .; Бор, Вильгельм А. (октябрь 2015 г.). «Повреждение ДНК, восстановление ДНК, старение и нейродегенерация». Перспективы Колд-Спринг-Харбор в медицине. 5 (10): a025130. Дои:10.1101 / cshperspect.a025130. ISSN 2157-1422. ЧВК 4588127. PMID 26385091.
- ^ Генслер Х.Л., Бернштейн Х. (сентябрь 1981 г.). «Повреждение ДНК как основная причина старения». Ежеквартальный обзор биологии. 56 (3): 279–303. Дои:10.1086/412317. PMID 7031747.
- ^ Генслер Х.Л. (1981). «Низкий уровень УФ-индуцированного внепланового синтеза ДНК в постмитотических клетках мозга хомяков: возможное отношение к старению». Экспериментальная геронтология. 16 (2): 199–207. Дои:10.1016/0531-5565(81)90046-2. PMID 7286098. S2CID 6261990.
- ^ Карран П., Москона А., Штраус Б. (июль 1977 г.). «Снижение репарации ДНК в нервных клетках сетчатки куриных эмбрионов. Постоянный дефицит способности к репарации в клеточной линии, полученной из поздних эмбрионов». Журнал клеточной биологии. 74 (1): 274–86. Дои:10.1083 / jcb.74.1.274. ЧВК 2109876. PMID 559680.
- ^ Лампидис Т.Дж., Шайбергер Г.Е. (декабрь 1975 г.). «Возрастная потеря синтеза репарации ДНК в изолированных клетках миокарда крысы». Экспериментальные исследования клеток. 96 (2): 412–6. Дои:10.1016/0014-4827(75)90276-1. PMID 1193184.
- ^ Родье, Фрэнсис; Кампизи, Юдифь; Бхаумик, Дипа (15 декабря 2007 г.). «Два лица p53: старение и подавление опухоли». Исследования нуклеиновых кислот. 35 (22): 7475–7484. Дои:10.1093 / нар / гкм744. ISSN 0305-1048. ЧВК 2190721. PMID 17942417.
- ^ Башня, Джон (сентябрь 2015 г.). «Запрограммированная смерть клеток при старении». Обзоры исследований старения. 23 (Pt A): 90–100. Дои:10.1016 / j.arr.2015.04.002. ISSN 1568-1637. ЧВК 4480161. PMID 25862945.
- ^ Сахин, Эргюн; Колла, Симона; Лиза, Марк; Мослехи, Джавид; Мюллер, Флориан Л .; Го, Мира; Купер, Маркус; Коттон, Даррелл; Fabian, Attila J .; Уолки, Карл; Мазер, Ричард С. (17 февраля 2011 г.). «Дисфункция теломер вызывает метаболические и митохондриальные нарушения». Природа. 470 (7334): 359–365. Bibcode:2011Натура.470..359S. Дои:10.1038 / природа09787. ISSN 1476-4687. ЧВК 3741661. PMID 21307849.
- ^ Петрусева, И.О .; Евдокимов, А. Н .; Лаврик, О. И. (2017). «Поддержание стабильности генома у голой кротовины». Acta Naturae. 9 (4): 31–41. Дои:10.32607/20758251-2017-9-4-31-41. ISSN 2075-8251. ЧВК 5762826. PMID 29340215.
- ^ Голдсмит Т (2009). «Старение млекопитающих: активные и пассивные механизмы». Журнал биологических гипотез. 2 (2): 59–64. Дои:10.1016 / j.bihy.2008.12.002. В статье сравниваются теории запрограммированного и непрограммируемого обслуживания старения в свете эмпирических данных.
- ^ Холлидей Р. (май 2006 г.). «Старение больше не является нерешенной проблемой в биологии». Летопись Нью-Йоркской академии наук. 1067 (1): 1–9. Bibcode:2006НЯСА1067 .... 1Ч. Дои:10.1196 / Анналы.1354.002. PMID 16803964. S2CID 9390016.
- ^ Гамильтон, W.D. (сентябрь 1966 г.). «Формирование старения путем естественного отбора». Журнал теоретической биологии. 12 (1): 12–45. Дои:10.1016/0022-5193(66)90184-6. ISSN 0022-5193. PMID 6015424.
- ^ Флатт, Томас; Шмидт, Пол С. (октябрь 2009 г.). «Интеграция эволюционной и молекулярной генетики старения». Biochimica et Biophysica Acta (BBA) - Общие предметы. 1790 (10): 951–962. Дои:10.1016 / j.bbagen.2009.07.010. ISSN 0304-4165. ЧВК 2972575. PMID 19619612.
- ^ Миттельдорф, Дж. (2006). «Хаотическая динамика населения и эволюция старения: предложение демографической теории старения». Исследования эволюционной экологии. 8: 561–74. О популяционной динамике как механизме эволюции старения.
- ^ Ли Р.Д. (август 2003 г.). «Переосмысление эволюционной теории старения: перенос, а не рождение, формирует старение у социальных видов». Труды Национальной академии наук Соединенных Штатов Америки. 100 (16): 9637–42. Bibcode:2003ПНАС..100.9637Л. Дои:10.1073 / пнас.1530303100. ЧВК 170970. PMID 12878733.
- ^ Скулачев В.П. (ноябрь 1997 г.). «Старение - это специфическая биологическая функция, а не результат нарушения в сложных живых системах: биохимические доказательства в поддержку гипотезы Вейсмана». Биохимия. Биохимия. 62 (11): 1191–5. PMID 9467841.
- ^ Goldsmith TC (июнь 2008 г.). «Старение, способность к развитию и индивидуальные требования к выгоде; медицинские последствия противоречий теории старения». Журнал теоретической биологии. 252 (4): 764–8. Дои:10.1016 / j.jtbi.2008.02.035. PMID 18396295.
- ^ Lenart P, Bienertová-Vašk J (август 2017 г.). «Не отставать от Красной Королевы: темп старения как адаптация». Биогеронтология. 18 (4): 693–709. Дои:10.1007 / s10522-016-9674-4. PMID 28013399. S2CID 11048849.
- ^ "Словарь терминов по раку NCI". Национальный институт рака. 2011-02-02. Получено 2020-04-11.
- ^ Карреро, Дидо; Сориа-Валлес, Клара; Лопес-Отин, Карлос (01.07.2016). «Признаки прогероидных синдромов: уроки мышей и перепрограммированные клетки». Модели и механизмы заболеваний. 9 (7): 719–735. Дои:10.1242 / дмм.024711. ISSN 1754-8403. ЧВК 4958309. PMID 27482812.
- ^ "Прогерия". WebMD. Получено 2020-04-11.
- ^ «Синдром прогерии Хатчинсона-Гилфорда». Домашний справочник по генетике. Получено 2019-03-27.
- ^ Кинг, Роберт С. (2013). Словарь генетики. Маллиган, Памела Хиппл, 1953-, Стэнсфилд, Уильям Д., 1930- (8-е изд.). Нью-Йорк: Издательство Оксфордского университета. ISBN 978-0-19-937686-5. OCLC 871046520.
- ^ Справка, Дом генетики. «Синдром прогерии Хатчинсона-Гилфорда». Домашний справочник по генетике. Получено 2020-04-11.
- ^ а б c Макдональд, Роджер Б. Биология старения (Второе изд.). Бока-Ратон. ISBN 978-0-8153-4567-1. OCLC 1056201427.
- ^ а б Справка, Дом генетики. «Синдром Вернера». Домашний справочник по генетике. Получено 2020-04-11.
- ^ Ямамото, К .; Imakiire, A .; Miyagawa, N .; Касахара, Т. (декабрь 2003 г.). «Отчет о двух случаях синдрома Вернера и обзор литературы». Журнал ортопедической хирургии (Гонконг). 11 (2): 224–233. Дои:10.1177/230949900301100222. ISSN 1022-5536. PMID 14676353.
- ^ Наварро С.Л., Кау П., Леви Н. (октябрь 2006 г.). «Молекулярные основы прогероидных синдромов». Молекулярная генетика человека. 15 (Suppl_2): R151–61. Дои:10.1093 / hmg / ddl214. PMID 16987878.
- ^ «Запись OMIM - # 210900 - СИНДРОМ БЛУМА; BLM». omim.org. Получено 2020-04-11.
- ^ Справка, Дом генетики. «Синдром Блума». Домашний справочник по генетике. Получено 2020-04-11.
- ^ «Запись OMIM - № 216400 - СИНДРОМ Кокейна A; CSA». omim.org. Получено 2020-04-11.
- ^ Справка, Дом генетики. «Синдром Ротмунда-Томсона». Домашний справочник по генетике. Получено 2020-04-11.
- ^ Чен Д., Гуаренте Л. (февраль 2007 г.). «SIR2: потенциальная цель для миметиков, ограничивающих калорийность». Тенденции в молекулярной медицине. 13 (2): 64–71. Дои:10.1016 / j.molmed.2006.12.004. PMID 17207661.
дальнейшее чтение
- Алкок Дж (2017). «Социобиология человека и теория группового отбора». О природе человека Биология, психология, этика, политика и религия. О природе человека. Эльзевир. С. 383–396. Дои:10.1016 / b978-0-12-420190-3.00023-5. ISBN 978-0-12-420190-3.</ref>
- Джин К. (октябрь 2010 г.). «Современные биологические теории старения». Старение и болезнь. 1 (2): 72–74. ЧВК 2995895. PMID 21132086.
- Гаврилова Н.С., Гаврилов Л.А., Семёнова В.Г., Евдокушкина Г.Н. (июнь 2004 г.). «Неужели исключительное долголетие человека связано с высокой ценой бесплодия? Проверка эволюционных теорий старения». Летопись Нью-Йоркской академии наук. 1019 (1): 513–7. Bibcode:2004НЯСА1019..513Г. CiteSeerX 10.1.1.10.7390. Дои:10.1196 / летопись.1297.095. PMID 15247077. S2CID 10335962.
- Гаврилова Н.С., Гаврилов Л.А. (2005). «Человеческое долголетие и воспроизводство: эволюционная перспектива». В Voland E, Chasiotis A, Schiefenhoevel W (ред.). Бабушка - эволюционное значение второй половины женской жизни. Нью-Брансуик, Нью-Джерси, США: Rutgers University Press. С. 59–80.
- Гаврилова Н.С., Гаврилов Л.А. (2002). «Эволюция старения». В Ekerdt DJ (ред.). Энциклопедия старения. 2. Нью-Йорк: Справочник Macmillan USA. С. 458–467.
- Гаврилов Л.А., Гаврилова Н.С. (февраль 2002 г.). «Эволюционные теории старения и долголетия». Журнал ScienceWorld. 2: 339–56. Дои:10.1100 / tsw.2002.96. ЧВК 6009642. PMID 12806021.
- Гаврилова Н.С., Гаврилов Л.А., Евдокушкина Г.Н., Семёнова В.Г., Гаврилова А.Л., Евдокушкина Н.Н., Кушнарева Ю.Е., Крутко В.Н. (август 1998 г.). «Эволюция, мутации и человеческое долголетие: королевские и благородные семьи Европы». Человеческая биология. 70 (4): 799–804. PMID 9686488.
внешние ссылки
- Эволюционные теории старения и долголетия
- Эволюционная теория старения от Жоау Педро де Магальяйнш.
- Programmed-Aging.Org Сайт предоставляет исчерпывающую информацию о запрограммированном старении, спорах о запрограммированном и непрограммированном старении и спорах об эволюции.
- Как эволюционное мышление влияет на представления людей о мерах по старению
- База данных по старению и долголетию животных AnAge Обеспечивает максимальный наблюдаемый возраст и возраст половой зрелости для многих животных.
- Доводы в пользу запрограммированного старения млекопитающих Описывает эмпирические данные, эволюционное обоснование и историческую перспективу в поддержку запрограммированного старения у млекопитающих.
- Таблица дожития в США за 2005 г. Вероятность смерти как функция возраста

