Боковой амиотрофический склероз - Amyotrophic lateral sclerosis
| Боковой амиотрофический склероз (ALS) | |
|---|---|
| Другие имена | Болезнь Лу Герига; Болезнь Шарко; болезнь двигательных нейронов (БДН)[1] |
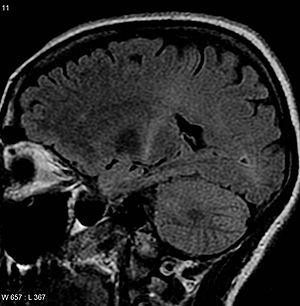 | |
| An МРТ головного мозга с повышенный сигнал Т2 в задней части внутренняя капсула что можно отследить до моторная кора, соответствует диагнозу БАС | |
| Специальность | Неврология |
| Симптомы | Жесткие мышцы, мышечные подергивания, постепенно нарастающая слабость[2] |
| Осложнения | Сложность в Говорящий, глотание, и дыхание; нарушение дыхания[2] |
| Обычное начало | 50–60[3] |
| Причины | Неизвестно (большинство), унаследовано (несколько) |
| Диагностический метод | Предположительно на основании симптомов и подтверждено МРТ[2] |
| Уход | Неинвазивная вентиляция[4] |
| Медикамент | Рилузол, Edaravone[5][6] |
| Прогноз | Ожидаемая продолжительность жизни 2–4 года[4] |
| Частота | 2,6 / 100 000 в год (Европа)[7] |
Боковой амиотрофический склероз (ALS), также известный как Болезнь Лу Герига в Канаде и США, а также заболевание двигательных нейронов (БДН) в Великобритании, Ирландии, Австралии, Южной Африке и Новой Зеландии является нейродегенеративный нервно-мышечное заболевание что приводит к постепенной потере двигательные нейроны этот контроль произвольные мышцы.[2][8][9] БАС - наиболее распространенный тип заболевание двигательного нейрона.[10][11]Ранние симптомы БАС включают: жесткие мышцы, мышечные подергивания, и постепенное увеличение слабости и атрофия мышц.[2] Это может начаться со слабости в руках или ногах, когда это известно как начало конечности, или с трудом в Говорящий или же глотание, когда он известен как бульбарный.[2][12] Примерно у половины пострадавших возникают хотя бы легкие проблемы с мышление и поведение, и большинство людей испытывают боль.[13][14] Пораженные мышцы отвечают за пережевывание пищи, речь и ходьбу.[2] Потеря мотонейронов продолжается до тех пор, пока не теряется способность есть, говорить, двигаться и, наконец, дышать.[2] БАС в конечном итоге вызывает паралич и ранняя смерть, обычно от нарушение дыхания.[15]
Большинство случаев БАС (от 90% до 95%) не имеют известной причины и известны как спорадический БАС.[2][16] Однако оба генетический и факторы окружающей среды считаются причастными.[17] Остальные 5-10% случаев имеют генетическую причину, связанную с история болезни в семье, и они известны как семейный БАС.[16][3] Около половины этих генетических случаев связаны с одним из двух конкретных гены.[2] Основной механизм включает повреждение обоих верхний и нижние двигательные нейроны.[2] В диагноз основан на признаках человека и симптомы, с проведением тестирования, чтобы исключить другие возможные причины.[2]
От БАС нет лекарства, и лечение направлено на улучшение симптомов.[8] Лекарство под названием рилузол может продлить жизнь примерно на два-три месяца.[5] Неинвазивная вентиляция может привести как к повышению качества, так и к увеличению продолжительности жизни.[4] Механическая вентиляция может продлить выживание, но не останавливает прогрессирование болезни.[18] А питательная трубка может помочь.[19] Заболевание может поражать людей любого возраста, но обычно начинается в возрасте около 60 лет, а в наследственных случаях - в возрасте около 50 лет.[3] Средняя выживаемость от начала болезни до смерти составляет от двух до четырех лет, хотя она может варьироваться, и около 10% живут дольше 10 лет.[4][20][2] смерть обычно наступает из-за дыхательной недостаточности.[3] В Европе заболевание поражает примерно двух-трех человек на 100 000 в год.[7] Ставки в большинстве стран мира неясны.[21] В Соединенных Штатах это чаще встречается в белые люди чем черные люди.[22]
Описание болезни датируется по крайней мере 1824 годом. Чарльз Белл.[23] В 1869 году связь между симптомами и основными неврологическими проблемами была впервые описана Жан-Мартен Шарко, который в 1874 году начал использовать термин боковой амиотрофический склероз.[23] Он стал хорошо известен в Соединенных Штатах в 20 веке, когда в 1939 году он затронул бейсболиста. Лу Гериг и позже во всем мире после диагноза 1963 г. космолог Стивен Хокинг.[24][25] Первый ген БАС был открыт в 1993 году, а первый модель животных был разработан в 1994 году.[26][27] В 2014 году видео Вызов ведра со льдом стал вирусным в Интернете и повысил осведомленность общественности об этом заболевании.[28]
Классификация
ALS - это заболевание двигательного нейрона, также пишется «болезнь двигательных нейронов», которая представляет собой группу неврологические расстройства которые выборочно влияют двигательные нейроны, клетки, которые контролируют произвольные мышцы тела.[2] Другие заболевания двигательных нейронов включают: первичный боковой склероз (PLS), прогрессирующая мышечная атрофия (PMA), прогрессирующий бульбарный паралич, псевдобульбарный паралич, и мономерная амиотрофия (ММА).[29]
Сам по себе БАС можно классифицировать несколькими разными способами: по скорости прогрессирования заболевания, что связано с возрастом начала; в зависимости от того, является ли он семейным или спорадическим, а также регионом, затронутым первым.[2] Примерно в 25% случаев в первую очередь поражаются мышцы лица, рта и горла, потому что двигательные нейроны в части мозговой ствол называется продолговатый мозг (ранее называвшаяся «лампочкой») начинают умирать первыми вместе с нижними двигательными нейронами. Эта форма называется "бульбарный «начало БАС». Примерно в 5% случаев первыми поражаются мышцы туловища.[3] В большинстве случаев болезнь распространяется и поражает другие отделы спинного мозга. У некоторых людей с БАС симптомы ограничиваются одной областью спинного мозга в течение, по крайней мере, 12–24 месяцев, прежде чем распространятся на вторую область; эти региональные варианты БАС связаны с лучшим прогнозом.[30]
Классический ALS, PLS и PMA

БАС можно классифицировать по типам пораженных мотонейронов. Типичный или «классический» БАС включает: верхние двигательные нейроны в мозгу, и нижние двигательные нейроны в спинном мозге.[31] Первичный боковой склероз (PLS) включает только верхние двигательные нейроны, и прогрессирующая мышечная атрофия (PMA) включает только нижние двигательные нейроны. Ведутся споры о том, являются ли PLS и PMA отдельными заболеваниями или просто вариантами ALS.[13]
На классический БАС приходится около 70% всех случаев БАС, и его можно подразделить на: БАС с началом в конечностях (также известное как спинальное начало) и бульбарный БАС.[13] БАС с началом конечностей, начинается со слабости в руках и ногах[12] и составляет около двух третей всех классических случаев БАС.[13] Бульбарный БАС начинается со слабости мускулов речи, жевания и глотания.[31] и составляет остальную треть случаев.[13] Бульбарное начало связано с худшим прогнозом, чем БАС на конечностях; популяционное исследование показало, что БАС с бульбарным началом имеет медианную выживаемость 2,0 года и 10-летнюю выживаемость 3%, в то время как БАС с началом конечностей имеет медианную выживаемость 2,6 года и 10-летнюю выживаемость 13 %.[32] Редкий вариант - БАС с респираторным началом, на который приходится около 3% всех случаев БАС,[13] при которых начальные симптомы - затрудненное дыхание (одышка ) при напряжении, в покое или лежа (ортопноэ ).[33] Спинальные и бульбарные симптомы, как правило, слабо выражены или отсутствуют вначале. Чаще встречается у мужчин.[20] БАС с респираторным началом имеет худший прогноз из всех вариантов БАС; в популяционном исследовании у лиц с респираторным заболеванием средняя выживаемость составила 1,4 года и 0% выживаемости через 10 лет.[32]
Первичный боковой склероз (ПБС) составляет около 5% всех случаев БАС и поражает верхние двигательные нейроны в руках и ногах.[20] Однако более 75% людей с явным PLS развивают более низкие двигательные нейронные признаки в течение четырех лет после появления симптомов, а это означает, что до тех пор нельзя поставить точный диагноз PLS.[34] PLS имеет лучший прогноз, чем классический ALS, поскольку он прогрессирует медленнее, приводит к меньшему функциональному снижению, не влияет на способность дышать и вызывает менее серьезную потерю веса.[20]
Прогрессирующая мышечная атрофия (ПМА) составляет около 5% всех случаев БАС и поражает нижние двигательные нейроны рук и ног.[20] Хотя ПМА в среднем ассоциируется с более длительным выживанием, чем классический БАС, со временем он все же прогрессирует в другие области спинного мозга, что в конечном итоге приводит к дыхательной недостаточности и смерти.[13] Признаки верхних мотонейронов могут развиться на поздних стадиях ПМА, и в этом случае диагноз может быть изменен на классический БАС.[34]
Региональные варианты
Региональные варианты БАС имеют симптомы, которые ограничиваются одной областью спинного мозга в течение как минимум года; они прогрессируют медленнее, чем классический БАС, и связаны с более длительным выживанием. Примеры включают синдром цепной руки, синдром цепной ноги и изолированный бульбарный БАС. Синдром цепной руки и синдром цепной ноги часто считают региональными вариантами ПМА, поскольку они затрагивают только нижние двигательные нейроны. Изолированный бульбарный БАС может затрагивать верхние или нижние двигательные нейроны. Эти региональные варианты БАС невозможно диагностировать при появлении симптомов; необходимо наблюдать невозможность распространения болезни на другие области спинного мозга в течение длительного периода времени (не менее 12 месяцев).[30]
Синдром цепной руки, также называемый плечевой амиотрофической диплегией,[а] характеризуется повреждением нижних мотонейронов только шейного отдела спинного мозга, что приводит к постепенному появлению слабости в проксимальных мышцах руки и снижению или отсутствию рефлексов. Синдром цепной ноги, также называемый амиотрофической диплегией ног,[b] характеризуется повреждением нижних мотонейронов только в пояснично-крестцовом отделе спинного мозга, что приводит к постепенному появлению слабости в ногах и снижению или отсутствию рефлексов. Изолированный бульбарный БАС характеризуется повреждением верхнего или нижнего мотонейрона только в бульбарной области, что приводит к постепенному возникновению затруднений с речью (дизартрия ) и глотание (дисфагия ); дыхание (дыхание) обычно сохраняется, по крайней мере, на начальном этапе. Два небольших исследования показали, что люди с изолированным бульбарным БАС могут жить дольше, чем люди с бульбарным БАС.[30]
Возраст начала
БАС также можно классифицировать в зависимости от возраста начала. Хотя пиковый возраст начала составляет от 58 до 63 лет для спорадического БАС и от 47 до 52 лет для семейного БАС,[3] около 10% всех случаев БАС начинаются в возрасте до 45 лет (БАС с «молодым началом») и около 1% всех случаев начинаются до 25 лет (БАС у подростков).[31] Люди, у которых развивается БАС в молодом возрасте, с большей вероятностью будут мужчинами, с меньшей вероятностью проявятся бульбарные симптомы и с большей вероятностью будут иметь более медленное прогрессирование заболевания.[34] Ювенильный БАС с большей вероятностью будет иметь наследственный характер, чем БАС у взрослых; гены, которые, как известно, связаны с ювенильным БАС, включают: ALS2, SETX, SPG11, FUS, и SIGMAR1. Хотя большинство людей с ювенильным БАС живут дольше, чем люди с БАС, начавшимся у взрослых, некоторые из них имеют специфические мутации в FUS и SOD1 которые связаны с плохим прогнозом.[35] Позднее начало (после 65 лет) связано с более быстрым ухудшением функций и более короткой выживаемостью.[36]
Признаки и симптомы
Расстройство вызывает мышечную слабость, атрофия, и мышечные спазмы по всему телу из-за дегенерации верхних двигательных и нижних двигательных нейронов. Люди, страдающие этим расстройством, могут в конечном итоге потерять способность инициировать и контролировать все произвольные движения.[4] хотя функция мочевого пузыря и кишечника и экстраокулярные мышцы (мышцы, отвечающие за движение глаз) обычно сохраняются[37][c] до финальных стадий болезни.[39]
Познавательный или поведенческая дисфункция присутствует у 30–50% людей с БАС.[40] Около половины людей с БАС испытают умеренные изменения в познании и поведении, а у 10–15% появятся признаки лобно-височная деменция.[4] Повторение фраз или жестов, апатия и потеря торможения часто сообщается о поведенческих особенностях БАС.[41] Языковая дисфункция, исполнительная дисфункция и проблемы с социальное познание и словесная память являются наиболее часто встречающимися когнитивными симптомами при БАС; метаанализ не обнаружил взаимосвязи между дисфункцией и тяжестью заболевания.[42] Однако было обнаружено, что когнитивные и поведенческие дисфункции коррелируют со снижением выживаемости у людей с БАС и увеличением нагрузки на лиц, осуществляющих уход; отчасти это может быть связано с дефицитом социального познания.[42] Около половины людей с БАС эмоциональная лабильность, в которых плачут или смеются без причины; это чаще встречается у людей с бульбарным БАС.[4]
Боль - это симптом, который испытывает большинство людей с БАС, и может принимать форму невропатическая боль (боль, вызванная повреждением нервов), спастичность, мышечные судороги и ноцицептивная боль вызвано пониженной подвижностью и мышечной слабостью; Примеры ноцицептивной боли при БАС включают: контрактуры (постоянное укорочение мышцы или сустава), боль в шее, боль в спине, боль в плече и пролежни.[14]
Сенсорные нервы и автономная нервная система обычно не подвержены влиянию, что означает, что большинство людей с БАС поддерживают слушание, достопримечательность, трогать, запах, и вкус.[2]
Начальные симптомы
Начало БАС может быть настолько незаметным, что симптомы не заметны.[2] Самые ранние симптомы БАС - мышечная слабость или мышечная атрофия. Другие симптомы включают проблемы с глотанием или дыханием, спазмы или жесткость пораженных мышц; мышечная слабость, поражающая руку или ногу; или невнятная и гнусавая речь. Части тела, пораженные ранними симптомами БАС, зависят от того, какие двигательные нейроны в организме повреждаются в первую очередь.[8]
При БАС с началом конечностей первые симптомы проявляются в руках или ногах. Если сначала поражаются ноги, человек может чувствовать неловкость, спотыкаться или спотыкаться при ходьбе или беге; это часто отмечается ходьбой с "опущенная нога "который мягко волочится по земле. Если сначала затронуты руки, они могут испытывать трудности с задачами, требующими ловкости рук, такими как застегивание рубашки, письмо или поворот ключа в замке.[8]
При бульбарном БАС первыми симптомами являются затруднение речи или глотания. Речь может стать невнятной, носовой или более тихой. Могут возникнуть трудности с глотанием и потеря подвижности языка. Меньшая часть людей страдает БАС с "респираторным началом", когда межреберные мышцы в первую очередь затрагиваются поддерживающие дыхательные пути.[3]
Со временем люди испытывают все большие затруднения при движении, глотании (дисфагия ), а также говорение или формирование слов (дизартрия ). Симптомы поражения верхних мотонейронов включают напряженные и жесткие мышцы (спастичность ) и преувеличенные рефлексы (гиперрефлексия ), включая сверхактивный рвотный рефлекс. Аномальный рефлекс, обычно называемый Знак Бабинского также указывает на повреждение верхнего мотонейрона. Симптомы дегенерации нижних мотонейронов включают мышечную слабость и атрофию, мышечные судороги и мимолетные подергивания мышц, которые можно увидеть под кожей (фасцикуляции ). Однако подергивание - это скорее побочный эффект, чем диагностический симптом; это происходит либо после, либо сопровождает слабость и атрофию.[2]
Прогресс
Хотя начальные симптомы и скорость прогрессирования варьируются от человека к человеку, болезнь в конечном итоге распространяется на незатронутые регионы, и пораженные регионы становятся более пораженными. Большинство людей в конечном итоге теряют способность ходить или пользоваться руками и руками, теряют способность говорить, глотать пищу и собственную слюну и начинают терять способность кашлять и самостоятельно дышать.[4]
Скорость прогрессирования можно измерить с помощью Шкала функциональных рейтингов ALS - пересмотренная (ALSFRS-R), инструментальный опрос из 12 пунктов, проводимый в виде клинического интервью или анкеты с самооценкой, который дает оценку от 48 (нормальное функционирование) до 0 (тяжелая инвалидность);[43] это наиболее часто используемый показатель результатов в клинических испытаниях, и врачи используют его для отслеживания прогрессирования заболевания.[44] Хотя степень вариабельности высока и у небольшого процента людей заболевание протекает гораздо медленнее, в среднем люди с БАС теряют около 0,9 балла FRS в месяц. Исследование, проведенное среди клиницистов, показало, что они оценили изменение наклона ALSFRS-R на 20% как клинически значимое.[45]
У людей моложе 40 лет прогрессирование заболевания обычно происходит медленнее,[46] умеренно страдают ожирением,[47] имеют симптомы, ограниченные в основном одной конечностью, и симптомы с симптомами в основном верхних мотонейронов.[32] И наоборот, прогрессирование происходит быстрее и прогноз хуже у людей с бульбарным БАС, БАС с респираторным началом и лобно-височной деменцией.[32]
Поздние стадии
Проблемы с жеванием и глотанием очень затрудняют прием пищи и повышают риск удушья или попадания пищи в легкие. На более поздних стадиях расстройства аспирационная пневмония могут развиваться, и поддержание нормального веса может стать серьезной проблемой, которая может потребовать введения зонда для кормления. Как диафрагма и межреберные мышцы из грудная клетка которые способствуют ослаблению дыхания, меры функция легких Такие как жизненная емкость и давление на вдохе снижается. При БАС с респираторным началом это может произойти до того, как станет очевидной значительная слабость конечностей. Наиболее частой причиной смерти среди людей с БАС являются: нарушение дыхания или же пневмония[3] и большинство людей с БАС умирают в собственном доме от первой причины, у них останавливается дыхание во время сна.[8]
Хотя респираторная поддержка может облегчить проблемы с дыханием и продлить жизнь, она не влияет на прогрессирование БАС. Большинство людей с БАС умирают через два-четыре года после постановки диагноза.[4] Около половины людей с БАС умирают в течение 30 месяцев после появления симптомов, а около 20% людей с БАС живут от пяти до 10 лет после появления симптомов.[3] Гитарист Джейсон Беккер живет с 1989 года с расстройством, в то время как космолог Стивен Хокинг прожил еще 55 лет после постановки диагноза, но такие случаи считаются необычными.[48]
Причина
Хотя точная причина БАС неизвестна, считается, что генетические факторы и факторы окружающей среды имеют примерно одинаковое значение.[17] Генетические факторы изучены лучше, чем факторы окружающей среды; окончательно не доказано, что какой-либо конкретный фактор окружающей среды вызывает БАС. А модель порога ответственности для ALS предполагает, что повреждение клеток накапливается с течением времени из-за генетических факторов, присутствующих при рождении, и воздействия экологических рисков на протяжении всей жизни.[21]
Генетика
БАС можно классифицировать как семейный или спорадический, в зависимости от того, имеется ли семейная история болезни.[20][49] Среди неврологов нет единого мнения о точном определении семейного БАС. Самым строгим определением является то, что человек с БАС должен иметь два или более родственники первой степени родства (дети, братья и сестры или родители), у которых также есть БАС. Менее строгое определение состоит в том, что человек с БАС должен иметь как минимум одну степень первой степени или родственник второй степени (бабушки и дедушки, внуки, тети, дяди, племянники, племянницы или сводные братья и сестры), у которых также есть БАС.[50] Обычно считается, что на семейный БАС приходится 10% всех случаев БАС, хотя оценки варьируются от 5%.[51] до 20%.[52] Более высокие оценки используют более широкое определение семейного БАС и более тщательно исследуют семейный анамнез людей с БАС.[50]
При спорадическом БАС семейная история болезни отсутствует.[39] Спорадический БАС и семейный БАС кажутся идентичными клинически и патологически и схожи генетически;[52] около 10% людей со спорадическим БАС имеют мутации в генах, которые, как известно, вызывают семейный БАС.[13] В свете этих параллелей термин «спорадический БАС» подвергался критике как вводящий в заблуждение, поскольку он подразумевает, что случаи спорадического БАС вызываются только факторами окружающей среды; термин «изолированный БАС» был предложен как более точная альтернатива.[52]
С семейным БАС связано более 20 генов, четыре из которых являются причиной большинства семейных случаев:[53] C9orf72 (40%), SOD1 (20%), FUS (1–5%), и TARDBP (1–5%).[13] Генетика семейного БАС изучена лучше, чем генетика спорадического БАС;[13] по состоянию на 2016 год[Обновить]известные гены БАС объяснили около 70% семейного БАС и около 15% спорадических БАС.[54][55] В целом, у родственников первой степени родства человека с БАС риск развития БАС составляет 1%.[17][56] ALS имеет олигогенный способ наследования, что означает, что мутации в двух или более генах должны вызывать заболевание.[26]
БАС и лобно-височная деменция (ЛВД) теперь считаются частью общего спектра заболеваний (БАС – БАС) из-за генетического, клинического и патологического сходства.[57] Генетически, C9orf72 повторные расширения составляют около 40% семейного БАС и 25% семейного ЛВД.[26] Клинически у 50% людей с БАС есть когнитивные или поведенческие нарушения, у 5–15% - ЛВС, у 40% людей с ЛВС есть симптомы двигательных нейронов, а у 12,5% - БАС.[13] Патологически аномальные агрегации белка TDP-43 наблюдаются у 97% пациентов с БАС и до 50% пациентов с ЛТД.[58] Другие гены, вызывающие FTD-ALS, включают: ЧЧД10, SQSTM1, и TBK1.[53]
Факторы окружающей среды
При отсутствии семейного анамнеза заболевания - около 90% случаев - причина неизвестна. Возможные ассоциации, свидетельства которых неубедительны, включают военную службу и курение.[40] Хотя исследования военной истории и частоты БАС противоречивы, доказательства того, что положительное соотношение.[59] Различные предлагаемые факторы включают воздействие экологические токсины (по результатам исследований географического распределения), а также употребления алкоголя и табака во время военной службы.[59]
Обзор 16 метаанализов, проведенный в 2016 году, показал, что существуют убедительные доказательства связи с хроническим профессиональным воздействием вести; наводящие на размышления данные о сельском хозяйстве, воздействии тяжелых металлов, кроме свинца, потреблении бета-каротина и травмах головы; и слабые доказательства потребления омега-3 жирных кислот, воздействия электромагнитных полей крайне низкой частоты, пестицидов и мочевой кислоты в сыворотке крови.[60]
В исследовании, проведенном США в 2017 г. Центры по контролю и профилактике заболеваний анализируя смертность в США с 1985 по 2011 год, профессии, связанные со смертностью от БАС, были белый воротничок, например, в управленческой, финансовой, архитектурной, компьютерной, юридической и образовательной сферах.[61] Другие потенциальные факторы риска остаются неподтвержденными, включая химическое воздействие, воздействие электромагнитного поля, род занятий, физические травмы и поражение электрическим током.[62][63] Существует предварительная связь с воздействием различных пестициды, в том числе хлорорганические инсектициды альдрин, дильдрин, ДДТ, и токсафен.[64][65][66]
Повреждение головы
Обзор 2015 года показал, что от умеренной до тяжелой травматическое повреждение мозга является фактором риска БАС, но было неясно, увеличивает ли частота легких черепно-мозговых травм.[67] Мета-анализ 2017 года обнаружил связь между травмами головы и БАС; однако эта связь исчезла, когда авторы рассмотрели возможность обратной причинно-следственной связи, которая заключается в идее о том, что травмы головы являются ранним признаком недиагностированного БАС, а не причиной БАС.[68]
Физическая активность
В ряде обзоров не было обнаружено никакой связи между объемом физической активности и риском развития БАС.[69][70][71] Обзор 2009 года показал, что доказательства того, что физическая активность является фактором риска БАС, были ограниченными, противоречивыми и недостаточного качества, чтобы сделать однозначный вывод.[72] В обзоре 2014 года был сделан вывод о том, что физическая активность в целом не является фактором риска для БАС, что футбол и американский футбол, возможно, связаны с БАС, и что не было достаточно доказательств, чтобы сказать, связаны ли с БАС занятия, требующие физических усилий.[73] Обзор 2016 года нашел доказательства неубедительными и отметил, что различия в дизайне исследований затрудняют сравнение исследований, поскольку они не используют одни и те же показатели физической активности или одинаковые диагностические критерии для БАС.[74]
Спортивный
И футбол, и американский футбол были определены как факторы риска БАС в нескольких исследованиях, хотя эта связь основана на небольшом количестве случаев БАС.[75] Ретроспективное когортное исследование, проведенное в 2012 г. с участием 3439 бывших НФЛ Игроки обнаружили, что их риск смерти от нейродегенеративных причин был в три раза выше, чем у населения США в целом, а их риск смерти от БАС или болезни Альцгеймера был в четыре раза выше.[76] Однако этот повышенный риск был рассчитан на основе двух смертей от болезни Альцгеймера и шести смертей от БАС из 334 смертей в этой когорте, что означает, что это исследование не дает окончательного доказательства того, что игра в американский футбол является фактором риска БАС.[77] Некоторые игроки НФЛ, которые, как считалось, умерли от БАС, на самом деле могли иметь хроническая травматическая энцефалопатия (CTE), нейродегенеративное заболевание, связанное с множественными травмами головы, которое может проявляться симптомами, очень похожими на ALS.[67][d]
Футбол был определен как возможный фактор риска БАС в ретроспективном когортном исследовании 24 000 итальянских футболистов, которые играли в период с 1960 по 1996 год. В этой группе было 375 смертей, в том числе восемь от БАС. Основываясь на этой информации и частоте случаев БАС, было подсчитано, что у футболистов в 11 раз больше шансов умереть от БАС, чем у населения Италии в целом.[21] Однако этот расчет подвергался критике за то, что он полагался на неоправданно низкое количество ожидаемых случаев БАС в когорте.[72] Когда для прогнозирования количества ожидаемых случаев использовался пожизненный риск развития БАС, вероятность смерти футболистов от БАС была не выше, чем у населения в целом.[21]
Курение
Возможно, курение связано с БАС. Обзор 2009 года пришел к выводу, что курение является установленным фактором риска БАС.[80] Систематический обзор и метаанализ 2010 года пришли к выводу, что нет сильной связи между курением и БАС, но что курение может быть связано с более высоким риском БАС у женщин.[81] Метаанализ 2011 года пришел к выводу, что курение увеличивает риск БАС по сравнению с тем, что он никогда не курит. Среди курильщиков, чем моложе они начали курить, тем выше вероятность того, что они заболеют БАС; однако ни количество выкуриваемых в течение года сигарет, ни количество выкуриваемых за день сигарет не повлияли на их риск развития БАС.[82]
Патофизиология
Невропатология
Определяющим признаком БАС является смерть обоих верхних мотонейронов (расположенных в моторная кора головного мозга) и нижних мотонейронов (расположенных в стволе и спинном мозге).[83] При БАС с лобно-височной деменцией нейроны лобных и височных долей мозга также умирают.[39] Патологический признак БАС - наличие органы включения (аномальные скопления белка), известные как Буниные тела в цитоплазме мотонейронов. Примерно у 97% людей с БАС основным компонентом телец включения является ТДП-43 белок;[12] однако в тех, у кого SOD1 или же FUS мутации, основной компонент телец включения[84][85] представляет собой белок SOD1 или белок FUS соответственно.[31] В грубая патология БАС, которые являются признаками заболевания, которые можно увидеть невооруженным глазом, включают атрофию скелетных мышц, атрофию моторной коры, склероз кортикоспинальный и кортикобульбарные пути, истончение подъязычные нервы (которые контролируют язык) и истончение передних корешков спинного мозга.[12] Помимо гибели двигательных нейронов, две другие характеристики, общие для большинства вариантов БАС, - это очаговая начальная патология, означающая, что симптомы начинаются в одной области спинного мозга, и прогрессирующее непрерывное распространение, что означает, что симптомы со временем распространяются на дополнительные области. Прион -подобное распространение неправильно свернутых белков от клетки к клетке может объяснить, почему БАС начинается в одной области и распространяется на другие.[31] В глимфатическая система может также участвовать в патогенез БАС.[86]
Биохимия
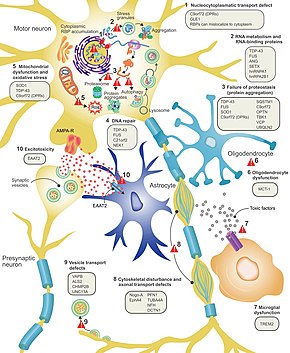
До сих пор не совсем понятно, почему нейроны умирают при БАС, но это нейродегенерация Считается, что он включает множество различных клеточных и молекулярных процессов.[13] Гены, которые, как известно, участвуют в БАС, можно разделить на три основные категории в зависимости от их нормальной функции: деградация белка, цитоскелет, и обработка РНК. Мутантный белок SOD1 образует внутриклеточные агрегаты, которые ингибируют деградацию белка. Цитоплазматические скопления дикого типа (нормальный) Белок SOD1 часто встречается при спорадическом БАС.[39] Считается, что неправильно свернутый мутант SOD1 может вызывать неправильную укладку и агрегацию SOD1 дикого типа в соседних нейронах прионоподобным образом.[12] Другие гены деградации белка, которые могут вызывать БАС при мутации, включают: VCP, OPTN, TBK1, и SQSTM1. Три гена, участвующих в БАС, которые важны для поддержания цитоскелета[39] и для аксонального транспорта[12] включают DCTN1, PFN1, и TUBA4A.[39]
Существует ряд генов БАС, которые кодируют РНК-связывающие белки. Первым был обнаружен белок TDP-43,[39] ядерный белок, который агрегируется в цитоплазме двигательных нейронов почти во всех случаях БАС; однако мутации в TARDBP, ген, который кодирует TDP-43, являются редкой причиной БАС.[12] FUS кодирует FUS, еще один РНК-связывающий белок с функцией, аналогичной TDP-43, который может вызывать БАС при мутации.[26] Считается, что мутации в TARDBP и FUS увеличивают аффинность связывания домена низкой сложности, вызывая агрегацию соответствующих белков в цитоплазме. Как только эти мутантные РНК-связывающие белки неправильно свернуты и агрегированы, они могут быть способны неправильно укладывать нормальный белок как внутри, так и между клетками прионоподобным образом.[39] Это также приводит к снижению уровней РНК-связывающего белка в ядре, что может означать, что их транскрипты РНК-мишени не подвергаются нормальному процессингу. Другие гены метаболизма РНК, связанные с БАС, включают: ANG, SETX, и MATR3.[12]
C9orf72 является наиболее часто мутируемым геном при БАС и вызывает гибель двигательных нейронов посредством ряда механизмов.[39] Патогенная мутация представляет собой экспансию гексануклеотидного повтора (серия из шести нуклеотидов, повторяющаяся снова и снова);[58] люди с 30 повторами являются нормальными, тогда как люди с сотнями или тысячами повторов могут иметь семейный БАС, лобно-височную деменцию или иногда спорадический БАС. Три механизма заболевания, связанные с этими C9orf72 повторы представляют собой отложение транскриптов РНК в ядре, трансляцию РНК в токсичные белки дипептидных повторов в цитоплазме и снижение уровней нормального белка C9orf72.[39]
Эксайтотоксичность, или гибель нервных клеток, вызванная высоким уровнем внутриклеточного кальция из-за чрезмерной стимуляции возбуждающим нейромедиатором глутамат, это механизм, который считается общим для всех форм БАС. Моторные нейроны более чувствительны к эксайтотоксичности, чем другие типы нейронов, потому что они имеют более низкую буферную способность кальция и тип рецептора глутамата ( Рецептор AMPA ), которая более проницаема для кальция. При БАС снижается уровень транспортера возбуждающих аминокислот 2 (EAAT2 ), который является основным транспортером, удаляющим глутамат из синапса; это приводит к повышению уровня синаптического глутамата и эксайтотоксичности. Рилузол, препарат, который незначительно продлевает выживаемость при БАС, подавляет высвобождение глутамата пресинаптическими нейронами; однако неясно, отвечает ли этот механизм за его терапевтический эффект.[12]
Диагностика

Ни один тест не может поставить точный диагноз БАС, хотя наличие признаков верхних и нижних мотонейронов в одной конечности является серьезным признаком.[2] Вместо этого диагноз БАС в первую очередь основан на симптомах и признаках врач наблюдает за человеком и проводит серию тестов, чтобы исключить другие заболевания.[2] Врачи получают полное история болезни и обычно проводят неврологическое обследование через регулярные промежутки времени, чтобы определить, есть ли такие симптомы, как мышечная слабость, атрофия мышц, гиперрефлексия, и спастичность ухудшаются.[2] Ряд биомаркеров этого состояния изучается, но пока они не используются в медицине.[88][89]
Диагностические критерии
Диагноз БАС основан на пересмотренных критериях Эль-Эскориала и критериях Авадзи.[12] Исходные критерии Эль-Эскориала имели четыре уровня диагностической достоверности в зависимости от того, сколько из четырех областей спинного мозга было вовлечено: бульбарный, шейный, грудной и поясничный. Определенный БАС был определен как признаки верхнего двигательного нейрона (UMN) и нижнего двигательного нейрона (LMN) в трех областях спинного мозга, вероятный БАС как признаки UMN и LMN в двух областях, возможный БАС как признаки UMN и LMN только в одной области и предполагаемый ALS только как LMN. Пересмотренные критерии Эль-Эскориала, также известные как критерии Эйрли-Хауса, исключили категорию «подозреваемого БАС» и добавили категорию «вероятный БАС, поддерживаемый лабораторией». Критерии Авадзи придают аномальным тестам ЭМГ такой же вес, что и клинические признаки дисфункции ЛМН при постановке диагноза БАС,[34] таким образом делая ненужной категорию «вероятный БАС, поддерживаемый лабораторией». Единственные три категории в критериях Авадзи - это определенный БАС, вероятный БАС и возможный БАС.[90]
Пересмотренные критерии Эль-Эскориала специфичны для БАС, а это означает, что тот, кто соответствует критериям, с большой вероятностью будет болен БАС; однако они не особенно чувствительны к БАС, а это означает, что тот, кто не соответствует критериям, все еще может иметь БАС. Их чувствительность особенно низка на ранних стадиях БАС. Критерии Awaji имеют лучшую чувствительность, чем критерии El Escorial Revised, особенно для БАС с бульбарным началом.[34] Метаанализ 2012 года показал, что критерии, пересмотренные Эль-Эскориал, имели чувствительность 62,2%, тогда как критерии Авадзи имели чувствительность 81,1%; оба набора критериев имели специфичность около 98%.[91] Критерии Эль-Эскориала были разработаны для стандартизации групп пациентов для клинических испытаний.[92] но не так полезны в клинической практике; возможный БАС, описанный в критериях Эль-Эскориала, почти всегда является клиническим БАС.[12]
Дифференциальная диагностика
Поскольку симптомы БАС могут быть похожи на симптомы широкого ряда других, более излечимых заболеваний или расстройств, необходимо провести соответствующие тесты, чтобы исключить возможность других состояний. Один из этих тестов электромиография (ЭМГ), специальный метод записи, который определяет электрическую активность в мышцах. Определенные результаты ЭМГ могут подтвердить диагноз БАС. Еще одни распространенные тестовые меры скорость нервной проводимости Конкретные отклонения в результатах NCV могут указывать, например, на то, что у человека есть форма периферическая невропатия (повреждение периферических нервов) или миопатия (мышечная болезнь), а не БАС. Хотя магнитно-резонансная томография (МРТ) часто бывает нормальным у людей с ранней стадией БАС, она может выявить доказательства других проблем, которые могут вызывать симптомы, таких как опухоль спинного мозга, рассеянный склероз, а грыжа межпозвоночного диска в области шеи, сирингомиелия, или шейный спондилез.[2]
Основываясь на симптомах человека и результатах осмотра и этих анализов, врач может назначить анализы крови и моча пробы для исключения возможности других заболеваний, а также стандартные лабораторные исследования. В некоторых случаях, например, если врач подозревает, что у человека может быть миопатия, а не БАС, может быть выполнена биопсия мышцы.[2]
Некоторые инфекционные заболевания могут иногда вызывать симптомы, похожие на БАС,[2] в том числе вирус иммунодефицита человека (ВИЧ ), человеческий Т-лимфотропный вирус (HTLV), Болезнь Лайма, и сифилис.[13] Неврологические расстройства, такие как рассеянный склероз, постполиомиелитный синдром, мультифокальная моторная нейропатия, CIDP, спинальная мышечная атрофия, и спинальная и бульбарная мышечная атрофия также может имитировать определенные аспекты болезни, и это следует учитывать.[2]
БАС необходимо дифференцировать от «мимических синдромов БАС», которые представляют собой несвязанные расстройства, которые могут иметь сходные проявления и клинические признаки с БАС или его вариантами.[93] Из-за прогноза, связанного с этим диагнозом, и разнообразия заболеваний или расстройств, которые могут напоминать БАС на ранних стадиях заболевания, люди с симптомами БАС всегда должны получать заключение неврологического специалиста, чтобы исключить альтернативные диагнозы. Миастенический синдром, также известный как синдром Ламберта-Итона, может имитировать БАС, и его первоначальное проявление может быть похоже на миастения (MG), излечимое аутоиммунное заболевание, которое иногда ошибочно принимают за БАС.[94][95] Синдром доброкачественной фасцикуляции - еще одно состояние, которое имитирует некоторые из ранних симптомов БАС, но сопровождается нормальными показаниями ЭМГ и не вызывает серьезной инвалидности.[96]
Однако в большинстве случаев диагноз БАС ставится правильно, при этом частота ошибок при диагностике в крупных клиниках БАС составляет менее 10%.[97][98] В одном исследовании было обследовано 190 человек, которые соответствовали диагностическим критериям БДН / БАС, а также были проведены лабораторные исследования в соответствии с протоколами исследований и регулярным мониторингом. У 30 из этих людей (16%) диагноз полностью изменился в период разработки клинического наблюдения.[99] В том же исследовании трем людям был поставлен ложноотрицательный диагноз MG, который может имитировать БАС и другие неврологические расстройства, что привело к задержке в диагностике и лечении. MG в высшей степени поддается лечению; БАС нет.[100]
Управление
От БАС нет лекарства. Лечение направлено на лечение симптомов и оказание поддерживающей помощи с целью улучшения качества жизни и продления выживаемости.[13] Лучше всего эту помощь оказывают многопрофильные бригады медицинских специалистов; Посещение многопрофильной клиники БАС связано с более длительной выживаемостью, меньшим количеством госпитализаций и улучшением качества жизни.[4] Рилузол продлевает выживаемость примерно на 2–3 месяца.[5] Эдаравоне немного замедляет функциональное снижение у небольшого числа людей с БАС;[101] это дорого и должно вводиться в виде ежедневных внутривенных инфузий, что может снизить качество жизни.[102] Другие лекарства могут использоваться для лечения других симптомов.[103]
Неинвазивная вентиляция (NIV) - основное лечение дыхательной недостаточности при БАС.[12] У людей с нормальной бульбарной функцией он продлевает выживаемость примерно на семь месяцев и улучшает качество жизни. Одно исследование показало, что НИВ неэффективны для людей с плохой бульбарной функцией.[104] в то время как другой предположил, что это может обеспечить умеренное улучшение выживаемости.[13] Многие люди с БАС плохо переносят НИВЛ.[105] Инвазивная вентиляция легких - это вариант для людей с запущенным БАС, когда НИВЛ недостаточно для купирования симптомов.[4] В то время как инвазивная вентиляция продлевает выживаемость, продолжается прогрессирование заболевания и функциональное снижение.[18] Это может снизить качество жизни людей с БАС или лиц, ухаживающих за ними.[19][18] Инвазивная вентиляция чаще используется в Японии, чем в Северной Америке или Европе.[106]
Физическая терапия может способствовать функциональной независимости[107][108] с помощью аэробных упражнений, упражнений на диапазон движений и растяжки.[103] Трудотерапия может помочь в повседневной жизни с помощью адаптивного оборудования.[109] Логопедия может помочь людям с БАС, которым трудно говорить.[108] Предотвращение потери веса и недоедания у людей с БАС улучшает как выживаемость, так и качество жизни.[13] Изначально затруднение глотания (дисфагия) можно контролировать с помощью диетических изменений и методов глотания. А питательная трубка следует учитывать, если кто-то с БАС теряет 5% или более веса своего тела или если он не может безопасно глотать пищу и воду.[12] Зонд для кормления обычно вставляется чрескожная эндоскопическая гастростомия (ПЭГ). Имеются слабые доказательства того, что трубки с ПЭГ улучшают выживаемость.[110] Введение ПЭГ обычно выполняется с целью улучшения качества жизни.[19]
Паллиативную помощь следует начинать вскоре после того, как кому-то поставили диагноз БАС.[111] Обсуждение вопросов в конце жизни дает людям с БАС время подумать о своих предпочтениях в отношении ухода в конце жизни и может помочь избежать нежелательных вмешательств или процедур. Уход в хосписе может улучшить лечение симптомов в конце жизни и увеличивает вероятность мирной смерти.[19] В последние дни жизни опиоиды можно использовать для лечения боли и одышки, а бензодиазепины - для лечения беспокойства.[18]
Лекарства
Рилузол Было установлено, что выживаемость умеренно увеличивается примерно на 2–3 месяца.[112][5] Это может иметь большее преимущество в выживании для людей с бульбарный БАС.[5] Это может работать, уменьшая выброс возбуждающего нейромедиатора. глутамат из пресинаптических нейронов.[12] Наиболее частые побочные эффекты - тошнота и недостаток энергии (астения ).[5] Люди с БАС должны начать лечение рилузолом как можно скорее после постановки диагноза.[111]
Эдаравоне было показано, что он незначительно замедляет снижение функции в небольшой группе людей с ранней стадией БАС.[e][f][101][114] Он может работать, защищая мотонейроны от окислительный стресс.[115] Наиболее частыми побочными эффектами являются синяки и нарушение походки.[114] Лечение эдаравоном дорогое и требует ежедневных часовых внутривенных инфузий в течение 10 дней в течение двухнедельного периода.[102]
Другие лекарства могут использоваться для уменьшения утомляемости, облегчения мышечных спазмов, контроля спастичности и уменьшения избытка слюны и мокрота.[103] Габапентин, прегабалин, и трициклические антидепрессанты (например., амитриптилин ) можно использовать при нейропатической боли, а нестероидные противовоспалительные препараты (НПВП ), ацетаминофен, и опиоиды может использоваться при ноцицептивной боли.[14]
Депрессию можно лечить селективные ингибиторы обратного захвата серотонина (СИОЗС) или трициклические антидепрессанты,[12] пока бензодиазепины можно использовать при тревоге.[4] Не существует лекарств для лечения когнитивных нарушений / лобно-височной деменции (FTD); тем не менее, СИОЗС и нейролептики могут помочь в лечении некоторых симптомов ЛВД.[12] Баклофен и тизанидин являются наиболее часто используемыми пероральными препаратами для лечения спастичности; ан интратекальный Помпа баклофен может применяться при сильной спастичности.[12] Атропин, скополамин, амитриптилин или гликопирролат может быть прописан, когда люди с БАС начинают испытывать проблемы с глотанием слюны (сиалорея ).[12]
Обзор 2017 года пришел к выводу, что мексилетин был безопасным и эффективным для лечения спазмов при БАС на основе рандомизированного контролируемого исследования, проведенного в 2016 году.[114] В исследовании, проведенном в 2020 году, AMX0035, комбинация фенилбутират натрия и тауурсодиол, было показано, что выживаемость пациентов продлевается на несколько месяцев.[116][117]
Поддержка дыхания
Неинвазивная вентиляция

Неинвазивная вентиляция (НИВ) является основным методом лечения дыхательной недостаточности при БАС.[12] и был первым лечением, которое улучшило как выживаемость, так и качество жизни.[4] NIV использует маску для лица или носа, подключенную к аппарату ИВЛ, который обеспечивает периодическое положительное давление для поддержки дыхания. Постоянное положительное давление не рекомендуется людям с БАС, потому что оно затрудняет дыхание.[18] Изначально НИВ применяют только ночью.[4] потому что первым признаком дыхательной недостаточности является снижение газообмена (гиповентиляция ) во сне; Симптомы, связанные с этой ночной гиповентиляцией, включают прерывистый сон, беспокойство, утренние головные боли и дневную усталость. По мере прогрессирования заболевания у людей с БАС появляется одышка в положении лежа, во время физической активности или разговора и, в конечном итоге, в состоянии покоя.[118] Другие симптомы включают плохую концентрацию, плохую память, спутанность сознания, инфекции дыхательных путей и слабый кашель. Дыхательная недостаточность - наиболее частая причина смерти при БАС.[4]
Важно контролировать респираторную функцию людей с БАС каждые три месяца, потому что начало НИВЛ вскоре после появления респираторных симптомов связано с увеличением выживаемости. Это включает в себя опрос человека с БАС, есть ли у него какие-либо респираторные симптомы, и измерение его респираторной функции.[4] Чаще всего используется вертикальное измерение. форсированная жизненная емкость (FVC), но это плохой детектор ранней дыхательной недостаточности и не лучший выбор для людей с бульбарными симптомами, поскольку им трудно поддерживать плотное прилегание вокруг мундштука. Измерение FVC, когда человек лежит на спине (FVC в положении лежа на спине), является более точным показателем слабости диафрагмы, чем FVC в вертикальном положении.[105] Нюхательное давление на вдохе через нос (SNIP) - это быстрый и удобный способ проверки прочности диафрагмы, на которую не влияет слабость бульбарных мышц.[18] Если у человека с БАС есть признаки и симптомы дыхательной недостаточности, ему следует пройти курс дневного анализ газов крови[4] искать гипоксемия (низкий уровень кислорода в крови) и гиперкапния (слишком много углекислого газа в крови).[18] Если дневной анализ газов крови в норме, тогда им следует провести ночной образ жизни. пульсоксиметрия искать гипоксемию во сне.[4]
Неинвазивная вентиляция продлевает выживаемость дольше, чем рилузол. Рандомизированное контролируемое исследование 2006 года показало, что НИВЛ продлевают выживаемость примерно на 48 дней и улучшают качество жизни; однако также было обнаружено, что некоторым людям с БАС это вмешательство приносит больше пользы, чем другим. Для людей с нормальной или только умеренно нарушенной бульбарной функцией НИВ продлевает выживаемость примерно на семь месяцев и значительно улучшает качество жизни. Для людей с плохой бульбарной функцией НИВ не продлевает выживаемость и не улучшает качество жизни, хотя и улучшает некоторые симптомы, связанные со сном.[104] Несмотря на очевидные преимущества НИВ, около 25–30% всех людей с БАС не переносят ее, особенно люди с когнитивными нарушениями или бульбарной дисфункцией.[105] Результаты крупного когортного исследования 2015 года показывают, что НИВЛ может продлить выживание у людей с бульбарной слабостью, и поэтому НИВ следует предлагать всем людям с БАС, даже если есть вероятность, что они будут с трудом переносить это.[13]
Инвазивная вентиляция
Инвазивная вентиляция обходит нос и рот (верхние дыхательные пути), делая разрез в трахее (трахеостомия ) и вставив трубка подключен к вентилятору.[18] Это вариант для людей с запущенным БАС, у которых респираторные симптомы плохо контролируются, несмотря на постоянное использование НИВ.[4] Хотя инвазивная вентиляция продлевает выживаемость, особенно для людей моложе 60 лет, она не лечит лежащий в основе нейродегенеративный процесс. Человек с БАС будет продолжать терять двигательную функцию, что затрудняет общение и иногда приводит к синдром запертости, при котором они полностью парализованы, за исключением глазных мышц.[18] Около половины людей с БАС, решивших пройти инвазивную вентиляцию легких, сообщают о снижении качества жизни.[19] но большинство по-прежнему считает его удовлетворительным. Однако инвазивная вентиляция ложится тяжелым бременем на лиц, осуществляющих уход, и может снизить качество их жизни.[18] Отношение к инвазивной вентиляции варьируется от страны к стране; около 30% людей с БАС в Японии выбирают инвазивную вентиляцию легких по сравнению с менее чем 5% в Северной Америке и Европе.[106]
Терапия

Физиотерапия играет большую роль в реабилитации людей с БАС. В частности, физиотерапевты, профессиональные терапевты и логопеды могут ставить цели и способствовать получению преимуществ для людей с БАС, задерживая потерю силы, поддерживая выносливость, ограничивая боль, улучшая речь и глотание, предотвращая осложнения и способствуя функциональной независимости.[107][108]
Трудотерапия и специальное оборудование, такое как вспомогательные технологии может также повысить независимость и безопасность людей на протяжении всего периода БАС.[109] Бережный, малотравматичный упражнение аэробики такие как выполнение повседневных дел, ходьба, плавание и стационарный велосипед может укрепить здоровые мышцы, улучшить здоровье сердечно-сосудистой системы и помочь людям бороться с усталостью и депрессией. Диапазон движений и упражнения на растяжку могут помочь предотвратить болезненные ощущения. спастичность и сокращение (контрактура) мышц. Физиотерапевты и эрготерапевты могут порекомендовать упражнения, которые обеспечивают эти преимущества без переутомления мышц, поскольку мышечное истощение может привести к ухудшению симптомов, связанных с БАС, вместо оказания помощи людям с БАС.[103] Они могут предложить такие устройства, как пандусы, скобы, ходунки, оборудование для ванных комнат (стулья для душа, стояки для унитаза и т. Д.) И инвалидные коляски, которые помогают людям оставаться мобильными. Трудотерапевты могут предоставить или порекомендовать оборудование и приспособления, позволяющие людям с БАС сохранять максимальную безопасность и независимость в повседневной деятельности.[109]
Людям с БАС, которым трудно говорить или глотать, может быть полезно работать с речевой патолог.[108] Эти специалисты в области здравоохранения могут обучать людей адаптивным стратегиям, например методам, помогающим им говорить громче и яснее. По мере прогрессирования БАС речевые патологи могут рекомендовать использование дополнительное и альтернативное общение такие как речевые усилители, устройства для генерации речи (или устройства связи с речевым выводом) или низкотехнологичные методы связи, такие как налобные лазерные указки, доски алфавита или сигналы да / нет.[108] Речевые патологи также могут помочь людям с диагнозом БАС с нарушением глотания (дисфагией), которое может включать измененную диету, упражнения на глотание, компенсаторные стратегии. Людям с БАС может потребоваться установка трахеостомы, в которой помогут SLP.[нужна цитата ]
Питание

Предотвращение потери веса и недоедания у людей с БАС улучшает как выживаемость, так и качество жизни.[13] Потеря веса при БАС вызвана истощением мышц из-за гибели двигательных нейронов, повышенным расходом энергии в покое и уменьшением потребления пищи. Затруднение глотания (дисфагия ) развивается примерно у 85% людей с БАС в какой-то момент на протяжении их болезни и является основной причиной снижения потребления пищи, что приводит к недоеданию и потере веса.[18] Важно регулярно оценивать вес и способность глотать людей с БАС.[4] Первоначально с дисфагией можно справиться с помощью диетических изменений и модифицированных методов глотания.[12] Обычно сначала возникают трудности с глотанием жидкостей, с которыми можно справиться, переключившись на более густые жидкости, такие как фруктовый нектар или смузи, или добавив жидкие загустители к разжижающим жидкостям, таким как вода и кофе. Людям с БАС следует есть мягкую, влажную пищу, которую легче проглотить, чем сухую, рассыпчатую или жевательную пищу.[118] Их также следует проинструктировать о том, как правильно держать голову во время глотания, чтобы облегчить глотание.[12] Существуют предварительные доказательства того, что высококалорийные диеты могут предотвратить дальнейшую потерю веса и улучшить выживаемость.[114] Пациенты будут проходить логопедию, чтобы справиться с их дисфагией и постоянно оценивать наиболее безопасную и наименее строгую последовательность диеты.
А питательная трубка следует учитывать, если кто-то с БАС теряет 5% или более веса своего тела или если он не может безопасно глотать пищу и воду.[12] Это может иметь форму гастростомия трубка, в которой трубка вводится через стенку брюшной полости в желудок, или назогастральный зонд, при котором через нос через пищевод вводится зонд в желудок.[18] Гастростомический зонд больше подходит для длительного использования.[4] чем через назогастральный зонд, что неудобно и может вызвать язвы пищевода.[18] Зонд для кормления обычно вставляется чрескожная эндоскопическая гастростомия (ПЭГ). Есть некоторые свидетельства того, что трубку ПЭГ следует вводить до того, как жизненная емкость легких упадет ниже 50% от ожидаемой, поскольку низкая жизненная емкость легких может быть связана с более высоким риском осложнений. Тем не менее, крупное исследование 2015 года показало, что введение ПЭГ безопасно для людей с запущенным БАС и низким жизненным потенциалом, если они находятся на НИВ во время процедуры.[114]
Имеются слабые доказательства того, что трубки с ПЭГ улучшают выживаемость.[110] Введение ПЭГ обычно выполняется с целью улучшения качества жизни.[19] поддерживая питание и прием лекарств.[4] Это снижает риск потери веса и обезвоживания, а также может уменьшить беспокойство от продолжительного приема пищи.[19] и уменьшенное потребление пищи перорально.[4]
Уход в конце жизни
Паллиативная помощь, который облегчает симптомы и улучшает качество жизни без лечения основного заболевания, должен начаться вскоре после того, как кому-то поставлен диагноз БАС.[111] Раннее обсуждение вопросов в конце жизни дает людям с БАС время подумать о своих предпочтениях в отношении ухода в конце жизни и может помочь избежать нежелательных вмешательств или процедур.[19] Как только они будут полностью проинформированы обо всех аспектах различных мер по продлению жизни, они могут заполнить расширенные директивы указывая на их отношение к неинвазивной вентиляции, инвазивной вентиляции и питательным зондам.[114] Позднее течение болезни, затруднение речи из-за мышечной слабости (дизартрия ) и когнитивная дисфункция может ухудшить их способность выражать свои пожелания относительно ухода.[12] Продолжающаяся неспособность выяснить предпочтения человека с БАС может привести к незапланированным и потенциально нежелательным экстренным вмешательствам, таким как инвазивная вентиляция легких. Если люди с БАС или члены их семей не хотят обсуждать вопросы, связанные с завершением жизни, может быть полезно использовать введение гастростомии или неинвазивной вентиляции как возможность поднять эту тему.[19]
Хосписное обслуживание или паллиативный уход в конце жизни особенно важен при БАС, поскольку помогает оптимизировать лечение симптомов и увеличивает вероятность мирной смерти.[19] Неясно, когда именно начинается фаза конца жизни при БАС, но это связано со значительными трудностями в движении, общении и, в некоторых случаях, мышлении.[12] Хотя многие люди с БАС боятся задохнуться (задохнуться),[19] они могут быть уверены, что это происходит редко, примерно в 0–3% случаев. Около 90% людей с БАС умирают мирно.[119] В последние дни жизни опиоиды можно использовать для снятия боли и одышка, пока бензодиазепины можно использовать для лечения беспокойства.[18]
Эпидемиология
БАС - наиболее распространенное заболевание двигательных нейронов у взрослых и третье по распространенности нейродегенеративное заболевание.[26] после Болезнь Альцгеймера и болезнь Паркинсона.[120] Во всем мире количество людей, у которых ежегодно развивается БАС, оценивается в 1,9 человека на 100 000 в год, в то время как количество людей, у которых есть БАС в любой момент времени, оценивается примерно в 4,5 человека на 100 000.[121] В Европе количество новых случаев заболевания в год составляет около 2,6 человек на 100 000 человек, а число заболевших составляет 7–9 человек на 100 000 человек.[7] Пожизненный риск развития БАС составляет 1: 350 для европейских мужчин и 1: 400 для европейских женщин.Мужчины имеют более высокий риск, главным образом потому, что спинальный БАС чаще встречается у мужчин, чем у женщин.[21] Число заболевших БАС в США в 2015 году составляло 5,2 человека на 100000 человек, и было больше среди белых, мужчин и людей старше 60 лет.[22] Число новых случаев составляет около 0,8 человек на 100 000 в год в Восточной Азии и около 0,7 человек на 100 000 в год в Южной Азии. Около 80% эпидемиологических исследований БАС было проведено в Европе и США, в основном на лицах североевропейского происхождения.[12] Недостаточно информации для определения частоты БАС в большей части мира, включая Африку, некоторые части Азии, Индию, Россию и Южную Америку.[21] В западной части Тихого океана есть несколько географических кластеров, где распространенность БАС, как сообщается, в 50–100 раз выше, чем в остальном мире, включая Гуам, Полуостров Кий Японии и Западная Новая Гвинея. Заболеваемость в этих областях снизилась с 1960-х годов;[1] причина остается неизвестной.[21]
Люди всех рас и этнических групп могут быть затронуты БАС,[22] но это чаще встречается у белых, чем у африканцев, азиатов или латиноамериканцев.[122] В США в 2015 году распространенность БАС среди белых составляла 5,4 человека на 100 000, в то время как среди черных - 2,3 человека на 100 000. Средний Запад имел самую высокую распространенность среди четырех регионов переписи США - 5,5 человек на 100 000, за ним следуют Северо-Восток (5,1), Юг (4,7) и Запад (4,4). На Среднем Западе и Северо-Востоке, вероятно, была более высокая распространенность БАС, потому что они имеют более высокую долю белых, чем Юг и Запад.[22] Этнически смешанные группы населения могут иметь более низкий риск развития БАС; исследование, проведенное на Кубе, показало, что люди смешанного происхождения с меньшей вероятностью умирали от БАС, чем белые или черные.[123] Также существуют различия в генетике БАС между разными этническими группами; самый распространенный ген БАС в Европе - C9orf72, с последующим SOD1, TARDBP, и FUS, в то время как наиболее распространенным геном БАС в Азии является SOD1, с последующим FUS, C9orf72, и TARDBP.[124]

БАС может поражать людей в любом возрасте,[40] но пик заболеваемости приходится на 50–75 лет.[13] и резко снижается через 80 лет.[3] Причина снижения заболеваемости среди пожилых людей неясна. Одна мысль заключается в том, что люди, дожившие до 80 лет, могут быть генетически не предрасположены к развитию БАС; альтернативно, БАС у пожилых людей может остаться невыявленным из-за сопутствующие заболевания (другие заболевания), трудности с посещением невролога или быстрая смерть от агрессивной формы БАС.[123] В США в 2015 году самый низкий уровень распространенности был в возрастной группе 18–39 лет, а самый высокий - в возрастной группе 70–79 лет.[22] Спорадический БАС обычно начинается в возрасте от 58 до 63 лет, в то время как семейный БАС начинается раньше, обычно от 47 до 52 лет.[3] По прогнозам, количество случаев БАС во всем мире увеличится с 222 801 в 2015 году до 376 674 в 2040 году, т.е. на 69%. Во многом это будет связано со старением населения мира, особенно в развивающихся странах.[122]
История

Описание болезни датируется по крайней мере 1824 годом. Чарльз Белл.[23] В 1850 г. Франсуа-Амилкар Аран был первым, кто описал заболевание, которое он назвал «прогрессирующей мышечной атрофией», формой БАС, при которой поражаются только нижние двигательные нейроны.[125] В 1869 году связь между симптомами и основными неврологическими проблемами была впервые описана Жан-Мартен Шарко, который впервые ввел термин боковой амиотрофический склероз в его статье 1874 года.[23] Синдром цепной руки, региональный вариант БАС, был впервые описан Альфред Вульпиан в 1886 г. Синдром цепной ноги, другой региональный вариант БАС, был впервые описан Пьер Мари и его ученик Патрикиос в 1918 году.[126]
В 1945 году американские военно-морские врачи сообщили, что БАС был в 100 раз более распространен среди Люди чаморро из Гуам чем в остальном мире. В 1956 году эндемичный для Гуама вариант БАС был назван «комплексом бокового амиотрофического склероза / паркинсонизма и деменции» (БАС / ПДК), поскольку он имел типичные симптомы БАС, сопровождающиеся паркинсонизм -подобные симптомы; имя на местном языке литико-бодиговская болезнь. Несмотря на ряд генетических и экологических исследований, причина БАС / ПДК остается неизвестной. Показатели заболеваемости достигли пика в начале 1950-х годов и после этого неуклонно снижались, а к 1985 году заболеваемость БАС / PDC на Гуаме была примерно такой же, как и во всем остальном мире.[127]
Первым геном, связанным с БАС, был SOD1, который был идентифицирован в 1993 году.[26] Это привело к разработке первых модель животных БАС, трансгенный SOD1 мышь, 1994 год.[27] В декабре 1995 года рилузол стал первым лекарством от БАС, одобренным FDA. Затем он был одобрен в Европе в 1996 году и в Японии в 1998 году.[102] В 1996 году была впервые опубликована функциональная рейтинговая шкала ALS (ALSFRS); это был опросник из 10 пунктов, который измерял способность людей с БАС выполнять ежедневные занятия.[128] В 1999 году шкала была изменена, чтобы больше внимания уделялось респираторным симптомам. Результирующий Шкала функциональных рейтингов ALS - пересмотренная (ALSFRS-R) - это вопросник из 12 пунктов, который заменяет единственный вопрос о дыхании вопросами о одышке, ортопноэ и дыхательной недостаточности.[129]
В 2006 году было обнаружено, что белок TDP-43 является основным компонентом телец включения, наблюдаемых как при БАС, так и при лобно-височной деменции (ЛВД), что свидетельствует о том, что БАС и ЛТД являются частью общего спектра заболеваний. Это привело к открытию в 2008 году, что мутации в TARDBP, ген, который кодирует TDP-43, являются причиной семейного БАС.[26] В 2011 году некодирующие повторные расширения в C9orf72 оказались основной причиной БАС и ЛВД.[12] Эдаравон был одобрен для лечения БАС в Японии и Южной Корее в 2015 году и в США в 2017 году.[115] По состоянию на 2017 год[Обновить], он не был одобрен для лечения БАС в Европе.[114]
Диагностические критерии
В 1950-х годах электродиагностическое тестирование (ЭМГ и NCV) начали использоваться для оценки клинически подозреваемого БАС. В 1969 г. Эдвард Х. Ламберт опубликовал первые диагностические критерии EMG / NCS для ALS, состоящие из четырех выводов, которые, по его мнению, полностью подтверждают диагноз.[130] В 1990 г. Всемирная федерация неврологии (WFN) провела встречу в Эль-Эскориал, Испания, чтобы разработать точные диагностические критерии БАС, чтобы помочь стандартизировать клинические испытания; итоговые критерии "Эль-Эскориала" были опубликованы в 1994 году.[131] В 1998 году WFN провела еще одно собрание для пересмотра критериев в Эйрли Хаус в г. Уоррентон, Вирджиния; полученные в результате критерии «Эйрли Хаус» или «Пересмотренный Эль Эскориал» были опубликованы в 2000 году.[132] В 2006 г. состоялось собрание Остров Авадзи в Японии, чтобы обсудить, как использовать тесты EMG и NCV для более ранней диагностики БАС; итоговые критерии «Авадзи» были опубликованы в 2008 году.[90]
Имя
Другие названия БАС включают болезнь Шарко, болезнь Лу Герига и болезнь двигательных нейронов.[1] Амиотрофный исходит из Греческий слово амиотрофия: а- означает "нет", мио относится к «мышце», и трофия означает «питание». Следовательно, амиотрофия означает "без питания мышц",[134] который описывает потерю сигналов, которые двигательные нейроны обычно посылают мышечным клеткам;[135] это приводит к характерной мышце атрофия наблюдается у людей с БАС. Боковой определяет области в спинном мозге человека, где расположены пораженные двигательные нейроны, управляющие мышцами. Склероз означает «рубцевание» или «затвердение» и относится к гибели мотонейронов спинного мозга.[134]
БАС иногда называют «болезнью Шарко», потому что Жан-Мартен Шарко был первым, кто связал клинические симптомы с патологией, наблюдаемой при вскрытии. Термин неоднозначный и может также относиться к Болезнь Шарко – Мари – Зуба и Болезнь Шарко.[136] Британский невролог Рассел Брэйн ввел термин «заболевание двигательных нейронов» в 1933 году, чтобы отразить свою веру в то, что БАС, прогрессирующий бульбарный паралич и прогрессирующая мышечная атрофия - все это разные формы одного и того же заболевания,[137] хотя «нейрон» следует писать как «нейрон».[138] В некоторых странах, особенно в США, БАС называют «болезнью Лу Герига»,[133] после американского бейсболиста Лу Гериг, который развил БАС в 1938 году, был вынужден прекратить играть в бейсбол в 1939 году и умер от этого в 1941 году.[139]
В Соединенных Штатах и континентальной Европе термины «БАС» или «болезнь Лу Герига» относятся ко всем формам заболевания, включая классический БАС, прогрессирующий бульбарный паралич, прогрессирующую мышечную атрофию и первичный боковой склероз.[140][36] В Соединенном Королевстве и Австралии термин «заболевание двигательных нейронов» используется для обозначения БАС; и другие заболевания, которые влияют на двигательные нейроны, лечат отдельно от болезней двигательных нейронов.[141][140]
Общество и культура
В августе 2014 г. популярный в Интернете, широко известный как "ALS Ice Bucket Challenge ".[142] Участники наполняют ведро льдом и водой, затем заявляют, кто их выдвинул для выполнения задания, и назначают трех других лиц по своему выбору для участия в нем. Затем участники выливают на себя ведра со льдом и водой. Однако это можно сделать и в другом порядке. Затем участники жертвуют не менее АМЕРИКАНСКИЙ ДОЛЛАР$ 10 (или аналогичная сумма в местной валюте) на исследование ALS в Ассоциация ALS, то Институт развития терапии БАС, Общество БАС Канады или же Ассоциация болезней моторных нейронов в Соединенном Королевстве. Ожидается, что все участники, которые откажутся, чтобы на них вылили лед и воду, пожертвуют не менее 100 долларов США на исследование ALS. По состоянию на июль 2015 г.[Обновить], Ice Bucket Challenge собрал 115 миллионов долларов для ассоциации ALS.[143] В конкурсе приняли участие многие знаменитости.[144] Конкурс Ice Bucket Challenge был отмечен как помощь в сборе средств, которые способствовали открытию того, что ген NEK1 потенциально может способствовать развитию БАС.[145][146]
Исследование
Модельные организмы

Многие различные организмы используются в качестве моделей для изучения БАС, в том числе: Saccharomyces cerevisiae (разновидность дрожжей),[87] Caenorhabditis elegans (аскариды), Drosophila melanogaster (обыкновенная плодовая муха), Данио Рерио (данио), Mus musculus (домовая мышь) и Раттус норвегикус (обыкновенная крыса).[13] Ни одна из этих моделей не представляет в полной мере БАС у людей, отчасти потому, что большинство моделей на животных основаны на сверхэкспрессии гена, что означает, что в трансгенную модель вставлены множественные копии мутантного гена человека, а отчасти потому, что нервная система человека сильно отличается от нервной системы человека. другие животные.[12]
Первой животной моделью БАС была SOD1G93A трансгенная мышь,[грамм] который был разработан в 1994 году. Он экспрессирует около 20–24 копий мутантного человеческого SOD1 ген[147] и воспроизводит большинство клинических и патологических данных, наблюдаемых при БАС.[148] Хотя сейчас существует более 20 различных SOD1 модели мыши, SOD1G93A модель остается как наиболее широко используемой SOD1 модель мыши[147] и наиболее широко используемая модель мыши ALS в целом.[27] Большая часть современного понимания патофизиологии БАС пришла из изучения моделей мышей, которые сверхэкспрессируют мутантный SOD1,[147] особенно SOD1G93A мышей.[27] Однако многие лекарственные мишени, которые показали свою эффективность в SOD1G93A трансгенная мышь не прошла клинических испытаний на людях; Другой SOD1 у моделей были похожие проблемы.[147] Большинство из этих препаратов были определены как потенциально эффективные на основании единственного исследования на грызунах. SOD1 модели, а затем потерпели неудачу в клинических испытаниях у пациентов, у которых в первую очередь был спорадический БАС.[87] Считается, что эти клинические испытания потерпели неудачу, потому что SOD1 мутации составляют только 2% всех случаев БАС[147] и потому что патология SOD1 Считается, что БАС отличается от всех других типов БАС; в нем отсутствуют аномальные агрегации белка TDP-43 или белка FUS, наблюдаемые почти во всех других случаях БАС.[26]
По состоянию на 2018 год их около 20 TARDBP моделей мышей, десяток FUS модели мышей, а также ряд C9orf72, PFN1, и UBQLN2 модели мышей. Существуют также новые методы разработки моделей на животных, в том числе вирусных. трансгенез, в котором вирусы используются для доставки мутантных генов к животной модели, и CRISPR / Cas9, который может быть использован для создания на животной модели нескольких мутированных генов. Оба эти метода быстрее и дешевле традиционных методов генной инженерии мышей; они также позволяют ученым изучать эффекты мутации у мышей разного генетического происхождения, что лучше отражает генетическое разнообразие, наблюдаемое у людей.[27]
Клеточные модели, используемые для изучения БАС, включают дрожжи Saccharomyces cerevisiae и двигательные нейроны крысы или мыши в культуре. Модели мелких животных включают плодовую мушку, аскариды. C. elegans, и данио. Из этих трех наиболее широко используется плодовая мушка; у него короткий жизненный цикл, короткая продолжительность жизни, сложная нервная система и множество доступных генетических инструментов. C. elegans имеет короткий жизненный цикл, им легко манипулировать генетически, и у него простая, но хорошо изученная нервная система. У рыбок данио есть прозрачные эмбрионы, в которые можно вводить ДНК или РНК, и они имеют продолжительность жизни до двух лет.[87] Индуцированные плюрипотентные стволовые клетки (ИПСК) можно использовать для преобразования кожи фибробласты в двигательные нейроны.[13] Теперь можно генерировать ИПСК у людей с БАС, которые затем можно преобразовать в мотонейроны спинного мозга, которые полезны для изучения механизмов заболевания и тестирования потенциальных лекарств от БАС. ИПСК позволяют моделировать спорадический БАС, чего нельзя сделать с моделями на животных.[87]
Лечение
С 1960-х по 2014 год около 50 препаратов от БАС были протестированы в рандомизированных контролируемых исследованиях (РКИ);[час] из них рилузол был единственным, который показал небольшое улучшение выживаемости. Протестированные препараты, эффективность которых не доказана в клинических испытаниях на людях, включают противовирусные препараты, антиэксайтотоксические препараты, факторы роста, нейротрофические факторы, противовоспалительные препараты, антиоксиданты, антиапоптотические препараты и препараты для улучшения функции митохондрий.[149]
Анализ 23 крупных РКИ фазы II и фазы III, которые потерпели неудачу в период с 2004 по 2014 год, пришел к выводу, что их неуспех было много. Эти испытания на людях были проведены на основании положительных результатов в SOD1 трансгенные мыши, которые не являются хорошей животной моделью для спорадического БАС. Кроме того, в большинстве доклинических исследований SOD1 мышам давали препарат на пресимптоматической стадии; это снижает вероятность того, что результаты будут применимы к людям с БАС, которые начинают лечение намного позже появления симптомов. Положительные результаты небольших исследований фазы II на людях также могут вводить в заблуждение и приводить к неудаче в исследованиях фазы III. Другие потенциальные проблемы включали то, что препарат не достиг предполагаемого места действия в центральной нервной системе и лекарственные взаимодействия между исследуемым препаратом и рилузолом.[149]
Повторяющийся транскраниальная магнитная стимуляция изучались при БАС в небольших и плохо спланированных клинических испытаниях; по состоянию на 2013 год[Обновить], доказательств было недостаточно, чтобы узнать, является ли рТМС безопасной или эффективной при БАС.[150] Один обзор 2016 г. терапия стволовыми клетками Испытания обнаружили предварительные доказательства того, что имплантация спинномозговых стволовых клеток была относительно безопасной и, возможно, эффективной.[151] А 2019 Кокрановский обзор клеточной терапии обнаружили, что не было достаточных доказательств, чтобы строить предположения об их эффективности.[152] Маситиниб был утвержден как орфанный препарат в Европе и США, исследования продолжаются с 2016 г.[Обновить].[153] Бета-адренергический агонист лекарства были предложены для лечения их воздействия на рост мышц и нейрозащиту, но исследований на людях недостаточно для определения их эффективности.[154]
Причина
С открытием, что ТДП-43, FUS, и C9orf72 может вызывать БАС, а также связанные с ним формы лобно-височной деменции (ЛВД / БАС)[155][156] Были предприняты активные усилия, чтобы понять, как эти мутации вызывают заболевание и может ли быть важна дисфункция других белков. По состоянию на 2013 год[Обновить] оказалось, что различия в метилирование остатков аргинина в белке FUS может иметь значение, а статус метилирования может быть способом отличить некоторые формы FTD от ALS.[157]
Смотрите также
Примечания
- ^ Дополнительные имена для синдром цепной руки включают лопаточно-плечевую форму БАС, синдром Вульпиана – Бернарта, синдром висящей руки и нейрогенный синдром человека в бочке.[20]
- ^ Дополнительные имена для синдром цепной ноги который затрагивает обе нижние конечности (двустороннее поражение дистальных отделов), включая псевдополиневритный БАС, синдром Патрикиоса, БАС Мари-Патрикио и малоберцовую форму БАС.[20]
- ^ Согласно одному когортному исследованию, 11,5% людей с БАС имеют дисфункцию экстраокулярных мышц.[38]
- ^ В 2013 году НФЛ достигла соглашения на 765 миллионов долларов о выплате компенсации более пяти тысячам бывшим игрокам НФЛ за травмы и болезни, связанные с сотрясением мозга.[78] Некоторые игроки НФЛ, участвовавшие в урегулировании споров, жаловались, что НФЛ недостаточно помогает игрокам. Судья по делу согласился, и в 2015 году НФЛ согласилась выплатить неограниченную сумму ущерба игрокам, у которых обнаружен БАС. болезнь Паркинсона, Болезнь Альцгеймера, или слабоумие.[79]
- ^ Критериями являются «оценка не менее 2 баллов по всем 12 пунктам ALSFRS-R, форсированная жизненная емкость легких 80% или более, определенный или вероятный БАС в соответствии с пересмотренными критериями Эль-Эскориала и продолжительность заболевания 2 года или менее».[101]
- ^ Основываясь на популяционных регистрах БАС, подсчитано, что этим критериям соответствуют менее 7% людей с БАС.[113]
- ^ «G93A» означает, что 93-й аминокислотный остаток в белке SOD1 был изменен с глицина на аланин.
- ^ Полный список см. Исследование бокового амиотрофического склероза № Прошедшие клинические испытания.
Рекомендации
- ^ а б c Wijesekera LC, Leigh PN (февраль 2009 г.). "Боковой амиотрофический склероз". Журнал редких заболеваний Orphanet. 3 (4): 3. Дои:10.1186/1750-1172-4-3. ЧВК 2656493. PMID 19192301.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у "Информационный бюллетень о боковом амиотрофическом склерозе (БАС) | Национальный институт неврологических заболеваний и инсульта". www.ninds.nih.gov. Получено 22 октября 2020.
- ^ а б c d е ж грамм час я j k Кирнан М.С., Вучич С., Чеа BC, Тернер М.Р., Эйзен А., Хардиман О., Баррелл Дж. Р., Зоинг М.С. (март 2011 г.). "Боковой амиотрофический склероз". Ланцет. 377 (9769): 942–55. Дои:10.1016 / с0140-6736 (10) 61156-7. PMID 21296405.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Хобсон Э.В., Макдермотт CJ (сентябрь 2016 г.). «Поддерживающее и симптоматическое лечение бокового амиотрофического склероза» (PDF). Обзоры природы. Неврология. 12 (9): 526–38. Дои:10.1038 / nrneurol.2016.111. PMID 27514291. S2CID 8547381.
- ^ а б c d е ж грамм Миллер Р., Митчелл Дж. Д., Мур Д.Х. (март 2012 г.). «Рилузол при боковом амиотрофическом склерозе (БАС) / болезни двигательных нейронов (БДН)». Кокрановская база данных систематических обзоров. 3 (3): CD001447. Дои:10.1002 / 14651858.CD001447.pub3. ЧВК 7055506. PMID 22419278.
- ^ «FDA одобряет препарат для лечения БАС». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. 5 мая 2017. В архиве из оригинала от 8 мая 2017 года.
- ^ а б c Hardiman O, Al-Chalabi A, Brayne C, Beghi E, van den Berg LH, Chio A, Martin S, Logroscino G, Rooney J (июль 2017 г.). «Меняющаяся картина бокового амиотрофического склероза: уроки европейских регистров». Журнал неврологии, нейрохирургии и психиатрии. 88 (7): 557–63. Дои:10.1136 / jnnp-2016-314495. PMID 28285264. S2CID 52871105.
- ^ а б c d е «Заболевание двигательных нейронов - NHS». nhs.uk. 15 января 2018 г.. Получено 24 октября 2020.
- ^ Австралия, Healthdirect (17 апреля 2020 г.). «Болезнь двигательных нейронов (БДН)». www.healthdirect.gov.au. Получено 24 октября 2020.
- ^ Цукки Э., Бонетто В., Сорару Г. и др. (15 октября 2020 г.). «Нейрофиламенты при нарушениях двигательных нейронов: к перспективным диагностическим и прогностическим биомаркерам». Молекулярная нейродегенерация. 15 (1): 58. Дои:10.1186 / s13024-020-00406-3. PMID 33059698. S2CID 222385359.
- ^ "Информационный бюллетень о заболеваниях двигательных нейронов | Национальный институт неврологических расстройств и инсульта". www.ninds.nih.gov. Получено 27 октября 2020.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа Hardiman O, Al-Chalabi A, Chio A, Corr EM, Logroscino G, Robberecht W., Shaw PJ, Simmons Z, van den Berg LH (октябрь 2017 г.). "Боковой амиотрофический склероз" (PDF). Обзоры природы. Праймеры для болезней. 3 (17071): 17071. Дои:10.1038 / nrdp.2017.71. PMID 28980624. S2CID 1002680.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты ван Эс М.А., Хардиман О, Чио А., Аль-Чалаби А., Пастеркамп Р.Дж., Велдинк Дж. Х., ван ден Берг Л. Х. (ноябрь 2017 г.). "Боковой амиотрофический склероз". Ланцет. 390 (10107): 2084–2098. Дои:10.1016 / S0140-6736 (17) 31287-4. PMID 28552366. S2CID 24483077.
- ^ а б c Chiò A, Mora G, Lauria G (февраль 2017 г.). «Боль при боковом амиотрофическом склерозе». Ланцет. Неврология. 16 (2): 144–57. arXiv:1607.02870. Дои:10.1016 / S1474-4422 (16) 30358-1. PMID 27964824. S2CID 38905437.
- ^ Хилтон Дж. Б., Белый АР, Крауч П. Дж. (Май 2015 г.). «Металл-дефицитный SOD1 при боковом амиотрофическом склерозе». Журнал молекулярной медицины (Берлин, Германия). 93 (5): 481–7. Дои:10.1007 / s00109-015-1273-3. PMID 25754173. S2CID 12043749.
- ^ а б «Понимание БАС». Ассоциация ALS.
- ^ а б c Винго Т.С., Катлер Д.Д., Яраб Н., Келли С.М., Гласс Д.Д. (2011). «Наследственность бокового амиотрофического склероза в клинически подтвержденном исследовательском регистре США». PLOS ONE. 6 (11): e27985. Bibcode:2011PLoSO ... 627985W. Дои:10.1371 / journal.pone.0027985. ЧВК 3222666. PMID 22132186.
- ^ а б c d е ж грамм час я j k л м п Сориани М., Деснуэль С. (май 2017 г.). «Менеджмент помощи при боковом амиотрофическом склерозе». Revue Neurologique. 173 (5): 288–89. Дои:10.1016 / j.neurol.2017.03.031. PMID 28461024.
- ^ а б c d е ж грамм час я j k Коннолли С., Гэлвин М., Хардиман О. (апрель 2015 г.). «Ведение пациентов с боковым амиотрофическим склерозом в конце жизни». Ланцет. Неврология. 14 (4): 435–42. Дои:10.1016 / S1474-4422 (14) 70221-2. PMID 25728958. S2CID 34109901.
- ^ а б c d е ж грамм час Суиннен Б., Робберехт В. (ноябрь 2014 г.). «Фенотипическая изменчивость бокового амиотрофического склероза». Обзоры природы. Неврология. 10 (11): 661–70. Дои:10.1038 / nrneurol.2014.184. PMID 25311585. S2CID 205516010.
- ^ а б c d е ж грамм Аль-Чалаби А., Хардиман О. (ноябрь 2013 г.). «Эпидемиология БАС: заговор генов, окружающей среды и времени». Обзоры природы. Неврология. 9 (11): 617–28. Дои:10.1038 / nrneurol.2013.203. PMID 24126629. S2CID 25040863.
- ^ а б c d е ж Мехта П., Кей В., Раймонд Дж., Пенджаби Р., Ларсон Т., Коэн Дж., Муравов О., Хортон К. (ноябрь 2018 г.). «Распространенность бокового амиотрофического склероза - США, 2015 г.». Еженедельный отчет о заболеваемости и смертности. 67 (46): 1285–1289. Дои:10,15585 / ммwr.mm6746a1. ЧВК 5858037. PMID 30462626.
- ^ а б c d е Rowland LP (март 2001 г.). «Как боковой амиотрофический склероз получил свое название: клинико-патологический гений Жана-Мартена Шарко». Архив неврологии. 58 (3): 512–15. Дои:10.1001 / archneur.58.3.512. PMID 11255459.
- ^ Келли, Эвелин Б. (2013). Энциклопедия генетики и болезней человека. Санта-Барбара, Калифорния: Гринвуд. С. 79–80. ISBN 978-0-313-38713-5. В архиве из оригинала от 8 сентября 2017 г.
- ^ Янгсон, Дэвид Б. Джейкоби, Роберт М. (2004). Энциклопедия здоровья семьи (3-е изд.). Тарритаун, штат Нью-Йорк: Маршалл Кавендиш. п. 1256. ISBN 978-0-7614-7486-9. В архиве из оригинала от 8 сентября 2017 г.
- ^ а б c d е ж грамм час Рентон А.Е., Чио А., Трейнор Б.Дж. (январь 2014 г.). «Состояние дел в генетике бокового амиотрофического склероза». Природа Неврология. 17 (1): 17–23. Дои:10.1038 / номер 3584. HDL:2318/156177. ЧВК 4544832. PMID 24369373.
- ^ а б c d е Lutz C (август 2018). «Мышиные модели БАС: прошлое, настоящее и будущее». Исследование мозга. 1693 (Часть A): 1–10. Дои:10.1016 / j.brainres.2018.03.024. PMID 29577886. S2CID 4641251.
- ^ Песня П (август 2014 г.). «Проблема ведра со льдом: государственный сектор должен быть готов к незамедлительному продвижению устойчивого развития системы медицинской помощи и исследования редких заболеваний». Исследования трудноизлечимых и редких заболеваний. 3 (3): 94–96. Дои:10.5582 / irdr.2014.01015. ЧВК 4214244. PMID 25364651.
- ^ «8B60 Болезнь двигательных нейронов». МКБ-11 по статистике смертности и заболеваемости. Всемирная организация здоровья. Получено 24 января 2019.
- ^ а б c Джавдат О., Статланд Дж. М., Барон Р. Дж., Кац Дж. С., Димачкие М. М. (ноябрь 2015 г.). «Региональные варианты бокового амиотрофического склероза (плечевая амиотрофическая диплегия, амиотрофическая диплегия ног и изолированный бульбарный боковой амиотрофический склероз)». Неврологические клиники. 33 (4): 775–85. Дои:10.1016 / j.ncl.2015.07.003. ЧВК 4629514. PMID 26515621.
- ^ а б c d е ж Град Л.И., Руло Г.А., Равиц Дж., Кашман Н.Р. (август 2017 г.). «Клинический спектр бокового амиотрофического склероза (БАС)». Перспективы Колд-Спринг-Харбор в медицине. 7 (8): a024117. Дои:10.1101 / cshperspect.a024117. ЧВК 5538408. PMID 28003278.
- ^ а б c d Chiò A, Calvo A, Moglia C, Mazzini L, Mora G (июль 2011 г.). «Фенотипическая гетерогенность бокового амиотрофического склероза: популяционное исследование». Журнал неврологии, нейрохирургии и психиатрии. 82 (7): 740–46. Дои:10.1136 / jnnp.2010.235952. PMID 21402743. S2CID 13416164.
- ^ Готье Г., Вершуерен А., Монье А., Аттариан С., Салорт-Кампана Е., Пуже Дж. (Август 2010 г.). «БАС с респираторным началом: клинические особенности и влияние неинвазивной вентиляции на прогноз». Боковой амиотрофический склероз. 11 (4): 379–82. Дои:10.3109/17482960903426543. PMID 20001486. S2CID 27672209.
- ^ а б c d е Аль-Чалаби А., Хардиман О., Кирнан М.С., Чио А., Рикс-Брукс Б., ван ден Берг Л.Х. (октябрь 2016 г.). «Боковой амиотрофический склероз: переход к новой системе классификации». Ланцет. Неврология. 15 (11): 1182–94. Дои:10.1016 / S1474-4422 (16) 30199-5. HDL:2318/1636249. PMID 27647646. S2CID 45285510.
- ^ Теох Х.Л., Кэри К., Сампайо Х., Моват Д., Росциоли Т., Фаррар М. (2017). «Унаследованные детские заболевания моторных нейронов: помимо спинальной мышечной атрофии». Нейронная пластичность. 2017: 6509493. Дои:10.1155/2017/6509493. ЧВК 5467325. PMID 28634552.
- ^ а б Tard C, Defebvre L, Moreau C, Devos D, Danel-Brunaud V (май 2017 г.). «Клинические особенности бокового амиотрофического склероза и их прогностическое значение». Revue Neurologique. 173 (5): 263–72. Дои:10.1016 / j.neurol.2017.03.029. PMID 28477850.
- ^ Луи А.Дж., Был Н.Н. (июнь 2009 г.). «Систематический обзор влияния упражнений средней интенсивности на функцию и прогрессирование заболевания при боковом амиотрофическом склерозе». Журнал неврологической физиотерапии. 33 (2): 68–87. Дои:10.1097 / NPT.0b013e31819912d0. PMID 19556916. S2CID 7650356.
- ^ Маккласки Л., Вандриэль С., Элман Л., Ван Дирлин В.М., Пауэрс Дж., Боллер А. и др. (15 октября 2014 г.). «Синдром ALS-Plus: непирамидные признаки в большой когорте ALS». Журнал неврологических наук. 345 (1–2): 118–24. Дои:10.1016 / j.jns.2014.07.022. ЧВК 4177937. PMID 25086858.
- ^ а б c d е ж грамм час я j Браун Р.Х., Аль-Чалаби А (13 июля 2017 г.). "Боковой амиотрофический склероз". Медицинский журнал Новой Англии. 377 (2): 162–172. Дои:10.1056 / NEJMra1603471. PMID 28700839.
- ^ а б c Мартин С., Аль Хлейфат А., Аль-Чалаби А. (2017). "Что вызывает боковой амиотрофический склероз?". F1000 Исследования. 6: 371. Дои:10.12688 / f1000research.10476.1. ЧВК 5373425. PMID 28408982.
- ^ Raaphorst J, Beeldman E, De Visser M, De Haan RJ, Schmand B (октябрь 2012 г.). «Систематический обзор поведенческих изменений при болезни двигательных нейронов». Боковой амиотрофический склероз. 13 (6): 493–501. Дои:10.3109/17482968.2012.656652. PMID 22424127. S2CID 22224140.
- ^ а б Бельдман Э., Раапхорст Дж., Кляйн Твеннаар М., де Виссер М., Шманд Б.А., де Хаан Р.Дж. (июнь 2016 г.).«Когнитивный профиль БАС: систематический обзор и обновление метаанализа». Журнал неврологии, нейрохирургии и психиатрии. 87 (6): 611–19. Дои:10.1136 / jnnp-2015-310734. PMID 26283685. S2CID 22082109.
- ^ Гордон PH, Миллер RG, Мур DH (сентябрь 2004 г.). «АЛСФРС-Р». Боковой амиотрофический склероз и другие заболевания двигательного нейрона. 5 Дополнение 1: 90–93. Дои:10.1080/17434470410019906. PMID 15512883. S2CID 218987659.
- ^ Creemers H, Grupstra H, Ноллет Ф, ван ден Берг Л. Х., Белен А. (июнь 2015 г.). «Прогностические факторы течения функционального состояния пациентов с БАС: систематический обзор». Журнал неврологии. 262 (6): 1407–23. Дои:10.1007 / s00415-014-7564-8. PMID 25385051. S2CID 31734765.
- ^ Castrillo-Viguera C, Grasso DL, Simpson E, Shefner J, Cudkowicz ME (2010). «Клиническое значение в изменении снижения ALSFRS-R». Боковой амиотрофический склероз (Журнальная статья). 11 (1–2): 178–80. Дои:10.3109/17482960903093710. PMID 19634063. S2CID 207619689.
- ^ Сабателли М., Мадиа Ф, Конте А., Луигетти М., Золлино М., Манкузо И., Ло Монако М., Липпи Дж., Тонали П. (сентябрь 2008 г.). "Естественная история бокового амиотрофического склероза молодых взрослых". Неврология. 71 (12): 876–81. Дои:10.1212 / 01.wnl.0000312378.94737.45. PMID 18596241. S2CID 10848454.
- ^ Паганони С., Дэн Дж., Яффа М., Цудкович М.Э., Уиллс А.М. (июль 2011 г.). «Индекс массы тела, а не дислипидемия, является независимым показателем выживаемости при боковом амиотрофическом склерозе». Мышцы и нервы. 44 (1): 20–24. Дои:10.1002 / mus.22114. ЧВК 4441750. PMID 21607987. Сложить резюме – Массачусетская больница общего профиля (11 мая 2011 г.).
- ^ «Стивен Хокинг служит образцом для подражания для пациентов с БАС». CNN. 20 апреля 2009 г. В архиве с оригинала 15 августа 2016 г.
- ^ «О семейном БАС - сотрудничество в области исследований БАС». Получено 27 октября 2020.
- ^ а б Вайда А., Маклафлин Р.Л., Хеверин М., Торп О., Абрахамс С., Аль-Чалаби А., Хардиман О. (март 2017 г.). «Генетическое тестирование при БАС: обзор текущей практики». Неврология. 88 (10): 991–999. Дои:10.1212 / WNL.0000000000003686. ЧВК 5333513. PMID 28159885.
- ^ Бирн С., Уолш С., Линч С., Беде П., Эламин М., Кенна К., Маклафлин Р., Хардиман О. (июнь 2011 г.). «Скорость семейного бокового амиотрофического склероза: систематический обзор и метаанализ». Журнал неврологии, нейрохирургии и психиатрии. 82 (6): 623–7. Дои:10.1136 / jnnp.2010.224501. HDL:2262/53330. PMID 21047878. S2CID 6254190.
- ^ а б c He J, Mangelsdorf M, Fan D, Bartlett P, Brown MA (декабрь 2015 г.). «Генетические исследования бокового амиотрофического склероза: от картирования ассоциации до секвенирования генома» (PDF). Нейробиолог. 21 (6): 599–615. Дои:10.1177/1073858414555404. PMID 25378359. S2CID 3437565.
- ^ а б Corcia P, Couratier P, Blasco H, Andres CR, Beltran S, Meininger V, Vourc'h P (май 2017 г.). «Генетика бокового амиотрофического склероза». Revue Neurologique. 173 (5): 254–262. Дои:10.1016 / j.neurol.2017.03.030. PMID 28449881.
- ^ Чиа Р., Чио А., Трейнор Би Джей (январь 2018 г.). «Новые гены, связанные с боковым амиотрофическим склерозом: диагностические и клинические последствия». Ланцет. Неврология. 17 (1): 94–102. Дои:10.1016 / S1474-4422 (17) 30401-5. ЧВК 5901717. PMID 29154141.
- ^ Zou ZY, Liu CY, Che CH, Huang HP (январь 2016 г.). «К точной медицине при боковом амиотрофическом склерозе». Анналы трансляционной медицины. 4 (2): 27. Дои:10.3978 / j.issn.2305-5839.2016.01.16. ЧВК 4731596. PMID 26889480.
- ^ Сонтхаймер, Харальд (2015). Заболевания нервной системы. Академическая пресса. п. 170. ISBN 978-0-12-800403-6. В архиве из оригинала 8 сентября 2017 г.. Получено 2 мая 2015.
- ^ Couratier P, Corcia P, Lautrette G, Nicol M, Marin B (май 2017 г.). «БАС и лобно-височная деменция относятся к общему спектру болезней». Revue Neurologique. 173 (5): 273–279. Дои:10.1016 / j.neurol.2017.04.001. PMID 28449882.
- ^ а б Нгуен Х.П., Ван Брокховен К., Ван дер Зи Дж. (Июнь 2018 г.). «Гены БАС в геномную эру и их значение для ЛТД». Тенденции в генетике. 34 (6): 404–423. Дои:10.1016 / j.tig.2018.03.001. PMID 29605155.
- ^ а б Борода Дж. Д., Камель Ф. (1 января 2015 г.). «Военная служба, развертывание и воздействие в связи с этиологией бокового амиотрофического склероза и выживаемостью». Эпидемиологические обзоры. 37 (1): 55–70. Дои:10.1093 / эпирев / mxu001. ЧВК 4325667. PMID 25365170.
- ^ Belbasis L, Bellou V, Evangelou E (март 2016 г.). «Факторы экологического риска и боковой амиотрофический склероз: общий обзор и критическая оценка текущих данных из систематических обзоров и метаанализов обсервационных исследований». Нейроэпидемиология. 46 (2): 96–105. Дои:10.1159/000443146. PMID 26731747. S2CID 13163292.
- ^ Борода Дж. Д., Стидж А. Л., Джу Дж., Лу Дж., Лакхаупт ЮВ, Шубауэр-Бериган МК (июль 2017 г.). "Смертность от бокового амиотрофического склероза и болезни Паркинсона среди различных профессиональных групп - США, 1985-2011 гг.". MMWR. Еженедельный отчет о заболеваемости и смертности. 66 (27): 718–722. Дои:10,15585 / ммwr.mm6627a2. ЧВК 5687590. PMID 28704346.
- ^ Сутеджа Н.А., Фишер К., Велдинк Дж. Х., ван дер Хейден Дж. Дж., Кромхаут Х, Хедерик Д., Хьюисман М. Х., Вокке Дж. Дж., Ван ден Берг Л. Х. (2009). «Что мы действительно знаем о профессии как факторе риска БАС: критический и систематический обзор». Боковой амиотрофический склероз. 10 (5–6): 295–301. Дои:10.3109/17482960802430799. PMID 19922116. S2CID 25772664.
- ^ Энгр С., Роос П.М., Пил Ф., Камель Ф., Фанг Ф (2015). «Факторы риска бокового амиотрофического склероза». Клиническая эпидемиология. 7: 181–93. Дои:10.2147 / CLEP.S37505. ЧВК 4334292. PMID 25709501.
- ^ Камель Ф., Умбах Д.М., Бедлак Р.С., Ричардс М., Уотсон М., Алаванджа М.К., Блэр А., Хоппин Дж. А., Шмидт С., Сандлер Д. П. (июнь 2012 г.). «Воздействие пестицидов и боковой амиотрофический склероз». Нейротоксикология. 33 (3): 457–62. Дои:10.1016 / j.neuro.2012.04.001. ЧВК 3358481. PMID 22521219.
- ^ Боццони В., Пансараса О, Диаманти Л., Носари Дж., Середа С., Серони М. (2016). «Боковой амиотрофический склероз и факторы окружающей среды». Функциональная неврология. 31 (1): 7–19. ЧВК 4819821. PMID 27027889.
- ^ Малек А.М., Барчовски А., Баузер Р., Юк А., Тэлботт Е. О. (август 2012 г.). «Воздействие пестицидов как фактор риска бокового амиотрофического склероза: метаанализ эпидемиологических исследований: воздействие пестицидов как фактор риска БАС». Экологические исследования. 117: 112–9. Bibcode:2012ER .... 117..112M. Дои:10.1016 / j.envres.2012.06.007. PMID 22819005.
- ^ а б Гарднер Р.К., Яффе К. (май 2015 г.). «Эпидемиология легкой черепно-мозговой травмы и нейродегенеративного заболевания». Молекулярная и клеточная нейронауки. 66 (Pt B): 75–80. Дои:10.1016 / j.mcn.2015.03.001. ЧВК 4461453. PMID 25748121.
- ^ Ватанабэ И, Ватанабэ Т. (октябрь 2017 г.). «Метааналитическая оценка связи между травмой головы и риском бокового амиотрофического склероза». Европейский журнал эпидемиологии. 32 (10): 867–879. Дои:10.1007 / s10654-017-0327-у. PMID 29080013. S2CID 449855.
- ^ Luna, J .; Логрошино, Г .; Couratier, P .; Марин Б. (май 2017 г.). «Актуальные вопросы эпидемиологии БАС: вариабельность возникновения БАС между популяциями и физическая активность как фактор риска». Revue Neurologique. 173 (5): 244–253. Дои:10.1016 / j.neurol.2017.03.035. ISSN 0035-3787. PMID 28477849.
- ^ Велдинк JH, Kalmijn S, Groeneveld GJ, Titulaer MJ, Wokke JH, van den Berg LH (январь 2005 г.). «Физическая активность и связь со спорадическим БАС». Неврология. 64 (2): 241–5. Дои:10.1212 / 01.WNL.0000149513.82332.5C. PMID 15668420. S2CID 36449771.
- ^ Armon C (ноябрь 2007 г.). "Спорт и травмы при боковом амиотрофическом склерозе". Журнал неврологических наук. 262 (1–2): 45–53. Дои:10.1016 / j.jns.2007.06.021. PMID 17681549. S2CID 20733887.
- ^ а б Харвуд, Калифорния, Макдермотт С.Дж., Шоу П.Дж. (август 2009 г.). «Физическая активность как экзогенный фактор риска при заболеваниях двигательных нейронов (БДН): обзор доказательств». Боковой амиотрофический склероз. 10 (4): 191–204. Дои:10.1080/17482960802549739. PMID 19263258. S2CID 14749160.
- ^ Хамиду Б., Куратье П., Безансон С., Николь М., Прею П.М., Марин Б. (июль 2014 г.). «Эпидемиологические доказательства того, что физическая активность не является фактором риска БАС». Европейский журнал эпидемиологии. 29 (7): 459–75. Дои:10.1007 / s10654-014-9923-2. PMID 24986107. S2CID 20563636.
- ^ Lacorte E, Ferrigno L, Leoncini E, Corbo M, Boccia S, Vanacore N (июль 2016 г.). «Физическая активность и физическая активность, связанная со спортом, досугом и профессиональной деятельностью как факторы риска БАС: систематический обзор». Неврология и биоповеденческие обзоры. 66: 61–79. Дои:10.1016 / j.neubiorev.2016.04.007. PMID 27108217. S2CID 24844638.
- ^ Couratier P, Corcia P, Lautrette G, Nicol M, Preux P, Marin B (январь 2016 г.). «Эпидемиология бокового амиотрофического склероза: обзор литературы». Нейроэпидемиология. 172 (1): 37–45. Дои:10.1016 / j.neurol.2015.11.002. PMID 26727307.
- ^ Тхармаратнам Т., Искандар М., Табобондунг Т., Тоббия I, Гопи-Раманан П., Табобондунг Т. (19 июня 2018 г.). "Хроническая травматическая энцефалопатия у профессиональных игроков в американский футбол: где мы сейчас?". Границы неврологии. 19 (9): 445. Дои:10.3389 / fneur.2018.00445. ЧВК 6018081. PMID 29971037.
- ^ Гарднер А., Айверсон Дж., МакКрори П. (январь 2014 г.). «Хроническая травматическая энцефалопатия в спорте: систематический обзор». Британский журнал спортивной медицины. 48 (2): 84–90. Дои:10.1136 / bjsports-2013-092646. PMID 23803602. S2CID 7182895.
- ^ Белсон, Кен (22 апреля 2015 г.). «Судья одобряет сделку в костюме от сотрясения мозга N.F.L.». Нью-Йорк Таймс. Получено 10 августа 2018.
- ^ «Кевин Тернер, игрок НФЛ, который впоследствии дрался с Лигой, умер в возрасте 46 лет». Нью-Йорк Таймс. 24 марта 2016 г. В архиве из оригинала 28 марта 2016 г.. Получено 27 марта 2016.
- ^ Armon C (ноябрь 2009 г.). «Курение можно считать установленным фактором риска спорадического БАС». Неврология. 73 (20): 1693–8. Дои:10.1212 / WNL.0b013e3181c1df48. ЧВК 2788806. PMID 19917993.
- ^ Алонсо А., Логрошино Дж., Эрнан М.А. (ноябрь 2010 г.). «Курение и риск бокового амиотрофического склероза: систематический обзор и метаанализ». Журнал неврологии, нейрохирургии и психиатрии. 81 (11): 1249–52. Дои:10.1136 / jnnp.2009.180232. PMID 20639382. S2CID 2079442.
- ^ Ван Х, О'Рейли ЭДж, Вайскопф М.Г., Логроскино Дж., Маккалоу М.Л., Тун М.Дж., Шацкин А., Колонель Л.Н., Аскерио А. (февраль 2011 г.). «Курение и риск бокового амиотрофического склероза: объединенный анализ 5 проспективных когорт». Архив неврологии. 68 (2): 207–13. Дои:10.1001 / archneurol.2010.367. ЧВК 3319086. PMID 21320987.
- ^ Роббрехт В., Филипс Т. (апрель 2013 г.). «Меняющаяся сцена бокового амиотрофического склероза». Обзоры природы. Неврология. 14 (4): 248–64. Дои:10.1038 / номер 3430. PMID 23463272. S2CID 208941.
- ^ Окамото К., Мизуно Ю. (апрель 2008 г.). «Буниновые тельца при боковом амиотрофическом склерозе». Невропатология. 28 (2): 109–15. Дои:10.1111 / j.1440-1789.2007.00873.x. PMID 18069968. S2CID 34398467.
- ^ Уайт Дж.А., Банерджи Р., Гунавардена С. (19 мая 2016 г.). «Транспорт аксонов и нейродегенерация: как морские препараты могут быть использованы для разработки терапевтических средств». Морские препараты. 14 (5): 102. Дои:10.3390 / md14050102. ЧВК 4882576. PMID 27213408.
- ^ Нг Ки Квонг, Кой Чонг; Mehta, Arpan R .; Недергаард, Майкен; Чандран, Сиддхартхан (20 августа 2020 г.). «Определение новых функций спинномозговой жидкости в патофизиологии БАС». Acta Neuropathologica Communications. 8 (1): 140. Дои:10.1186 / s40478-020-01018-0. ISSN 2051-5960. ЧВК 7439665. PMID 32819425.
- ^ а б c d е Филип Ван Дамм П., Робберехт В., Ван ден Бош Л. (май 2017 г.). «Моделирование бокового амиотрофического склероза: прогресс и возможности». Модели и механизмы заболеваний. 10 (5): 537–49. Дои:10.1242 / дмм.029058. ЧВК 5451175. PMID 28468939.
- ^ Сюй З., Хендерсон Р.Д., Дэвид М., МакКомб ПА (2016). «Нейрофиламенты как биомаркеры бокового амиотрофического склероза: систематический обзор и метаанализ». PLOS ONE. 11 (10): e0164625. Bibcode:2016PLoSO..1164625X. Дои:10.1371 / journal.pone.0164625. ЧВК 5061412. PMID 27732645.
- ^ Vu LT, Bowser R (январь 2017 г.). «Биомаркеры на основе жидкости для бокового амиотрофического склероза». Нейротерапия. 14 (1): 119–134. Дои:10.1007 / s13311-016-0503-х. ЧВК 5233638. PMID 27933485.
- ^ а б де Карвалью М., Денглер Р., Эйзен А., Англия Д. Д., Каджи Р., Кимура Дж. и др. (Март 2008 г.). «Электродиагностические критерии диагностики БАС». Клиническая нейрофизиология. 119 (3): 497–503. Дои:10.1016 / j.clinph.2007.09.143. PMID 18164242. S2CID 14851649.
- ^ Коста Дж., Сваш М., де Карвалью М. (ноябрь 2012 г.). «Критерии Авадзи для диагностики бокового амиотрофического склероза: систематический обзор». Архив неврологии. 69 (11): 1410–1416. Дои:10.1001 / archneurol.2012.254. PMID 22892641.
- ^ Белш Дж. М. (март 2000 г.). «Диагностические критерии БАС El Escorial Revisited: соответствуют ли они потребностям врачей, а также исследователей?». Боковой амиотрофический склероз и другие заболевания двигательного нейрона. 1 (Приложение 1): S57 – S60. Дои:10.1080/14660820052415925. PMID 11464928. S2CID 6828235.
- ^ Силани В., Мессина С., Полетти Б., Морелли С., Доретти А., Тикоцци Н., Мадерна Л. (март 2011 г.). «Диагноз: боковой амиотрофический склероз 2010 г.». Archives Italiennes de Biologie. 149 (1): 5–27. Дои:10.4449 / aib.v149i1.1260. PMID 21412713.
- ^ «Миастенический синдром Ламберта-Итона (LEMS)». Misc.medscape.com. В архиве из оригинала 14 мая 2013 г.. Получено 18 апреля 2013.
- ^ "LEMS.com, Миастенический синдром Ламберта-Итона: О нас". Lems.com. В архиве из оригинала 20 января 2013 г.. Получено 18 апреля 2013.
- ^ Миллс КР (ноябрь 2010 г.). «Характеристики фасцикуляций при боковом амиотрофическом склерозе и доброкачественном синдроме фасцикуляции». Мозг. 133 (11): 3458–69. Дои:10.1093 / мозг / awq290. PMID 20959307.
- ^ Эйзен А. (2002). «Боковой амиотрофический склероз: обзор». BCMJ. 44 (7): 362–366. Архивировано из оригинал 21 июня 2013 г.. Получено 21 августа 2014.
- ^ Давенпорт Р.Дж., Свинглер Р.Дж., канцлер А.М., Уорлоу С.П. (февраль 1996 г.). «Как избежать ложноположительных диагнозов болезни двигательных нейронов: уроки из шотландского Регистра болезней двигательных нейронов». Журнал неврологии, нейрохирургии и психиатрии. 60 (2): 147–51. Дои:10.1136 / jnnp.60.2.147. ЧВК 1073793. PMID 8708642.
- ^ Киея М.А., Оливейра А.С., Сильва Х.С., Габбай А.А. (декабрь 2010 г.). «Боковой амиотрофический склероз: соображения по диагностическим критериям». Arquivos de Neuro-Psiquiatria. 68 (6): 837–42. Дои:10.1590 / S0004-282X2010000600002. PMID 21243238.
- ^ Аль-Асми А., Нандхагопал Р., Джейкоб П.С., Гуджар А. (февраль 2012 г.). «Ошибочный диагноз миастении и последующее клиническое значение: отчет о болезни и обзор литературы». Медицинский журнал Университета Султана Кабуса. 12 (1): 103–8. Дои:10.12816/0003095. ЧВК 3286704. PMID 22375266.
- ^ а б c Абэ К., Масаси А., Цудзи С., Итояма Й., Собуэ Г., Того М. и др. (Июль 2017 г.). «Безопасность и эффективность эдаравона у четко определенных пациентов с боковым амиотрофическим склерозом: рандомизированное двойное слепое плацебо-контролируемое исследование». Ланцет. Неврология. 16 (7): 505–12. Дои:10.1016 / S1474-4422 (17) 30115-1. PMID 28522181.
- ^ а б c Йео CJ, Simmons Z (май 2018 г.). «Обсуждение эдаравона с пациентом с БАС: этические рамки с точки зрения США». Боковой амиотрофический склероз и лобно-височная дегенерация. 19 (3–4): 167–72. Дои:10.1080/21678421.2018.1425455. PMID 29334251. S2CID 4627647.
- ^ а б c d Оррелл Р.В. (2010). «Болезнь двигательных нейронов: систематические обзоры лечения БАС и СМА». Британский медицинский бюллетень. 93: 145–59. Дои:10.1093 / bmb / ldp049. PMID 20015852.
- ^ а б Радунович А., Аннане Д., Рафик М., Брассингтон Р., Мустфа Н. (6 октября 2017 г.). «Механическая вентиляция легких при боковом амиотрофическом склерозе / заболевании двигательных нейронов». Кокрановская база данных систематических обзоров. 10 (10): CD004427. Дои:10.1002 / 14651858.CD004427.pub4. ЧВК 6485636. PMID 28982219.
- ^ а б c Ахмед Р., Ньюкомб Р., Пайпер А., Льюис С., Йи Б., Кирнан М., Грюнштейн Р. (апрель 2016 г.). «Нарушения сна и дыхательной функции при боковом амиотрофическом склерозе». Отзывы о медицине сна. 26: 33–42. Дои:10.1016 / j.smrv.2015.05.007. PMID 26166297.
- ^ а б Эйзен А., Кригер С. (ноябрь 2013 г.). «Этические соображения в лечении бокового амиотрофического склероза». Прогресс в нейробиологии. 110: 45–53. Дои:10.1016 / j.pneurobio.2013.05.001. PMID 23735671. S2CID 26282198.
- ^ а б Льюис М, Рушанан С (2007). «Роль физиотерапии и трудотерапии в лечении бокового амиотрофического склероза». Нейрореабилитация. 22 (6): 451–61. Дои:10.3233 / NRE-2007-22608. PMID 18198431.
- ^ а б c d е «Боковой амиотрофический склероз (БАС)». Американская ассоциация речи, языка и слуха, Роквилл, Мэриленд. Архивировано из оригинал 2 августа 2012 г.. Получено 30 ноября 2016.
- ^ а б c Арбесман М, Шеард К. (2014). «Систематический обзор эффективности вмешательств, связанных с трудовой терапией для людей с боковым амиотрофическим склерозом». Американский журнал профессиональной терапии. 68 (1): 20–26. Дои:10.5014 / ajot.2014.008649. PMID 24367951.
- ^ а б Кацберг HD, Бенатар М (январь 2011 г.). «Энтеральное зондовое питание при боковом амиотрофическом склерозе / заболевании двигательных нейронов». Кокрановская база данных систематических обзоров (1): CD004030. Дои:10.1002 / 14651858.CD004030.pub3. ЧВК 7163276. PMID 21249659.
- ^ а б c Андерсен П.М., Абрахамс С., Боразио Г.Д., де Карвалью М., Чио А., Ван Дамм П. и др. (Март 2012 г.). «Руководство EFNS по клиническому лечению бокового амиотрофического склероза (MALS) - пересмотренный отчет специальной группы EFNS». Европейский журнал неврологии. 19 (3): 360–75. Дои:10.1111 / j.1468-1331.2011.03501.x. PMID 21914052. S2CID 5746940.
- ^ Карлези С., Паскуали Л., Пьяцца С., Ло Герфо А., Калдараццо Иенко Е., Алесси Р., Форнаи Ф, Сицилиано Г. (март 2011 г.). «Стратегии клинического подхода к нейродегенерации при боковом амиотрофическом склерозе». Archives Italiennes de Biologie. 149 (1): 151–67. Дои:10.4449 / aib.v149i1.1267. PMID 21412722.
- ^ Hardiman O, van den Berg LH (июль 2017 г.). «Эдаравон: новое лечение БАС на горизонте?». Ланцет. Неврология. 16 (7): 490–91. Дои:10.1016 / S1474-4422 (17) 30163-1. PMID 28522180. S2CID 7609862.
- ^ а б c d е ж грамм Дорст Дж, Людольф А., Хюберс А. (2018). «Болезненная и симптоматическая терапия бокового амиотрофического склероза».. Терапевтические достижения при неврологических расстройствах. 11: 1756285617734734. Дои:10.1177/1756285617734734. ЧВК 5784546. PMID 29399045.
- ^ а б Такей К., Ватанабе К., Юки С., Акимото М., Саката Т., Палумбо Дж. (Октябрь 2017 г.). «Эдаравон и его клиническая разработка для лечения бокового амиотрофического склероза». Боковой амиотрофический склероз. 18 (sup 1): 5–10. Дои:10.1080/21678421.2017.1353101. PMID 28872907.
- ^ Паганони, Сабрина; Хендрикс, Сюзанна; Диксон, Сэмюэл П .; Ноултон, Ньюман; Macklin, Eric A .; Берри, Джеймс Д .; Эллиотт, Майкл А .; Майзер, Сэмюэл; Карам, Чафик; Ласка, Джеймс Б.; Овеги, Маргарет Айо (2020). «Долгосрочная выживаемость участников испытания CENTAUR фенилбутирата натрия-таурусодиола при БАС». Мышцы и нервы. н / д (н / д). Дои:10.1002 / mus.27091. ISSN 1097-4598. PMID 33063909.
- ^ Беллак, Пэм. «Лекарство может продлить жизнь пациентам с БАС на несколько месяцев, как показывают исследования». chicagotribune.com. Получено 23 октября 2020.
- ^ а б Паганони С., Карам С., Джойс Н., Бедлак Р., Картер Г. (2015). «Комплексная реабилитационная помощь по всему спектру бокового амиотрофического склероза». Нейрореабилитация. 37 (1): 53–68. Дои:10.3233 / NRE-151240. ЧВК 5223769. PMID 26409693.
- ^ Данель-Брюно В., Тузе Л., Шевалье Л., Моро С., Девос Д., Вандулеге С., Лефевр Л. (май 2017 г.). «Этические соображения и паллиативная помощь пациентам с боковым амиотрофическим склерозом: обзор». Revue Neurologique. 173 (5): 300–07. Дои:10.1016 / j.neurol.2017.03.032. PMID 28479121.
- ^ Checkoway H, Lundin JI, Kelada SN (2011). «Глава 22: Нейродегенеративные заболевания». В Ротман Н., Эно П., Шульте П., Смит М., Боффетта П., Перера Ф. (ред.). Молекулярная эпидемиология: принципы и практика. Международное агентство по изучению рака. С. 408–409. ISBN 978-9283221630.
- ^ Chiò A, Logroscino G, Traynor BJ, Collins J, Simeone JC, Goldstein LA, White LA (2013). «Глобальная эпидемиология бокового амиотрофического склероза: систематический обзор опубликованной литературы». Нейроэпидемиология. 41 (2): 118–30. Дои:10.1159/000351153. ЧВК 4049265. PMID 23860588.
- ^ а б Артур К.С., Кальво А., Прайс Т.Р., Гейгер Дж. Т., Чио А., Трейнор Б.Дж. (11 августа 2016 г.). «Прогнозируемое увеличение заболеваемости боковым амиотрофическим склерозом с 2015 по 2040 год». Nature Communications. 7 (12408): 12408. Bibcode:2016НатКо ... 712408A. Дои:10.1038 / ncomms12408. ЧВК 4987527. PMID 27510634.
- ^ а б Луна Дж, Логрошино Дж, Куратье П., Марин Б. (май 2017 г.). «Актуальные вопросы эпидемиологии БАС: вариабельность возникновения БАС между популяциями и физическая активность как фактор риска». Revue Neurologique. 173 (5): 244–53. Дои:10.1016 / j.neurol.2017.03.035. PMID 28477849.
- ^ Zou ZY, Zhou ZR, Che CH, Liu CY, He RL, Huang HP (июль 2017 г.). «Генетическая эпидемиология бокового амиотрофического склероза: систематический обзор и метаанализ». Журнал неврологии, нейрохирургии и психиатрии. 88 (77): 540–49. Дои:10.1136 / jnnp-2016-315018. PMID 28057713. S2CID 41974606.
- ^ Виссер Дж., Де Йонг Дж. М., де Виссер М. (февраль 2008 г.). «История прогрессирующей мышечной атрофии: синдром или болезнь?». Неврология. 70 (9): 723–27. Дои:10.1212 / 01.wnl.0000302187.20239.93. PMID 18299524. S2CID 22629725.
- ^ Wijesekera LC, Mathers S, Talman P, Galtrey C, Parkinson MH, Ganesalingam J, Willey E, Ampong MA, Ellis CM, Shaw CE, Al-Chalabi A, Leigh PN (март 2009 г.). «Естественная история и клинические особенности вариантов БАС с цепной рукой и ногой с цепом». Неврология. 72 (12): 1087–94. Дои:10.1212 / 01.wnl.0000345041.83406.a2. ЧВК 2821838. PMID 19307543.
- ^ Ли SE (декабрь 2011 г.). «Синдром деменции Гуама повторно посещен в 2011 году». Текущее мнение в неврологии. 24 (6): 517–24. Дои:10.1097 / WCO.0b013e32834cd50a. PMID 21986681.
- ^ Брукс Б.Р., Санджак М., Рингель С., Англия Дж., Бринкманн Дж., Пестронк А. и др. (Февраль 1996 г.). «Функциональная рейтинговая шкала бокового амиотрофического склероза: оценка повседневной активности пациентов с боковым амиотрофическим склерозом». Архив неврологии. 53 (2): 141–7. Дои:10.1001 / archneur.1996.00550020045014. PMID 8639063.
- ^ Cedarbaum JM, Stambler N, Malta E, Fuller C, Hilt D, Thurmond B, Nakanishi A (октябрь 1999 г.). «ALSFRS-R: пересмотренная функциональная рейтинговая шкала ALS, которая включает оценки респираторной функции». Журнал неврологических наук. 162 (1–2): 13–21. Дои:10.1016 / s0022-510x (99) 00210-5. PMID 10540002. S2CID 7057926.
- ^ Уилборн AJ (октябрь 1998 г.). «Клиническая нейрофизиология в диагностике бокового амиотрофического склероза: критерии Ламберта и Эль-Эскориала». Журнал неврологических наук. 160 (Приложение 1): S25–29. Дои:10.1016 / s0022-510x (98) 00194-4. PMID 9851644. S2CID 32884687.
- ^ Брукс Б.Р. (июль 1994 г.). "Эль-Эскориал Всемирная федерация неврологии Критерии диагностики бокового амиотрофического склероза". Журнал неврологических наук. 124 (Приложение): 96–107. Дои:10.1016 / 0022-510x (94) 90191-0. PMID 7807156. S2CID 32678612.
- ^ Брукс Б.Р., Миллер Р.Г., Swash M, Munsat TL (декабрь 2000 г.). «Повторный визит в El Escorial: пересмотренные критерии диагностики бокового амиотрофического склероза». Боковой амиотрофический склероз и другие заболевания двигательного нейрона. 1 (5): 293–9. Дои:10.1080/146608200300079536. PMID 11464847. S2CID 22725949.
- ^ а б Teive HA, Lima PM, Germiniani FM, Munhoz RP (май 2016 г.). «Что в имени? Проблемы, факты и противоречия относительно неврологических эпонимов». Arquivos de Neuro-Psiquiatria. 74 (5): 423–25. Дои:10.1590 / 0004-282X20160040. PMID 27191240.
- ^ а б "Что такое БАС?". Ассоциация ALS. В архиве из оригинала 21 декабря 2018 г.. Получено 23 декабря 2018.
- ^ «БАС: боковой амиотрофический склероз». Ассоциация мышечной дистрофии. 18 декабря 2015. В архиве с оригинала 6 августа 2018 г.. Получено 23 декабря 2018.
- ^ Goetz CG (март 2000 г.). «Боковой амиотрофический склероз: ранний вклад Жана-Мартена Шарко». Мышцы и нервы. 23 (3): 336–43. Дои:10.1002 / (SICI) 1097-4598 (200003) 23: 3 <336 :: AID-MUS4> 3.0.CO; 2-L. PMID 10679709.
- ^ Гордон PH (2006). «Глава 1: История БАС». В Мицумото H, Прзедборски S, Гордон PH (ред.). Боковой амиотрофический склероз. CRC Press. п. 9. ISBN 978-0824729240.
- ^ Mehta AR, Mehta PR, Anderson SP, MacKinnon BL, Compston A (январь 2020 г.). "Этимология серого вещества и нейрон (е)". Мозг. 143 (1): 374–379. Дои:10.1093 / мозг / awz367. ЧВК 6935745. PMID 31844876.
- ^ Гордон PH (октябрь 2013 г.). «Боковой амиотрофический склероз: обновленная информация о клинических характеристиках, патофизиологии, лечении и терапевтических исследованиях 2013 г.». Старение и болезнь. 4 (5): 295–310. Дои:10.14336 / AD.2013.0400295. ЧВК 3794725. PMID 24124634.
- ^ а б Хьюн В., Саймон Н.Г., Гросскройц Дж., Тернер М.Р., Вучич С., Кирнан М.С. (июль 2016 г.). «Оценка верхнего двигательного нейрона при боковом амиотрофическом склерозе». Клиническая нейрофизиология. 127 (7): 2643–2660. Дои:10.1016 / j.clinph.2016.04.025. PMID 27291884. S2CID 3757685.
- ^ «Заболевания двигательных нейронов». www.uclh.nhs.uk. Получено 26 октября 2020.
- ^ «Джордж Буш представляет, возможно, лучший вызов ведерке со льдом при БАС». Независимый. В архиве из оригинала 21 августа 2014 г.. Получено 20 августа 2014.
- ^ «Ice Bucket Challenge финансирует открытие генов в исследовании БАС (БДН)». Новости BBC. 27 июля 2016 г. В архиве из оригинала 28 июля 2016 г.. Получено 27 июля 2016.
- ^ Александр, Элла. «Ice Bucket Challenge: Леди Гага, Джастин Бибер, G-Dragon и Опра - пока самые забавные реакции».
- ^ «Ice Bucket Challenge финансирует открытие гена, связанного с БАС». В архиве из оригинала 27 июля 2016 г.. Получено 27 июля 2016.
- ^ Кенна К.П., ван Дормаал П.Т., Деккер А.М. и др. (Сентябрь 2016 г.). «Варианты NEK1 придают предрасположенность к боковому амиотрофическому склерозу». Природа Генетика. 48 (9): 1037–42. Дои:10,1038 / нг.3626. ЧВК 5560030. PMID 27455347.
- ^ а б c d е Moujalled D, White AR (март 2016 г.). «Достижения в разработке методов лечения бокового амиотрофического склероза». Препараты ЦНС. 30 (3): 227–43. Дои:10.1007 / s40263-016-0317-8. HDL:11343/216653. PMID 26895253. S2CID 13487502.
- ^ Пичер-Мартель V, Вальдманис П.Н., Гулд П.В., Жюльен Дж. П., Дюпре Н. (июль 2016 г.). «От животных моделей до болезней человека: генетический подход к персонализированной медицине при БАС». Acta Neuropathologica Communications. 11 (4): 70. Дои:10.1186 / s40478-016-0340-5. ЧВК 4940869. PMID 27400686.
- ^ а б Мицумото Х., Брукс Б.Р., Силани В. (ноябрь 2014 г.). «Клинические испытания бокового амиотрофического склероза: почему так много отрицательных испытаний и как их можно улучшить?». Ланцет. Неврология. 13 (11): 1127–38. Дои:10.1016 / S1474-4422 (14) 70129-2. PMID 25316019. S2CID 28510979.
- ^ Фанг Дж, Чжоу М., Ян М., Чжу С., Хэ Л. (май 2013 г.). «Повторяющаяся транскраниальная магнитная стимуляция для лечения бокового амиотрофического склероза или болезни двигательных нейронов». Кокрановская база данных систематических обзоров (5): CD008554. Дои:10.1002 / 14651858.CD008554.pub3. ЧВК 7173713. PMID 23728676.
- ^ Чен К.С., Саковски С.А., Фельдман Е.Л. (март 2016 г.). «Интраспинальная трансплантация стволовых клеток при боковом амиотрофическом склерозе». Анналы неврологии. 79 (3): 342–53. Дои:10.1002 / ana.24584. ЧВК 4789073. PMID 26696091.
- ^ Абдул Вахид, С. Фадила; Закон, Чжэ Канг; Исмаил, Нор Азима; Лай, Най Мин (19 декабря 2019 г.). «Клеточная терапия бокового амиотрофического склероза / болезни двигательных нейронов». Кокрановская база данных систематических обзоров. 12: CD011742. Дои:10.1002 / 14651858.CD011742.pub3. ISSN 1469-493X. ЧВК 6920743. PMID 31853962.
- ^ «Публичное изложение мнения о назначении маситиниба мезилата сиротам для лечения бокового амиотрофического склероза» (PDF). EMA. Европейское агентство по лекарственным средствам, Комитет по орфанным лекарственным препаратам. 22 сентября 2016. В архиве (PDF) из оригинала от 6 ноября 2016 г.. Получено 6 ноября 2016.
- ^ Bartus RT, Bétourné A, Basile A, Peterson BL, Glass J, Boulis NM (январь 2016 г.). «Агонисты β2-адренорецепторов как новые, безопасные и потенциально эффективные методы лечения бокового амиотрофического склероза (БАС)». Нейробиология болезней. 85: 11–24. Дои:10.1016 / j.nbd.2015.10.006. PMID 26459114. S2CID 536279.
- ^ Бройер С., Зимянин В., Герман А. (апрель 2018 г.). «Прионоподобные свойства белков, имеющих отношение к заболеванию, при боковом амиотрофическом склерозе». Журнал нейронной передачи. 125 (4): 591–613. Дои:10.1007 / s00702-018-1851-y. PMID 29417336. S2CID 3895544.
- ^ Lau DH, Hartopp N, Welsh NJ, Mueller S, Glennon EB, Mórotz GM, Annibali A, Gomez-Suaga P, Stoica R, Paillusson S, Miller CC (февраль 2018 г.). «Нарушение передачи сигналов ER-митохондрий при лобно-височной деменции и связанном с ней боковом амиотрофическом склерозе». Смерть и болезнь клеток. 9 (3): 327. Дои:10.1038 / s41419-017-0022-7. ЧВК 5832427. PMID 29491392.
- ^ Neumann M (октябрь 2013 г.). «Лобно-височная долевая дегенерация и боковой амиотрофический склероз: молекулярные сходства и различия». Revue Neurologique. 169 (10): 793–98. Дои:10.1016 / j.neurol.2013.07.019. PMID 24011641.
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |



