Валозин-содержащий белок - Valosin-containing protein
Валозин-содержащий белок (VCP) или АТФаза переходного эндоплазматического ретикулума (TER-АТФаза) также известен как или p97 у млекопитающих и CDC48 в С. cerevisiae, является фермент что у людей кодируется VCP ген.[5][6][7] TER-АТФаза - это АТФаза фермент присутствует во всех эукариоты и архебактерии. Его основная функция состоит в том, чтобы отделить белковые молекулы от крупных клеточных структур, таких как белковые сборки, мембраны органелл и хроматин, и, таким образом, облегчают деградацию высвобождаемых полипептидов мультисубъединичной протеазой протеасома.
p97 /CDC48 является членом AAA + (расширенное семейство АТФаз, связанных с различной клеточной активностью) Семейство АТФаз. Ферменты этого семейства встречаются у всех видов, от бактерий до людей. Многие из них важны шапероны которые регулируют сворачивание или разворачивание белков-субстратов. p97 / CDC48 является ААА + АТФазой типа II, что означает, что он содержит два тандемных домена АТФазы (названные D1 и D2, соответственно) (Рисунок 1).
Два домена АТФазы соединены коротким полипептидным линкером. Домен, предшествующий домену D1 (N-концевой домен) и короткий карбоксильный терминал tail участвуют во взаимодействии с кофакторами.[8] N-домен соединен с доменом D1 коротким линкером N-D1.
Большинство известных субстратов p97 / CDC48 модифицированы убиквитин цепи и деградировал 26S протеасома. Соответственно, многие коферменты и адаптеры p97 / CDC48 имеют домены, которые могут распознавать убиквитин.[9] Стало очевидным, что взаимодействия между ubiquitin и кофакторами p97 / CDC48 критичны для многих из предполагаемых функций, хотя точная роль этих взаимодействий еще предстоит выяснить.
Открытие
CDC48 был обнаружен в ходе генетического скрининга генов, участвующих в регуляции клеточного цикла в бутоньерки.[10] Скрининг выявил несколько аллелей Cdc48 что влияет на рост клеток при недопустимых температурах. Гомолог CDC48 у млекопитающих первоначально был охарактеризован как предшественник белка массой 97 кДа для малого пептида валозина. Поэтому он был назван валозин-содержащим белком (VCP) или p97,[11] но последующие исследования показали, что валозин является артефактом очистки, не связанным с p97. Тем не менее, номенклатура VCP все еще используется в литературе.
Тканевое и субклеточное распределение
p97 / CDC48 - один из наиболее распространенных цитоплазматических белков в эукариотических клетках. Он повсеместно экспрессируется во всех тканях многоклеточных организмов. Было обнаружено, что у людей экспрессия мРНК p97 умеренно повышена при определенных типах рака.[9]
В клетках млекопитающих p97 преимущественно локализован в цитоплазме, и значительная его часть связана с мембранами клеточных органелл, таких как эндоплазматический ретикулум (ER), Гольджи, митохондрии и эндосомы.[6][12][13][14][15] Субклеточная локализация CDC48 полностью не охарактеризована, но, вероятно, аналогична его аналогу у млекопитающих. Фракция p97 / CDC48 также была обнаружена в ядре.[16]
Структура
Согласно кристаллическим структурам полноразмерного p97 дикого типа,[17][18] шесть субъединиц p97 собираются в бочкообразную структуру, в которой домены N-D1 и D2 образуют два концентрических, уложенных друг на друга кольца (Рисунок 2).
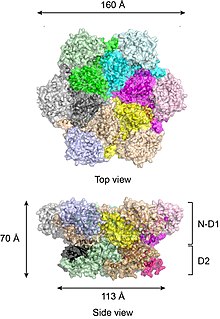
Кольцо N-D1 больше (162 Å в диаметре), чем кольцо D2 (113 Å) из-за латерально прикрепленных N-доменов. Домены D1 и D2 очень гомологичны как по последовательности, так и по структуре, но они выполняют разные функции. Например, для гексамерной сборки p97 требуется только домен D1, но не домен D2.[19] В отличие от многих бактериальных белков AAA + сборка гексамера p97 не зависит от присутствия нуклеотида. Гексамерная сборка p97 может претерпевать драматические конформационные изменения во время цикла гидролиза нуклеотидов,[20][21][22][23][24] и обычно считается, что эти конформационные изменения создают механическую силу, которая прикладывается к молекулам субстрата, чтобы влиять на их стабильность и функцию. Однако неясно, как именно p97 генерирует силу.
Цикл гидролиза АТФ
Активность гидролиза АТФ необходима для функций p97 / CDC48.[25] Два АТФазных домена р97 (D1 и D2) не эквивалентны, потому что домен D2 проявляет более высокую активность АТФазы, чем домен D1 в белке дикого типа. Тем не менее их деятельность зависит друг от друга.[26][27][28][29] Например, связывание нуклеотидов с доменом D1 требуется для связывания АТФ с доменом D2, а связывание нуклеотидов и гидролиз в D2 требуется для домена D1 для гидролиза АТФ.
На АТФазную активность p97 может влиять множество факторов. Например, его можно стимулировать теплом.[29] или предполагаемым белком-субстратом.[30] В Leishmania infantum, то ЛиБелок VCP необходим для внутриклеточного развития паразита и его выживания в условиях теплового стресса.[31] Ассоциация с кофакторами может иметь как положительное, так и отрицательное влияние на активность АТФазы p97.[32][33]
Мутации в p97 также могут влиять на его активность. Например, мутантные белки p97, несущие точечные мутации, обнаруженные у пациентов с мультисистемная протеинопатия (MSP; ранее известная как IBMPFD (миопатия с тельцами включения, связанная с костной болезнью Педжета и лобно-височной деменцией)) (см. Ниже) имеет 2-3-кратное увеличение активности АТФазы.[27][34][35]
p97 / CDC48-взаимодействующие белки
Недавние протеомные исследования выявили большое количество белков, взаимодействующих с p97. Многие из этих белков служат адаптерами, которые связывают p97 / CDC48 с конкретным субклеточным компартментом, чтобы функционировать на определенном клеточном пути. Другие функционируют как адаптеры, которые привлекают субстраты к p97 / CDC48 для обработки. Некоторые белки, взаимодействующие с p97, также являются ферментами, такими как N-гликаназа, убиквитинлигаза и деубиквитиназа, которые помогают p97 в обработке субстратов.
Большинство кофакторов связывают p97 / CDC48 через его N-домен, но некоторые взаимодействуют с коротким карбокси-концевым хвостом в p97 / CDC48. Репрезентативными белками, взаимодействующими с N-доменом, являются Ufd1, Npl4, p47 и FAF1.[36][37][38] Примерами кофакторов, которые взаимодействуют с карбоксиконцевым хвостом p97, являются PLAA, PNGase и Ufd2.[39][40][41]
Молекулярные основы связывания кофакторов были изучены для некоторых кофакторов, которые взаимодействуют с N-доменом p97. N-домен состоит из двух субдоменов примерно одинакового размера: N-концевого двойного Y-образного цилиндра и C-концевого b-образного цилиндра (Рисунок 3).

Структурные исследования показывают, что многие кофакторные белки связываются с N-доменом в щели, образованной между двумя субдоменами.
Среди тех, которые связываются с N-доменом p97, обнаружены два наиболее часто встречающихся мотива последовательности: один называется мотивом UBX (убиквитин регуляторный X).[42] а другой называется VIM (мотив, взаимодействующий с VCP).[43] Домен UBX представляет собой модуль из 80 остатков со складкой, очень напоминающей структуру убиквитина. Мотив, взаимодействующий с VCP (VIM), представляет собой мотив линейной последовательности (RX5AAX2R) обнаружен в ряде кофакторов p97, включая gp78,[44] SVIP (малый белок, ингибирующий VCP)[45] и VIMP (мембранный белок, взаимодействующий с VCP).[46] Хотя домен UBX использует поверхностную петлю, тогда как VIM формирует спираль для связывания p97, как UBX, так и VIM связываются в одном и том же месте между двумя субдоменами N-домена (Рисунок 3).[47] Было высказано предположение, что иерархическое связывание с отдельными кофакторами может быть важным для широких функций p97 / CDC48.[48][49]
Функция
p97 / CDC48 выполняет разнообразные функции, регулируя стабильность и, следовательно, активность своих субстратов. Общая функция p97 / CDC48 состоит в том, чтобы отделить белки от большой белковой сборки или неподвижных клеточных структур, таких как мембраны или хроматин, позволяя высвобожденным белковым молекулам расщепляться протеасомой. Функции p97 / CDC48 можно разделить на следующие три основные категории.
Контроль качества протеина
Лучше всего охарактеризованная функция p97 заключается в посредничестве в сети процессов контроля качества белка для поддержания гомеостаза белка.[50] К ним относятся деградация белка, связанная с эндоплазматическим ретикулумом (ERAD) и деградация, связанная с митохондриями.[14][51] В этих процессах гидролиз АТФ с помощью p97 / CDC48 необходим для извлечения аберрантных белков из мембран ER или митохондрий. p97 / CDC48 также необходим для высвобождения дефектных продуктов трансляции, остановившихся на рибосомах, в процессе, называемом деградацией, связанной с рибосомами.[52][53][54] Похоже, что только после экстракции из мембран или большой сборки белка, такой как рибосома, протеасома может расщепить полипептиды. В дополнение к этой функции «сегрегазы», p97 / CDC48 может играть дополнительную роль в транспортировке высвобождаемых полипептидов в протеасому. Эта функция шаперонирования, по-видимому, особенно важна для деградации некоторых склонных к агрегации неправильно свернутых белков в ядре.[55] Несколько линий доказательств также указывают на участие p97 в аутофагии, процессе, который превращает клеточные белки (включая неправильно свернутые), поглощая их в пузырьки, окруженные двойной мембраной, названные аутофагосомами, но точная роль p97 в этом процессе неясна.[56]
Функции, связанные с хроматином
p97 также широко функционирует в ядре эукариот, высвобождая белковые молекулы из хроматинов аналогично тому, как это происходит в ERAD.[57] Идентифицированные субстраты p97 включают репрессор транскрипции α2 и комплекс РНК-полимеразы (Pol) II и ДНК-геликазу CMG в почкующихся дрожжах, а также реплицирующий ДНК фактор лицензирования CDT1, белки репарации ДНК DDB2 и XPC, регулятор митоза Aurora B и некоторые ДНК-полимеразы млекопитающих. клетки. Эти субстраты связывают функцию p97 с транскрипцией гена, репликацией и репарацией ДНК, а также с развитием клеточного цикла.
Слияние мембран и торговля ими
Биохимические и генетические исследования также показали, что p97 участвует в слиянии пузырьков, что приводит к образованию аппарата Гольджи в конце митоза.[58] Этот процесс требует адаптера связывания убиквитина p47 и ассоциированной с p97 деубиквитиназы VCIP135 и, таким образом, соединения мембранного слияния с путями убиквитина. Однако точная роль p97 в образовании Гольджи неясна из-за отсутствия информации о соответствующих субстратах. Недавние исследования также предполагают, что p97 может регулировать перенос пузырьков от плазматической мембраны к лизосомам, процесс, называемый эндоцитозом.[56]
Клиническое значение
Ссылки на болезни человека
Впервые сообщалось, что мутации в VCP вызывают синдром, характеризующийся: лобно-височная деменция, миопатия с тельцами включения, и Костная болезнь Педжета Вирджинией Кимонис в 2004 году.[59] В 2010 году мутации в VCP также оказались причиной боковой амиотрофический склероз от Брайан Трейнор и Адриано Чио.[60] Это открытие было примечательно, поскольку оно представляло собой начальную генетическую связь между двумя несопоставимыми неврологическими заболеваниями, боковым амиотрофическим склерозом и лобно-височной деменцией.
Мутации в VCP являются примером плейотропия, где мутации в одном и том же гене вызывают разные фенотипы. Период, термин мультисистемная протеинопатия (MSP) был придуман для описания этой конкретной формы плейотропии.[61] Хотя MSP встречается редко, растущий интерес к этому синдрому проистекает из молекулярных представлений, которые это состояние обеспечивает в этиологической взаимосвязи между распространенными возрастными дегенеративными заболеваниями мышц, костей и мозга. Было подсчитано, что ~ 50% MSP может быть вызвано миссенс-мутациями, влияющими на ген валозинсодержащего белка (VCP).[62]
Лечение рака
Первый ингибитор p97 Ээярестатин (EerI) был обнаружен путем скрининга и характеристики соединений, которые ингибируют разложение субстрата ERAD, меченного флуоресценцией.[63][64] Механизм ингибирования p97 с помощью EerI неясен, но при применении к клеткам он индуцирует биологические фенотипы, связанные с ингибированием p97, такие как ингибирование ERAD, повышение стресса ER и индукция апоптоза. Важно отметить, что EerI демонстрирует значительную противораковую активность. in vitro предпочтительно против раковых клеток, выделенных от пациентов, и может действовать синергетически с ингибитором протеасом бортезомиб убить раковые клетки.[65] Эти наблюдения наталкивают на мысль о нацеливании на p97 в качестве потенциальной терапии рака. Эта идея была дополнительно подтверждена изучением нескольких конкурентных и аллостерических ингибиторов АТФ.[66][67][68] Совсем недавно был разработан мощный и специфический ингибитор p97 CB-5083, который демонстрирует многообещающую противораковую активность на моделях опухоли ксенотрансплантата мышей.[69] В настоящее время соединение оценивается в рамках фазы 1 клинических испытаний.[70]
Заметки
Версия этой статьи 2015 года была обновлена внешним экспертом в соответствии с моделью двойной публикации. Соответствующие академическая экспертная оценка статья была опубликована в Ген и может быть процитирован как: Ди Ся, Вай Кван Тан, Ихонг Е (2 марта 2016 г., 25 мая 2016 г.). «Структура и функция AAA + АТФазы p97 / Cdc48p». Ген. 583 (1): 64–77. Дои:10.1016 / J.GENE.2016.02.042. ЧВК 4821690. PMID 26945625. Проверить значения даты в: | дата = (Помогите)CS1 maint: использует параметр авторов (ссылка на сайт) |
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000165280 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000028452 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Druck T, Gu Y, Prabhala G, Cannizzaro LA, Park SH, Huebner K, Keen JH (ноябрь 1995 г.). «Хромосомная локализация генов человека для полипептидов адаптера клатрина AP2 бета и AP50 и клатрин-связывающего белка, VCP». Геномика. 30 (1): 94–7. Дои:10.1006 / geno.1995.0016. PMID 8595912.
- ^ а б Rabouille C, Levine TP, Peters JM, Warren G (сентябрь 1995 г.). «NSF-подобная АТФаза, p97 и NSF опосредуют цистернальный отрастание из митотических фрагментов Гольджи». Ячейка. 82 (6): 905–14. Дои:10.1016/0092-8674(95)90270-8. PMID 7553851. S2CID 2663141.
- ^ «Ген Entrez: белок, содержащий валозин VCP».
- ^ Огура Т., Уилкинсон А.Дж. (июль 2001 г.). «АТФазы надсемейства AAA +: общая структура - разнообразная функция». Гены в клетки. 6 (7): 575–97. Дои:10.1046 / j.1365-2443.2001.00447.x. PMID 11473577. S2CID 6740778.
- ^ а б Йе Й (октябрь 2006 г.). «Различные функции с общим регулятором: убиквитин берет на себя управление АТФазой AAA». Журнал структурной биологии. 156 (1): 29–40. Дои:10.1016 / j.jsb.2006.01.005. PMID 16529947.
- ^ Моир Д., Стюарт С.Е., Осмонд BC, Ботштейн Д. (апрель 1982 г.). «Чувствительные к холоду мутанты дрожжевого цикла клеточного деления: изоляция, свойства и исследования псевдореверсии». Генетика. 100 (4): 547–63. ЧВК 1201831. PMID 6749598.
- ^ Коллер К.Дж., Браунштейн М.Дж. (1987). «Использование клона кДНК для идентификации предполагаемого белка-предшественника, содержащего валозин». Природа. 325 (6104): 542–5. Bibcode:1987Натура.325..542K. Дои:10.1038 / 325542a0. PMID 3468358. S2CID 19200775.
- ^ Ачарья У., Джейкобс Р., Петерс Дж. М., Уотсон Н., Фаркуар М. Г., Малхотра В. (сентябрь 1995 г.). «Формирование стеков Гольджи из пузырьковых мембран Гольджи требует двух различных событий слияния». Ячейка. 82 (6): 895–904. Дои:10.1016/0092-8674(95)90269-4. PMID 7553850. S2CID 14725335.
- ^ Latterich M, Fröhlich KU, Schekman R (сентябрь 1995 г.). «Слияние мембран и клеточный цикл: Cdc48p участвует в слиянии мембран ER». Ячейка. 82 (6): 885–93. Дои:10.1016/0092-8674(95)90268-6. PMID 7553849. S2CID 17922017.
- ^ а б Сюй С., Пэн Г, Ван И, Фанг С., Карбовски М. (февраль 2011 г.). «ААА-АТФаза p97 необходима для белкового обмена внешней митохондриальной мембраны». Молекулярная биология клетки. 22 (3): 291–300. Дои:10.1091 / mbc.E10-09-0748. ЧВК 3031461. PMID 21118995.
- ^ Раманатан Х.Н., Йе Й (февраль 2012 г.). «АТФаза p97 связывается с EEA1, чтобы регулировать размер ранних эндосом». Клеточные исследования. 22 (2): 346–59. Дои:10.1038 / кр.2011.80. ЧВК 3271578. PMID 21556036.
- ^ Madeo F, Schlauer J, Zischka H, Mecke D, Fröhlich KU (январь 1998 г.). «Фосфорилирование тирозина регулирует зависимую от клеточного цикла ядерную локализацию Cdc48p». Молекулярная биология клетки. 9 (1): 131–41. Дои:10.1091 / mbc.9.1.131. ЧВК 25228. PMID 9436996.
- ^ ДеЛабарр Б., Брюнгер А.Т. (октябрь 2003 г.). «Полная структура белка, содержащего p97 / валозин, выявляет связь между нуклеотидными доменами». Структурная биология природы. 10 (10): 856–63. Дои:10.1038 / nsb972. PMID 12949490. S2CID 19281416.
- ^ Дэвис Дж. М., Брюнгер А. Т., Вайс В. И. (май 2008 г.). «Улучшенные структуры полноразмерного p97, АТФазы AAA: значение для механизмов зависимых от нуклеотидов конформационных изменений». Структура. 16 (5): 715–26. Дои:10.1016 / j.str.2008.02.010. PMID 18462676.
- ^ Ван Кью, Сонг Си, Ли Си Си (январь 2003 г.). «Гексамеризации p97-VCP способствует связывание АТФ с доменом D1 и требуется для АТФазы и биологической активности». Сообщения о биохимических и биофизических исследованиях. 300 (2): 253–60. Дои:10.1016 / s0006-291x (02) 02840-1. PMID 12504076.
- ^ Беурон Ф., Древены И., Юань Х, Пай В.Э., МакКаун С., Бриггс Л.С., Клифф М.Дж., Канеко Ю., Уоллис Р., Исааксон Р.Л., Лэдбери Дж. «Конформационные изменения в адапторном комплексе AAA ATPase p97-p47». Журнал EMBO. 25 (9): 1967–76. Дои:10.1038 / sj.emboj.7601055. ЧВК 1456939. PMID 16601695.
- ^ Беурон Ф., Флинн Т.С., Ма Дж., Кондо Х., Чжан Х, Фримонт П.С. (март 2003 г.). «Движение и отрицательная кооперативность между доменами p97, выявленные с помощью криоэлектронной микроскопии и квантованной модели упругой деформации». Журнал молекулярной биологии. 327 (3): 619–29. Дои:10.1016 / с0022-2836 (03) 00178-5. PMID 12634057.
- ^ ДеЛабарр Б., Брюнгер А.Т. (март 2005 г.). «Нуклеотид-зависимое движение и механизм действия p97 / VCP». Журнал молекулярной биологии. 347 (2): 437–52. Дои:10.1016 / j.jmb.2005.01.060. PMID 15740751.
- ^ Rouiller I, DeLaBarre B, May AP, Weis WI, Brunger AT, Milligan RA, Wilson-Kubalek EM (декабрь 2002 г.). «Конформационные изменения многофункциональной АТФазы p97 AAA во время ее цикла АТФазы». Структурная биология природы. 9 (12): 950–7. Дои:10.1038 / nsb872. PMID 12434150. S2CID 16061425.
- ^ Тан В.К., Ли Д., Ли С.К., Эссер Л., Дай Р., Го Л., Ся Д. (июль 2010 г.). «Новая АТФ-зависимая конформация во фрагменте N-D1 p97, выявленная кристаллическими структурами мутантов, связанных с заболеванием». Журнал EMBO. 29 (13): 2217–29. Дои:10.1038 / emboj.2010.104. ЧВК 2905243. PMID 20512113.
- ^ Ван Кью, Сонг Си, Ли СС (2004). «Молекулярные перспективы p97-VCP: прогресс в понимании его структуры и различных биологических функций». Журнал структурной биологии. 146 (1–2): 44–57. Дои:10.1016 / j.jsb.2003.11.014. PMID 15037236.
- ^ Нисикори С., Эсаки М., Яманака К., Сугимото С., Огура Т. (май 2011 г.). «Положительная кооперативность АТФазы p97 AAA имеет решающее значение для основных функций». Журнал биологической химии. 286 (18): 15815–20. Дои:10.1074 / jbc.M110.201400. ЧВК 3091191. PMID 21454554.
- ^ а б Тан В.К., Ся Д. (декабрь 2013 г.). «Измененная межсубъединичная коммуникация является молекулярной основой функциональных дефектов патогенных мутантов p97». Журнал биологической химии. 288 (51): 36624–35. Дои:10.1074 / jbc.M113.488924. ЧВК 3868774. PMID 24196964.
- ^ Йе Й, Мейер Х. Х., Рапопорт Т.А. (июль 2003 г.). «Функция комплекса p97-Ufd1-Npl4 при ретротранслокации из ER в цитозоль: двойное распознавание неубиквитинированных полипептидных сегментов и полиубиквитиновых цепей». Журнал клеточной биологии. 162 (1): 71–84. Дои:10.1083 / jcb.200302169. ЧВК 2172719. PMID 12847084.
- ^ а б Песня C, Ван Ци, Ли CC (февраль 2003 г.). «АТФазная активность p97-валозин-содержащего белка (VCP). D2 опосредует основную ферментативную активность, а D1 вносит вклад в индуцированную нагреванием активность». Журнал биологической химии. 278 (6): 3648–55. Дои:10.1074 / jbc.M208422200. PMID 12446676.
- ^ ДеЛабарре Б., Кристиансон Дж. К., Копито Р. Р., Брюнгер А. Т. (май 2006 г.). «Остатки центральной поры опосредуют активность p97 / VCP, необходимую для ERAD». Молекулярная клетка. 22 (4): 451–62. Дои:10.1016 / j.molcel.2006.03.036. PMID 16713576.
- ^ Гедес Агиар Б., Падманабхан П.К., Дюма С., Пападопулу Б. (июнь 2018 г.). «Валозин-содержащий белок VCP / p97 необходим для внутриклеточного развития Leishmania и его выживания в условиях теплового стресса». Клеточная микробиология. 20 (10): e12867. Дои:10,1111 / см. 12867. PMID 29895095. S2CID 48359590.
- ^ Мейер Х. Х., Кондо Х., Уоррен Г. (октябрь 1998 г.). «Кофактор p47 регулирует АТФазную активность слитого с мембраной белка, p97». Письма FEBS. 437 (3): 255–7. Дои:10.1016 / s0014-5793 (98) 01232-0. PMID 9824302. S2CID 33962985.
- ^ Zhang X, Gui L, Zhang X, Bulfer SL, Sanghez V, Wong DE, Lee Y, Lehmann L, Lee JS, Shih PY, Lin HJ, Iacovino M, Weihl CC, Arkin MR, Wang Y, Chou TF (апрель 2015 г.) ). «Изменение регуляции кофактора с ассоциированными с заболеванием мутациями p97 / VCP». Труды Национальной академии наук Соединенных Штатов Америки. 112 (14): E1705–14. Bibcode:2015PNAS..112E1705Z. Дои:10.1073 / pnas.1418820112. ЧВК 4394316. PMID 25775548.
- ^ Halawani D, LeBlanc AC, Rouiller I., Michnick SW, Servant MJ, Latterich M (август 2009 г.). «Наследственные тельца включения, связанные с миопатией, мутации p97 / VCP в домене NH2 и кольце D1 модулируют активность АТФазы p97 / VCP и конформацию кольца D2». Молекулярная и клеточная биология. 29 (16): 4484–94. Дои:10.1128 / MCB.00252-09. ЧВК 2725746. PMID 19506019.
- ^ Weihl CC, Dalal S, Pestronk A, Hanson PI (январь 2006 г.). «Связанные с миопатией тельца включения в p97 / VCP нарушают деградацию эндоплазматического ретикулума». Молекулярная генетика человека. 15 (2): 189–99. Дои:10.1093 / hmg / ddi426. PMID 16321991.
- ^ Йе Й, Мейер Х. Х., Рапопорт Т.А. (декабрь 2001 г.). «ААА-АТФаза Cdc48 / p97 и ее партнеры транспортируют белки из ER в цитозоль». Природа. 414 (6864): 652–6. Bibcode:2001Натура.414..652л. Дои:10.1038 / 414652a. PMID 11740563. S2CID 23397533.
- ^ Кондо Х, Рабуй С., Ньюман Р., Левин Т. П., Паппин Д., Фримонт П., Уоррен Г. (июль 1997 г.). «p47 представляет собой кофактор p97-опосредованного слияния мембран». Природа. 388 (6637): 75–8. Bibcode:1997Натура.388Р..75К. Дои:10.1038/40411. PMID 9214505. S2CID 32646222.
- ^ Песня EJ, Yim SH, Kim E, Kim NS, Lee KJ (март 2005 г.). «Человеческий фактор 1, связанный с Fas, взаимодействуя с убиквитинированными белками и валозин-содержащим белком, участвует в пути убиквитин-протеасомы». Молекулярная и клеточная биология. 25 (6): 2511–24. Дои:10.1128 / MCB.25.6.2511-2524.2005. ЧВК 1061599. PMID 15743842.
- ^ Цю Л., Пашкова Н., Уокер Дж. Р., Винисторфер С., Аллали-Хассани А., Акуцу М., Пайпер Р., Де-Паганон С. (январь 2010 г.). «Структура и функции комплекса PLAA / Ufd3-p97 / Cdc48». Журнал биологической химии. 285 (1): 365–72. Дои:10.1074 / jbc.M109.044685. ЧВК 2804184. PMID 19887378.
- ^ Чжао Дж., Чжоу Х, Ван Л., Ли Дж., Шинделин Х., Леннарц В. Дж. (Май 2007 г.). «Исследования взаимодействия пептид: N-гликаназа-p97 предполагают, что фосфорилирование p97 модулирует деградацию, связанную с эндоплазматическим ретикулумом». Труды Национальной академии наук Соединенных Штатов Америки. 104 (21): 8785–90. Bibcode:2007PNAS..104.8785Z. Дои:10.1073 / pnas.0702966104. ЧВК 1885580. PMID 17496150.
- ^ Шеффер В., Акуцу М., Олма М.Х., Гомес Л.С., Кавасаки М., Дикич I (май 2014 г.). «Связывание OTULIN с доменом PUB HOIP контролирует передачу сигналов NF-κB». Молекулярная клетка. 54 (3): 349–61. Дои:10.1016 / j.molcel.2014.03.016. PMID 24726327.
- ^ Шуберт К., Бухбергер А. (август 2008 г.). «Белки домена UBX: основные регуляторы ААА-АТФазы Cdc48 / p97». Клеточные и молекулярные науки о жизни. 65 (15): 2360–71. Дои:10.1007 / s00018-008-8072-8. PMID 18438607.
- ^ Стапф С., Картрайт Е., Байкрофт М., Хофманн К., Бухбергер А. (ноябрь 2011 г.). «Общее определение мотива, взаимодействующего с p97 / валозин-содержащим белком (VCP) (VIM), определяет новое семейство кофакторов p97». Журнал биологической химии. 286 (44): 38670–8. Дои:10.1074 / jbc.M111.274472. ЧВК 3207395. PMID 21896481.
- ^ Баллар П., Шен Й, Ян Х, Фанг С. (ноябрь 2006 г.). «Роль нового p97 / валозин-содержащего белка-взаимодействующего мотива gp78 в деградации, связанной с эндоплазматическим ретикулумом». Журнал биологической химии. 281 (46): 35359–68. Дои:10.1074 / jbc.M603355200. PMID 16987818.
- ^ Баллар П., Чжун Ю., Нагахама М., Тагая М., Шен Ю., Фанг С. (ноябрь 2007 г.). «Идентификация SVIP как эндогенного ингибитора деградации, связанной с эндоплазматическим ретикулумом». Журнал биологической химии. 282 (47): 33908–14. Дои:10.1074 / jbc.M704446200. PMID 17872946.
- ^ Йе Й, Шибата Й, Юн С., Рон Д., Рапопорт Т.А. (июнь 2004 г.). «Комплекс мембранных белков опосредует ретранслокацию из просвета ЭПР в цитозоль». Природа. 429 (6994): 841–7. Bibcode:2004Натура.429..841Y. Дои:10.1038 / природа02656. PMID 15215856. S2CID 4317750.
- ^ Hänzelmann P, Schindelin H (ноябрь 2011 г.). «Структурная и функциональная основа мотива, взаимодействующего с p97 / валозин-содержащим белком (VCP): взаимоисключающее связывание кофакторов с N-концевым доменом p97». Журнал биологической химии. 286 (44): 38679–90. Дои:10.1074 / jbc.M111.274506. ЧВК 3207442. PMID 21914798.
- ^ Мейер HH, Короче JG, Seemann J, Pappin D, Warren G (май 2000 г.). «Комплекс ufd1 и npl4 млекопитающих связывает AAA-ATPase, p97, с убиквитином и путями ядерного транспорта». Журнал EMBO. 19 (10): 2181–92. Дои:10.1093 / emboj / 19.10.2181. ЧВК 384367. PMID 10811609.
- ^ Бухбергер А., Шинделин Х., Хенцельманн П. (сентябрь 2015 г.). «Контроль функции p97 путем связывания кофактора». Письма FEBS. 589 (19 Pt A): 2578–89. Дои:10.1016 / j.febslet.2015.08.028. PMID 26320413. S2CID 41082524.
- ^ Мейер Х, Ошибка М, Бремер С (февраль 2012 г.). «Новые функции VCP / p97 AAA-ATPase в системе убиквитина». Природа клеточной биологии. 14 (2): 117–23. Дои:10.1038 / ncb2407. PMID 22298039. S2CID 23562362.
- ^ Кристиансон Дж. К., Йе Й (апрель 2014 г.). «Очистка эндоплазматического ретикулума: убиквитин главный». Структурная и молекулярная биология природы. 21 (4): 325–35. Дои:10.1038 / nsmb.2793. PMID 24699081. S2CID 43665193.
- ^ Брэндман О., Стюарт-Орнштейн Дж., Вонг Д., Ларсон А., Уильямс С.К., Ли Г.В., Чжоу С., Кинг Д., Шен П.С., Вайбезан Дж., Данн Дж. Г., Рускин С., Инада Т., Фрост А., Вайсман Дж. С. (ноябрь 2012 г.) . «Связанный с рибосомами комплекс контроля качества запускает деградацию растущих пептидов и сигнализирует о стрессе трансляции». Ячейка. 151 (5): 1042–54. Дои:10.1016 / j.cell.2012.10.044. ЧВК 3534965. PMID 23178123.
- ^ Defenouillère Q, Yao Y, Mouaikel J, Namane A, Galopier A, Decourty L, Doyen A, Malabat C, Saveanu C, Jacquier A, Fromont-Racine M (март 2013 г.). «Cdc48-ассоциированный комплекс, связанный с частицами 60S, необходим для удаления аберрантных продуктов трансляции». Труды Национальной академии наук Соединенных Штатов Америки. 110 (13): 5046–51. Bibcode:2013PNAS..110.5046D. Дои:10.1073 / пнас.1221724110. ЧВК 3612664. PMID 23479637.
- ^ Верма Р., Оания Р.С., Колава, штат Нью-Джерси, Дешайес Р.Дж. (январь 2013 г.). «Cdc48 / p97 способствует деградации аберрантных растущих полипептидов, связанных с рибосомой». eLife. 2: e00308. Дои:10.7554 / eLife.00308. ЧВК 3552423. PMID 23358411.
- ^ Галлахер П.С., Клаус Кандадай С.В., Гарднер Р.Г. (май 2014 г.). «Требование к Cdc48 / p97 при деградации контроля качества ядерного белка зависит от субстрата и коррелирует с нерастворимостью субстрата». Журнал клеточной науки. 127 (Pt 9): 1980–91. Дои:10.1242 / jcs.141838. ЧВК 4004975. PMID 24569878.
- ^ а б Ошибка М., Мейер Х (август 2012 г.). «Выход на новые рынки - VCP / p97 в эндоцитозе и аутофагии». Журнал структурной биологии. 179 (2): 78–82. Дои:10.1016 / j.jsb.2012.03.003. PMID 22450227.
- ^ Дантума Н.П., Acs K, Люйстербург М.С. (ноябрь 2014 г.). «Остаться или уйти: выделение хроматина, опосредованное VCP / p97, в ответ на повреждение ДНК». Экспериментальные исследования клеток. 329 (1): 9–17. Дои:10.1016 / j.yexcr.2014.08.025. PMID 25169698.
- ^ Учияма К., Кондо Х (февраль 2005 г.). «p97 / p47-опосредованный биогенез Гольджи и ER». Журнал биохимии. 137 (2): 115–9. Дои:10.1093 / jb / mvi028. PMID 15749824. S2CID 10459261.
- ^ Уоттс, Джайлз Д. Дж .; Ваймер, Джилл; Ковач, Маргарет Дж .; Mehta, Sarju G .; Мам, Стивен; Дарвиш, Дэниел; Пестронк, Алан; Уайт, Майкл П .; Кимонис, Вирджиния Э. (2004). «Миопатия с тельцами включения, связанная с костной болезнью Педжета и лобно-височной деменцией, вызывается мутантным валозин-содержащим белком». Природа Генетика. 36 (4): 377–381. Дои:10,1038 / ng1332. ISSN 1061-4036. PMID 15034582.
- ^ Джонсон, Джанель О .; Мандриоли, Джессика; Бенатар, Майкл; Абрамзон, Евгения; Ван Дирлин, Вивианна М .; Трояновский, Джон К .; Гиббс, Дж. Рафаэль; Брунетти, Маура; Гронка, Сьюзен (09.12.2010). «Секвенирование экзома выявляет мутации VCP как причину семейного БАС». Нейрон. 68 (5): 857–864. Дои:10.1016 / j.neuron.2010.11.036. ISSN 1097-4199. ЧВК 3032425. PMID 21145000.
- ^ Тейлор, Дж. Пол (2015-08-25). «Мультисистемная протеинопатия: пересекающаяся генетика дегенерации мышц, костей и мозга». Неврология. 85 (8): 658–660. Дои:10.1212 / WNL.0000000000001862. ISSN 1526-632X. PMID 26208960. S2CID 42203997.
- ^ Ле Бер I, Ван Бортель I, Николя Дж., Буйя-Ахмед К., Камузат А., Валлон Д., Де Септенвиль А., Латуш М., Латтанте С., Кабаши Е., Йорнеа Л., Ханнекен Д., Брайс А. (апрель 2014 г.). «Мутации hnRNPA2B1 и hnRNPA1 редки у пациентов с« мультисистемной протеинопатией »и фенотипами лобно-височной долевой дегенерации». Нейробиология старения. 35 (4): 934.e5–6. Дои:10.1016 / j.neurobiolaging.2013.09.016. PMID 24119545. S2CID 207160856.
- ^ Fiebiger E, Hirsch C, Vyas JM, Gordon E, Ploegh HL, Tortorella D (апрель 2004 г.). «Рассечение пути дислокации мембранных белков типа I с помощью нового низкомолекулярного ингибитора, ээярестатина». Молекулярная биология клетки. 15 (4): 1635–46. Дои:10.1091 / mbc.E03-07-0506. ЧВК 379262. PMID 14767067.
- ^ Ван Кью, Шинкре Б.А., Ли Дж.Г., Венигер М.А., Лю Й., Чен В., Вистнер А., Тренкле В.К., Йе Й (ноябрь 2010 г.). «Ингибитор ERAD Иеярестатин I представляет собой бифункциональное соединение с мембранно-связывающим доменом и ингибиторной группой p97 / VCP». PLOS ONE. 5 (11): e15479. Bibcode:2010PLoSO ... 515479W. Дои:10.1371 / journal.pone.0015479. ЧВК 2993181. PMID 21124757.
- ^ Ван К., Мора-Йенсен Х., Венигер М.А., Перес-Галан П., Вольффорд С., Хай Т., Рон Д., Чен В., Тренкл В., Вистнер А., Йе Й. (февраль 2009 г.). «Ингибиторы ERAD объединяют стресс ER с эпигенетическим механизмом для активации BH3-только белка NOXA в раковых клетках». Труды Национальной академии наук Соединенных Штатов Америки. 106 (7): 2200–5. Bibcode:2009PNAS..106.2200W. Дои:10.1073 / pnas.0807611106. ЧВК 2629785. PMID 19164757.
- ^ Чжоу Т.Ф., Ли К., Франковски К.Дж., Шенен Ф.Дж., Дешайс Р.Дж. (февраль 2013 г.). «Исследование взаимосвязи структура-активность показывает, что ML240 и ML241 являются мощными и селективными ингибиторами АТФазы p97». ChemMedChem. 8 (2): 297–312. Дои:10.1002 / cmdc.201200520. ЧВК 3662613. PMID 23316025.
- ^ Чоу Т.Ф., Браун С.Дж., Минонд Д., Нордин Б.Е., Ли К., Джонс А.С., Чейз П., Порубски П.Р., Штольц Б.М., Шонен Ф.Дж., Патричелли М.П., Ходдер П., Розен Х., Деше Р.Дж. (март 2011 г.). «Обратимый ингибитор p97, DBeQ, нарушает как убиквитин-зависимые, так и аутофагические пути выведения белка». Труды Национальной академии наук Соединенных Штатов Америки. 108 (12): 4834–9. Bibcode:2011PNAS..108.4834C. Дои:10.1073 / pnas.1015312108. ЧВК 3064330. PMID 21383145.
- ^ Магнаги П., Д'Алессио Р., Валсасина Б., Аванзи Н., Рицци С., Аса Д., Гаспарри Ф., Коззи Л., Кукчи Ю., Оррениус К., Получчи П., Баллинари Д., Перрера С., Леоне А., Черви Г., Казале Е., Сяо Ю., Вонг С., Андерсон Д. Д., Гальвани А., Донати Д., О'Брайен Т., Джексон П. К., Исакчи А. (сентябрь 2013 г.). «Ковалентные и аллостерические ингибиторы АТФазы VCP / p97 вызывают гибель раковых клеток». Природа Химическая Биология. 9 (9): 548–56. Дои:10.1038 / nchembio.1313. PMID 23892893.
- ^ Андерсон DJ, Ле Муань Р., Джакович С., Кумар Б., Райс Дж., Вонг С., Ван Дж., Яо Б., Валле Э, Поцелуй фон Соли С., Мадриага А., Сориано Ф., Менон М.К., Ву З.Й., Кампманн М., Чен Й. , Weissman JS, Aftab BT, Yakes FM, Shawver L, Zhou HJ, Wustrow D, Rolfe M (ноябрь 2015 г.). «Нацеленность на АТФазу p97 AAA как подход к лечению рака через нарушение гомеостаза белка». Раковая клетка. 28 (5): 653–665. Дои:10.1016 / j.ccell.2015.10.002. ЧВК 4941640. PMID 26555175.
- ^ Zhou HJ, Wang J, Yao B, Wong S, Djakovic S, Kumar B, Rice J, Valle E, Soriano F, Menon MK, Madriaga A, Kiss von Soly S, Kumar A, Parlati F, Yakes FM, Shawver L, Ле Муань Р., Андерсон Д. Д., Рольфе М., Вустров Д. (декабрь 2015 г.). «Открытие первого в своем классе, мощного, селективного и перорального биодоступного ингибитора АТФазы p97 AAA (CB-5083)». Журнал медицинской химии. 58 (24): 9480–97. Дои:10.1021 / acs.jmedchem.5b01346. PMID 26565666.
дальнейшее чтение
- Гуинто Дж. Б., Ритсон Г. П., Тейлор Дж. П., Форман М. С. (июль 2007 г.). «Валозин-содержащий белок и патогенез лобно-височной деменции, связанной с миопатией с тельцами включения». Acta Neuropathologica. 114 (1): 55–61. Дои:10.1007 / s00401-007-0224-7. PMID 17457594. S2CID 2094590.
- Доусон С.Дж., Белый Лос-Анджелес (май 1992 г.). «Лечение эндокардита Haemophilus aphrophilus ципрофлоксацином». Журнал инфекции. 24 (3): 317–20. Дои:10.1016 / S0163-4453 (05) 80037-4. PMID 1602151.
- Pleasure IT, Black MM, Keen JH (сентябрь 1993 г.). «Валозин-содержащий белок, VCP, является повсеместным клатрин-связывающим белком». Природа. 365 (6445): 459–62. Bibcode:1993Натура.365..459П. Дои:10.1038 / 365459a0. PMID 8413590. S2CID 4307576.
- Germain-Lee EL, Obie C, Valle D (август 1997 г.). «NVL: новый член семейства АТФаз AAA, локализованный в ядре». Геномика. 44 (1): 22–34. Дои:10.1006 / geno.1997.4856. PMID 9286697.
- Хойл Дж., Тан К.Х., Фишер Э.М. (октябрь 1997 г.). «Картирование гена валозинсодержащего белка (VCP) на хромосоме 9 человека и хромосоме 4 мыши и вероятного псевдогена на X-хромосоме мыши». Геном млекопитающих. 8 (10): 778–80. Дои:10.1007 / s003359900566. PMID 9321476. S2CID 563437.
- Дай Р.М., Чен Э., Лонго Д.Л., Горбеа К.М., Ли С.К. (февраль 1998 г.). «Вовлечение валозин-содержащего белка, АТФазы, очищенной совместно с IkappaBalpha и 26S протеасомой, в опосредованной убиквитин-протеасомой деградации IkappaBalpha». Журнал биологической химии. 273 (6): 3562–73. Дои:10.1074 / jbc.273.6.3562. PMID 9452483.
- Rabouille C, Kondo H, Newman R, Hui N, Freemont P, Warren G (март 1998 г.). «Синтаксин 5 является общим компонентом опосредованных NSF и p97 путей повторной сборки цистерн Гольджи из митотических фрагментов Гольджи in vitro». Ячейка. 92 (5): 603–10. Дои:10.1016 / S0092-8674 (00) 81128-9. PMID 9506515. S2CID 17285800.
- Чжан Ш., Лю Дж., Кобаяши Р., Тонкс Н.К. (июнь 1999 г.). «Идентификация регулятора клеточного цикла VCP (p97 / CDC48) в качестве субстрата полосы 4.1, связанной с протеин-тирозинфосфатазой PTPH1». Журнал биологической химии. 274 (25): 17806–12. Дои:10.1074 / jbc.274.25.17806. PMID 10364224.
- Чжан Х., Ван Ц., Каджино К., Грин М.И. (май 2000 г.). «VCP, слабая АТФаза, участвующая во множестве клеточных событий, физически взаимодействует с BRCA1 в ядре живых клеток». ДНК и клеточная биология. 19 (5): 253–63. Дои:10.1089/10445490050021168. PMID 10855792.
- Lavoie C, Chevet E, Roy L, Tonks NK, Fazel A, Posner BI, Paiement J, Bergeron JJ (декабрь 2000 г.). «Фосфорилирование тирозина p97 регулирует сборку переходного эндоплазматического ретикулума in vitro». Труды Национальной академии наук Соединенных Штатов Америки. 97 (25): 13637–42. Bibcode:2000PNAS ... 9713637L. Дои:10.1073 / pnas.240278097. ЧВК 17628. PMID 11087817.
- Сеньорэн-Берни Д., Вердел А., Курте С., Лемерсье С., Гарин Дж., Руссо С., Хохбин С. (декабрь 2001 г.). «Идентификация компонентов комплекса гистондеацетилазы 6 мыши: связь между сигнальными путями ацетилирования и убиквитинирования». Молекулярная и клеточная биология. 21 (23): 8035–44. Дои:10.1128 / MCB.21.23.8035-8044.2001. ЧВК 99970. PMID 11689694.
- Ян К.С., Вайнер Х (апрель 2002 г.). «Двухгибридный скрининг дрожжей выявляет партнеров по связыванию Tom34 человека, которые обладают АТФазной активностью и образуют комплекс с Tom34 в цитозоле». Архивы биохимии и биофизики. 400 (1): 105–10. Дои:10.1006 / abbi.2002.2778. PMID 11913976.
- Асаи Т., Томита Ю., Накацука С., Хошида Ю., Мёи А., Йошикава Х., Аозаса К. (март 2002 г.). «VCP (p97) регулирует сигнальный путь NFkappaB, который важен для метастазирования клеточной линии остеосаркомы». Японский журнал исследований рака. 93 (3): 296–304. Дои:10.1111 / j.1349-7006.2002.tb02172.x. ЧВК 5926968. PMID 11927012.
- Кобаяси Т., Танака К., Иноуэ К., Какидзука А. (декабрь 2002 г.). «Функциональная АТФазная активность p97 / валозин-содержащего белка (VCP) необходима для контроля качества эндоплазматического ретикулума в нейронально дифференцированных клетках PC12 млекопитающих». Журнал биологической химии. 277 (49): 47358–65. Дои:10.1074 / jbc.M207783200. PMID 12351637.
- Uchiyama K, Jokitalo E, Kano F, Murata M, Zhang X, Canas B, Newman R, Rabouille C, Pappin D, Freemont P, Kondo H (декабрь 2002 г.). «VCIP135, новый важный фактор для p97 / p47-опосредованного слияния мембран, необходим для сборки Гольджи и ER in vivo». Журнал клеточной биологии. 159 (5): 855–66. Дои:10.1083 / jcb.200208112. ЧВК 2173386. PMID 12473691.
внешние ссылки
- GeneReviews / NIH / NCBI / UW запись о миопатии с включенными тельцами с костной болезнью Педжета и / или лобно-височной деменцией
- Обзор всей структурной информации, доступной в PDB для UniProt: P55072 (АТФаза переходной эндоплазматической сети) в PDBe-KB.