Биохимия - Biochemistry
| Часть серии по |
| Биохимия |
|---|
 |
| Ключевые компоненты |
| История биохимии |
| Глоссарии |
| Порталы: Биохимия |
Биохимия или же биологическая химия, это изучение химические процессы внутри и в отношении жизни организмы.[1] Поддисциплина обоих биология и химия, биохимию можно разделить на три области: структурная биология, энзимология и метаболизм. За последние десятилетия 20-го века биохимия успешно объяснила жизненные процессы с помощью этих трех дисциплин. Почти все области наук о жизни раскрываются и развиваются с помощью биохимических методологий и исследований.[2] Биохимия фокусируется на понимании химической основы, которая позволяет биологические молекулы вызвать процессы, происходящие в живых клетки и между ячейками,[3] в свою очередь, в значительной степени относящиеся к пониманию ткани и органы, а также строение и функции организма.[4] Биохимия тесно связана с молекулярная биология что является изучением молекулярный механизмы биологических явлений.[5]
Большая часть биохимии имеет дело со структурами, функциями и взаимодействиями биологических макромолекулы, Такие как белки, нуклеиновые кислоты, углеводы, и липиды. Они обеспечивают структуру клеток и выполняют многие функции, связанные с жизнью.[6] Химический состав клетки также зависит от реакций небольших молекулы и ионы. Это может быть неорганический (Например, воды и металл ионов) или органический (например, аминокислоты, которые привыкли синтезировать белки ).[7] Механизмы, используемые клетки, чтобы использовать энергию из их среды через химические реакции известны как метаболизм. Результаты биохимии применяются прежде всего в лекарство, питание и сельское хозяйство. В медицине биохимики исследуют причины и лечит из болезни.[8] Изучение питания изучает, как поддерживать здоровье и хорошее самочувствие, а также влияние дефицит питательных веществ.[9] В сельском хозяйстве биохимики исследуют почва и удобрения. Улучшение выращивания сельскохозяйственных культур, хранения урожая и борьба с вредителями тоже цели.
История

В самом широком смысле биохимию можно рассматривать как исследование компонентов и состава живых существ и того, как они объединяются, чтобы стать жизнью. В этом смысле история биохимии может уйти еще до древние греки.[10] Однако биохимия как специфическая научная дисциплина началось где-то в 19 веке или немного раньше, в зависимости от того, на каком аспекте биохимии уделяется внимание. Некоторые утверждали, что началом биохимии могло быть открытие первых фермент, диастаза (теперь называется амилаза ), в 1833 г. Ансельм Пайен,[11] в то время как другие считали Эдуард Бюхнер первая демонстрация сложного биохимического процесса спиртовое брожение в бесклеточных экстрактах в 1897 году зародилась биохимия.[12][13] Некоторые могут также указать в качестве его начала на влиятельную работу 1842 г. Юстус фон Либих, Химия животных или органическая химия в ее приложениях к физиологии и патологии, который представил химическую теорию метаболизма,[10] или даже раньше, в исследованиях XVIII века ферментация и дыхание к Антуан Лавуазье.[14][15] Многие другие пионеры в этой области, которые помогли раскрыть сложные слои биохимии, были объявлены основателями современной биохимии. Эмиль Фишер, изучавший химию белков,[16] и Ф. Гоуланд Хопкинс, изучавшие ферменты и динамическую природу биохимии, представляют собой два примера ранних биохимиков.[17]
Сам термин «биохимия» происходит от комбинации биология и химия. В 1877 г. Феликс Хоппе-Зейлер использовал термин (биохимия на немецком языке) как синоним физиологическая химия в предисловии к первому выпуску журнала Zeitschrift für Physiologische Chemie (Journal of Physiological Chemistry), где он выступал за создание институтов, посвященных этой области исследований.[18][19] Немец химик Карл Нойберг однако часто упоминается, что это слово было изобретено в 1903 году,[20][21][22] в то время как некоторые приписывают это Франц Хофмайстер.[23]
Когда-то считалось, что жизнь и ее материалы обладают каким-то существенным свойством или субстанцией (часто называемой "жизненно важный принцип ") отличное от любого, обнаруженного в неживой материи, и считалось, что только живые существа могут производить молекулы жизни.[25] Затем, в 1828 году, Фридрих Вёлер опубликовал статью о синтез из мочевина, доказывая, что органический соединения могут быть созданы искусственно.[26] С тех пор биохимия продвинулась вперед, особенно с середины 20-го века, с развитием новых методов, таких как хроматография, дифракция рентгеновских лучей, двойная поляризационная интерферометрия, ЯМР-спектроскопия, радиоизотопное мечение, электронная микроскопия и молекулярная динамика симуляции. Эти методы позволили открыть и детально проанализировать многие молекулы и метаболические пути из клетка, Такие как гликолиз и Цикл Кребса (цикл лимонной кислоты) и привел к пониманию биохимии на молекулярном уровне.
Еще одно значимое историческое событие в биохимии - открытие ген, и его роль в передаче информации в клетке. В 1950-х годах Джеймс Д. Уотсон, Фрэнсис Крик, Розалинд Франклин и Морис Уилкинс сыграли важную роль в разгадывании структуры ДНК и предложении ее связи с генетической передачей информации.[27] В 1958 г. Джордж Бидл и Эдвард Татум получил Нобелевская премия за работу с грибами, показывающую, что один ген производит один фермент.[28] В 1988 г. Колин Вилы был первым человеком, осужденным за убийство с ДНК доказательства, которые привели к росту Криминалистика.[29] В последнее время, Эндрю З. Огонь и Крейг С. Мелло получил Нобелевская премия 2006 г. для открытия роли РНК-интерференция (РНКи ), в заглушении экспрессия гена.[30]
Исходные материалы: химические элементы жизни
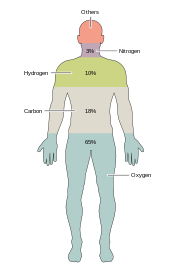
Около двух десятков химические элементы необходимы для различных видов биологическая жизнь. Самые редкие элементы на Земле не нужны жизни (за исключением селен и йод )[нужна цитата ], а несколько общих (алюминий и титан ) не используются. У большинства организмов общие потребности в элементах, но есть несколько различий между растения и животные. Например, морские водоросли используют бром, но наземные растения и животные, похоже, в этом не нуждаются. Всем животным требуется натрий, но некоторые растения этого не делают. Растениям нужны бор и кремний, но животным может не хватить (или может потребоваться сверхмалое количество).
Всего шесть элементов -углерод, водород, азот, кислород, кальций и фосфор - составляют почти 99% массы живых клеток, в том числе в организме человека (см. состав человеческого тела для полного списка). В дополнение к шести основным элементам, которые составляют большую часть человеческого тела, людям требуется меньшее количество, возможно, еще 18.[31]
Биомолекулы
Четыре основных класса молекул в биохимии (часто называемые биомолекулы ) находятся углеводы, липиды, белки, и нуклеиновые кислоты.[32] Многие биологические молекулы полимеры: в этой терминологии мономеры относительно небольшие макромолекулы, которые связаны вместе, чтобы создать большие макромолекулы известные как полимеры. Когда мономеры соединяются вместе, чтобы синтезировать биологический полимер, они проходят процесс, называемый дегидратационный синтез. Различные макромолекулы могут собираться в более крупные комплексы, часто необходимые для биологическая активность.
Углеводы


Две основные функции углеводов - хранение энергии и обеспечение структуры. Один из распространенных сахара известная как глюкоза - это углевод, но не все углеводы являются сахарами. На Земле больше углеводов, чем любой другой известный тип биомолекул; они используются для хранения энергии и генетическая информация, а также играть важную роль в клетке, чтобы клеточные взаимодействия и коммуникации.
Самый простой вид углеводов - это моносахарид, который среди других свойств содержит углерод, водород и кислород, в основном в соотношении 1: 2: 1 (обобщенная формула CпЧАС2пОп, куда п не меньше 3). Глюкоза (C6ЧАС12О6) - один из важнейших углеводов; другие включают фруктоза (C6ЧАС12О6), сахар, обычно связанный с сладкий вкус из фрукты,[33][а] и дезоксирибоза (C5ЧАС10О4), компонент ДНК. Моносахарид может переключаться между ациклическая форма (открытая цепь) и циклический форма. Форму с открытой цепью можно превратить в кольцо из атомов углерода, соединенных мостиком кислород атом, созданный из карбонильная группа одного конца и гидроксил группа другого. Циклическая молекула имеет полуацеталь или же гемикетальный группы, в зависимости от того, была ли линейная форма альдоза или кетоза.[34]
В этих циклических формах кольцо обычно имеет 5 или же 6 атомы. Эти формы называются фуранозы и пиранозы соответственно - по аналогии с фуран и пиран, простейшие соединения с тем же углеродно-кислородным кольцом (хотя в них отсутствует углерод-углеродный двойные связи этих двух молекул). Например, альдогексоза глюкоза может образовывать полуацетальную связь между гидроксилом на углероде 1 и кислородом на углероде 4, давая молекулу с 5-членным кольцом, называемую глюкофураноза. Такая же реакция может происходить между атомами углерода 1 и 5 с образованием молекулы с 6-членным кольцом, называемым глюкопираноза. Циклические формы с 7-атомным кольцом, называемые гептозы редки.
Два моносахарида могут быть соединены гликозидный или же эфирная связь в дисахарид через реакция дегидратации во время которого высвобождается молекула воды. Обратная реакция, при которой гликозидная связь дисахарида разрывается на два моносахарида, называется гидролиз. Самый известный дисахарид - это сахароза или обычный сахар, который состоит из глюкоза молекула и фруктоза молекула объединилась. Другой важный дисахарид - это лактоза содержится в молоке, состоит из молекулы глюкозы и галактоза молекула. Лактоза может гидролизоваться лактаза, а дефицит этого фермента приводит к непереносимость лактозы.
Когда соединяются несколько (от трех до шести) моносахаридов, это называется олигосахарид (олиго- что означает «несколько»). Эти молекулы обычно используются в качестве маркеров и сигналы, а также имеет некоторые другие применения.[35] Многие моносахариды, соединенные вместе, образуют полисахарид. Они могут быть соединены в одну длинную линейную цепочку, а могут быть разветвленный. Двумя наиболее распространенными полисахаридами являются: целлюлоза и гликоген, оба состоящие из повторяющейся глюкозы мономеры. Целлюлоза важная структурная составляющая растений клеточные стенки и гликоген используется как форма хранения энергии у животных.
Сахар можно охарактеризовать как наличие сокращение или нередуцирующие концы. А уменьшающий конец углевода представляет собой атом углерода, который может находиться в равновесии с открытой цепью альдегид (альдоза ) или кето-форма (кетоза ). Если соединение мономеров происходит по такому атому углерода, свободная гидроксильная группа пираноза или же фураноза форма обменивается с ОН-боковой цепью другого сахара, давая полный ацеталь. Это предотвращает раскрытие цепи до альдегидной или кето формы и делает модифицированный остаток невосстанавливающим. Лактоза содержит восстанавливающий конец в своей глюкозной составляющей, тогда как галактозная составляющая образует полный ацеталь с С4-ОН группой глюкозы. Сахароза не имеет восстанавливающего конца из-за полного образования ацеталя между альдегидным углеродом глюкозы (С1) и кетоуглеродом фруктозы (С2).
Липиды
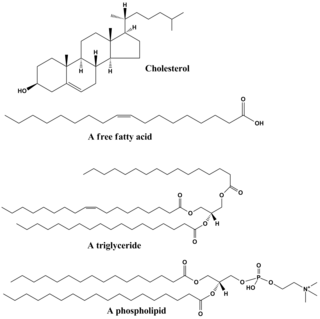
Липиды включают широкий спектр молекулы и до некоторой степени является ловушкой для относительно нерастворимых в воде или неполярный соединения биологического происхождения, в том числе воск, жирные кислоты, полученное из жирных кислот фосфолипиды, сфинголипиды, гликолипиды, и терпеноиды (например., ретиноиды и стероиды ). Некоторые липиды линейные, с открытой цепью алифатический молекулы, а другие имеют кольцевую структуру. Некоторые ароматный (с циклической [кольцевой] и планарной [плоской] структурой), а другие - нет. Некоторые из них гибкие, а другие жесткие.
Липиды обычно состоят из одной молекулы глицерин в сочетании с другими молекулами. В триглицериды, основная группа основных липидов, состоит из одной молекулы глицерина и трех жирные кислоты. В этом случае жирные кислоты считаются мономером и могут быть насыщенный (нет двойные связи в углеродной цепи) или ненасыщенные (одна или несколько двойных связей в углеродной цепи).
Большинство липидов содержат полярный характер в дополнение к тому, что он в значительной степени неполярный. Как правило, основная их структура неполярная или неполярная. гидрофобный («водобоязненный»), что означает, что он плохо взаимодействует с полярными растворителями, такими как вода. Другая часть их строения полярная или гидрофильный («любящий воду») и будет иметь тенденцию ассоциироваться с полярными растворителями, такими как вода. Это делает их амфифильный молекулы (имеющие как гидрофобные, так и гидрофильные части). В случае холестерин полярная группа представляет собой простой –ОН (гидроксил или спирт). В случае фосфолипидов полярные группы значительно больше и более полярны, как описано ниже.
Липиды - неотъемлемая часть нашего ежедневного рациона. Наиболее масла и молочные продукты которые мы используем для приготовления и еды, как масло сливочное, сыр, топленое масло и т. д., состоят из жиры. Растительные масла богаты различными полиненасыщенные жирные кислоты (ПНЖК). Липидсодержащие продукты перевариваются в организме и расщепляются на жирные кислоты и глицерин, которые являются конечными продуктами распада жиров и липидов. Липиды, особенно фосфолипиды, также используются в различных фармацевтические продукты, либо в виде со-солюбилизаторов (например, в парентеральных инфузиях), либо в виде носитель наркотиков компоненты (например, в липосома или же трансфертный ).
Белки
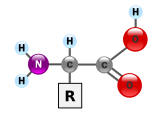
Белки очень большие молекулы - макробиополимеры - сделанные из мономеров, называемых аминокислоты. Аминокислота состоит из альфа-атома углерода, присоединенного к амино- группа, –NH2, а карбоновая кислота группа, –COOH (хотя они существуют как –NH3+ и –COO− в физиологических условиях), простой атом водорода и боковая цепь, обычно обозначаемая как «–R». Боковая цепь "R" различна для каждой аминокислоты, из которых 20 стандартные. Именно эта группа «R» делала каждую аминокислоту особенной, а свойства боковых цепей сильно влияют на общую трехмерное строение протеина. Некоторые аминокислоты выполняют функции сами по себе или в модифицированной форме; например, глутамат функционирует как важный нейротрансмиттер. Аминокислоты могут быть соединены через пептидная связь. В этом обезвоживание При синтезе молекула воды удаляется, и пептидная связь соединяет азот аминогруппы одной аминокислоты с углеродом группы карбоновой кислоты другой. Полученная молекула называется дипептид, а короткие отрезки аминокислот (обычно менее тридцати) называются пептиды или полипептиды. Более длинные отрезки заслуживают титула белки. Например, важная кровь сыворотка белок альбумин содержит 585 аминокислотных остатков.[38]


Белки могут выполнять структурные и / или функциональные роли. Например, движение белков актин и миозин в конечном итоге несут ответственность за сокращение скелетных мышц. Одним из свойств многих белков является то, что они специфически связываются с определенной молекулой или классом молекул - они могут быть очень сильно выборочно в том, что они связывают. Антитела являются примером белков, которые присоединяются к одному определенному типу молекул. Антитела состоят из тяжелых и легких цепей. Две тяжелые цепи будут связаны с двумя легкими цепями через дисульфидные связи между их аминокислотами. Антитела являются специфичными в зависимости от различий в N-концевом домене.[39]
В иммуноферментный анализ (ELISA), который использует антитела, является одним из наиболее чувствительных тестов, которые современная медицина использует для обнаружения различных биомолекул. Однако, вероятно, наиболее важными белками являются ферменты. Практически каждая реакция в живой клетке требует, чтобы фермент понижал энергию активации реакции. Эти молекулы распознают определенные молекулы реагентов, называемые субстраты; они тогда катализировать реакция между ними. Понизив энергия активации, фермент ускоряет эту реакцию в 10 раз.11 или больше; реакция, на спонтанное завершение которой обычно уходит более 3000 лет, с ферментом может занять менее секунды. Сам фермент не расходуется в процессе и может катализировать ту же реакцию с новым набором субстратов. С помощью различных модификаторов можно регулировать активность фермента, что позволяет контролировать биохимию клетки в целом.[нужна цитата ]
Структура белков традиционно описывается в виде четырехуровневой иерархии. В первичная структура белка состоит из его линейной последовательности аминокислот; например, «аланин-глицин-триптофан-серин-глутамат-аспарагин-глицин-лизин-…». Вторичная структура занимается местной морфологией (морфология - это изучение структуры). Некоторые комбинации аминокислот имеют тенденцию свертываться в спираль, называемую α-спираль или в лист, называемый β-лист; некоторые α-спирали можно увидеть на схеме гемоглобина выше. Третичная структура представляет собой всю трехмерную форму белка. Эта форма определяется последовательностью аминокислот. Фактически, одно изменение может изменить всю структуру. Альфа-цепь гемоглобина содержит 146 аминокислотных остатков; замена глутамат остаток в положении 6 с валин остаток настолько изменяет поведение гемоглобина, что приводит к серповидноклеточная анемия. Ну наконец то, четвертичная структура касается структуры белка с несколькими пептидными субъединицами, такого как гемоглобин с его четырьмя субъединицами. Не все белки содержат более одной субъединицы.[40]
Проглатываемые белки обычно распадаются на отдельные аминокислоты или дипептиды в тонкий кишечник а затем впитался. Затем они могут быть соединены с образованием новых белков. Промежуточные продукты гликолиза, цикла лимонной кислоты и пентозофосфатный путь может быть использован для образования всех двадцати аминокислот, и большинство бактерий и растений обладают всеми необходимыми ферментами для их синтеза. Однако люди и другие млекопитающие могут синтезировать только половину из них. Они не могут синтезировать изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, и валин. Поскольку они должны быть проглочены, это незаменимые аминокислоты. У млекопитающих действительно есть ферменты для синтеза аланин, аспарагин, аспартат, цистеин, глутамат, глутамин, глицин, пролин, серин, и тирозин, заменимые аминокислоты. Пока они могут синтезировать аргинин и гистидин, они не могут производить его в достаточном количестве для молодых растущих животных, поэтому их часто считают незаменимыми аминокислотами.
Если аминогруппа удаляется из аминокислоты, остается углеродный скелет, называемый α-кетокислота. Ферменты под названием трансаминазы может легко переносить аминогруппу с одной аминокислоты (превращая ее в α-кетокислоту) на другую α-кетокислоту (делая ее аминокислотой). Это важно для биосинтеза аминокислот, так как для многих путей промежуточные соединения других биохимических путей превращаются в скелет α-кетокислот, а затем добавляется аминогруппа, часто через трансаминирование. Затем аминокислоты могут быть связаны вместе с образованием белка.
Аналогичный процесс используется для расщепления белков. Сначала он гидролизуется до входящих в его состав аминокислот. Свободный аммиак (NH3), существующий как аммоний ион (NH4 +) в крови токсичен для жизненных форм. Следовательно, должен существовать подходящий способ его выведения. В зависимости от потребностей животных у разных животных выработались разные тактики. Одноклеточный организмы просто выделяют аммиак в окружающую среду. Так же, костлявая рыба может выпустить аммиак в воду, где он быстро растворяется. Как правило, млекопитающие превращают аммиак в мочевину через цикл мочевины.
Чтобы определить, связаны ли два белка, или, другими словами, решить, гомологичны они или нет, ученые используют методы сравнения последовательностей. Такие методы, как выравнивание последовательностей и структурные выравнивания мощные инструменты, которые помогают ученым определять гомологии между родственными молекулами. Актуальность поиска гомологий между белками выходит за рамки формирования эволюционной модели белковые семейства. Обнаружив, насколько похожи две белковые последовательности, мы узнаем об их структуре и, следовательно, об их функции.
Нуклеиновые кислоты

Нуклеиновые кислоты, так называемые из-за их преобладания в клеточных ядра, это родовое название семейства биополимеров. Это сложные высокомолекулярные биохимические макромолекулы, которые могут переносить генетическая информация во всех живых клетках и вирусах.[2] Мономеры называются нуклеотиды, и каждый состоит из трех компонентов: азотистого гетероциклического основание (либо пурин или пиримидин ), пентозный сахар и фосфат группа.[41]
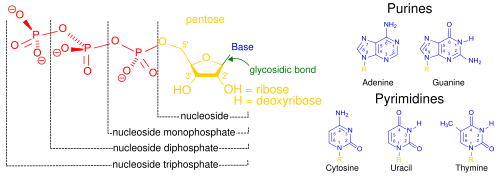
Наиболее распространенные нуклеиновые кислоты: дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК). В фосфатная группа и сахар каждой нуклеотидной связи друг с другом образует основу нуклеиновой кислоты, в то время как последовательность азотистых оснований хранит информацию. Наиболее распространены азотистые основания: аденин, цитозин, гуанин, тимин, и урацил. В азотистые основания каждой цепи нуклеиновой кислоты будет образовывать водородные связи с некоторыми другими азотистыми основаниями в дополнительной цепи нуклеиновой кислоты (подобно застежке-молнии). Аденин связывается с тимином и урацилом, тимин связывается только с аденином, а цитозин и гуанин могут связываться только друг с другом.
Помимо генетического материала клетки, нуклеиновые кислоты часто играют роль вторые мессенджеры, а также образующие основную молекулу для аденозинтрифосфат (АТФ), молекула первичного энергоносителя, присутствующая во всех живых организмах. Кроме того, азотистые основания, возможные в двух нуклеиновых кислотах, различны: аденин, цитозин и гуанин присутствуют как в РНК, так и в ДНК, в то время как тимин встречается только в ДНК, а урацил - в РНК.
Метаболизм
Углеводы как источник энергии
Глюкоза является источником энергии для большинства форм жизни. Например, полисахариды распадаются на мономеры ферменты (гликогенфосфорилаза удаляет остатки глюкозы из полисахарида гликогена). Дисахариды, такие как лактоза или сахароза, расщепляются на двухкомпонентные моносахариды.
Гликолиз (анаэробный)
Глюкоза метаболизируется в основном за счет десяти этапов. путь называется гликолиз, в результате чего одна молекула глюкозы расщепляется на две молекулы пируват. Это также дает две чистые молекулы АТФ, энергетическая валюта клеток, а также два восстанавливающих эквивалента преобразования НАД+ (никотинамидадениндинуклеотид: окисленная форма) до NADH (никотинамидадениндинуклеотид: восстановленная форма). Для этого не требуется кислород; если кислород недоступен (или клетка не может использовать кислород), НАД восстанавливается путем преобразования пирувата в лактат (молочная кислота) (например, у людей) или этиловый спирт плюс диоксид углерода (например, в дрожжи ). Другие моносахариды, такие как галактоза и фруктоза, могут превращаться в промежуточные продукты гликолитического пути.[42]
Аэробика
В аэробный клетки с достаточным количеством кислорода, как и в большинстве клеток человека, пируват подвергается дальнейшему метаболизму. Он необратимо превращается в ацетил-КоА, выделяя один атом углерода в качестве побочного продукта углекислый газ, генерируя другой редуцирующий эквивалент как НАДН. Две молекулы ацетил-КоА (из одной молекулы глюкозы) затем попадают в цикл лимонной кислоты, производя две молекулы АТФ, еще шесть молекул НАДН и два восстановленных (уби) хинона (через FADH2 как связанный с ферментом кофактор) и высвобождение оставшихся атомов углерода в виде диоксида углерода. Образующиеся молекулы НАДН и хинола затем поступают в ферментные комплексы дыхательной цепи, электронная транспортная система переводя электроны в конечном итоге на кислород и сохраняя высвобождаемую энергию в виде градиента протонов над мембраной (внутренняя митохондриальная мембрана у эукариот). Таким образом, кислород восстанавливается до воды и исходные акцепторы электронов НАД+ и хинон регенерируются. Вот почему люди вдыхают кислород и выдыхают углекислый газ. Энергия, высвобождаемая при переносе электронов из высокоэнергетических состояний в НАДН и хиноле, сначала сохраняется в виде протонного градиента и преобразуется в АТФ через АТФ-синтазу. Это порождает дополнительный 28 молекул АТФ (24 из 8 НАДН + 4 из 2 хинолов), в сумме до 32 молекул АТФ, законсервированных на расщепленную глюкозу (две из гликолиза + две из цитратного цикла).[43] Ясно, что использование кислорода для полного окисления глюкозы дает организму гораздо больше энергии, чем любая кислородно-независимая метаболическая функция, и это считается причиной того, что сложная жизнь появилась только после того, как атмосфера Земли накопила большое количество кислорода.
Глюконеогенез
В позвоночные, сильно сокращаясь скелетные мышцы (например, во время тяжелой атлетики или спринта) не получают достаточно кислорода, чтобы удовлетворить потребность в энергии, и поэтому они переключаются на анаэробный метаболизм, превращая глюкозу в лактат. Комбинация глюкозы неуглеводного происхождения, такой как жир и белки. Это происходит только когда гликоген запасы в печени истощены. Путь - это решающий поворот гликолиз от пирувата до глюкозы и может использовать множество источников, таких как аминокислоты, глицерин и Цикл Кребса. Белок и жир в большом количестве катаболизм обычно возникают, когда люди страдают от голода или определенных эндокринных нарушений.[44] В печень регенерирует глюкозу, используя процесс, называемый глюконеогенез. Этот процесс не совсем противоположен гликолизу и на самом деле требует в три раза больше энергии, получаемой от гликолиза (используются шесть молекул АТФ по сравнению с двумя, полученными при гликолизе). Аналогично описанным выше реакциям, произведенная глюкоза может подвергаться гликолизу в тканях, которым нужна энергия, сохраняться в виде гликогена (или крахмал в растениях), или преобразовываться в другие моносахариды, или объединяться в ди- или олигосахариды. Комбинированные пути гликолиза во время упражнений, прохождения лактата через кровоток в печень, последующий глюконеогенез и выброс глюкозы в кровоток называют Цикл Кори.[45]
Связь с другими биологическими науками "молекулярного масштаба"

Исследователи в области биохимии используют специальные методы, присущие биохимии, но все чаще сочетают их с методами и идеями, разработанными в области биохимии. генетика, молекулярная биология, и биофизика. Между этими дисциплинами нет четкой границы. Биохимия изучает химия необходим для биологической активности молекул, молекулярная биология изучает их биологическую активность, генетика изучает их наследственность, которая передается их геном. Это показано на следующей схеме, на которой изображено одно из возможных представлений о взаимосвязях между полями:
- Биохимия это изучение химических веществ и жизненно важных процессов, происходящих в живых организмы. Биохимики сосредоточить внимание на роли, функциях и структуре биомолекулы. Изучение химии биологических процессов и синтез биологически активных молекул являются примерами биохимии. Биохимия изучает жизнь на атомном и молекулярном уровне.
- Генетика это изучение влияния генетических различий в организмах. Это часто может быть связано с отсутствием нормального компонента (например, одного ген ). Исследование "мутанты «- организмы, в которых отсутствует один или несколько функциональных компонентов по сравнению с так называемыми»дикого типа "или нормальный фенотип. Генетические взаимодействия (эпистаз ) может часто сбивать с толку простые толкования таких "нокаутировать "учеба.
- Молекулярная биология изучение молекулярных основ процессов репликация, транскрипция, перевод, и функции клеток. В центральная догма молекулярной биологии где генетический материал транскрибируется в РНК, а затем транслируется в белок несмотря на чрезмерное упрощение, по-прежнему является хорошей отправной точкой для понимания данной области. Картина была переработана с учетом появления новых ролей для РНК. Молекулярная биология изучает жизнь на молекулярном и клеточном уровне
- 'Химическая биология ' стремится разрабатывать новые инструменты на основе маленькие молекулы которые позволяют минимизировать возмущение биологических систем, предоставляя подробную информацию об их функциях. Кроме того, химическая биология использует биологические системы для создания неприродных гибридов между биомолекулами и синтетическими устройствами (например, пустыми вирусные капсиды что может доставить генная терапия или же молекулы лекарства ).
Экстремофилов
Экстремофилов являются микроорганизмами, которые живут в экстремальных условиях, некоторые из которых могут давать некоторые исключения или вариации некоторых из упомянутых выше законов природы. Например, в июле 2019 года научное исследование Кидд Майн в Канаде обнаружил серодышащие организмы которые живут на глубине 7900 футов под поверхностью и поглощают сера вместо кислорода для облегчения клеточного дыхания. Эти организмы также примечательны тем, что поедают камни, такие как пирит, в качестве обычного источника пищи.[46][47][48]
В ДНК-полимераза термофильных бактерий Thermus aquaticus, добыт в 1968 г. и назван Taq полимераза, представляет собой биохимический репликатор ДНК, устойчивый к относительно высоким температурам (50-80 ° C), что позволило молекулярным биологам облегчить осложнения в ПЦР (полимеразная цепная реакция) метод.
Смотрите также
Списки
Смотрите также
- Биохимия (журнал)
- Биологическая химия (журнал)
- Биофизика
- Химическая экология
- Вычислительное биомоделирование
- Выделенный химикат на биологической основе
- Номер ЕС
- Гипотетические типы биохимии
- Международный союз биохимии и молекулярной биологии
- Метаболом
- Метаболомика
- Молекулярная биология
- Молекулярная медицина
- Биохимия растений
- Протеолиз
- Малая молекула
- Структурная биология
- Цикл TCA
Примечания
а. ^ Фруктоза - не единственный сахар, содержащийся во фруктах. Глюкоза и сахароза также содержатся в различных количествах в различных фруктах, и иногда их количество превышает количество фруктозы. Например, 32% съедобной части Дата глюкоза, по сравнению с 24% фруктозы и 8% сахарозы. Тем не мение, персики содержат больше сахарозы (6,66%), чем фруктозы (0,93%) или глюкозы (1,47%).[49]
Рекомендации
- ^ «Биология / Биохимия». acs.org.
- ^ а б Voet (2005), стр. 3.
- ^ Карп (2009), стр. 2.
- ^ Миллер (2012). п. 62.
- ^ Astbury (1961), стр. 1124.
- ^ Эльдра (2007), стр. 45.
- ^ Метки (2012), Глава 14.
- ^ Финкель (2009), стр. 1–4.
- ^ ЮНИСЕФ (2010), с. 61, 75.
- ^ а б Helvoort (2000), стр. 81.
- ^ Охотник (2000), стр. 75.
- ^ Hamblin (2005), стр. 26.
- ^ Охотник (2000), стр. 96–98.
- ^ Берг (1980), стр. 1–2.
- ^ Холмс (1987), стр. XV.
- ^ Фельдман (2001), стр. 206.
- ^ Rayner-Canham (2005), стр. 136.
- ^ Ziesak (1999), стр. 169.
- ^ Kleinkauf (1988), стр. 116.
- ^ Бен-Менахем (2009), стр. 2982.
- ^ Амслер (1986), стр. 55.
- ^ Horton (2013), стр. 36.
- ^ Kleinkauf (1988), стр. 43.
- ^ Эдвардс (1992), стр. 1161–1173.
- ^ Фиске (1890), стр. 419–20.
- ^ Кауфман (2001), стр. 121–133.
- ^ Тропп (2012), стр. 19–20.
- ^ Кребс (2012), стр. 32.
- ^ Дворецкий (2009), стр. 5.
- ^ Чандан (2007), стр. 193–194.
- ^ Nielsen (1999), стр. 283–303.
- ^ Slabaugh (2007), стр. 3–6.
- ^ Уайтинг (1970), стр. 1–31.
- ^ Voet (2005), стр. 358–359.
- ^ Варки (1999), стр. 17.
- ^ Страйер (2007), стр. 328.
- ^ Voet (2005), гл. 12 Липиды и мембраны.
- ^ Metzler (2001), стр. 58.
- ^ Feige, Matthias J .; Хендершот, Линда М .; Бюхнер, Йоханнес (2010). «Как сворачиваются антитела». Тенденции в биохимических науках. 35 (4): 189–198. Дои:10.1016 / j.tibs.2009.11.005. ЧВК 4716677. PMID 20022755.
- ^ Фромм и Харгроув (2012), стр. 35–51.
- ^ Saenger (1984), стр. 84.
- ^ Фромм и Харгроув (2012), стр. 163–180.
- ^ Voet (2005), гл. 17 Гликолиз.
- ^ Биологический словарь. Издательство Оксфордского университета. 17 сентября 2015. ISBN 9780198714378.
- ^ Фромм и Харгроув (2012), стр. 183–194.
- ^ «Следуй за водой»: гидрогеохимические ограничения на микробные исследования 2,4 км под поверхностью в обсерватории Deep Fluid and Deep Life в Кидд-Крик, Гранат С. Лоллар, Оливер Варр, Джон Теллинг, Магдалена Р. Осбурн и Барбара Шервуд Лоллар, принято 15 января 2019 г., принято 1 июля 2019 г., опубликовано онлайн: 18 июля 2019 г.
- ^ Самые старые подземные воды в мире поддерживают жизнь благодаря химическому составу воды и горных пород, 29 июля 2019 г., deepcarbon.net.
- ^ Странные формы жизни, найденные глубоко в шахте, указывают на огромные `` подземные Галапагосы '', Кори С. Пауэлл, 7 сентября 2019 г., nbcnews.com.
- ^ Уайтинг, G.C. (1970), стр. 5.
Цитированная литература
- Амслер, Марк (1986). Языки творчества: модели, решение проблем, дискурс. University of Delaware Press. ISBN 978-0-87413-280-9.
- Эстбери, W.T. (1961). «Молекулярная биология или ультраструктурная биология?». Природа. 190 (4781): 1124. Bibcode:1961Натура.190.1124А. Дои:10.1038 / 1901124a0. PMID 13684868. S2CID 4172248.
- Бен-Менахем, Ари (2009). Историческая энциклопедия естественных и математических наук. Историческая энциклопедия естественных и математических наук Ари Бен-Менахема. Берлин: Springer. Springer. п. 2982. Bibcode:2009хенм.книга ..... B. ISBN 978-3-540-68831-0.
- Бертон, Фельдман (2001). Нобелевская премия: история гения, противоречий и престижа. Издательство Аркады. ISBN 978-1-55970-592-9.
- Батлер, Джон М. (2009). Основы судебного типирования ДНК. Академическая пресса. ISBN 978-0-08-096176-7.
- Сен, Чандан К .; Рой, Сашвати (2007). «MiRNA: Лицензия на убийство посланника». ДНК и клеточная биология. 26 (4): 193–194. Дои:10.1089 / dna.2006.0567. PMID 17465885.
- Кларенс, Питер Берг (1980). Университет штата Айова и биохимия с момента их основания. ISBN 978-0-87414-014-9.
- Эдвардс, Карен Дж .; Браун, Дэвид Дж .; Спинк, Нил; Скелли, Джейн В .; Нейдл, Стивен (1992). «Молекулярная структура додекамера d B-ДНК (CGCAAATTTGCG) 2 - исследование закрутки пропеллера и структуры воды с малой бороздкой при разрешении 2 · 2 Å». Журнал молекулярной биологии. 226 (4): 1161–1173. Дои:10.1016 / 0022-2836 (92) 91059-х. PMID 1518049.
- Эльдра П. Соломон; Линда Р. Берг; Дайана В. Мартин (2007). Биология, 8-е издание, международное студенческое издание. Томсон Брукс / Коул. ISBN 978-0-495-31714-2. Архивировано из оригинал на 2016-03-04.
- Fariselli, P .; Росси, I .; Capriotti, E .; Касадио, Р. (2006). "WWWH дистанционного обнаружения гомологов: современное состояние". Брифинги по биоинформатике. 8 (2): 78–87. Дои:10.1093 / bib / bbl032. PMID 17003074.
- Фиске, Джон (1890). Очерки космической философии, основанные на доктринах эволюции, с критикой позитивной философии, том 1. Бостон и Нью-Йорк: Хоутон, Миффлин. Получено 16 февраля 2015.
- Финкель, Ричард; Кубедду, Луиджи; Кларк, Мишель (2009). Иллюстрированные обзоры Липпинкотта: фармакология (4-е изд.). Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-7155-9.
- Krebs, Jocelyn E .; Goldstein, Elliott S .; Левин, Бенджамин; Килпатрик, Стивен Т. (2012). Основные гены. Издательство "Джонс и Бартлетт". ISBN 978-1-4496-1265-8.
- Фромм, Герберт Дж .; Харгроув, Марк (2012). Основы биохимии. Springer. ISBN 978-3-642-19623-2.
- Хэмблин, Джейкоб Дарвин (2005). Наука начала двадцатого века: энциклопедия. ABC-CLIO. ISBN 978-1-85109-665-7.
- Хелворт, Тон ван (2000). Арне Хессенбрух (ред.). Справочник по истории науки. Издательство Фицрой Дирборн. ISBN 978-1-884964-29-9.
- Холмс, Фредерик Лоуренс (1987). Лавуазье и химия жизни: исследование научного творчества. Университет Висконсин Press. ISBN 978-0-299-09984-8.
- Хортон, Дерек, изд. (2013). Достижения в химии и биохимии углеводов, том 70. Академическая пресса. ISBN 978-0-12-408112-3.
- Хантер, Грэм К. (2000). Жизненные силы: открытие молекулярной основы жизни. Академическая пресса. ISBN 978-0-12-361811-5.
- Карп, Джеральд (2009). Клеточная и молекулярная биология: концепции и эксперименты. Джон Вили и сыновья. ISBN 978-0-470-48337-4.
- Кауфман, Джордж Б .; Chooljian, Стивен Х. (2001). «Фридрих Вёлер (1800–1882), к двухсотлетию со дня его рождения». Химический педагог. 6 (2): 121–133. Дои:10.1007 / s00897010444a. S2CID 93425404.
- Кляйнкауф, Хорст; Дёрен, Ханс фон; Янике Лотар (1988). Корни современной биохимии: закорючка Фрица Липпмана и ее последствия. Walter de Gruyter & Co. стр. 116. ISBN 978-3-11-085245-5.
- Ноулз, Дж. Р. (1980). "Катализируемые ферментами реакции переноса фосфорила". Ежегодный обзор биохимии. 49: 877–919. Дои:10.1146 / annurev.bi.49.070180.004305. PMID 6250450. S2CID 7452392.
- Метцлер, Дэвид Эверетт; Мецлер, Кэрол М. (2001). Биохимия: химические реакции живых клеток. 1. Академическая пресса. ISBN 978-0-12-492540-3.
- Miller G; Спулман Скотт (2012). Наука об окружающей среде - биоразнообразие - важнейшая часть природного капитала Земли. Cengage Learning. ISBN 978-1-133-70787-5. Получено 2016-01-04.
- Нильсен, Форрест Х. (1999). Морис Э. Шилс; и другие. (ред.). Ультра-следовые минералы; Современное питание при здоровье и болезнях. Балтимор: Уильямс и Уилкинс. С. 283–303. HDL:10113/46493.
- Пит, Алиса (2012). Маркс, Аллан; Либерман Майкл А. (ред.). Базовая медицинская биохимия Марка (Lieberman, Marks's Basic Medical Biochemistry) (4-е изд.). ISBN 978-1-60831-572-7.
- Rayner-Canham, Marelene F .; Райнер-Кэнхэм, Марелин; Райнер-Кэнхэм, Джеффри (2005). Женщины в химии: их меняющиеся роли от алхимических времен до середины двадцатого века. Фонд химического наследия. ISBN 978-0-941901-27-7.
- Рохас-Руис, Фернандо А .; Варгас-Мендес, Леонор Й .; Кузнецов, Владимир В. (2011). «Проблемы и перспективы химической биологии, успешной междисциплинарной области естественных наук». Молекулы. 16 (3): 2672–2687. Дои:10.3390 / молекулы16032672. ЧВК 6259834. PMID 21441869.
- Saenger, Вольфрам (1984). Принципы структуры нуклеиновой кислоты. Нью-Йорк: Springer-Verlag. ISBN 978-0-387-90762-8.
- Slabaugh, Michael R .; Сигер, Спенсер Л. (2013). Органическая и биохимия сегодня (6-е изд.). Пасифик Гроув: Брукс Коул. ISBN 978-1-133-60514-0.
- Шервуд, Лорали; Кландорф, Хиллар; Янси, Пол Х. (2012). Физиология животных: от генов к организмам. Cengage Learning. ISBN 978-0-8400-6865-1.
- Страйер Л., Берг Дж. М., Тимочко Дж. Л. (2007). Биохимия (6-е изд.). Сан-Франциско: W.H. Фримен. ISBN 978-0-7167-8724-2.
- Тропп, Бертон Э. (2012). Молекулярная биология (4-е изд.). Джонс и Бартлетт Обучение. ISBN 978-1-4496-0091-4.
- ЮНИСЕФ (2010). Факты для жизни (PDF) (4-е изд.). Нью-Йорк: Детский фонд Организации Объединенных Наций. ISBN 978-92-806-4466-1.
- Ульвелинг, Дэмиен; Франкастель, Клэр; Хубе, Флоран (2011). «Когда один лучше, чем два: РНК с двойными функциями» (PDF). Биохимия. 93 (4): 633–644. Дои:10.1016 / j.biochi.2010.11.004. PMID 21111023.
- Варки А., Каммингс Р., Эско Дж., Джессика Ф., Харт Дж., Март Дж. (1999). Основы гликобиологии. Лабораторный пресс Колд-Спринг-Харбор. ISBN 978-0-87969-560-6.
- Voet, D; Воет, JG (2005). Биохимия (3-е изд.). Хобокен, Нью-Джерси: John Wiley & Sons Inc. ISBN 978-0-471-19350-0. Архивировано из оригинал 11 сентября 2007 г.
- Уайтинг, Г.К. (1970). «Сахар». В A.C. Hulme (ред.). Биохимия фруктов и продуктов из них. Том 1. Лондон и Нью-Йорк: Academic Press. ISBN 978-0-12-361201-4.
- Зиесак, Анн-Катрин; Крэм Ганс-Роберт (1999). Издательство Вальтера де Грюйтера, 1749–1999 гг.. Walter de Gruyter & Co. ISBN 978-3-11-016741-2.
- Эшкрофт, Стив. "Профессор сэр Филип Рэндл; Исследователь метаболизма: [1-е издание]". Независимый. ProQuest 311080685.
дальнейшее чтение
- Фрутон, Джозеф С. Белки, ферменты, гены: взаимодействие химии и биологии. Издательство Йельского университета: Нью-Хейвен, 1999. ISBN 0-300-07608-8
- Кейт Робертс, Мартин Рафф, Брюс Альбертс, Питер Уолтер, Джулиан Льюис и Александр Джонсон, Молекулярная биология клетки
- Колер, Роберт. От медицинской химии к биохимии: создание биомедицинской дисциплины. Издательство Кембриджского университета, 1982.
- Maggio, Lauren A .; Виллинский, Джон М .; Steinberg, Ryan M .; Митчен, Даниэль; Wass, Joseph L .; Донг, Тинг (2017). «Википедия как портал для биомедицинских исследований: относительное распределение и использование цитат в английской Википедии». PLOS ONE. 12 (12): e0190046. Bibcode:2017PLoSO..1290046M. Дои:10.1371 / journal.pone.0190046. ЧВК 5739466. PMID 29267345.
внешняя ссылка
| Библиотечные ресурсы о Биохимия |
- «Биохимическое общество».
- Виртуальная библиотека биохимии, молекулярной биологии и клеточной биологии
- Биохимия, 5-е изд. Полный текст Берга, Тимочко и Страйера, любезно предоставлен NCBI.
- SystemsX.ch - Швейцарская инициатива в области системной биологии
- Полный текст биохимии Кевина и Индиры, вводный учебник по биохимии.