Олигосахарид - Oligosaccharide
An олигосахарид (/ ˌⱭlɪgoʊˈsækəˌɹaɪd /[1]; с греческого ὀλίγος олигос, «несколько» и σάκχαρ сачар, "сахар") сахарид полимер содержащие небольшое число (обычно от трех до десяти[2][3][4][5]) из моносахариды (простые сахара). Олигосахариды могут выполнять множество функций, включая распознавание и связывание клеток.[6] Например, гликолипиды играют важную роль в иммунном ответе.
Обычно они представлены как гликаны: цепи олигосахаридов, связанные с липиды или к совместимому аминокислота боковые цепи в белки, к N- или же О-гликозидные связи. N-Связанные олигосахариды всегда являются пентасахаридами, присоединенными к аспарагин через бета-связь с азотом амина боковой цепи.[7] Альтернативно, О-связанный олигосахариды обычно присоединяются к треонину или серину на спиртовой группе боковой цепи. Не все природные олигосахариды входят в состав гликопротеинов или гликолипидов. Некоторые, например рафиноза серии, происходят как хранение или транспортировка углеводы в растениях. Другие, такие как мальтодекстрины или же целлодекстрины, возникают в результате микробного разложения более крупных полисахариды Такие как крахмал или же целлюлоза.
Гликозилирование
В биологии гликозилирование это процесс, при котором углевод ковалентно присоединяется к органической молекуле, создавая такие структуры, как гликопротеины и гликолипиды.[8]
N-Связанные олигосахариды
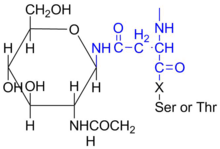
N-Связанное гликозилирование включает присоединение олигосахарида к аспарагин через бета-связь с азотом амина боковой цепи.[7] Процесс N-связанное гликозилирование происходит котрансляционно или одновременно во время трансляции белков. Поскольку он добавляется котрансляционно, считается, что N-связанное гликозилирование помогает определить укладку полипептидов из-за гидрофильной природы сахаров. Все N-связанные олигосахариды представляют собой пентасахариды: пять моносахаридов в длину.
В N-гликозилирование у эукариот олигосахаридный субстрат собирается прямо на мембране эндоплазматический ретикулум.[9] За прокариоты, этот процесс происходит на плазматическая мембрана. В обоих случаях акцепторная подложка представляет собой аспарагин остаток. Остаток аспарагина, связанный с N-связанный олигосахарид обычно встречается в последовательности Asn-X-Ser / Thr,[7] где X может быть любой аминокислотой, кроме пролин, хотя в этой позиции редко можно увидеть Asp, Glu, Leu или Trp.
О-Связанные олигосахариды

Олигосахариды, участвующие в О-связанные гликозилирования присоединены к треонин или же серин на гидроксильная группа боковой цепи.[7] О-связанное гликозилирование происходит в аппарат Гольджи, где моносахаридные единицы добавляются к полной полипептидной цепи. Белки клеточной поверхности и внеклеточные белки О-гликозилированный.[10] Сайты гликозилирования в О-связанные олигосахариды определяются вторичный и третичные структуры полипептида, который диктует, где гликозилтрансферазы добавит сахара.
Гликозилированные биомолекулы
Гликопротеины и гликолипиды по определению ковалентно связанный к углеводам. Их очень много на поверхности клетки, и их взаимодействие способствует общей стабильности клетки.
Гликопротеины
Гликопротеины имеют отличные структуры олигосахаридов, которые оказывают значительное влияние на многие из их свойств,[11] влияющие на критические функции, такие как антигенность, растворимость, и сопротивление протеазы. Гликопротеины важны как рецепторы клеточной поверхности, молекулы клеточной адгезии, иммуноглобулины, и опухолевые антигены.[12]
Гликолипиды
Гликолипиды важны для распознавания клеток и важны для модуляции функции мембранных белков, которые действуют как рецепторы.[13] Гликолипиды - это молекулы липидов, связанные с олигосахаридами, обычно присутствующие в липидный бислой. Кроме того, они могут служить рецепторами для клеточного распознавания и передачи клеточных сигналов.[13] Головка олигосахарида служит связывающим партнером в рецептор Мероприятия. Механизмы связывания рецепторов с олигосахаридами зависят от состава олигосахаридов, которые открыты или представлены над поверхностью мембраны. Существует большое разнообразие механизмов связывания гликолипидов, что делает их такой важной мишенью для патогенов, как место взаимодействия и проникновения.[14] Например, сопровождающий активность гликолипидов была изучена на предмет ее соответствия ВИЧ-инфекции.
Функции
Распознавание клеток
Все клетки покрыты гликопротеинами или гликолипидами, которые помогают определять типы клеток.[7] Лектины или белки, которые связывают углеводы, могут распознавать определенные олигосахариды и предоставлять полезную информацию для распознавания клеток на основе связывания олигосахаридов.[нужна цитата ]
Важным примером распознавания олигосахаридными клетками является роль гликолипидов в определении группы крови. Различные группы крови различаются по модификации гликана, присутствующей на поверхности клеток крови.[15] Их можно визуализировать с помощью масс-спектрометрии. Олигосахариды, обнаруженные на A, B и H антиген происходят на несокращающийся концы олигосахарида. Антиген H (который указывает на группу крови O) служит предшественником антигенов A и B.[7] Следовательно, у человека с группой крови A антиген и антиген H будут присутствовать на гликолипидах плазматической мембраны эритроцитов. У человека с группой крови B будут присутствовать антигены B и H. У человека с группой крови AB будут присутствовать антигены A, B и H. И, наконец, у человека с группой крови O будет присутствовать только антиген H. Это означает, что все группы крови имеют антиген H, что объясняет, почему группа крови O известна как «универсальный донор».[нужна цитата ]
Как транспортные везикулы узнают о конечном пункте назначения белка, который они транспортируют?
Пузырьки направляются разными способами, но есть два основных:
- Сигналы сортировки закодированы в аминокислотной последовательности белков.
- Олигосахарид прикреплен к белку.
Сигналы сортировки распознаются специфическими рецепторами, которые находятся в мембранах или поверхностных оболочках почкующихся везикул, гарантируя, что белок транспортируется к соответствующему месту назначения.
Клеточная адгезия
Многие клетки производят специфические связывающие углеводы белки, известные как лектины, которые опосредуют адгезию клеток с олигосахаридами.[16] Selectins Семейство лектинов опосредует определенные процессы межклеточной адгезии, в том числе лейкоцитов, к эндотелиальным клеткам.[7] При иммунном ответе эндотелиальные клетки могут временно экспрессировать определенные селектины в ответ на повреждение или повреждение клеток. В ответ между двумя молекулами будет происходить реципрокное взаимодействие селектин-олигосахарид, которое позволяет лейкоциту помочь устранить инфекцию или повреждение. Связывание белков и углеводов часто опосредуется водородная связь и силы Ван дер Ваальса.[нужна цитата ]
Диетические олигосахариды
Фруктоолигосахариды (FOS), которые содержатся во многих овощах, представляют собой короткие цепочки фруктоза молекулы. Они отличаются от фруктаны Такие как инулин, которые, как и полисахариды, имеют гораздо более высокую степень полимеризации чем ФОС и другие олигосахариды, но, как и инулин и другие фруктаны, они считаются растворимыми пищевыми волокнами. Галактоолигосахариды (GOS), которые также встречаются в природе, состоят из коротких цепочек галактоза молекулы. Грудное молоко является примером этого и содержит олигосахариды, известные как олигосахариды грудного молока (ОПЗ), которые получены из лактоза.[17][18] Эти олигосахариды имеют биологическая функция в развитии Кишечная флора из младенцы. Примеры включают лакто-N-тетраоза, лакто-N-неотетраоза и лакто-N-фукопентаоза.[17][18] Эти соединения нельзя переварен в человеке тонкий кишечник, а вместо этого перейти к толстая кишка, где они способствуют росту Бифидобактерии, которые полезны для здоровья кишечника.[19]
Олигосахариды маннана (MOS) широко используются в корма для животных для улучшения здоровья желудочно-кишечного тракта. Обычно их получают из стенок дрожжевых клеток Saccharomyces cerevisiae. Олигосахариды маннана отличаются от других олигосахаридов тем, что они не ферментируются, а их основной способ действия включает агглютинацию патогенов фимбрий типа 1 и иммуномодуляцию.[20]
Источники
Олигосахариды входят в состав волокно из растительной ткани. ФОС и инулин присутствуют в Иерусалимский артишок, лопух, цикорий, лук-порей, лук, и спаржа. Инулин составляет значительную часть ежедневного рациона большей части населения мира. ФОС также может синтезироваться ферментами гриба. Aspergillus niger действующий на сахароза. GOS естественным образом встречается в соевые бобы и может быть синтезирован из лактоза. ФОС, ГОС и инулин также продаются в качестве пищевых добавок.[нужна цитата ]
Смотрите также
Рекомендации
- ^ «Определение ОЛИГОСАХАРИДА». www.merriam-webster.com. Получено 2018-10-15.
- ^ Олигосахариды в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- ^ Уолстра П., Воутерс Дж. Т., Гертс Т. Дж. (2008). Молочная наука и технологии (второе изд.). CRC, Тейлор и Фрэнсис.[страница нужна ]
- ^ Уитни Э., Рольфес С.Р. (2008). Понимание питания (Одиннадцатое изд.). Томсон Уодсворт..[страница нужна ]
- ^ «Олигосахарид». Британская энциклопедия.
- ^ «Молекулярная биология клетки. 4-е издание». Получено 16 августа 2018.
- ^ а б c d е ж грамм Воет Д., Воет Дж., Пратт С. (2013). Основы биохимии: жизнь на молекулярном уровне (4-е изд.). Хобокен, Нью-Джерси: John Wiley & Sons, Inc. ISBN 978-0470-54784-7..[страница нужна ]
- ^ Варки А, изд. (2009). Основы гликобиологии (2-е изд.). Издательство Cold Spring Harbor Laboratories Press. ISBN 978-0-87969-770-9..[страница нужна ]
- ^ Шварц Ф., Эби М. (октябрь 2011 г.). «Механизмы и принципы N-связанное гликозилирование белков ». Текущее мнение в структурной биологии. 21 (5): 576–82. Дои:10.1016 / j.sbi.2011.08.005. PMID 21978957.
- ^ Петер-Каталинич Й (2005). «Методы в энзимологии: О-гликозилирование белков ». Методы в энзимологии. 405: 139–71. Дои:10.1016 / S0076-6879 (05) 05007-X. ISBN 978-0-12-182810-3. PMID 16413314.
- ^ Goochee CF (1992). «Факторы биопроцесса, влияющие на структуру гликопротеиновых олигосахаридов». Развитие биологической стандартизации. 76: 95–104. PMID 1478360.
- ^ Эльбейн А.Д. (октябрь 1991 г.). "Роль N-связанные олигосахариды в функции гликопротеина ». Тенденции в биотехнологии. 9 (10): 346–52. Дои:10.1016 / 0167-7799 (91) 90117-Z. PMID 1367760.
- ^ а б Манна М., Рог Т., Ваттулайнен I (август 2014 г.). «Проблемы понимания функций гликолипидов: открытый взгляд, основанный на молекулярном моделировании». Biochimica et Biophysica Acta (BBA) - Молекулярная и клеточная биология липидов. 1841 (8): 1130–45. Дои:10.1016 / j.bbalip.2013.12.016. PMID 24406903.
- ^ Фантини Дж (2007). «Взаимодействие белков с липидными рафтами через гликолипид-связывающие домены: биохимический фон и потенциальные терапевтические применения». Современная лекарственная химия. 14 (27): 2911–7. Дои:10.2174/092986707782360033. PMID 18045136.
- ^ Kailemia MJ, Ruhaak LR, Lebrilla CB, Amster IJ (январь 2014 г.). «Анализ олигосахаридов с помощью масс-спектрометрии: обзор последних разработок». Аналитическая химия. 86 (1): 196–212. Дои:10.1021 / ac403969n. ЧВК 3924431. PMID 24313268.
- ^ Фейзи Т (1993). «Олигосахариды, которые опосредуют межклеточную адгезию млекопитающих». Текущее мнение в структурной биологии. 3 (5): 701–10. Дои:10.1016 / 0959-440X (93) 90053-N.
- ^ а б Мисфельд, Роджер Л. (июль 2017 г.). Биохимия. Макэвой, Меган М. (Первое издание). Нью-Йорк, штат Нью-Йорк. ISBN 978-0-393-61402-2. OCLC 952277065.
- ^ а б «Олигосахариды человеческого молока». Глобальный веб-сайт NNI. Получено 2020-12-04.
- ^ Моис А.М. (31.10.2017). Микробиом кишечника: изучение связи между микробами, диетой и здоровьем. ABC-CLIO. п. 58. ISBN 978-1-4408-4265-8.
- ^ Smiricky-Tjardes MR, Flickinger EA, Grieshop CM, Bauer LL, Murphy MR, Fahey GC (октябрь 2003 г.). «Характеристики ферментации выбранных олигосахаридов фекальной микрофлорой свиней in vitro». Журнал зоотехники. 81 (10): 2505–14. Дои:10,2527 / 2003,81102505x. PMID 14552378.
внешняя ссылка
 СМИ, связанные с Олигосахариды в Wikimedia Commons
СМИ, связанные с Олигосахариды в Wikimedia Commons
