Плутоний - Plutonium
 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Плутоний | ||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Произношение | /плuˈтoʊпяəм/ | |||||||||||||||||||||||||||||||||||||||||||||||
| Внешность | серебристо-белый, на воздухе тускнеющий до темно-серого | |||||||||||||||||||||||||||||||||||||||||||||||
| Массовое число | [244] | |||||||||||||||||||||||||||||||||||||||||||||||
| Плутоний в периодическая таблица | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Атомный номер (Z) | 94 | |||||||||||||||||||||||||||||||||||||||||||||||
| Группа | группа н / д | |||||||||||||||||||||||||||||||||||||||||||||||
| Период | период 7 | |||||||||||||||||||||||||||||||||||||||||||||||
| Блокировать | f-блок | |||||||||||||||||||||||||||||||||||||||||||||||
| Категория элемента | Актинид | |||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [Rn ] 5f6 7 с2 | |||||||||||||||||||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 18, 32, 24, 8, 2 | |||||||||||||||||||||||||||||||||||||||||||||||
| Физические свойства | ||||||||||||||||||||||||||||||||||||||||||||||||
| Фаза вSTP | твердый | |||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 912.5 K (639,4 ° С, 1182,9 ° F) | |||||||||||||||||||||||||||||||||||||||||||||||
| Точка кипения | 3505 К (3228 ° С, 5842 ° F) | |||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (возлеr.t.) | 19.85 (239Пу)[1] г / см3 | |||||||||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (приm.p.) | 16,63 г / см3 | |||||||||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 2.82 кДж / моль | |||||||||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 333,5 кДж / моль | |||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 35,5 Дж / (моль · К) | |||||||||||||||||||||||||||||||||||||||||||||||
Давление газа
| ||||||||||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | ||||||||||||||||||||||||||||||||||||||||||||||||
| Состояния окисления | +2, +3, +4, +5, +6, +7 (анамфотерный окись) | |||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 1,28 | |||||||||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
| |||||||||||||||||||||||||||||||||||||||||||||||
| Радиус атома | эмпирические: 159вечера | |||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 187 ± 13 часов | |||||||||||||||||||||||||||||||||||||||||||||||
| Другие свойства | ||||||||||||||||||||||||||||||||||||||||||||||||
| Естественное явление | от разложения | |||||||||||||||||||||||||||||||||||||||||||||||
| Кристальная структура | моноклинический | |||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука | 2260 РС | |||||||||||||||||||||||||||||||||||||||||||||||
| Тепловое расширение | 46,7 мкм / (м · К) (при 25 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 6,74 Вт / (м · К) | |||||||||||||||||||||||||||||||||||||||||||||||
| Удельное электрическое сопротивление | 1,460 мкОм · м (при 0 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||
| Магнитный заказ | парамагнитный | |||||||||||||||||||||||||||||||||||||||||||||||
| Модуль для младших | 96 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||
| Модуль сдвига | 43 ГПа | |||||||||||||||||||||||||||||||||||||||||||||||
| коэффициент Пуассона | 0.21 | |||||||||||||||||||||||||||||||||||||||||||||||
| Количество CAS | 7440-07-5 | |||||||||||||||||||||||||||||||||||||||||||||||
| История | ||||||||||||||||||||||||||||||||||||||||||||||||
| Именование | после карликовая планета Плутон, названный в честь классический бог подземного мира Плутон | |||||||||||||||||||||||||||||||||||||||||||||||
| Открытие | Гленн Т. Сиборг, Артур Валь, Джозеф В. Кеннеди, Эдвин Макмиллан (1940–1) | |||||||||||||||||||||||||||||||||||||||||||||||
| Главный изотопы плутония | ||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||
Плутоний это радиоактивный химический элемент с символ Пу и атомный номер 94. Это актинид металл серебристо-серого цвета, тускнеет при контакте с воздухом и образует тусклое покрытие при окисленный. Элемент обычно показывает шесть аллотропы и четыре состояния окисления. Он реагирует с углерод, галогены, азот, кремний, и водород. При контакте с влажным воздухом образует оксиды и гидриды которые могут расширить образец до 70% в объеме, который, в свою очередь, отслаивается в виде порошка, который пирофорный. Он радиоактивен и может накапливаться в кости, что делает опасным обращение с плутонием.
Плутоний был впервые произведен и выделен 14 декабря 1940 г. дейтрон бомбардировка уран-238 в 1,5 метра (60 дюймов) циклотрон на Калифорнийский университет в Беркли. Первый, нептуний-238 (период полураспада 2,1 сут), что впоследствии бета-распад сформировать новый элемент с атомным номером 94 и атомным весом 238 (период полураспада 88 лет). С уран был назван в честь планеты Уран и нептуний после планеты Нептун, элемент 94 назван в честь Плутон, который в то время тоже считался планетой. Секретность военного времени не позволяла команде Калифорнийского университета опубликовать свое открытие до 1948 года.
Плутоний - это элемент с наивысшим атомным номером, который встречается в природе. Следовые количества образуются в месторождениях природного урана-238, когда уран-238 захватывает нейтроны, испускаемые при распаде других атомов урана-238. Плутоний гораздо чаще встречается на Земле с 1945 года как продукт захват нейтронов и бета-распад, где некоторые из нейтроны выпущен деление процесс превращает ядра урана-238 в плутоний-239.





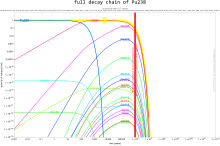

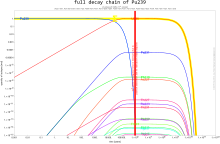






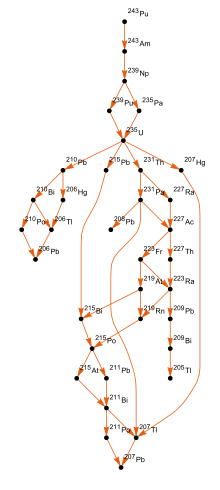
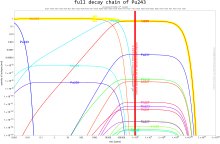



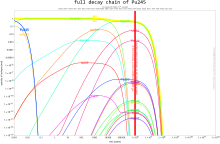


Количество изотопов в цепочках распада в определенный момент времени рассчитывается с помощью Уравнение Бейтмана.Обе плутоний-239 и плутоний-241 находятся делящийся, что означает, что они могут выдержать ядерная цепная реакция, что приводит к заявкам в ядерное оружие и ядерные реакторы. Плутоний-240 демонстрирует высокий уровень спонтанное деление, поднимая нейтронный поток любого образца, содержащего его. Присутствие плутония-240 ограничивает пригодность образца плутония для оружия или его качество в качестве реакторного топлива, а процент плутония-240 определяет его оценка (оружейный, топливного или реакторного). Плутоний-238 имеет период полураспада 87,7 лет и выделяет альфа-частицы. Это источник тепла в радиоизотопные термоэлектрические генераторы, которые используются для питания некоторых космический корабль. Изотопы плутония дороги и их неудобно разделять, поэтому определенные изотопы обычно производятся в специализированных реакторах.
Производство плутония в полезных количествах впервые было основной частью Манхэттенский проект в течение Вторая Мировая Война который разработал первые атомные бомбы. В Толстяк бомбы, использованные в Троица ядерное испытание в июле 1945 г., а в бомбардировка Нагасаки в августе 1945 г. был плутоний ядра. Человеческие радиационные эксперименты исследования плутония проводились без информированное согласие, и несколько аварии с критичностью Некоторые смертельные случаи произошли после войны. Утилизация плутониевые отходы из атомная электростанция и демонтированное ядерное оружие построен во время Холодная война это распространение ядерного оружия и забота об окружающей среде. Другие источники плутоний в окружающей среде находятся выпадать от многочисленных наземных ядерных испытаний, теперь запрещен.
Характеристики
Физические свойства
Плутоний, как и большинство металлов, сначала имеет ярко-серебристый цвет, очень похожий на никель, но это окисляет очень быстро становится тускло-серым, хотя также отмечаются желтый и оливково-зеленый.[2][3] При комнатной температуре плутоний находится в α (альфа) форма. Это наиболее распространенная структурная форма элемента (аллотроп ), примерно такой же твердый и хрупкий, как серый чугун если это не легированный с другими металлами, чтобы сделать его мягким и пластичным. В отличие от большинства металлов, он не является хорошим проводником высокая температура или же электричество. Имеет низкий температура плавления (640 ° C) и необычно высокой точка кипения (3228 ° С).[2]
Альфа-распад, высвобождение высокоэнергетического гелий ядро, является наиболее распространенной формой радиоактивный распад для плутония.[4] Масса 5 кг 239Pu содержит около 12.5×1024 атомы. При периоде полураспада 24 100 лет около 11.5×1012 его атомов распадаются каждую секунду, испуская 5,157МэВ альфа-частица. Это составляет 9,68 Вт мощности. Тепло, возникающее при замедлении этих альфа-частиц, делает его теплым на ощупь.[5][6]
Удельное сопротивление это мера того, насколько сильно материал противодействует потоку электрический ток. Удельное сопротивление плутония при комнатной температуре очень велико для металла и становится еще выше при более низких температурах, что необычно для металлов.[7] Эта тенденция продолжается до 100K, ниже которой сопротивление быстро уменьшается для свежих образцов.[7] Затем удельное сопротивление начинает увеличиваться со временем примерно при 20 К из-за радиационного повреждения со скоростью, определяемой изотопным составом образца.[7]
Из-за самооблучения образец плутония истощается по всей своей кристаллической структуре, что означает, что упорядоченное расположение его атомов со временем нарушается радиацией.[8] Самостоятельное облучение также может привести к отжиг который противодействует некоторым эффектам усталости при повышении температуры выше 100 К.[9]
В отличие от большинства материалов, плутоний увеличивает плотность при плавлении на 2,5%, но жидкий металл показывает линейное уменьшение плотности с температурой.[7] Вблизи точки плавления жидкий плутоний имеет очень высокую вязкость и поверхностное натяжение по сравнению с другими металлами.[8]
Аллотропы
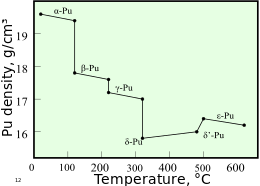
Плутоний обычно имеет шесть аллотропов и образует седьмой (дзета, ζ) при высокой температуре в ограниченном диапазоне давлений.[10] Эти аллотропы, которые представляют собой различные структурные модификации или формы элемента, имеют очень похожие внутренние энергии но значительно различаются плотности и кристаллические структуры. Это делает плутоний очень чувствительным к изменениям температуры, давления или химического состава и допускает резкие изменения объема после фазовые переходы от одной аллотропной формы к другой.[8] Плотность разных аллотропов варьируется от 16,00 г / см3 до 19,86 г / см3.[11]
Присутствие этого множества аллотропов очень затрудняет обработку плутония, так как он очень легко меняет состояние. Например, α-форма существует при комнатной температуре в нелегированном плутонии. Он имеет характеристики обработки, аналогичные чугун но меняется на пластичный и податливый β (бета) образуются при несколько более высоких температурах.[12] Причины сложной фазовой диаграммы до конца не выяснены. Форма α имеет низкую симметрию моноклинический структура, отсюда ее хрупкость, прочность, сжимаемость и плохая теплопроводность.[10]
Плутоний в δ (дельта) форма обычно существует в диапазоне от 310 ° C до 452 ° C, но устойчива при комнатной температуре, когда легирована небольшим процентным содержанием галлий, алюминий, или же церий, повышая работоспособность и позволяя сваренный.[12] Форма δ имеет более типичный металлический характер и примерно такая же прочная и пластичная, как алюминий.[10] В оружии деления взрывчатка ударные волны используемый для сжатия плутониевой активной зоны, также вызовет переход от обычного плутония в δ-фазе к более плотной α-форме, что значительно поможет достичь сверхкритичность.[13] Ε-фаза, твердый аллотроп с самой высокой температурой, демонстрирует аномально высокие атомные концентрации. самодиффузия по сравнению с другими элементами.[8]
Ядерное деление

Плутоний - радиоактивный актинид металл, чей изотоп, плутоний-239, является одним из трех основных делящийся изотопы (уран-233 и уран-235 два других); плутоний-241 также очень делящийся. Чтобы считаться делящимся, изотоп атомное ядро должен иметь возможность распадаться или деление при ударе медленный нейтрон и высвободить достаточно дополнительных нейтронов для поддержания ядерная цепная реакция путем расщепления дополнительных ядер.[14]
Чистый плутоний-239 может иметь коэффициент умножения (kэфф) больше единицы, что означает, что если металл присутствует в достаточном количестве и с соответствующей геометрией (например, сфера достаточного размера), он может образовывать критическая масса.[15] При делении часть энергия связи ядра, который удерживает ядро вместе, выделяется в виде большого количества электромагнитной и кинетической энергии (большая часть последней быстро преобразуется в тепловую энергию). При делении килограмма плутония-239 может произойти взрыв, эквивалентный 21000 единицам. тонн тротила (88,000 ГДж ). Именно эта энергия делает плутоний-239 полезным в ядерное оружие и реакторы.[5]
Наличие изотопа плутоний-240 в образце ограничивает его потенциал ядерной бомбы, так как плутоний-240 имеет относительно высокий спонтанное деление скорость (~ 440 делений в секунду на грамм - более 1000 нейтронов в секунду на грамм),[16] повышая фоновые уровни нейтронов и, таким образом, увеличивая риск преддонация.[17] Плутоний идентифицируется как оружейный, топливного качества или реакторного качества в зависимости от процентного содержания плутония-240, которое он содержит. Плутоний оружейного качества содержит менее 7% плутония-240. Топливный плутоний содержит от 7% до менее 19%, а энергетический реактор содержит 19% и более плутония-240. Сверхчистый плутоний, с содержанием плутония-240 менее 4%, используется в ВМС США оружие хранится в непосредственной близости от экипажей кораблей и подводных лодок из-за его более низкой радиоактивности.[18] Изотоп плутоний-238 не является делящийся, но может подвергаться ядерному делению легко с быстрые нейтроны а также альфа-распад.[5]
Изотопы и нуклеосинтез
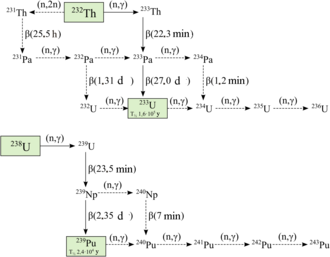
20 радиоактивные изотопы плутония. Самыми долгоживущими являются плутоний-244 с периодом полураспада 80,8 миллиона лет, плутоний-242 с периодом полураспада 373 300 лет и плутоний-239 с периодом полураспада 24 110 лет. Все оставшиеся радиоактивные изотопы имеют период полураспада менее 7000 лет. Этот элемент также имеет восемь метастабильные состояния, хотя все они имеют период полураспада менее одной секунды.[4]
Известные изотопы плутония варьируются в массовое число от 228 до 247. Основными видами распада изотопов с массовыми числами ниже, чем у наиболее стабильного изотопа плутония-244, являются спонтанное деление и альфа-излучение, в основном образующий уран (92 протоны ) и нептуний (93 протона) изотопов как продукты распада (пренебрегая широким кругом дочерних ядер, создаваемых процессами деления). Первичная мода распада для изотопов с массовыми числами выше плутония-244: бета-излучение, в основном формирующие америций (95 протонов) изотопов в качестве продуктов распада. Плутоний-241 - это родительский изотоп из серия распада нептуния, распадаясь на америций-241 через бета-излучение.[4][19]
Плутоний-238 и 239 - наиболее широко синтезируемые изотопы.[5] Плутоний-239 синтезируется посредством следующей реакции с использованием урана (U) и нейтронов (n) посредством бета-распада (β−) с нептунием (Np) в качестве промежуточного продукта:[20]
Нейтроны от деления урана-235 захвачен ядрами урана-238 с образованием урана-239; а бета-распад превращает нейтрон в протон с образованием нептуния-239 (период полураспада 2,36 дня), а другой бета-распад образует плутоний-239.[21] Эгон Бретчер работает на британском Трубные сплавы Проект предсказал эту реакцию теоретически в 1940 году.[22]
Плутоний-238 синтезируется путем бомбардировки урана-238 дейтроны (D, ядра тяжелых водород ) в следующей реакции:[23]
В этом процессе дейтрон, поражающий уран-238, производит два нейтрона и нептуний-238, который самопроизвольно распадается, испуская отрицательные бета-частицы, с образованием плутония-238.[24]
Теплота распада и свойства деления
Изотопы плутония подвергаются радиоактивному распаду, в результате чего образуется спад тепла. Различные изотопы выделяют разное количество тепла на массу. Теплота распада обычно указывается в ватт / килограмм или милливатт / грамм. В более крупных кусках плутония (например, в оружейной яме) и при недостаточном отводе тепла результирующий самонагревание может быть значительным.
| Изотоп | Режим распада | Период полураспада (годы) | Спад тепла (Вт / кг) | Самопроизвольное деление нейтроны (1 / (г · с)) | Комментарий |
|---|---|---|---|---|---|
| 238Пу | альфа к 234U | 87.74 | 560 | 2600 | Очень высокая температура распада. Даже в небольших количествах может вызвать значительное самонагревание. Самостоятельно используется в радиоизотопные термоэлектрические генераторы. |
| 239Пу | альфа к 235U | 24100 | 1.9 | 0.022 | Основной используемый делящийся изотоп. |
| 240Пу | альфа к 236U, спонтанное деление | 6560 | 6.8 | 910 | Основная примесь в образцах 239Изотоп Pu. Содержание плутония обычно указывается в процентах от 240Пу. Высокая степень самопроизвольного деления препятствует использованию ядерного оружия. |
| 241Пу | бета-минус, чтобы 241Являюсь | 14.4 | 4.2 | 0.049 | Разлагается до америция-241; его накопление представляет радиационную опасность в старых образцах. |
| 242Пу | альфа к 238U | 376000 | 0.1 | 1700 | 242Пу распадается на 238U через альфа-распад; будет также распадаться спонтанным делением. |
Соединения и химия

При комнатной температуре чистый плутоний имеет серебристый цвет, но при окислении становится тусклым.[26] Элемент отображает четыре обычных ионных состояния окисления в водный раствор и один редкий:[11]
- Pu (III), как Pu3+ (голубая лаванда)
- Pu (IV), как Pu4+ (желто-коричневый)
- Pu (V), как PuO+
2 (светло-розовый)[примечание 1] - Pu (VI), как PuO2+
2 (розовый оранжевый) - Pu (VII), как PuO3−
5 (зеленый) - семивалентный ион встречается редко.
Цвет, который показывают растворы плутония, зависит как от степени окисления, так и от природы кислоты. анион.[28] Именно кислотный анион влияет на степень комплексирование - как атомы соединяются с центральным атомом - разновидностей плутония. Кроме того, формальная степень окисления плутония +2 известна в комплексе [K (2.2.2-криптанд)] [PuIICp ″3], Cp ″ = C5ЧАС3(SiMe3)2.[29]
Металлический плутоний производится путем реакции тетрафторид плутония с барий, кальций или же литий при 1200 ° С.[30] На него напали кислоты, кислород, и пара, но не щелочи и легко растворяется в концентрированных соляной, гидроиодный и хлорная кислота.[31] Расплавленный металл необходимо хранить в вакуум или инертная атмосфера избегать реакции с воздухом.[12] При 135 ° C металл воспламеняется на воздухе и взрывается, если его поместить в четыреххлористый углерод.[32]

Плутоний - химически активный металл. На влажном воздухе или во влажном аргон, металл быстро окисляется, образуя смесь оксиды и гидриды.[2] Если металл подвергается достаточно длительному воздействию ограниченного количества водяного пара, порошковое покрытие поверхности из PuO2 сформирован.[2] Также сформирован гидрид плутония но при избытке водяного пара образуется только PuO2.[31]
Плутоний демонстрирует огромные и обратимые скорости реакции с чистым водородом, образуя гидрид плутония.[8] Он также легко реагирует с кислородом, образуя PuO и PuO.2 а также промежуточные оксиды; Оксид плутония заполняет на 40% больше объема, чем металлический плутоний. Металл реагирует с галогены, порождая соединения с общей формулой PuX3 где X может быть F, Cl, Br или I и PuF4 тоже видно. Наблюдаются следующие оксигалогениды: PuOCl, PuOBr и PuOI. Он будет реагировать с углеродом с образованием PuC, азотом с образованием PuN и кремний сформировать ПуСи2.[11][32]
Порошки плутония, его гидридов и некоторых оксидов, таких как Pu2О3находятся пирофорный, что означает, что они могут самовоспламеняться при температуре окружающей среды, и поэтому с ними обращаются в инертной сухой атмосфере азота или аргона. Объемный плутоний воспламеняется только при нагревании выше 400 ° C. Пу2О3 самопроизвольно нагревается и превращается в PuO2, который устойчив в сухом воздухе, но при нагревании реагирует с водяным паром.[33]
Тигли использовались для содержания плутония, необходимо выдерживать его сильную сокращение характеристики. Тугоплавкие металлы Такие как тантал и вольфрам вместе с более стабильными оксидами, бориды, карбиды, нитриды и силициды может терпеть это. Таяние в электродуговая печь можно использовать для производства небольших слитков металла без тигля.[12]
Церий используется как химический имитатор плутония для разработки технологий локализации, извлечения и других технологий.[34]
Электронная структура
Плутоний - это элемент, в котором 5f электроны являются переходной границей между делокализованным и локализованным; поэтому он считается одним из самых сложных элементов.[35] Аномальное поведение плутония вызвано его электронной структурой. Разница в энергии между подоболочками 6d и 5f очень мала. Размер оболочки 5f достаточно, чтобы позволить электронам образовывать связи внутри решетки, на самой границе между локализованным и связывающим поведением. Близость энергетических уровней приводит к множеству низкоэнергетических электронных конфигураций с почти равными энергетическими уровнями. Это приводит к конкуренции 5fп7 с2 и 5fп-16d17 с2 конфигурации, что обуславливает сложность его химического поведения. Высоконаправленная природа 5f-орбиталей отвечает за направленные ковалентные связи в молекулах и комплексах плутония.[8]
Сплавы
Плутоний может образовывать сплавы и промежуточные соединения с большинством других металлов. Исключения включают литий, натрий, калий, рубидий и цезий из щелочных металлов; и магний, кальций, стронций, и барий щелочноземельные металлы; и европий и иттербий из редкоземельные металлы.[31] Частичное исключение составляют тугоплавкие металлы. хром, молибден, ниобий, тантал и вольфрам, которые растворимы в жидком плутонии, но нерастворимы или слабо растворимы в твердом плутонии.[31] Галлий, алюминий, америций, скандий а церий может стабилизировать δ-фазу плутония при комнатной температуре. Кремний, индий, цинк и цирконий допускают образование метастабильного δ-состояния при быстром охлаждении. Большое количество гафний, гольмий и таллий также позволяет некоторое удерживание δ-фазы при комнатной температуре. Нептуний - единственный элемент, который может стабилизировать α-фазу при более высоких температурах.[8]
Сплавы плутония можно производить, добавляя металл к расплавленному плутонию. Если легирующий металл является достаточно восстановительным, плутоний можно добавлять в форме оксидов или галогенидов. Сплавы плутоний-галлий с δ-фазой и плутоний-алюминиевые сплавы производятся путем добавления фторида плутония (III) к расплавленному галлию или алюминию, что позволяет избежать непосредственного контакта с высокореакционным металлическим плутонием.[36]
- Плутоний-галлий используется для стабилизации δ-фазы плутония, избегая проблем, связанных с α-фазой и α – δ. Его основное применение - в ямы из взрывное ядерное оружие.[37]
- Плутоний-алюминий является альтернативой сплаву Pu – Ga.Это был исходный элемент, который рассматривался для стабилизации δ-фазы, но его способность реагировать с альфа-частицами и выделять нейтроны снижает его пригодность для ям для ядерного оружия. Сплав плутоний – алюминиевый также может использоваться в качестве компонента ядерное топливо.[38]
- Плутоний – галлий – кобальт сплав (PuCoGa5) является нетрадиционный сверхпроводник, показывающий сверхпроводимость ниже 18,5 К, что на порядок выше, чем самый высокий между тяжелый фермион систем и имеет большой критический ток.[35][39]
- Плутоний-цирконий сплав можно использовать как ядерное топливо.[40]
- Плутоний-церий и плутоний-церий-кобальт сплавы используются в качестве ядерного топлива.[41]
- Плутоний-урановыйс содержанием плутония около 15–30 мол.%, может использоваться в качестве ядерного топлива для реакторов на быстрых нейтронах. Его пирофорный природа и высокая подверженность коррозии вплоть до самовоспламенения или разложения после воздействия воздуха требуют легирования с другими компонентами. Добавление алюминия, углерода или меди не приводит к заметному улучшению скорости разложения, сплавы циркония и железа имеют лучшую коррозионную стойкость, но они также распадаются в течение нескольких месяцев на воздухе. Добавление титана и / или циркония значительно увеличивает температуру плавления сплава.[42]
- Плутоний – уран – титан и плутоний – уран – цирконий были исследованы на предмет использования в качестве ядерного топлива. Добавление третьего элемента увеличивает коррозионную стойкость, снижает воспламеняемость и улучшает пластичность, технологичность, прочность и тепловое расширение. Плутоний – уран – молибден имеет лучшую коррозионную стойкость, образуя защитную пленку из оксидов, но титан и цирконий предпочтительнее по физическим причинам.[42]
- Торий – уран – плутоний исследовали как ядерное топливо для реакторов на быстрых нейтронах.[42]
Вхождение

Следы плутония-238, плутония-239, плутония-240 и плутония-244 могут быть обнаружены в природе. Небольшие следы плутония-239, несколько частей на триллион, а продукты его распада естественным образом содержатся в некоторых концентрированных рудах урана,[43] такой как естественный ядерный реактор деления в Окло, Габон.[44] Отношение плутония-239 к урану на Сигарное озеро месторождение урана колеблется от 2.4×10−12 к 44×10−12.[45] Эти следовые количества 239Пу происходят следующим образом: в редких случаях 238U подвергается самопроизвольному делению, и при этом ядро испускает один или два свободных нейтрона с некоторой кинетической энергией. Когда один из этих нейтронов попадает в ядро другого 238Атом U, он поглощается атомом, который становится 239U. Имея относительно короткий период полураспада, 239U распадается на 239Np, распадающийся на 239Пу.[46][47] Наконец, чрезвычайно малые количества плутония-238, относящиеся к чрезвычайно редким двойной бета-распад урана-238, обнаружены в пробах природного урана.[48]
Из-за относительно длительного периода полураспада, составляющего около 80 миллионов лет, было высказано предположение, что плутоний-244 происходит естественно как первичный нуклид, но ранние сообщения о его обнаружении не подтвердились.[49] Однако его длительный период полураспада обеспечил его циркуляцию по Солнечной системе до того, как он вымирание,[50] и действительно, свидетельства спонтанного деления вымерших 244Pu был обнаружен в метеоритах.[51] Прежнее присутствие 244Подтверждено наличие Pu в ранней Солнечной системе, так как сегодня он проявляется как избыток его дочерей, либо 232Чт (от пути альфа-распада) или ксенон изотопов (из спонтанное деление ). Последние, как правило, более полезны, потому что химический состав тория и плутония довольно схож (оба являются преимущественно четырехвалентными), и, следовательно, избыток тория не может быть убедительным доказательством того, что часть его образовалась в виде дочернего плутония.[52] 244Pu имеет самый продолжительный период полураспада из всех трансурановых нуклидов и производится только в r-процесс в сверхновые и столкновение нейтронные звезды; когда ядра выбрасываются из этих событий с высокой скоростью, чтобы достичь Земли, 244Один только Pu среди трансурановых нуклидов имеет достаточно длительный период полураспада, чтобы пережить путешествие, и, следовательно, крошечные следы живых межзвездных 244Пу был обнаружен в глубоком морском дне. Потому что 240Pu также встречается в цепочка распада из 244Pu, таким образом, он также должен присутствовать в светское равновесие, хотя и в еще меньших количествах.[53]
Мельчайшие следы плутония обычно обнаруживаются в организме человека из-за 550 атмосферных и подводных ядерные испытания которые были выполнены, и небольшому количеству крупных ядерные аварии. Большинство атмосферных и подводных ядерных испытаний было остановлено Договор об ограниченном запрещении испытаний в 1963 г., который был подписан и ратифицирован США, Соединенным Королевством, Советский союз, и другие народы. Продолжающиеся испытания ядерного оружия в атмосфере с 1963 года странами, не подписавшими договор, в том числе Китай (Атомная бомба тест выше пустыня Гоби в 1964 г., водородная бомба испытание в 1967 г. и последующие испытания) и во Франции (испытания проводились совсем недавно, в 1990-х годах). Поскольку плутоний-239 преднамеренно производится для ядерного оружия и ядерных реакторов, он является наиболее распространенным изотопом плутония.[32]
История
Открытие
Энрико Ферми и группа ученых из Римский университет сообщили, что они открыли элемент 94 в 1934 году.[54] Ферми назвал элемент гесперий и упомянул об этом в своей Нобелевской лекции в 1938 году.[55] На самом деле образец представлял собой смесь бария, криптон, и другие элементы, но в то время об этом не было известно.[56] Ядерное деление был открыт в Германии в 1938 году Отто Хан и Фриц Штрассманн. Затем механизм деления был теоретически объяснен Лиз Мейтнер и Отто Фриш.[57]

Плутоний (в частности, плутоний-238) был сначала произведен, выделен и затем химически идентифицирован в период с декабря 1940 г. по февраль 1941 г. Гленн Т. Сиборг, Эдвин Макмиллан, Эмилио Сегре, Джозеф В. Кеннеди, и Артур Валь бомбардировкой урана дейтронами в 60-дюймовом (150 см) циклотрон на Радиационная лаборатория Беркли на Калифорнийский университет в Беркли.[58][59][60]Нептуний-238 был создан непосредственно в результате бомбардировки, но распался под действием бета-излучения с периодом полураспада немногим более двух дней, что указывает на образование элемента 94.[32]
Документ, документирующий открытие, был подготовлен командой и отправлен в журнал. Физический обзор в марте 1941 г.,[32] но публикация была отложена до года после окончания Вторая Мировая Война из соображений безопасности.[61] На Кавендишская лаборатория в Кембридж, Эгон Бретчер и Норман Перо понял, что реактор на медленных нейтронах, работающий на урановом топливе, теоретически будет производить значительное количество плутония-239 в качестве побочного продукта. Они подсчитали, что элемент 94 будет делящимся и имеет дополнительное преимущество в том, что он химически отличается от урана и может быть легко отделен от него.[22]
Макмиллан недавно назвал первый трансурановый элемент нептуний в честь планеты. Нептун, и предложил назвать элемент 94, являющийся следующим элементом в серии, в честь того, что тогда считалось следующей планетой, Плутон.[5][заметка 2] Николас Кеммер из Кембриджа независимо предложили то же название, основываясь на тех же аргументах, что и команда Беркли.[22] Первоначально Сиборг считал название «плутоний», но позже подумал, что оно звучит не так хорошо, как «плутоний».[63] Он выбрал буквы «Пу» в качестве шутки в отношении междометия «P U», чтобы указать на особенно отвратительный запах, который незаметно перешел в периодическую таблицу.[заметка 3] Альтернативные названия, рассматриваемые Сиборгом и другими, были "ultimium" или "extremium" из-за ошибочного убеждения, что они нашли последнее возможное элемент на периодическая таблица.[65]
Раннее исследование

Было обнаружено, что химический состав плутония похож на уран после нескольких месяцев первоначальных исследований.[32] Ранние исследования были продолжены в секрете Металлургическая лаборатория из Чикагский университет. 20 августа 1942 г. было впервые выделено и измерено следовое количество этого элемента. Было произведено около 50 микрограммов плутония-239 в сочетании с ураном и продуктами деления, и было выделено только около 1 микрограмма.[43][66] Эта процедура позволила химикам определить атомный вес нового элемента.[67][примечание 4] 2 декабря 1942 года на площадке для игры в ракетки под западной трибуной в Stagg Field Чикагского университета исследователи во главе с Энрико Ферми достигла первой самоподдерживающейся цепной реакции в котле из графита и урана, известной как CP-1. Используя теоретическую информацию, полученную при эксплуатации CP-1, DuPont построила экспериментальный производственный реактор с воздушным охлаждением, известный как X-10, и пилотная установка химического разделения в Ок-Ридже. Установка для разделения с использованием методов, разработанных Гленном Т. Сиборгом и группой исследователей из Met Lab, удалила плутоний из урана, облученного в реакторе X-10. Информация с CP-1 была также полезна для ученых Met Lab, проектирующих реакторы для производства плутония с водяным охлаждением для Хэнфорда. Строительство на месте началось в середине 1943 года.[68]
В ноябре 1943 г. трифторид плутония был уменьшен, чтобы создать первый образец металлического плутония: несколько микрограммов металлических шариков.[43] Было произведено достаточно плутония, чтобы сделать его первым синтетическим элементом, видимым невооруженным глазом.[69]
Также были изучены ядерные свойства плутония-239; исследователи обнаружили, что когда в него попадает нейтрон, он распадается (делится), высвобождая больше нейтронов и энергии. Эти нейтроны могут поражать другие атомы плутония-239 и т.д. в результате экспоненциально быстрой цепной реакции. Это может привести к взрыву, достаточно мощному, чтобы разрушить город, если изотопа сконцентрируется достаточно, чтобы сформировать критическая масса.[32]
На ранних этапах исследований животных использовали для изучения воздействия радиоактивных веществ на здоровье. Эти исследования начались в 1944 году в Радиационной лаборатории Калифорнийского университета в Беркли и проводились Джозефом Г. Гамильтоном. Гамильтон хотел ответить на вопросы о том, как плутоний будет варьироваться в организме в зависимости от режима воздействия (пероральный прием, вдыхание, абсорбция через кожу), степени удерживания и того, как плутоний будет фиксироваться в тканях и распределяться между различными органами. Гамильтон начал вводить крысам растворимые порции плутония-239 в дозах микрограмм, используя различные валентные состояния и различные методы введения плутония (перорально, внутривенно и т. Д.). В конце концов, лаборатория в Чикаго также провела собственные эксперименты с инъекциями плутония с использованием различных животных, таких как мыши, кролики, рыбы и даже собаки. Результаты исследований в Беркли и Чикаго показали, что физиологическое поведение плутония значительно отличается от поведения радия. Наиболее тревожным результатом было то, что в печени и в «активно метаболизирующейся» части кости произошло значительное отложение плутония. Кроме того, скорость выведения плутония с экскрементами различалась между видами животных в пять раз. Из-за такого разброса было чрезвычайно сложно оценить, какой будет уровень для людей.[70]
Производство во время Манхэттенского проекта
Во время Второй мировой войны правительство США учредило Манхэттенский проект, которому было поручено разработать атомную бомбу. Тремя основными исследовательскими и производственными объектами проекта были заводы по производству плутония на том месте, где сейчас находится Хэнфорд сайт, то обогащение урана объекты на Ок-Ридж, Теннесси, и лаборатория исследования и разработки оружия, ныне известная как Лос-Аламосская национальная лаборатория.[71]


Первым промышленным реактором, производившим плутоний-239, был Графитовый реактор X-10. Он был запущен в 1943 году и был построен на заводе в Ок-Ридже, который позже стал Национальная лаборатория Окриджа.[32][примечание 5]
В январе 1944 года рабочие заложили фундамент первого здания химического разделения, завода Т, расположенного в 200-Западном. К октябрю были завершены строительство завода T и его дочернего предприятия в 200-West, U Plant. (Завод U использовался только для обучения во время Манхэттенского проекта.) Разделительное здание в 200-Ист, завод B было завершено в феврале 1945 года. Второй объект, запланированный для 200-Востока, был отменен. Строившие их рабочие, получившие прозвище «Королева Мэри», представляли собой потрясающие сооружения, похожие на каньон, длиной 800 футов, шириной 65 футов и высотой 80 футов, в которых находилось 40 технологических бассейнов. Внутреннее пространство выглядело жутковато, поскольку операторы за семифутовым бетонным экраном управляли оборудованием дистанционного управления, просматривая телевизионные мониторы и перископы из верхней галереи. Даже с массивными бетонными крышками технологических бассейнов, меры предосторожности против радиационного облучения были необходимы и повлияли на все аспекты проектирования завода.[68]
5 апреля 1944 г. Эмилио Сегре в Лос-Аламосе был получен первый образец плутония, произведенного в реакторе из Ок-Риджа.[73] В течение десяти дней он обнаружил, что плутоний, полученный в реакторе, имеет более высокую концентрацию изотопа плутония-240, чем плутоний, произведенный на циклотроне. Плутоний-240 имеет высокую скорость спонтанного деления, что увеличивает общий фоновый уровень нейтронов в образце плутония.[74] Оригинал пушечный плутониевое оружие под кодовым названием "Тонкий человек ", пришлось отказаться в результате - увеличенное количество спонтанных нейтронов означало, что ядерная предварительная детонация (шипеть ) было вероятно.[75]
Вся работа по проектированию плутониевого оружия в Лос-Аламосе вскоре была изменена на более сложное взрывное устройство под кодовым названием "Толстяк ". С помощью имплозивного оружия плутоний сжимается до высокой плотности с взрывные линзы - технически более сложная задача, чем простая конструкция типа пушки, но она необходима для использования плутония в оружейных целях. Обогащенный уран, напротив, может использоваться с любым методом.[75]
Строительство Хэнфорда Реактор B Первый ядерный реактор промышленного размера для производства материалов был завершен в марте 1945 года. Реактор B производил делящийся материал для плутониевого оружия, использовавшегося во время Второй мировой войны.[примечание 6] B, D и F были первоначальными реакторами, построенными в Хэнфорде, а шесть дополнительных реакторов, производящих плутоний, были построены позже на этом объекте.[78]
К концу января 1945 года высокоочищенный плутоний подвергся дальнейшей концентрации в завершенном здании химической изоляции, где оставшиеся примеси были успешно удалены. Лос-Аламос получил свой первый плутоний из Хэнфорда 2 февраля. Хотя до конца войны еще не было ясно, может ли быть произведено достаточно плутония для использования в бомбах, Хэнфорд к началу 1945 года уже был в эксплуатации. Прошло всего два года с тех пор, как полковник Франклин Матиас сначала основал свою временную штаб-квартиру на берегу реки Колумбия.[68]
В соответствии с Кейт Браун, заводы по производству плутония в Хэнфорде и Маяк в России в течение четырех десятилетий "оба выбросили в окружающую среду более 200 миллионов кюри радиоактивных изотопов - вдвое больше, чем выбросили в атмосферу. Чернобыльская катастрофа в каждом случае ".[79] Большая часть этого радиоактивное загрязнение на протяжении многих лет происходили обычные операции, но непредвиденные аварии все же происходили, и руководство завода держало этот секрет в секрете, поскольку загрязнение не ослабевает.[79]
В 2004 г. сейф был обнаружен при раскопках могильной траншеи в г. Хэнфордский ядерный объект. Внутри сейфа находились различные предметы, в том числе большая стеклянная бутылка с беловатой жидкостью, которая впоследствии была идентифицирована как самый старый из известных существующих образцов оружейного плутония. Изотопный анализ Тихоокеанская Северо-Западная национальная лаборатория указывает, что плутоний в баллоне был произведен в графитовом реакторе X-10 в Ок-Ридже в 1944 году.[80][81][82]
Атомные бомбы Trinity и Fat Man
Первое испытание атомной бомбы под кодовым названием "Троица" и взорвался 16 июля 1945 г. Аламогордо, Нью-Мексико, использовала плутоний в качестве делящегося материала.[43] Имплозивная конструкция "гаджет ", как было кодовое название устройства" Тринити ", использовали обычные взрывные линзы для сжатия сферы плутония до сверхкритической массы, которая одновременно подвергалась осыпанию нейтронами из «Еж», инициатор из полоний и бериллий (источник нейтронов: (α, n) реакция ).[32] Вместе это обеспечило безудержную цепную реакцию и взрыв. Общее оружие весило более 4 тонны, хотя в его активной зоне использовалось всего 6,2 кг плутония.[83] Около 20% плутония, используемого в оружии Тринити, подверглось делению, что привело к взрыву с энергией, эквивалентной примерно 20 000 тонн в тротиловом эквиваленте.[84][примечание 7]
Аналогичная конструкция использовалась в атомной бомбе «Толстяк», сброшенной на Нагасаки, Япония 9 августа 1945 года, в результате чего погибло 35 000–40 000 человек и было уничтожено 68–80% военной продукции в Нагасаки.[86] Только после объявления о первых атомных бомбах существование и название плутония стало известно общественности от Манхэттенского проекта. Смит отчет.[87]
Использование и отходы холодной войны
Большие запасы оружейный плутоний были созданы как Советским Союзом, так и Соединенными Штатами во время Холодная война. Американские реакторы в Хэнфорде и Сайт реки Саванна в Южной Каролине произведено 103 тонны,[88] и примерно 170 тонн плутония военного назначения было произведено в СССР.[89][примечание 8] Каждый год около 20 тонн этого элемента все еще производится как побочный продукт атомная энергия промышленность.[11] В хранилище может находиться до 1000 тонн плутония, причем более 200 тонн либо внутри, либо извлечены из ядерного оружия.[32]СИПРИ оценил мировой плутоний складировать в 2007 г. - около 500 тонн, поровну разделенных между оружейными и гражданскими запасами.[91]
Радиоактивное загрязнение на Завод Скалистых Квартир в первую очередь в результате двух крупных пожаров плутония в 1957 и 1969 годах. В течение всего срока эксплуатации станции с 1952 по 1992 год были выброшены гораздо более низкие концентрации радиоактивных изотопов. Преобладающие ветры от станции разносили воздушное загрязнение на юг и восток, в населенные пункты к северо-западу от Денвера. . О загрязнении района Денвера плутонием от пожаров и других источников не сообщалось публично до 1970-х годов. Согласно исследованию 1972 года, в соавторстве с Эдвард Мартелл «В более густонаселенных районах Денвера уровень загрязнения плутонием в поверхностных почвах в несколько раз превышает уровень радиоактивных осадков», а загрязнение плутонием «к востоку от завода в Рокки-Флэтс в сотни раз больше, чем в результате ядерных испытаний».[92] Как отмечает Карл Джонсон в Ambio, «Воздействие плутония и других радионуклидов в выхлопных газах завода на большую часть населения в районе Денвера датируется 1953 годом».[93] Производство оружия на заводе Rocky Flats было остановлено после комбинированного ФБР и EPA рейд 1989 года и годы протестов. С тех пор завод был остановлен, а его здания снесены и полностью удалены с территории.[94]
В США часть плутония, извлеченного из демонтированного ядерного оружия, переплавляют для образования стеклянных бревен. оксид плутония которые весят две тонны.[32] Стекло изготовлено из боросиликаты смешанный с кадмий и гадолиний.[примечание 9] Эти журналы планируется заключить в нержавеющая сталь и хранится на глубине 4 км (2 мили) под землей в скважинах, которые будут засыпаны конкретный.[32] США планировали таким образом хранить плутоний в Хранилище ядерных отходов Юкка-Маунтин, что примерно в 100 милях (160 км) к северо-востоку от Лас Вегас, Невада.[95]
5 марта 2009 г. Министр энергетики Стивен Чу заявил на слушаниях в Сенате, что «территория Юкка-Маунтин больше не рассматривалась как вариант для хранения отходов реактора».[96] Начиная с 1999 г., ядерные отходы военного назначения захоронены в Опытная установка по изоляции отходов в Нью-Мексико.
Президентским меморандумом от 29 января 2010 г. президент Обама учредил Комиссия Голубой ленты по ядерному будущему Америки.[97] В своем заключительном отчете Комиссия выдвинула рекомендации по разработке комплексной стратегии, которую необходимо реализовать, включая:[98]
- «Рекомендация № 1: Соединенным Штатам следует предпринять комплексную программу обращения с ядерными отходами, которая приведет к своевременному развитию одной или нескольких постоянных глубинных геологических установок для безопасного захоронения отработавшего топлива и высокоактивных ядерных отходов».[98]
Медицинские эксперименты
Во время и после окончания Второй мировой войны ученые, работавшие над Манхэттенским проектом и другими исследовательскими проектами в области ядерного оружия, проводили исследования воздействия плутония на лабораторных животных и людей.[99] Исследования на животных показали, что несколько миллиграммов плутония на килограмм ткани - смертельная доза.[100]
В случае с людьми это включало инъекцию растворов, содержащих (обычно) пять микрограммов плутония, больничным пациентам, которые, как считается, либо неизлечимо больны, либо имеют ожидаемую продолжительность жизни менее десяти лет либо из-за возраста, либо из-за хронического заболевания.[99] Это количество было уменьшено до одного микрограмма в июле 1945 года после того, как исследования на животных показали, что способ распределения плутония в костях был более опасным, чем радий.[100] Большинство предметов, Эйлин Уэлсом говорит, были бедны, бессильны и больны.[101]
С 1945 по 1947 год восемнадцати испытуемым-людям вводили плутоний без информированное согласие. Тесты использовались для создания диагностических инструментов для определения поглощения плутония организмом с целью разработки стандартов безопасности при работе с плутонием.[99] Ebb Cade был невольным участником медицинских экспериментов, включавших инъекцию 4,7 мкг плутония 10 апреля 1945 г. Ок-Ридж, Теннесси.[102][103] Этот эксперимент проводился под наблюдением Гарольд Ходж.[104] Другие эксперименты под руководством Комиссия по атомной энергии США а Манхэттенский проект продолжался до 1970-х годов. Файлы плутония ведет хронику жизни участников секретной программы, называя каждого участника и обсуждая этические и медицинские исследования, тайно проводимые учеными и врачами. Этот эпизод теперь считается серьезным нарушением медицинская этика и из Клятва Гиппократа.[105]
Правительство скрыло большую часть этих радиационных неудач до 1993 года, когда президент Билл Клинтон приказал изменить политику, и федеральные агентства предоставили соответствующие записи. Получившееся расследование было предпринято президентом. Консультативный комитет по радиационным экспериментам на людях, и он раскрыл большую часть материала об исследованиях плутония на людях. Комитет опубликовал противоречивый отчет за 1995 год, в котором говорилось, что «были совершены злодеяния», но не осуждал тех, кто их совершил.[101]
Приложения
Взрывчатые вещества

Изотоп плутоний-239 является ключевым делящимся компонентом ядерного оружия из-за легкости деления и доступности. Заключение бомбы плутониевый карьер в вмешиваться (дополнительный слой плотного материала) уменьшает количество плутония, необходимое для достижения критическая масса к отражение убегающих нейтронов обратно в плутониевую активную зону. Это уменьшает количество плутония, необходимое для достижения критичности, с 16 кг до 10 кг, что представляет собой сферу диаметром около 10 сантиметров (4 дюйма).[106] Эта критическая масса составляет около трети от критической массы урана-235.[5]
Плутониевые бомбы Fat Man использовали взрывное сжатие плутония для получения значительно более высоких плотностей, чем обычно, в сочетании с центральным источником нейтронов, чтобы начать реакцию и повысить эффективность. Таким образом, только 6,2 кг плутония требовалось для взрывной выход эквивалент 20 килотонн в тротиловом эквиваленте.[84][107] Гипотетически всего 4 кг плутония - а может быть, даже меньше - можно было бы использовать для создания единой атомной бомбы с использованием очень сложных конструкций сборки.[107]
Смешанное оксидное топливо
Отработавшее ядерное топливо от нормального легководные реакторы содержит плутоний, но представляет собой смесь плутоний-242, 240, 239 и 238. Смесь недостаточно обогащена для эффективного ядерного оружия, но может быть использована один раз в качестве МОКС-топливо.[108] Случайный захват нейтронов вызывает рост количества плутония-242 и 240 каждый раз, когда плутоний облучается в реакторе низкоскоростными «тепловыми» нейтронами, так что после второго цикла плутоний может потребляться только реакторы на быстрых нейтронах. Если реакторы на быстрых нейтронах недоступны (нормальный случай), избыточный плутоний обычно выбрасывается и образует один из самых долгоживущих компонентов ядерных отходов. Желание потреблять этот плутоний и другие трансурановый топливо и снижение радиотоксичности отходов - это обычная причина, по которой инженеры-ядерщики создают реакторы на быстрых нейтронах.[109]
Самый распространенный химический процесс, PUREX (плутонийURAnium БЫВШИЙтяга) переработка отработанное ядерное топливо для извлечения плутония и урана, которое может быть использовано для образования смешанного оксидного топлива (МОКС) для повторного использования в ядерных реакторах. В топливную смесь можно добавлять оружейный плутоний. МОКС-топливо используется в легководные реакторы и состоит из 60 кг плутония на тонну топлива; через четыре года три четверти плутония сжигается (превращается в другие элементы).[32] Реакторы-размножители специально разработаны для создания большего количества расщепляющегося материала, чем они потребляют.[110]
МОКС-топливо используется с 1980-х годов и широко используется в Европе.[108] В сентябре 2000 г. США и Российская Федерация подписал Соглашение об обращении с плутонием и его утилизации каждый согласился утилизировать 34 тонны оружейного плутония.[111] В Министерство энергетики США планирует утилизировать 34 тонны оружейного плутония в Соединенных Штатах до конца 2019 года путем преобразования плутония в МОКС-топливо, которое будет использоваться в коммерческих ядерных энергетических реакторах.[111]
МОКС-топливо улучшает полное выгорание. После трех лет использования топливный стержень перерабатывается для удаления отходов, которые к тому времени составляют 3% от общего веса стержней.[32] Любые изотопы урана или плутония, произведенные в течение этих трех лет, остаются, а стержень возвращается в производство.[примечание 10] Наличие до 1% галлия на массу в оружейном плутониевый сплав потенциально может помешать длительной эксплуатации легководного реактора.[112]
Плутоний, извлеченный из отработавшего реакторного топлива, представляет небольшую опасность распространения из-за чрезмерного загрязнения неделящимся плутонием-240 и плутонием-242. Разделение изотопов невозможно. Специальный реактор, работающий на очень низком сжечь (следовательно, минимальное воздействие на новообразованный плутоний-239 дополнительных нейтронов, которое вызывает его преобразование в более тяжелые изотопы плутония) обычно требуется для производства материала, пригодного для использования в эффективных ядерное оружие. В то время как плутоний "оружейного качества" определяется как содержащий не менее 92% плутония-239 (от общего количества плутония), Соединенным Штатам удалось взорвать устройство до 20Кт с использованием плутония, который, как считается, содержит только около 85% плутония-239, так называемого «топливного» плутония.[113] Плутоний «реакторного качества», производимый с помощью обычного цикла выгорания LWR, обычно содержит менее 60% Pu-239, до 30% паразитного Pu-240 / Pu-242 и 10–15% делящегося Pu-241.[113] Неизвестно, можно ли взорвать устройство, использующее плутоний, полученный из переработанных ядерных отходов гражданского назначения, однако такое устройство может гипотетически взорваться и распространить радиоактивные материалы по большой городской территории. В МАГАТЭ консервативно классифицирует плутоний всех изотопных векторов как материал «прямого использования», то есть «ядерный материал, который может быть использован для производства компонентов ядерных взрывчатых веществ без трансмутации или дальнейшего обогащения».[113]
Источник энергии и тепла


Период полураспада изотопа плутоний-238 составляет 87,74 года.[114] Он испускает большое количество тепловая энергия с низким уровнем обоих гамма излучение /фотоны и спонтанные нейтронные лучи / частицы.[115] Являясь альфа-излучателем, он сочетает в себе излучение высокой энергии с низким проникновением и поэтому требует минимального экранирования. Лист бумаги можно использовать для защиты от альфа-частиц, испускаемых плутонием-238. Один килограмм изотопа может генерировать около 570 Вт тепла.[5][115]
Эти характеристики делают его хорошо подходящим для выработки электроэнергии для устройств, которые должны работать без прямого обслуживания в течение времени, приближающегося к продолжительности жизни человека. Поэтому он используется в радиоизотопные термоэлектрические генераторы и радиоизотопные нагреватели такие как в Кассини,[116] Вояджер, Галилео и Новые горизонты[117] космические зонды, и Любопытство [118] и Упорство (Марс 2020 ) Марсоходы.
В 1977 году были запущены два космических корабля "Вояджер", каждый из которых содержал плутониевый источник питания мощностью 500 Вт. Спустя более 30 лет каждый источник все еще производит около 300 Вт, что позволяет ограниченную работу каждого космического корабля.[119] Более ранняя версия той же технологии использовала пять Пакеты для экспериментов на Лунной поверхности Аполлона, начиная с Аполлон-12 в 1969 г.[32]
Плутоний-238 также успешно использовался для питания искусственного сердца. кардиостимуляторы, чтобы снизить риск повторной операции.[120][121] Он был в значительной степени заменен на литиевые первичные клетки, но по состоянию на 2003 г.[Обновить] от 50 до 100 кардиостимуляторов с плутониевым питанием все еще имплантировали и функционировали живым пациентам в Соединенных Штатах.[122] К концу 2007 года количество кардиостимуляторов, работающих на плутонии, сократилось до девяти.[123] Плутоний-238 изучался как способ дополнительного тепла для подводное плавание с аквалангом.[124] Плутоний-238 в смеси с бериллием используется для генерации нейтронов в исследовательских целях.[32]
Меры предосторожности
Токсичность
Есть два аспекта вредного воздействия плутония: радиоактивность и яд тяжелого металла последствия. Изотопы и соединения плутония радиоактивны и накапливаются в Костный мозг. Загрязнение оксидом плутония произошло в результате ядерные катастрофы и радиоактивные инциденты, включая военные ядерные аварии, в которых сгорело ядерное оружие.[125] Исследования последствий этих небольших выбросов, а также широко распространенной болезни отравления лучами и смерти после атомные бомбардировки Хиросимы и Нагасаки, предоставили обширную информацию об опасностях, симптомах и прогнозе радиационное отравление, что в случае Японские выжившие в значительной степени не было связано с прямым воздействием плутония.[126]
Во время распада плутония выделяются три типа излучения: альфа, бета и гамма. Альфа, бета и гамма-излучение - это все формы ионизирующего излучения. При остром или длительном воздействии существует опасность серьезные последствия для здоровья включая лучевая болезнь, генетическое повреждение, рак, и смерть. Опасность увеличивается с увеличением воздействия.[32] Альфа-излучение может распространяться только на короткие расстояния и не может проходить через внешний мертвый слой кожи человека. Бета-излучение может проникать через кожу человека, но не может проходить через все тело. Гамма-излучение может проходить через все тело.[127]Несмотря на то, что альфа-излучение не может проникнуть через кожу, проглоченный или вдыхаемый плутоний облучает внутренние органы.[32] Альфа-частицы, образующиеся при вдыхании плутония, вызывают рак легких у группы европейских ядерщиков.[128] В скелет, где накапливается плутоний, а печень, где он собирается и становится концентрированным, подвергаются риску.[31] Плутоний не всасывается в организм эффективно при попадании внутрь; только 0,04% оксида плутония всасывается после приема внутрь.[32] Поглощенный организмом плутоний выводится из организма очень медленно, с биологический период полураспада 200 лет.[129] Плутоний очень медленно проходит через клеточные мембраны и границы кишечника, поэтому абсорбция при приеме внутрь и включение в структуру кости происходит очень медленно.[130][131]
Плутоний более опасен при вдыхании, чем при приеме внутрь. Риск рак легких увеличивается, как только общая радиация эквивалент дозы вдыхаемого плутония превышает 400 мЗв.[132] По оценкам Министерства энергетики США, риск рака в течение всей жизни при вдыхании 5000 частиц плутония, примерно 3мкм широкий, на 1% выше среднего фона по США.[133] Проглатывание или вдыхание больших количеств может вызвать острое радиационное отравление и, возможно, смерть. Однако известно, что ни одно человеческое существо не умерло из-за вдыхания или проглатывания плутония, и многие люди имеют в организме измеримые количества плутония.[113]
"горячая частица «Теория, согласно которой частица плутониевой пыли облучает локализованное пятно легочной ткани, не поддерживается основными исследованиями - такие частицы более подвижны, чем первоначально предполагалось, и их токсичность не увеличивается из-за формы частиц.[130] При вдыхании плутоний может попасть в кровоток. Попадая в кровоток, плутоний перемещается по всему телу в кости, печень или другие органы. Плутоний, который достигает органов тела, обычно остается в организме в течение десятилетий и продолжает подвергать окружающие ткани воздействию радиации и, таким образом, может вызвать рак.[134]
Часто цитируемая цитата Ральф Нейдер утверждает, что фунта плутониевой пыли, разлетевшейся в атмосфере, было бы достаточно, чтобы убить 8 миллиардов человек.[135] Это было оспорено Бернард Коэн, противник общепринятого линейная беспороговая модель радиационной токсичности. Коэн подсчитал, что один фунт плутония может убить не более 2 миллионов человек при вдыхании, так что токсичность плутония примерно равна токсичности плутония. нервно-паралитический газ.[136]
За несколькими группами людей, подвергшихся воздействию плутониевой пыли (например, люди, живущие с подветренной стороны испытательных полигонов Невады, выжившие в Нагасаки, работники ядерных установок и «неизлечимо больные» пациенты, которым вводили Pu в 1945–46 годах для изучения метаболизма Pu), тщательно наблюдали и проанализированы. Коэн обнаружил, что эти исследования несовместимы с высокими оценками токсичности плутония, сославшись на такие случаи, как Альберт Стивенс кто дожил до старости после инъекции плутония.[130] «Около 25 сотрудников Лос-Аламосской национальной лаборатории вдыхали значительное количество плутониевой пыли в течение 1940-х годов; согласно теории горячих частиц, к настоящему времени у каждого из них есть шанс 99,5% умереть от рака легких, но есть среди них не было ни одного рака легких ».[136][137]
Морская токсичность
Исследование токсичности плутония для человека так же важно, как и изучение воздействия на фауну морских систем. Известно, что плутоний попадает в морскую среду в результате сброса отходов или случайной утечки с атомных станций. Хотя самые высокие концентрации плутония в морской среде обнаруживаются в отложениях, сложный биогеохимический цикл плутония означает, что он также находится во всех других отсеках.[138]Например, различные виды зоопланктона, которые помогают в цикл питательных веществ будет потреблять элемент ежедневно. Полное выведение проглоченного плутония зоопланктоном делает его дефекацию чрезвычайно важным механизмом выведения плутония из поверхностных вод.[139] Однако зоопланктон, который становится жертвой хищничества более крупных организмов, может стать средством передачи плутония рыбам.
Помимо потребления, рыба также может подвергаться воздействию плутония из-за своего географического распределения по земному шару. В одном исследовании изучалось влияние трансурановых элементов (плутоний-238, плутоний-239, плутоний-240 ) на различных рыбах, обитающих в Чернобыльская зона отчуждения (CEZ). Результаты показали, что часть самок окуня в CEZ показала либо отказ, либо задержку созревания гонад.[140] Подобные исследования обнаружили большие скопления плутония в органах дыхания и пищеварения трески, камбалы и сельди.[141]
Токсичность плутония не менее губительна для личинок рыб в местах хранения ядерных отходов. Неразвитая икра подвергается более высокому риску, чем развитая взрослая рыба, подвергающаяся воздействию этого элемента на этих участках отходов. Национальная лаборатория Ок-Ридж показала, что эмбрионы карпа и гольяна, выращенные в растворах, содержащих изотопы плутония, не вылуплялись; яйца, которые вылупились, показали значительные отклонения от нормы по сравнению с контрольными развитыми эмбрионами.[142] Было обнаружено, что более высокие концентрации плутония вызывают проблемы у морской фауны, подверженной воздействию этого элемента.
Сохранение океана - важная тема, часто обсуждаемая в научном сообществе. Изменение климата и акульи плавники, например, две основные концепции, которые популярны и активно пропагандируются. Тем не менее, экологические последствия сброса ядерных отходов в прибрежные воды - это область, которая не так изучена и о которой не говорят. Факты свидетельствуют о том, что неосторожное удаление отходов с атомных станций увеличивает количество токсичных материалов, попадающих в океаны. Таким образом, необходимо лучше регулировать и управлять прибрежными районами вблизи ядерных объектов, чтобы защитить морскую среду и фауну внутри них.
Потенциал критичности

Следует проявлять осторожность, чтобы избежать накопления количества плутония, которое приближается к критической массе, особенно потому, что критическая масса плутония составляет лишь треть от массы урана-235.[5] Критическая масса плутония испускает смертельное количество нейтронов и гамма излучение.[143] Плутоний в растворе с большей вероятностью образует критическую массу, чем в твердой форме из-за На модерации водородом в воде.[сомнительный ][11]
Аварии критичности произошли в прошлом, некоторые из них со смертельным исходом. Неосторожное обращение с карбид вольфрама кирпичи вокруг плутониевой сферы весом 6,2 кг привели к смертельной дозе радиации в Лос-Аламосе 21 августа 1945 года, когда ученый Гарри Даглян получил дозу 5,1 зиверта (510ремы ) и умер через 25 дней.[144][145] Девять месяцев спустя другой ученый из Лос-Аламоса, Луи Слотин, погиб в аналогичной аварии с участием бериллиевого отражателя и той же плутониевой активной зоны (так называемая "ядро демона "), который ранее унес жизнь Дагляна.[146]
В декабре 1958 года во время процесса очистки плутония в Лос-Аламосе в смесительной емкости образовалась критическая масса, в результате чего погиб химический оператор по имени Сесил Келли. Другой ядерные аварии произошли в Советском Союзе, Японии, США и многих других странах.[147]
Воспламеняемость
Металлический плутоний представляет опасность пожара, особенно если материал мелкодисперсный. Во влажной среде плутоний образует гидриды на его поверхности, которые являются пирофорными и могут воспламениться на воздухе при комнатной температуре. Плутоний расширяется до 70% в объеме при окислении и, таким образом, может разрушить свой контейнер.[33] Дополнительную опасность представляет радиоактивность горящего материала. Оксид магния песок, вероятно, является наиболее эффективным материалом для тушения плутониевого пожара. Охлаждает горящий материал, действуя как радиатор, а также блокирует кислород. Особые меры предосторожности необходимы при хранении или обращении с плутонием в любой форме; вообще сухой инертный газ атмосфера обязательна.[33][примечание 11]
Транспорт
Земля и море
Обычно плутоний транспортируется через более стабильный оксид плутония в герметичной упаковке. Типичный транспорт состоит из одного грузовика, перевозящего один защищенный транспортный контейнер, вмещающий несколько упаковок с общим весом от 80 до 200 кг оксида плутония. Морская партия может состоять из нескольких контейнеров, в каждом из которых находится запечатанная упаковка.[149] Соединенные Штаты Комиссия по ядерному регулированию гласит, что он должен быть твердым, а не порошком, если его содержание превышает 0,74ТБк (20 Кюри ) радиоактивной активности.[150] В 2016 году корабли Тихоокеанская цапля[151] и Тихоокеанская цапля из Pacific Nuclear Transport Ltd. перевезла 331 кг (730 фунтов) плутония на правительственный объект США в г. Саванна Ривер, Южная Каролина.[152][153]
Воздуха
Правительственные правила воздушного транспорта США разрешают перевозку плутония по воздуху с учетом ограничений на другие опасные материалы, перевозимые тем же рейсом, требований к упаковке и укладке в задней части самолета.[154]
В 2012 году СМИ сообщили, что плутоний был вывезен из Норвегии в коммерческих целях. пассажирские авиалинии - примерно раз в два года, в том числе один раз в 2011 году.[155] Правила разрешают самолету перевозить 15 граммов расщепляющегося материала.[155] По словам одного из старших советников, с такой транспортировкой плутония проблем нет.старший даритель) в Statens strålevern.[155]
Примечания
Сноски
- ^ В PuO+
2 ион нестабилен в растворе и непропорционально превращается в Pu4+ и PuO2+
2; Пу4+ затем окислит оставшиеся PuO+
2 к PuO2+
2, восстанавливаясь, в свою очередь, до Pu3+. Таким образом, водные растворы PuO+
2 со временем склоняются к смеси Pu3+ и PuO2+
2. UO+
2 нестабильно по той же причине.[27] - ^ Это был не первый случай, когда кто-то предлагал назвать элемент «плутоний». Спустя десять лет после открытия бария профессор Кембриджского университета предложил переименовать его в «плутоний», потому что этого элемента не было (как было предложено Греческий корень, барыс, он был назван в честь) тяжелый. Он рассудил, что, поскольку это было произведено относительно новой техникой электролиз, его название должно относиться к Огонь. Таким образом, он предложил назвать его в честь римского бога подземного мира, Плутон.[62]
- ^ Как говорится в одной статье со ссылкой на информацию, которую Сиборг дал в своем выступлении: «Очевидным выбором для символа был бы Pl, но Сиборг шутливо предложил Пу, как слова, которые воскликнет ребенок:« Пи-ю! » когда почувствовал запах чего-то плохого. Сиборг подумал, что его это предложение вызовет сильную критику, но комитет по присвоению имен принял символ без единого слова ".[64]
- ^ Кабинет 405 Лаборатория Джорджа Герберта Джонса, где произошло первое выделение плутония, получил название Национальный исторический памятник в мае 1967 г.
- ^ Во время Манхэттенского проекта плутоний также часто назывался просто «49»: цифра 4 была последней цифрой в 94 (атомный номер плутония), а 9 была последней цифрой плутония-239, оружейного качества. делящийся изотоп, используемый в ядерных бомбах.[72]
- ^ Американское общество инженеров-механиков (ASME) учредило B Reactor в качестве национального исторического памятника машиностроения в сентябре 1976 года.[76] В августе 2008 года B Reactor получил статус США. Национальный исторический памятник.[77]
- ^ Расчет эффективности основан на том факте, что при делении 1 кг плутония-239 (или урана-235) выделяется примерно 17 единиц энергии. kt, что приводит к округленной оценке 1,2 кг плутония, фактически расщепленного с получением выхода 20 кт.[85]
- ^ Большая часть этого плутония использовалась для создания делящихся ядер термоядерного оружия, использующего Дизайн Теллера – Улама. Эти так называемые «водородные бомбы» представляют собой разновидность ядерного оружия, которое использует бомбу деления для запуска термоядерная реакция тяжелых водород изотопы. Их разрушительная мощность обычно составляет миллионы тонн тротилового эквивалента по сравнению с тысячами тонн тротилового эквивалента устройств, работающих только на делении.[90]
- ^ Оксид циркония гадолиния (Б-г
2Zr
2О
7) был изучен, потому что он мог удерживать плутоний до 30 миллионов лет.[90] - ^ Распад плутония в отработавшем топливном стержне: плутоний-239 (~ 58%), 240 (24%), 241 (11%), 242 (5%), 238 (2%).[90]
- ^ На заводе произошел крупный пожар, вызванный плутонием. Завод Скалистых Квартир возле Боулдер, Колорадо в 1969 г.[148]
Цитаты
- ^ Рассчитывается из атомного веса и атомного объема. Элементарная ячейка, содержащая 16 атомов, имеет объем 319,96 кубических Å, согласно Зигфрид С. Хеккер (2000). «Плутоний и его сплавы: от атомов до микроструктуры» (PDF). Лос-Аламос Сайенс. 26: 331.. Это дает плотность для 239Пу из (1,66053906660 × 10−24г / дальтон × 239,0521634 дальтон / атом × 16 атомов / элементарная ячейка) / (319,96 Å3на элементарную ячейку × 10−24куб.см / Å3) или 19,85 г / куб.
- ^ а б c d «Плутоний радиоактивный». Беспроводная информационная система для аварийно-спасательных служб (WISER). Bethesda (MD): Национальная медицинская библиотека США, Национальные институты здравоохранения. Архивировано из оригинал 22 августа 2011 г.. Получено 23 ноября, 2008. (текст в общественном достоянии)
- ^ «Обработка азотной кислоты». Ежеквартальное исследование актинидов. Лос-Аламос (Нью-Мексико): Национальная лаборатория Лос-Аламоса (3-й квартал). 2008 г.. Получено 9 февраля, 2010.
Хотя диоксид плутония обычно оливково-зеленого цвета, образцы могут быть разных цветов. Обычно считается, что цвет является функцией химической чистоты, стехиометрии, размера частиц и способа приготовления, хотя цвет, полученный в результате данного метода приготовления, не всегда воспроизводится.
- ^ а б c Sonzogni, Алехандро А. (2008). «Карта нуклидов». Аптон: Национальный центр ядерных данных, Брукхейвенская национальная лаборатория. Получено 13 сентября, 2008.
- ^ а б c d е ж грамм час Хейзерман 1992, п. 338
- ^ Родос 1986, стр. 659–660 Леона Маршалл: «Когда держишь комок в руке, он теплый, как живой кролик»
- ^ а б c d Шахтер 1968, п. 544
- ^ а б c d е ж грамм Хеккер, Зигфрид С. (2000). «Плутоний и его сплавы: от атомов к микроструктуре» (PDF). Лос-Аламос Сайенс. 26: 290–335. Получено 15 февраля, 2009.
- ^ Hecker, Siegfried S .; Марц, Джозеф К. (2000). «Старение плутония и его сплавов» (PDF). Лос-Аламос Сайенс. Лос-Аламос, Нью-Мексико: Национальная лаборатория Лос-Аламоса (26): 242. Получено 15 февраля, 2009.
- ^ а б c d Бейкер, Ричард Д .; Hecker, Siegfried S .; Харбур, Делберт Р. (1983). «Плутоний: военный кошмар, но мечта металлурга» (PDF). Лос-Аламос Сайенс. Лос-Аламосская национальная лаборатория: 148, 150–151.. Получено 15 февраля, 2009.
- ^ а б c d е Лиде 2006, стр. 4–27
- ^ а б c d Шахтер 1968, п. 542
- ^ «Фазовые переходы кристаллов плутония». GlobalSecurity.org.
- ^ «Глоссарий - Делящийся материал». Комиссия по ядерному регулированию США. 20 ноября 2014 г.. Получено 5 февраля, 2015.
- ^ Азимов 1988, п. 905
- ^ Гласстон, Самуэль; Редман, Лесли М. (июнь 1972 г.). «Введение в ядерное оружие» (PDF). Отдел военного применения Комиссии по атомной энергии. п. 12. WASH-1038. Архивировано из оригинал (PDF) 27 августа 2009 г.
- ^ Гослинг 1999, п. 40
- ^ «Плутоний: первые 50 лет» (PDF). Министерство энергетики США. 1996. DOE / DP-1037. Архивировано из оригинал (PDF) 18 февраля 2013 г.
- ^ Хейзерман 1992, п. 340
- ^ Kennedy, J. W .; Сиборг, Г. Т .; Segrè, E .; Валь, А. С. (1946). «Свойства Элемента 94». Физический обзор. 70 (7–8): 555–556. Bibcode:1946ПхРв ... 70..555К. Дои:10.1103 / PhysRev.70.555.
- ^ Гринвуд 1997, п. 1259
- ^ а б c Кларк 1961 С. 124–125.
- ^ Сиборг, Гленн Т .; McMillan, E .; Kennedy, J. W .; Валь, А. С. (1946). «Радиоактивный элемент 94 из дейтронов на уране». Физический обзор. 69 (7–8): 366. Bibcode:1946ПхРв ... 69..366С. Дои:10.1103 / PhysRev.69.366.
- ^ Бернштейн 2007 С. 76–77.
- ^ "Может ли плутоний реакторного качества производить оружие ядерного деления?". Совет по ядерному топливному циклу, Институт экономики энергетики, Япония. Май 2001 г.
- ^ Хейзерман 1992, п. 339
- ^ Крукс, Уильям Дж. (2002). «Учебный модуль 10 по вопросам инженерии безопасности ядерной критичности - Безопасность критичности при обработке материалов, часть 1» (PDF). Архивировано из оригинал (PDF) 20 марта 2006 г.. Получено 15 февраля, 2006.
- ^ Мэтлак, Джордж (2002). Праймер плутония: введение в химию плутония и его радиоактивность. Лос-Аламосская национальная лаборатория. LA-UR-02-6594.
- ^ Виндорф, Кори Дж .; Чен, Го П; Кросс, Джастин Н; Эванс, Уильям Дж .; Фурче, Филипп; Gaunt, Эндрю Дж .; Янике, Майкл Т .; Козимор, Стош А .; Скотт, Брайан Л. (2017). "Идентификация формального состояния окисления плутония +2: синтез и характеристика {PuII[C5ЧАС3(SiMe3)2]3}−". Варенье. Chem. Soc. 139 (11): 3970–3973. Дои:10.1021 / jacs.7b00706. PMID 28235179.
- ^ Иглсон 1994, п. 840
- ^ а б c d е Шахтер 1968, п. 545
- ^ а б c d е ж грамм час я j k л м п о п q р s Эмсли 2001, стр. 324–329
- ^ а б c «Праймер по самопроизвольному нагреву и пирофорности - пирофорные металлы - плутоний». Вашингтон (округ Колумбия): Министерство энергетики США, Управление ядерной безопасности, обеспечения качества и окружающей среды. 1994. Архивировано с оригинал 28 апреля 2007 г.
- ^ Crooks, W. J .; и другие. (2002). «Низкотемпературная реакция ReillexTM HPQ и азотной кислоты». Экстракция растворителем и ионный обмен. 20 (4–5): 543–559. Дои:10.1081 / SEI-120014371.
- ^ а б Дюме, Бель (20 ноября 2002 г.). «Плутоний - тоже сверхпроводник». PhysicsWeb.org.
- ^ Moody, Hutcheon & Grant 2005 г., п. 169
- ^ Колман, Д. Г. и Коллетти, Л. П. (2009). «Водные коррозионные свойства металлического плутония и плутоний-галлиевых сплавов при воздействии водных растворов нитратов и хлоридов». Транзакции ECS. Электрохимическое общество. 16 (52): 71. ISBN 978-1-56677-751-3.
- ^ Херст и Уорд 1956
- ^ Курро, Н. Дж. (Весна 2006 г.). «Нетрадиционная сверхпроводимость в PuCoGa5» (PDF). Лос-Аламосская национальная лаборатория. Архивировано из оригинал (PDF) 22 июля 2011 г.. Получено 24 января, 2010.
- ^ Маккуайг, Франклин Д. «Сплав Pu – Zr для жаропрочного фольгового топлива» Патент США 4059439 , Выпущено 22 ноября 1977 г.
- ^ Jha 2004, п. 73
- ^ а б c Кей 1965, п. 456
- ^ а б c d Шахтер 1968, п. 541
- ^ «Окло: Природные ядерные реакторы». Министерство энергетики США, Управление по обращению с гражданскими радиоактивными отходами. 2004. Архивировано с оригинал 20 октября 2008 г.. Получено 16 ноября, 2008.
- ^ Кертис, Дэвид; Фабрика-Мартин, июнь; Пол, Диксон; Крамер, Ян (1999). «Необычные элементы природы: плутоний и технеций». Geochimica et Cosmochimica Acta. 63 (2): 275–285. Bibcode:1999GeCoA..63..275C. Дои:10.1016 / S0016-7037 (98) 00282-8.
- ^ Бернштейн 2007 С. 75–77.
- ^ Hoffman, D. C .; Lawrence, F. O .; Mewherter, J. L .; Рурк, Ф. М. (1971). «Обнаружение плутония-244 в природе». Природа. 234 (5325): 132–134. Bibcode:1971 г., природа. 234..132H. Дои:10.1038 / 234132a0.
- ^ Петерсон, Иварс (7 декабря 1991 г.). «Уран проявляет редкую радиоактивность». Новости науки. Wiley-Blackwell. 140 (23): 373. Дои:10.2307/3976137. JSTOR 3976137.
- ^ Hoffman, D.C .; Lawrence, F. O .; Mewherter, J. L .; Рурк, Ф. М. (1971). «Обнаружение плутония-244 в природе». Природа. 234 (5325): 132–134. Bibcode:1971 г., природа. 234..132H. Дои:10.1038 / 234132a0. № 34.
- ^ Тернер, Гренвилл; Харрисон, Т. Марк; Холланд, Грег; Mojzsis, Стивен Дж .; Гилмор, Джейми (1 января 2004 г.). "Вымерший 244Пу в древних цирконах » (PDF). Наука. 306 (5693): 89–91. Bibcode:2004Наука ... 306 ... 89Т. Дои:10.1126 / science.1101014. JSTOR 3839259. PMID 15459384.
- ^ Hutcheon, I.D .; Прайс, П. Б. (1 января 1972 г.). «Следы деления плутония-244: свидетельства в лунной породе возрастом 3,95 миллиарда лет». Наука. 176 (4037): 909–911. Bibcode:1972Научный ... 176..909H. Дои:10.1126 / science.176.4037.909. JSTOR 1733798. PMID 17829301.
- ^ Кунц, Иоахим; Стаудахер, Томас; Аллегр, Клод Ж. (1 января 1998 г.). «Ксенон деления плутония, обнаруженный в мантии Земли». Наука. 280 (5365): 877–880. Bibcode:1998Научный ... 280..877K. Дои:10.1126 / science.280.5365.877. JSTOR 2896480.
- ^ Валлнер, А .; Faestermann, T .; Feige, J .; Feldstein, C .; Knie, K .; Корщинек, Г .; Кучера, В .; Ofan, A .; Пол, М .; Quinto, F .; Rugel, G .; Штайнер, П. (30 марта 2014 г.). "Изобилие живых 244Pu в глубоководных водоемах на Земле указывает на редкость нуклеосинтеза актинидов ». Nature Communications. 6: 5956. arXiv:1509.08054. Bibcode:2015 НатКо ... 6E5956W. Дои:10.1038 / ncomms6956.
- ^ Холден, Норман Э. (2001). «Краткая история ядерных данных и их оценка». 51-е заседание Рабочей группы по поперечной оценке USDOE. Аптон (Нью-Йорк): Национальный центр ядерных данных, Брукхейвенская национальная лаборатория. Получено 3 января, 2009.
- ^ Ферми, Энрико (12 декабря 1938 г.). «Искусственная радиоактивность, создаваемая нейтронной бомбардировкой: Нобелевская лекция» (PDF). Шведская королевская академия наук.
- ^ Дарден, Линдли (1998). «Природа научного исследования». Колледж-Парк: факультет философии Мэрилендского университета. Получено 3 января, 2008.
- ^ Бернштейн 2007 С. 44–52.
- ^ Сиборг, Гленн Т. «Ранняя история LBNL: элементы 93 и 94». Департамент передовых вычислений для науки, Национальная лаборатория Лоуренса Беркли. Получено 17 сентября, 2008.
- ^ Гленн Т. Сиборг. "Плутониевая история". Лаборатория Лоуренса Беркли, Калифорнийский университет. LBL-13492, DE82 004551.
- ^ Э. Сегре, Разум всегда в движении, Калифорнийский университет Press, 1993, стр. 162-169.
- ^ Сиборг и Сиборг 2001 С. 71–72.
- ^ Хейзерман 1992, п. 338.
- ^ Кларк, Дэвид Л .; Хобарт, Дэвид Э. (2000). «Размышления о наследии легенды: Гленн Т. Сиборг, 1912–1999» (PDF). Лос-Аламос Сайенс. 26: 56–61, на 57. Получено 15 февраля, 2009.
- ^ Кларк, Дэвид Л .; Хобарт, Дэвид Э. (2000). «Размышления о наследии легенды: Гленн Т. Сиборг, 1912–1999» (PDF). Лос-Аламос Сайенс. 26: 56–61, на 57. Получено 15 февраля, 2009.
- ^ «Фронтальное интервью с Сиборгом». Линия фронта. Служба общественного вещания. 1997 г.. Получено 7 декабря, 2008.
- ^ Гленн Т. Сиборг (1977). "История секции C-I лаборатории МЕТ, апрель 1942 - апрель 1943". Калифорнийский университет, Беркли (США). Лаборатория Лоуренса Беркли. Дои:10.2172/7110621.
- ^ «Комната 405, Лаборатория Джорджа Герберта Джонса». Служба национальных парков. Архивировано из оригинал 8 февраля 2008 г.. Получено 14 декабря, 2008.
- ^ а б c «Периодическая таблица элементов». Лос-Аламосская национальная лаборатория. Получено 15 сентября, 2015.
- ^ Шахтер 1968, п. 540
- ^ "Плутоний". Фонд атомного наследия. Получено 15 сентября, 2015.
- ^ "Выбор сайта". История LANL. Лос-Аламос, Нью-Мексико: Национальная лаборатория Лос-Аламоса. Получено 23 декабря, 2008.
- ^ Хаммель, Э. Ф. (2000). "Укрощение" 49 "- большая наука за короткое время. Воспоминания Эдварда Ф. Хаммела, В: Купер Н.Г. Ред. Проблемы плутониевой науки" (PDF). Лос-Аламос Сайенс. 26 (1): 2–9. Получено 15 февраля, 2009.
- Хеккер, С. С. (2000). «Плутоний: исторический обзор. В: Проблемы плутониевой науки». Лос-Аламос Сайенс. 26 (1): 1–2. Получено 15 февраля, 2009.
- ^ Сублет, Кэри. "Хронология атомной истории 1942–1944 гг.". Вашингтон (округ Колумбия): Фонд атомного наследия. Получено 22 декабря, 2008.
- ^ Hoddeson et al. 1993 г. С. 235–239.
- ^ а б Hoddeson et al. 1993 г. С. 240–242.
- ^ Вален 1989, п. 1.
- ^ «Действия еженедельного списка». Служба национальных парков. 29 августа 2008 г.. Получено 30 августа, 2008.
- ^ Вален 1989, п. iv, 1
- ^ а б Линдли, Роберт (2013). «Кейт Браун: ядерные« Плутопии »- крупнейшая программа социального обеспечения в американской истории». History News Network.
- ^ Ринкон, Пол (2 марта 2009 г.). "BBC NEWS - Наука и окружающая среда - В бутылке найдена ядерная реликвия США". Новости BBC. Получено 2 марта, 2009.
- ^ Гебель, Эрика (2009). «Старый плутоний, новые фокусы». Аналитическая химия. 81 (5): 1724. Дои:10.1021 / ac900093b.
- ^ Schwantes, Jon M .; Мэтью Дуглас; Стивен Э. Бонд; Джеймс Д. Бриггс; и другие. (2009). «Ядерная археология в бутылке: свидетельство деятельности США до Троицы с оружием из захоронения отходов». Аналитическая химия. 81 (4): 1297–1306. Дои:10.1021 / ac802286a. PMID 19152306.
- ^ Sublette, Кэри (3 июля 2007 г.). «8.1.1 Дизайн устройства, толстяка и« Джо 1 »(RDS-1)». Часто задаваемые вопросы о ядерном оружии, издание 2.18. Архив ядерного оружия. Получено 4 января, 2008.
- ^ а б Малик, Джон (сентябрь 1985). "Результаты взрывов Хиросимы и Нагасаки" (PDF). Лос-Аламос. п. Таблица VI. LA-8819. Получено 15 февраля, 2009.
- ^ На рисунке 1 кг = 17 уз см. Гарвин, Ричард (4 октября 2002 г.). «Распространение ядерного оружия и материалов среди государственных и негосударственных субъектов: что это означает для будущего ядерной энергетики» (PDF). Симпозиум Мичиганского университета. Федерация американских ученых. Получено 4 января, 2009.
- ^ Скляр 1984 С. 22–29.
- ^ Бернштейн 2007, п. 70.
- ^ «Исторический американский технический рекорд: реактор B (здание 105-B)». Ричленд: Министерство энергетики США. 2001. с. 110. DOE / RL-2001-16. Получено 24 декабря, 2008.
- ^ Кокран, Томас Б. (1997). Защита материалов, пригодных для ядерного оружия в России (PDF). Международный форум по незаконному обороту ядерных материалов. Вашингтон (округ Колумбия): Совет по защите природных ресурсов, Inc. Архивировано из оригинал (PDF) 5 июля 2013 г.. Получено 21 декабря, 2008.
- ^ а б c Эмсли 2001.
- ^ Стокгольмский международный институт исследования проблем мира 2007 г., п. 567.
- ^ Поэт, С. Э .; Мартелл, EA (октябрь 1972 г.). «Загрязнение плутонием-239 и америцием-241 в районе Денвера». Физика здоровья. 23 (4): 537–48. Дои:10.1097/00004032-197210000-00012. PMID 4634934.
- ^ Джонсон, К. Дж. (Октябрь 1981 г.). «Заболеваемость раком в зоне, загрязненной радионуклидами, вблизи ядерной установки». Ambio. 10 (4): 176–182. JSTOR 4312671. Перепечатано в Джонсон, К. Дж. (Октябрь 1981 г.). «Заболеваемость раком в зоне, загрязненной радионуклидами, вблизи ядерной установки». Коло Мед. 78 (10): 385–92. PMID 7348208.
- ^ «Национальный заповедник дикой природы Роки-Флэтс». Служба рыболовства и дикой природы США. Получено 2 июля, 2013.
- ^ Пресс-секретарь (23 июля 2002 г.). "Президент подписывает законопроект о горе Юкка". Вашингтон (округ Колумбия): Офис пресс-секретаря Белого дома. Архивировано из оригинал 6 марта 2008 г.. Получено 9 февраля, 2015.
- ^ Хеберт, Х. Йозеф (6 марта 2009 г.). «Ядерные отходы не попадут в гору Юкка в Неваде, - заявил чиновник Обамы». Чикаго Трибьюн. п. 4. Архивировано из оригинал 24 марта 2011 г.. Получено 17 марта, 2011.
- ^ «О комиссии». Архивировано из оригинал 21 июня 2011 г.
- ^ а б Комиссия Голубой ленты по ядерному будущему Америки. «Отчет Подкомитета по утилизации для полной комиссии» (PDF). Архивировано из оригинал (PDF) 25 января 2017 г.. Получено 26 февраля, 2017.
- ^ а б c Мосс, Уильям; Экхардт, Роджер (1995). "Эксперименты по введению плутония в человека" (PDF). Лос-Аламос Сайенс. Лос-Аламосская национальная лаборатория. 23: 188, 205, 208, 214. Получено 6 июня, 2006.
- ^ а б Воелц, Джордж Л. (2000). «Плутоний и здоровье: насколько велик риск?». Лос-Аламос Сайенс. Лос-Аламос (Нью-Мексико): Национальная лаборатория Лос-Аламоса (26): 78–79.
- ^ а б Лонгворт, Р. К. (ноябрь – декабрь 1999 г.). «Введен! Рецензия на книгу: Плутониевые файлы: секретные медицинские эксперименты Америки в период холодной войны». Бюллетень ученых-атомщиков. 55 (6): 58–61. Дои:10.2968/055006016.
- ^ Мосс, Уильям и Роджер Экхардт. (1995). «Эксперименты по инъекции человеческого плутония». Лос-Аламосская наука. 23: 177–233.
- ^ Открытость, DOE. (Июнь 1998 г.). Радиационные эксперименты на человеке: отчет ACHRE. Глава 5: Эксперименты в районе Манхэттена; первая инъекция. Вашингтон, округ Колумбия. Заведующий документами типографии правительства США.
- ^ AEC нет. UR-38, Ежеквартальный технический отчет за 1948 г.
- ^ Если, Майкл С. (1995). "'Этический вред и эксперименты с введением плутония " (PDF). Лос-Аламос Сайенс. 23: 280–283. Получено 15 февраля, 2009.
- ^ Мартин 2000, п. 532.
- ^ а б «Дизайн ядерного оружия». Федерация американских ученых. 1998. Архивировано с оригинал 26 декабря 2008 г.. Получено 7 декабря, 2008.
- ^ а б «Смешанное оксидное (МОКС) топливо». Лондон (Великобритания): Всемирная ядерная ассоциация. 2006 г.. Получено 14 декабря, 2008.
- ^ До и Чанг 2011 С. 254–256.
- ^ До и Чанг 2011, п. 15.
- ^ а б «Хранение плутония на участке реки Саванна Министерства энергетики: первый годовой отчет для Конгресса» (PDF). Совет по безопасности оборонных ядерных объектов. 2004. стр. A – 1.. Получено 15 февраля, 2009.
- ^ Бесманн, Теодор М. (2005). «Термохимическое поведение галлия в топливе смешанного оксидного легководного реактора (LWR) на основе оружейного материала». Журнал Американского керамического общества. 81 (12): 3071–3076. Дои:10.1111 / j.1151-2916.1998.tb02740.x.
- ^ а б c d "Плутоний". Всемирная ядерная ассоциация. Март 2009 г.. Получено 28 февраля, 2010.
- ^ «Наука для критических масс: как плутоний меняется со временем». Институт энергетики и экологических исследований.
- ^ а б «От источников тепла к источникам сердца: Лос-Аламос сделал материал для насоса, работающего на плутонии». Ежеквартальное исследование актинидов. Лос-Аламос: Национальная лаборатория Лос-Аламоса (1). 2005. Архивировано с оригинал 16 февраля 2013 г.. Получено 15 февраля, 2009.
- ^ "Почему миссия Кассини не может использовать солнечные массивы" (PDF). НАСА / Лаборатория реактивного движения. 6 декабря 1996 г. Архивировано с оригинал (PDF) 26 февраля 2015 г.. Получено Двадцать первое марта, 2014.
- ^ Санкт-Флер, Николай, "Радиоактивное сердце космического корабля New Horizons к Плутону", Нью-Йорк Раз, 7 августа 2015 года. 125-фунтовый генератор этого корабля [называется] термоэлектрическим генератором с радиоизотопом общего назначения. [Он] был заполнен 24 фунтами плутония, который производил около 240 ватт электроэнергии, когда он покинул Землю в 2006 году. , по словам Райана Бектеля, инженера из Министерства энергетики, работающего над космической ядерной энергетикой. Во время пролета Плутона батарея вырабатывала 202 Вт, сказал г-н Бектел. Мощность будет продолжать уменьшаться по мере распада металла, но ее достаточно по словам Курта Нибура, научного сотрудника НАСА в миссии New Horizons, чтобы управлять зондом еще на 20 лет ». Проверено 10 августа 2015.
- ^ Мошер, Дэйв (19 сентября 2013 г.). «Проблема плутония НАСА может положить конец исследованиям глубокого космоса». Проводной. Получено 5 февраля, 2015.
- ^ "Срок службы космического корабля" Вояджер ". Лаборатория реактивного движения. 11 июня 2014 г.. Получено 5 февраля, 2015.
- ^ Венкатешвара Шарма Маллела; В. Иланкумаран и Н. Шриниваса Рао (2004). «Тенденции развития батарей для кардиостимуляторов». Индийский электрофизиол стимуляции. 4 (4): 201–212. ЧВК 1502062. PMID 16943934.
- ^ "Электрокардиостимулятор с плутониевым питанием (1974)". Ассоциированные университеты Ок-Ридж. Получено 6 февраля, 2015.
- ^ "Электрокардиостимулятор с плутониевым питанием (1974)". Ок-Ридж: Orau.org. 2011 г.. Получено 1 февраля, 2015.
- ^ «Ядерный кардиостимулятор по-прежнему активен спустя 34 года». 19 декабря 2007 г.. Получено 14 марта, 2019.
- ^ Бейлс, Джон Дж .; Тейлор, Дуглас (1970). SEALAB III - Система подогрева изотопного купальника для дайвера (Отчет). Порт-Уенем: военно-морская лаборатория гражданского строительства. AD0708680.
- ^ «Токсикологический профиль плутония» (PDF). Министерство здравоохранения и социальных служб США, Агентство регистрации токсичных веществ и заболеваний (ATSDR). Ноябрь 2010 г.. Получено 9 февраля, 2015.
- ^ Литтл, М. П. (июнь 2009 г.). «Раковые и неканцерогенные эффекты у японских выживших после атомной бомбы». J Radiol Prot. 29 (2A): A43–59. Bibcode:2009JRP .... 29 ... 43л. Дои:10.1088 / 0952-4746 / 29 / 2A / S04. PMID 19454804.
- ^ «Плутоний, идентификационный номер CAS: 7440-07-5». Центры по контролю и профилактике заболеваний (CDC) Агентство регистрации токсичных веществ и заболеваний. Получено 5 февраля, 2015.
- ^ Греллье, Джеймс; Аткинсон, Уилл; Берар, Филипп; Бингхэм, Дерек; Бирчалл, Алан; Бланшардон, Эрик; Бык, Ричард; Гусева Цану, Ирина; Шелтон-де Ватэр, Сесиль; Кокерилл, Руперт; До, Минь Т; Энгельс, Хильда; Фигуэрола, Хорди; Фостер, Адриан; Холмсток, Люк; Хюртген, Кристиан; Лорье, Доминик; Панчер, Мэтью; Ридделл, Тони; Самсон, Эрик; Тьерри-Шеф, Изабель; Тирмарш, Марго; Vrijheid, Martine; Кардис, Элизабет (2017). «Риск смерти от рака легких у ядерщиков в результате внутреннего облучения радионуклидами, излучающими альфа-частицы». Эпидемиология. 28 (5): 675–684. Дои:10.1097 / EDE.0000000000000684. ЧВК 5540354. PMID 28520643.
- ^ «Техническая подготовка по радиологическому контролю» (PDF). Министерство энергетики США. Архивировано из оригинал (PDF) 30 июня 2007 г.. Получено 14 декабря, 2008.
- ^ а б c Коэн, Бернард Л. «Миф о токсичности плутония». Архивировано из оригинал 26 августа 2011 г.
- ^ Коэн, Бернард Л. (май 1977 г.). «Опасности, связанные с отравлением плутонием». Журнал радиационной безопасности: физика здоровья. 32 (5): 359–379. Дои:10.1097/00004032-197705000-00003. PMID 881333.
- ^ Браун, Шеннон С.; Маргарет Ф. Шенбек; Дэвид МакКлюр; и другие. (Июль 2004 г.). «Рак легких и внутренние дозы в легких среди плутониевых рабочих на заводе в Роки-Флэтс: исследование случай-контроль». Американский журнал эпидемиологии. Оксфордские журналы. 160 (2): 163–172. Дои:10.1093 / aje / kwh192. PMID 15234938. Получено 15 февраля, 2009.
- ^ «Информационный бюллетень ANL о здоровье человека - плутоний» (PDF). Аргоннская национальная лаборатория. 2001. Архивировано с оригинал (PDF) 16 февраля 2013 г.. Получено 16 июня, 2007.
- ^ «Радиационная защита, плутоний: что делает плутоний, когда он попадает в организм?». Агентство по охране окружающей среды США. Получено 15 марта, 2011.
- ^ «Разве Ральф Надер сказал, что фунт плутония может вызвать 8 миллиардов случаев рака?». Получено 3 января, 2013.
- ^ а б Бернард Л. Коэн. «Вариант с использованием ядерной энергии, глава 13, Плутоний и бомбы». Получено 28 марта, 2011. (Интернет-версия книги Коэна Вариант с ядерной энергией (Пленум Пресс, 1990) ISBN 0-306-43567-5).
- ^ Воелц, Г. Л. (1975). «Что мы узнали о плутонии из человеческих данных». Журнал радиационной безопасности Health Physics: 29.
- ^ Скваржец, В; Струминская, Д; Борыло, А (2001). «Биоаккумуляция и распределение плутония в рыбе Гданьского залива». Журнал экологической радиоактивности. 55issue = 2: 167–178. Дои:10.1016 / s0265-931x (00) 00190-9.
- ^ Бакстер, М.; Фаулер, S; Povined, P (1995). «Наблюдения за плутонием в Мировом океане». Прикладное излучение и изотопы. 46 (11): 1213–1223. Дои:10.1016/0969-8043(95)00163-8.
- ^ Леребур, А; Гудков Д; Нагорская, Л; Каглян, А; Ризевский, В; Лещенко, А (2018). «Влияние радиации окружающей среды на здоровье и репродуктивное состояние рыб из Чернобыля». Экологические науки и технологии. 52 (16): 9442–9450. Дои:10.1021 / acs.est.8b02378.
- ^ Скваржец, В; Струминская, Д; Борыло, А (2001). «Биоаккумуляция и распределение плутония в рыбе Гданьского залива». Журнал экологической радиоактивности. 55issue = 2: 167–178. Дои:10.1016 / s0265-931x (00) 00190-9.
- ^ Тилль, Джон Э .; Kaye, S. V .; Трабалка, Дж. Р. (1976). «Токсичность урана и плутония для развивающихся эмбрионов рыб». Национальная лаборатория Окриджа: 187.
- ^ Шахтер 1968, п. 546
- ^ Рорк, Кевин Н. (2000). «Выдан отчет о критических авариях». Лос-Аламос (Нью-Мексико): Лос-Аламосская национальная лаборатория. Архивировано из оригинал 8 октября 2008 г.. Получено 16 ноября, 2008.
- ^ Ханнер 2004, п. 85.
- ^ "Рамер Шрайбер". Биографии сотрудников. Лос-Аламос: Национальная лаборатория Лос-Аламоса. Архивировано из оригинал 3 января 2013 г.. Получено 16 ноября, 2008.
- ^ Маклафлин, Монахан и Пруво, 2000, п. 17.
- ^ Олбрайт, Дэвид; О'Нил, Кевин (1999). "Уроки ядерной секретности в Скалистых равнинах". Краткое описание проблемы ISIS. Институт науки и международной безопасности (ISIS). Архивировано из оригинал 8 июля 2008 г.. Получено 7 декабря, 2008.
- ^ «Перевозка радиоактивных материалов». Всемирная ядерная ассоциация. Получено 6 февраля, 2015.
- ^ «§ 71.63 Особые требования к поставкам плутония». Комиссия по ядерному регулированию США. Получено 6 февраля, 2015.
- ^ "Тихоокеанская цапля". Получено 22 марта, 2016.
- ^ Ямагути, мари. «Два британских корабля прибывают в Японию для перевозки плутония в США». Получено 22 марта, 2016.
- ^ «Два британских корабля прибывают в Японию для перевозки плутония для хранения в США» Получено 22 марта, 2016.
- ^ «Часть 175.704 отгрузки плутония». Свод федеральных правил 49 - Транспорт. Получено 1 августа, 2012.
- ^ а б c Av Ida Søraunet Wangberg и Anne Kari Hinna. "Klassekampen: Flyr plutonium med rutefly". Klassekampen.no. Получено 13 августа, 2012.
Рекомендации
- Азимов Исаак (1988). «Ядерные реакторы». Понимание физики. Нью-Йорк: Barnes & Noble Publishing. ISBN 0-88029-251-2.
- Бернштейн, Джереми (2007). Плутоний: история самого опасного элемента в мире. Вашингтон, округ Колумбия: Джозеф Генри Пресс. ISBN 978-0-309-10296-4. OCLC 76481517.
- Кларк, Рональд (1961). Рождение бомбы: невыразимая история участия Великобритании в оружии, изменившем мир. Лондон: Дом Феникса. OCLC 824335.
- Иглсон, Мэри (1994). Краткая энциклопедия химии. Берлин: Вальтер де Грюйтер. ISBN 978-3-11-011451-5.
- Эмсли, Джон (2001). "Плутоний". Строительные блоки природы: руководство по элементам от А до Я. Оксфорд (Великобритания): Издательство Оксфордского университета. ISBN 0-19-850340-7.
- Гослинг, Ф. Г. (1999). Манхэттенский проект: создание атомной бомбы (PDF). Ок-Ридж: Министерство энергетики США. ISBN 0-7881-7880-6. DOE / MA-0001-01 / 99. Архивировано из оригинал (PDF) 24 февраля 2009 г.. Получено 15 февраля, 2009.
- Greenwood, N. N .; Эрншоу, А. (1997). Химия элементов (2-е изд.). Оксфорд (Великобритания): Баттерворт-Хайнеманн. ISBN 0-7506-3365-4.
- Хейзерман, Дэвид Л. (1992). «Элемент 94: Плутоний». Изучение химических элементов и их соединений. Нью-Йорк (NY): TAB Books. стр.337–340. ISBN 0-8306-3018-X.
- Ходдесон, Лилиан; Хенриксен, Пол В .; Мид, Роджер А .; Вестфол, Кэтрин Л. (1993). Критическая сборка: техническая история Лос-Аламоса в годы Оппенгеймера, 1943–1945 гг.. Нью-Йорк: Издательство Кембриджского университета. ISBN 0-521-44132-3. OCLC 26764320.
- Ханнер, Джон (2004). Изобретая Лос-Аламос. ISBN 978-0-8061-3891-6.
- Hurst, D.G .; Уорд, А. Г. (1956). Канадские исследовательские реакторы (PDF). Оттава: Atomic Energy of Canada Limited. OCLC 719819357. Получено 6 февраля, 2015.
- Джа, Д. К. (2004). Ядерная энергия. Издательство Discovery. ISBN 81-7141-884-8.
- Каку, Мичио; Тренер, Дженнифер (1983). Атомные обе стороны: Лучшие аргументы за и против самых Спорные технологии. W. W. Norton & Company. ISBN 9780393301281. Получено 8 декабря, 2013.
- Кей, А. Э. (1965). плутоний 1965 г.. Тейлор и Фрэнсис.
- Лиде, Дэвид Р., изд. (2006). Справочник по химии и физике (87-е изд.). Бока-Ратон: CRC Press, Taylor & Francis Group. ISBN 0-8493-0487-3.
- Magurno, B.A .; Перлштейн, С., ред. (1981). Материалы конференции по методам и процедурам оценки ядерных данных. BNL-NCS 51363 (PDF). II. Аптон: Брукхейвенская национальная лаборатория. Получено 6 августа, 2014.
- Мартин, Джеймс Э. (2000). Физика для радиационной защиты. Wiley-Interscience. ISBN 0-471-35373-6.
- Маклафлин, Томас П .; Monahan, Shean P .; Пруво, Норман Л. (2000). Обзор аварий с критичностью (PDF). Лос-Аламос: Национальная лаборатория Лос-Аламоса. LA-13638. Получено 6 февраля, 2015.
- Miner, William N .; Шонфельд, Фред В. (1968). "Плутоний". В Клиффорде А. Хэмпеле (ред.). Энциклопедия химических элементов. Нью-Йорк (NY): Reinhold Book Corporation. стр.540–546. LCCN 68029938.
- Муди, Кентон Джеймс; Hutcheon, Ian D .; Грант, Патрик М. (2005). Ядерно-криминалистический анализ. CRC Press. ISBN 0-8493-1513-1.
- Родос, Ричард (1986). Создание атомной бомбы. Нью-Йорк: Саймон и Шустер. ISBN 0-671-65719-4.
- Сиборг, Г. Т .; Сиборг, Э. (2001). Приключения в атомный век: от Уоттса до Вашингтона. Фаррар, Штраус и Жиру. ISBN 0-374-29991-9.
- Скляр, Морти (1984). Nuke-Rebuke: писатели и художники против ядерной энергии и оружия. Серия антологий «Современник». Дух, который движет нами Пресса.
- Стокгольмский международный институт исследования проблем мира (2007). Ежегодник СИПРИ 2007: Вооружения, разоружение и международная безопасность. Издательство Оксфордского университета. ISBN 978-0-19-923021-1.
- Till, C.E .; Чанг, Ю. И. (2011). Изобилие энергии: история интегрального быстрого реактора, сложная история простой реакторной технологии с упором на ее научную основу для неспециалистов. Чарльз Э. Тилль и Юн Иль Чанг. ISBN 978-1-4663-8460-6.
- Вален, Р. К. (1989). История участка 100-Б (PDF). Ричленд, Вашингтон: Westinghouse Hanford Company. WHC-EP-0273. Архивировано из оригинал (PDF) 27 марта 2009 г.. Получено 15 февраля, 2009.
- Уэлсом, Эйлин (2000). Плутониевые файлы: секретные медицинские эксперименты Америки в период холодной войны. Нью-Йорк: Рэндом Хаус. ISBN 0-385-31954-1.
внешняя ссылка
- Аудио помощь
- Больше устных статей
- «Цифровая библиотека по ядерным вопросам Алсоса - плутоний». Вашингтонский университет и университет Ли. Архивировано из оригинал 3 февраля 2009 г.. Получено 15 февраля, 2009.
- Sutcliffe, W.G .; и другие. (1995). "Взгляд на опасность плутония". Национальная лаборатория Лоуренса Ливермора. Архивировано из оригинал 29 сентября 2006 г.
- Johnson, C.M .; Дэвис, З.С. (1997). «Ядерное оружие: варианты утилизации избыточного оружейного плутония». Отчет CRS для Конгресса № 97-564 ENR. Получено 15 февраля, 2009.
- «Физические, ядерные и химические свойства плутония». IEER. 2005. Получено 15 февраля, 2009.
- Бхадешия, Х. «Кристаллография плутония».
- Сэмюэлс, Д. (2005). «Конец эпохи плутония». Откройте для себя журнал. 26 (11).
- Pike, J .; Шерман, Р. (2000). «Производство плутония». Федерация американских ученых. Архивировано из оригинал 3 февраля 2009 г.. Получено 15 февраля, 2009.
- «Производство и изготовление плутония».
- Онг, К. (1999). «Мировые запасы плутония». Nuclear Files.org. Архивировано из оригинал 5 августа 2014 г.. Получено 15 февраля, 2009.
- «Проблемы плутониевой науки». Лос-Аламос Сайенс. I и II (26). 2000 г.. Получено 15 февраля, 2009.
- "Плутоний". Королевское химическое общество. Получено 6 февраля, 2015.
- "Плутоний". Периодическая таблица видео. Ноттингемский университет. Получено 6 февраля, 2015.

![{displaystyle {ce {{^ {238} _ {92} U} + {^ {1} _ {0} n} -> {^ {239} _ {92} U} -> [eta ^ {-}] [23,5 {ce {min}}] {^ {239} _ {93} Np} -> [eta ^ {-}] [2,3565 {ce {d}}] {^ {239} _ {94} Pu}} }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f9ba9e4744226a97ce8a41fd5b5e50b18cc259a9)
![{displaystyle {egin {align} {ce {{^ {238} _ {92} U} + {^ {2} _ {1} D} ->}} & {ce {{^ {238} _ {93} Np} + 2_ {0} ^ {1} n}} & {ce {^ {238} _ {93} Np -> [eta ^ {-}] [2.117 {ce {d}}] {^ {238 } _ {94} Пу}}} конец {выровнено}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1b584c932e52212178b2befe7a512a7b28f87d35)

